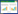文章信息
- 李凯, 张俊华, 蔡慧姿, 牛柏寒, 张明妍
- LI Kai, ZHANG Junhua, CAI Huizi, NIU Bohan, ZHANG Mingyan
- 中药注射剂治疗非小细胞肺癌临床试验结局指标文献研究
- Literature review of outcome in clinical trials of traditional Chinese medicine injections for non-small cell lung cancer
- 天津中医药, 2021, 38(2): 209-212
- Tianjin Journal of Traditional Chinese Medicine, 2021, 38(2): 209-212
- http://dx.doi.org/10.11656/j.issn.1672-1519.2021.02.15
-
文章历史
- 收稿日期: 2020-12-07
原发性支气管肺癌,又称肺癌。在全球范围内,肺癌是男性最常见的癌症和癌症死亡的主要原因,是第三大最常见的癌症(乳腺癌和结直肠癌之后)和第二大癌症死亡原因(乳腺癌之后[1-2])。其中小细胞肺癌(SCLC)约占14%[3],5年生存率仅为2%~10%[4],非小细胞肺癌(NSCLC)占肺癌的80%以上,5年生存率小于15%[5]。手术治疗已被认为是早期肺癌治疗和获得长期疗效的可靠手段,但结果并不令人满意。肺癌复发转移率高。放疗和化疗虽然对一些患者有效,但有很强的不良反应,大多数仅有姑息作用[1-2]。
中医药在肺癌治疗中广泛应用,在改善症状,提高机体免疫力,提高生存质量,延长生存期等方面具有优势[6-7]。虽然有许多研究报告中医治疗肺癌的有效性,但由于临床试验方法学质量较低,导致这些研究成果难以被认可[8-9]。选择性报告结局指标导致同类试验难以比较和合并,限制了系统评价的有效性,降低了每个临床研究的价值,产生了研究浪费等问题[10]。因此,选择合理、实用、公认的结局指标对于设计临床试验至关重要。
核心指标集(COS)是一组商定的标准化结局指标集,应至少在同一健康领域[11]的所有试验中测量和报告。研制COS来评估中医干预治疗肺癌的有效性,将最大限度地减少报告结局指标的异质性,从而提高中医临床研究的方法质量。本研究通过对中药注射剂治疗非小细胞肺癌随机对照临床试验(RCT)进行抽样分析,收集相关结局指标并分析存在的问题,为构建核心指标集奠定基础。
1 资料与方法 1.1 纳入与排除标准纳入标准:1)研究类型:RCT。2)研究对象:明确符合非小细胞肺癌诊断的患者,排除纳入其他疾病的研究。3)干预措施:中药注射剂,对照措施不做限制。4)结局指标:提取纳入研究采用的所有结局指标。排除标准:1)合并其他疾病的研究。2)以针灸、推拿、穴位敷贴等为干预措施的研究。3)学位论文。
1.2 文献检索计算机检索中国知网数据库(CNKI),万方数据(WanFang),维普数据库(VIP),中国生物医学文献服务系统(SinoMed),Embase,Cochrane library,Web of Science和PubMed 8个数据库。以2018年发表的文献为样本。检索词包括非小细胞肺癌、肺鳞癌、肿腺癌、肺大细胞癌、肺癌、肺肿瘤、肺岩、肺积等。为了避免漏检,未对中医药干预进行限定。
1.3 文献筛选与资料提取由两位作者严格按照纳入与排除标准独立筛选文献、提取资料,并交叉核对。如有分歧,经讨论解决或咨询第三方协商解决,提取信息主要包括:1)纳入研究的基本信息,包括文题、第一作者等。2)研究对象的基线特征,如例数、病程、疾病严重程度、中医证候等。3)干预措施,包括药物名称、疗程、等相关细节。4)结局指标及其测量方法、时间点。
2 结果 2.1 文献筛选流程初检共获得5 643篇相关文献,根据纳入排除标准,经筛选后最终纳入94个RCT,其中92篇中文文献,2篇英文文献。见图 1。
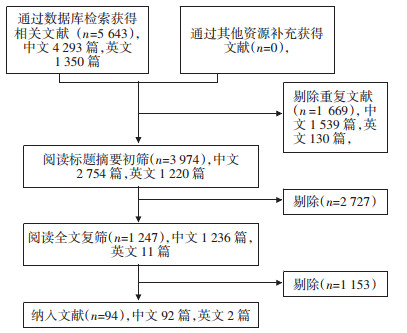
|
| 图 1 文献筛选流程 Fig. 1 literature selection process |
94个RCT研究共纳入8 450位患者。样本量大小为40~326例,平均每项研究的样本量为90例。
2.2.2 严重程度有77个研究说明了肺癌的严重程度,其中16项描述为中晚期或晚期。61个研究使用TNM分期,其中52个研究为Ⅲ~Ⅳ期。
2.2.3 中医证型5个(5.7%)研究报告了中医证型,分别为:气阴两虚证(2个),气虚证(2个),肺脾气虚证(1个)。
2.2.4 干预措施干预措施为中药注射剂,共涉及17种。其中康莱特注射液(15个),参麦注射液(7个),参芪扶正注射液(10个),复方苦参注射液(14个),华蟾素注射液(5个),艾迪注射液(12个),康艾注射液(6个),参芎葡萄糖注射液(1个),血塞通注射液(1个),鸦胆子乳油注射液(1个),痰热清注射液(1个),黄芪多糖注射液(1个),消癌平注射液(3个),蟾酥注射液(1个),胃复安注射液(1个),斑蝥酸钠维生素B6注射液(2个),苦参碱注射液(1个),香菇多糖注射液(2个)。
2.2.5 疗程94项临床试验均对疗程进行了描述。疗程跨度为5 d~18周,具体分布为:5个研究≤ 2周(%),2周 < 16个研究≤4周(%),4周 < 39项研究≤6周(%),6周 < 9项研究≤8周(%),21项研究>8周(%),4项研究疗程不详。
3 结局指标 3.1 指标域在全部对结局指标进行查重、归类、统一规范化处理后,发现在纳入的94项研究中共计使用了310个结局指标(64种),单个研究指标数量最少为1个,最多达9个,平均每个研究结局指标的数量为3.3个。以指标的功能属性为依据,将收集到的结局指标从临床疗效评价、中医指标、症状体征、理化检查、生活质量、远期预后、经济学评估和安全性事件8个域进行归类。见图 2。
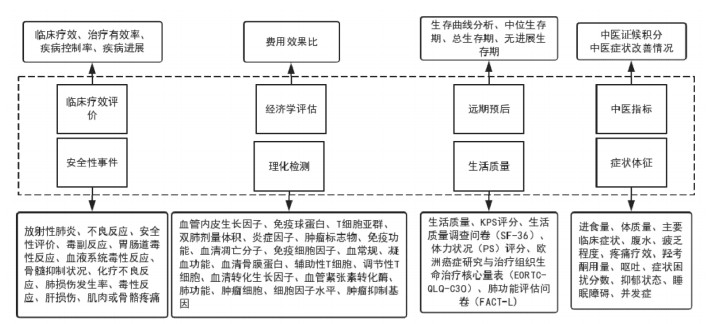
|
| 图 2 指标域 Fig. 2 Outcome field |
排前10位的结局指标依次为:临床疗效、不良反应、生活质量、免疫功能、肿瘤标志物水平、卡氏(KPS)评分、毒副作用、T细胞亚群变化、中医证候积分、总生存期。见表 1。
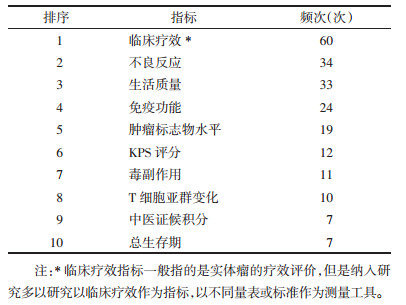
频次排名前5位的指标有41(43.6%)项研究使用两个指标,共9种组合形式;16(17%)项研究使用3个指标,共5种组合形式;5(5.3%)项研究使用4个指标,共3种组合形式。没有同时使用5项指标的研究。见表 2。
排除安全性事件指标域中的不良反应,频次排列前3位的指标的测量时间点如下。1)临床疗效评价:60项研究测量时间点有13个,其中22项(36.7%)研究测量时点选择治疗6周后,4项研究未描述测量时点。2)生活质量评价:33项研究有11个测量时点,13项(39.3%)研究选择治疗6周后测量,4项研究未描述测量时点。3)免疫功能:23项研究测量时点有6个,10项(43.4%)研选择治疗6周后测量,1项研究未描述测量时点。见图 3。
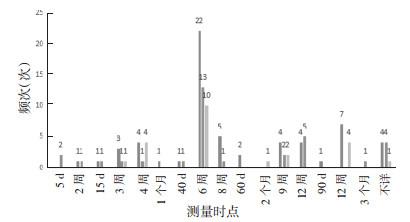
|
| 图 3 测量时点 Fig. 3 Measuring point |
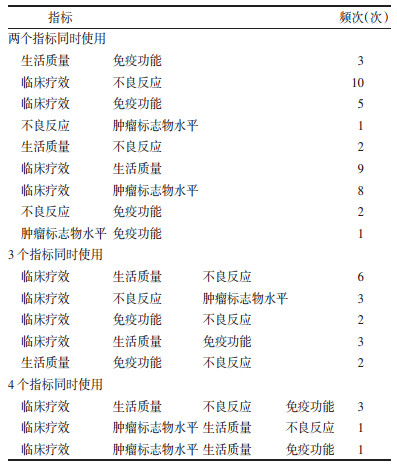
排名前5位的指标测量工具,同一指标测量标准至多为14种,至少为4种,有3项指标共计32个研究未描述测量工具,其中34个不良反应指标中有26项未描述测量标准。见表 3。
在对结局指标分类整理过程中,发现原始研究中采用的指标存在差异性大、不规范等问题,特别是指标不规范问题尤为突出。本项研究中,发现中药注射剂治疗非小细胞肺癌RCT采用的结局指标存在问题。具体为:1)结局指标临床相关性欠缺。指标多以临床疗效,理化检查,安全性事件等指标为主,经济学评估,症状体征,远期终点事件等指标很少使用。2)缺少中医药相关指标的应用。87项研究仅有9项研究描述了中医证候,中医药相关的指标使用仅为10.3%。3)指标组合随意。在不同试验中,两个或多个指标同时使用的情况各有不同,随意性较大。4)相同指标测量时点多样,时间跨度较大。同一指标测时点多达15个。5)相同指标测量工具不一致。同一指标测量方法多达26种,依据的标准来源各有不同,甚至有些为自拟标准。
本研究存在一定的局限性,如纳入的研究为已发表的RCT,且只纳入2018年整年发表的文献。另外,在研究过程中发现,纳入的RCT质量参差不齐,但本研究无研究质量的权重。
基于当前研究结果来看,发现中药注射剂治疗非小细胞肺癌的临床试验结局指标存在不规范、不实用、不公认等系列问题,因此构建COS,规范同类临床研究中指标的选择与测量,可减少同类临床研究结局指标不合理的问题,也有利于证据的综合分析。
| [1] |
陈万青, 左婷婷, 郑荣寿, 等. 2013年中国肺癌发病与死亡分析[J]. 中华肿瘤杂志, 2017, 39(10): 795-800. CHEN W Q, ZUO T T, ZHENG R S, et al. Lung cancer incidence and mortality in China in 2013[J]. Chinese Journal of Oncology, 2017, 39(10): 795-800. DOI:10.3760/cma.j.issn.0253-3766.2017.10.015 |
| [2] |
MAO Y, YANG D, HE J, et al. Epidemiology of lung cancer[J]. Surgical Oncology Clinics, 2016, 25(3): 439-445. |
| [3] |
BADE B C, DELA C C S. Lung cancer 2020: epidemiology, etiology, and prevention[J]. Clinics in Chest Medicine, 2020, 41(1): 1-24. DOI:10.1016/j.ccm.2019.10.001 |
| [4] |
HOWLADER N, NOONE A, KRAPCHO M, et al. (2013) SEER cancer statistics review, 1975-2010[M]. Bethesda, MD: National Cancer Institute, 2013.
|
| [5] |
CHENG Y. Progress in therapy for small cell lung cancer[J]. China Journals Books Network, 2010, 101(8): 44-47. |
| [6] |
HUANG Y T, HEIST R S, CHIRRIEAC L R, et al. Genome-wide analysis of survival in early-stage non-small-cell lung cancer[J]. Journal of Clinical Oncology, 2009, 27(16): 2660. DOI:10.1200/JCO.2008.18.7906 |
| [7] |
XU W, YANG G, XU Y, et al. The possibility of traditional Chinese medicine as maintenance therapy for advanced non-small cell lung cancer[J]. Evidence-based Complementary and Alternative Medicine, 2014, 2014: 278917. |
| [8] |
SHI Y, SUN Y. Medical management of lung cancer: experience in China[J]. Thoracic Cancer, 2015, 6(1): 10-16. DOI:10.1111/1759-7714.12168 |
| [9] |
CHEN S, ZHANG Z, ZHANG X, et al. TCM therapies combined with chemotherapy for preventing recurrence and metastasis in postoperative Ⅱ to ⅢA NSCLC: a protocol for a systematic review and meta-analysis[J]. Medicine (Baltimore), 2019, 98(9): e14724. DOI:10.1097/MD.0000000000014724 |
| [10] |
ZHANG L, ZHANG J, CHEN J, et al. Clinical research of traditional Chinese medicine needs to develop its own system of core outcome sets[J]. Evidence-based Complementary and Alternative Medicine, 2013, 2013: 202703. |
| [11] |
CHAN A W, SONG F, VICJERS A, et al. Increasing value and reducing waste: addressing inaccessible research[J]. Lancet, 2014, 383(9913): 257-266. DOI:10.1016/S0140-6736(13)62296-5 |
 2021, Vol. 38
2021, Vol. 38