文章信息
- 王一洲, 赵强
- WANG Yizhou, ZHAO Qiang
- 伸筋易骨法调控家兔软骨细胞增殖减轻软骨变性的实验研究
- Experimental study on the effect of Shenjin Yigu method regulating the proliferation of rabbit chondrocytes to reduce the degeneration of cartilage
- 天津中医药, 2021, 38(2): 228-232
- Tianjin Journal of Traditional Chinese Medicine, 2021, 38(2): 228-232
- http://dx.doi.org/10.11656/j.issn.1672-1519.2021.02.19
-
文章历史
- 收稿日期: 2020-11-10
膝骨性关节炎(KOA)是以关节软骨及软骨下骨变性为主要特征的退行性骨关节病,是最常见的下肢致痛因素之一,随着病情的发展,KOA还会进一步引起下肢功能障碍、关节畸形等症状,据统计KOA已成为致残率最高的退行性骨关节疾患[1]。KOA的主要病理表现是软骨平滑性的破坏,以及由此导致的细胞外基质力学重构,软骨细胞异常增殖和肥大化是造成这一病理表现的主要原因[2]。软骨细胞的主要功能是维持细胞外基质中胶原蛋白和蛋白聚糖的平衡,软骨细胞的异常增殖和肥大化将会导致细胞外基质重构,启动并逐渐加重KOA病理进程[3-4]。甲状旁腺激素相关蛋白(PTHrP)对软骨细胞增殖的调控具有重要意义,当KOA发生时,增生的软骨细胞分泌PTHrP,抑制软骨细胞终末化并稳定细胞状态,这一调控过程通过软骨细胞表面的机械门控钙通道级联转导[5-7]。课题组前期初步探索并发现:KOA引起的关节力学重构影响机械敏感离子通道活化,伸筋易骨法能够改善关节周围软组织性能,提高钙通道活性,增加软骨细胞内钙离子浓度,刺激成骨标志蛋白SOX9的表达,促进软骨合成代谢[8-11]。PTHrP作为驱动软骨增殖的重要因子,探讨其在伸筋易骨法调控软骨细胞增殖中的作用具有一定意义。笔者应用改良的Hulth造模法制备KOA兔模型,比较伸筋易骨法和玻璃酸钠关节腔注射治疗的作用效果,观察伸筋易骨法调控PTHrP,影响软骨增殖的超微结构变化。
1 材料与方法 1.1 试剂超纯RNA提取试剂盒、HiFi-MMLV cDNA第一链合成试剂盒、UltraSYBR Mixture(With ROX)、DNase 1、5×RNA Loading Buffer(康为世纪,中国);戊二醛、丙酮、EPON812环氧树脂(淮南市科迪化工科技有限公司,中国);四氧化锇、二甲砷酸钠、多聚甲醛(南京化学试剂股份有限公司,中国);醋酸双氧铀(EMS公司,美国);柠檬酸铅(上海鼓臣生物技术有限公司,中国);超纯RNA提取试剂盒、HiFi-MMLV cDNA第一链合成试剂盒、UltraSYBR Mixture(With ROX)、DNase 1、5×RNA Loading Buffer(康为世纪,中国)。
1.2 仪器ABI7500型荧光定量PCR仪(Applied Biosystems,美国);NANODROP 2000型分光光度计(Therno scientific,美国);QL-902型螺旋震荡仪(海门市其林贝尔仪器制造有限公司,中国);超薄切片机(Leica公司,德国);Tecnai G2透射电子显微镜(FEI公司,美国);低温高速离心机(Beckman公司,美国);JSM-7800F型超高分辨热场发射扫描电镜(JEOL公司,日本);LyoQuest Plus-55型冷冻干燥机(Telstar公司,西班牙)。
1.3 模型制备[12]1)兔称质量后,无菌条件下,后腿上方靠近尾部脱毛,常规皮肤消毒,3%戊巴比妥钠(1 mL/kg)耳缘静脉注射麻醉。2)仰卧固定,备皮,铺巾。3)内侧支持韧带外缘打开1 cm窗口,逐层分离打开关节。4)分离胫侧副韧带并切断,剪除内侧半月板,切断前交叉韧带,避免损伤关节软骨。5)逐层缝合。6)术后连续3 d青霉素20万U肌肉注射抗感染治疗,1周后开始单通道小动物跑台强迫兔活动0.5 h,连续30 d。
假手术组按照上述方法操作。
模型评价:Lysholm评分、步态足印分析等方法检测造模成果。
1.4 治疗方法推拿组操作:1)在助手的协助下使兔保持仰卧位,先以指揉法沿股直肌、股外侧肌、股内侧肌自下而上行5次操作,将兔下肢屈髋屈膝外展位摆放,以指按法操作于内外膝眼,并向上、向中间推挤髌骨1 min。2)以食指和拇指相对用力,夹持大腿前面肌群,模拟叩揉法自下而上操作5次,以推法沿髂胫束平推5次。3)使兔患肢曲髋屈膝,术者一手握持小腿末端,一手拇指向外侧拨髌骨,配合膝关节的屈伸5次,顺时针摇膝5次,踝关节跖屈位牵拉膝关节5次。4)提拿髌骨1 min,结束手法。以上手法治疗,每日1次,7 d为1个疗程,共治疗3个疗程。
玻璃酸钠注射组操作:1)仰卧位固定下肢,常规备皮、铺巾。2)沿髌骨内缘中点进针,针尖突破关节腔后稍后撤,注入玻璃酸钠注射液2 mL,屈伸关节并研磨髌骨使药液均匀分布。3)伤口敷料,每周1次,共注射3次。
1.5 组织样本提取及标本制作空气栓处死,逐层分离关节腔,清理半月板、韧带等附着组织,手术刀刮取关节软骨,磷酸盐缓冲液(PBS)加压冲洗3遍,正面向上贴敷于载玻片。扫描电镜标本于4%多聚甲醛4 ℃避光过夜,乙醇脱水后醋酸异戊酯置换,F-13临界温度干燥,镀金,待上机检测。透射电镜检测标本用眼科剪剪成1 mm×1 mm×1 mm块状,放入2.5%戊二醛和2%的多聚甲醛混合液中(pH=7.4)固定过夜;吸出固定液,0.15 mol/L二甲砷酸钠冲洗3遍,加入1%四氧化锇(pH值7.4),固定2 h,弃液,冲洗;丙酮梯度脱水,依次放入3∶1、1∶1、1∶3 EPON812环氧树脂混合液中,弃液,冲洗;100%环氧树脂渗透过夜;加入1.5% 的加速剂,混匀。环氧树脂包埋,烘烤,聚合。Leica EM UC6超薄切片机进行超薄切片,每片厚度为70 nm。2%醋酸双氧铀溶液染色,冲洗;再用2%柠檬酸铅溶液染色,冲洗1 min,晾干。将制备好的超薄切片载网在透射电子显微镜FEI Tecnai Spirit 120 kv中进行观察,成像。
1.6 PTHrP mRNA的检测1)用超纯RNA提取试剂提取组织样本中总RNA。2)取5 μL RNA用1%琼脂糖凝胶进行电泳,以检测RNA的完整性。3)将RNA模板、引物、5×RT Buffer和RNase-freeWater溶解并置于冰上备用。4)向反应管中加入20 μL反应体系进行反转录。5)用ABI 7500型荧光定量PCR仪,设定反应条件为:预变性:95 ℃ 10 s,95 ℃ 5 s,60 ℃ 34 s,40个循环。每对引物设3个复孔。6)结果用ABI PRISM 7500分析。引物:PTHrP-F(5′- AGAAGAAG AAGCGGCGAACT-3′),PTHrP-R(5′-CAATGCCTC CGTGAATCGAG-3′)。
1.7 统计学方法采用SPSS24.0统计软件对相关数据进行统计学分析,计量资料使用均数±标准差(x±s)表示,各组软骨组织中PTHrP mRNA的浓度比较采用单因素方差分析,组间两两比较采用LSD 法,α=0.05为检验水准,P < 0.05为差异具有统计学意义。
2 结果 2.1 扫描电镜观察显示正常组软骨组织和假手术组软骨组织表面有垄沟排列有序的波浪形明暗带,组织表面无纤维裸露,无血管和细胞分布;模型组表面垄沟样明暗带明显紊乱,箭头所指处可见裸露的胶原纤维和软骨基质,大量软骨细胞暴露在软骨表面;推拿组和玻璃酸钠组软骨表面有少量的胶原裸露,但垄沟样明暗带排列有序,箭头所指处可见纤维裸露部分有纵向纤维爬过表面,提示软骨修复。见图 1。

|
| 图 1 各组软骨组织扫描电镜观察(×1 000) Fig. 1 Scanning electron microscope observation of cartilage tissues in each group(×1 000) |
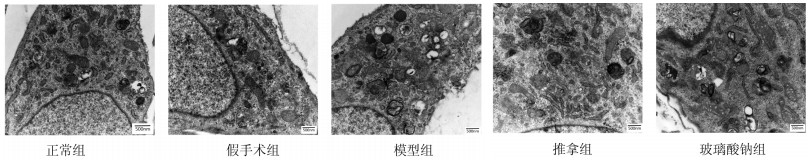
正常组软骨细胞和假手术组软骨细胞呈椭圆形,细胞内以常染色质为主,细胞核形态正常,胞质内少量脂滴,大量线粒体、粗面内质网等细胞器围绕核周,胶原纤维致密且排列规整;模型组软骨细胞形态肥大,细胞质凝聚于核膜,细胞核偏移,高尔基体扩张,箭头所指处可见粗面内质网形态异常,核膜上多个膜孔,线粒体消失,胶原纤维断裂;推拿组和玻璃酸钠组软骨细胞细胞形态扁平,核偏移,细胞器减少,但可见正常形态的线粒体和粗面内质网,箭头所指处可见线粒体双模结构正常,细胞内可见多个自噬小体。见图 2。
|
| 图 2 各组软骨细胞透射电镜观察 Fig. 2 Transmission electron microscope observation of chondrocytes in each group |
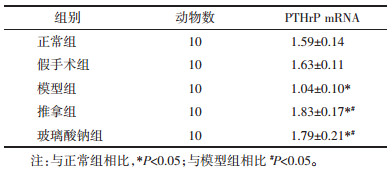
RT-PCR法检测各组软骨组织PTHrP mRNA的表达,假手术组与正常组PTHrP mRNA的表达比较,无统计学意义(P>0.05);模型组与正常组比较,具有统计学意义(P<0.05);推拿组、玻璃酸钠组与模型组比较,具有统计学意义(P<0.05);推拿组与玻璃酸钠组相比,无统计学意义(P>0.05);推拿组、玻璃酸钠组与正常组相比,具有显著性差异(P<0.05)。提示推拿手法与玻璃酸钠关节腔注射均能促进PTHrP mRNA的表达,刺激软骨增殖,抑制软骨肥大化。见表 1。
|
中医学将KOA归属于“骨痹”“筋痹”等范畴,《黄帝内经·长刺节论》描述筋痹有“筋孪节痛,不可以行”的症状,强调KOA发病早期肌肉张力发生变化,并伴随疼痛和活动功能障碍。当疾病逐渐进展,症状发展为“骨重不可举,骨髓酸痛”之骨痹,此时,关节周围软组织性能整体下降并出现软骨下骨硬化,以关节酸痛为主要症状的骨重构是这一时期的典型表现。伸筋易骨法是赵强主任传承古法并结合其临床经验逐渐总结出的KOA保守治疗方案,其中独创的推拿手法包括屈膝点按、推摇牵挤、抱膝叩揉等,整套手法以增强肌肉性能、调节滑膜炎性内环境、促进软骨增殖为主要目的,通过点按激痛点促进筋膜内炎性致痛物质释放,缓解局部代谢障碍,增强肌肉力学性能。通过推摇牵挤等运动关节类手法,多轴拉伸关节滑膜,调节滑膜细胞响应应力刺激,减轻滑膜内炎性反应。整套手法缓急兼顾、动静结合,从KOA发病的各个环节切入,整体调控软骨组织的增殖和修复。
软骨细胞增殖和凋亡的动态平衡是维持软骨组织性能的重要因素,研究发现,不同强度机械刺激能够诱导软骨细胞增殖状态发生变化,软骨细胞将机械信号整合并调控其生理功能[13]。PTHrP在成骨细胞和肥大软骨细胞中均高表达,其通过激活磷脂酶C(PLC)/蛋白激酶C(PKC)通路抑制软骨细胞肥大化并促进软骨正常增殖[14],PTHrP已被证实为软骨增殖的潜在靶向分子。KOA早期大量巨噬细胞和淋巴细胞侵入滑膜并释放炎症因子,白细胞介素-1β(IL-1β)、肿瘤坏死因子-α(TNF-α)等通过不同途径活化MMPs,其中MMP13过表达将导致细胞外基质内的蛋白聚糖和Ⅱ型胶原分解,引起软骨重构,Wang等[15]发现PTHrP能够抑制软骨组织中MMP-13进而增加Ⅱ型胶原蛋白和蛋白聚糖的表达,维持软骨结构,促进细胞增殖。PTHrP的表达具有明显的机械依赖性,软骨细胞通过细胞外基质感受表面应力刺激,当KOA发生时,关节周围肌肉的力学性能首先发生减退,进而影响髌股关节、胫股平台的理想物理环境,软骨表面出现应力集中,软骨细胞中的PTHrP明显降低[16],导致软骨细胞肥大化和细胞外基质重构[17],这与实验中观察到的模型组软骨细胞PTHrP mRNA表达降低相符。KOA早期,肥大前软骨细胞能够刺激增殖软骨细胞分泌PTHrP以维持其祖细胞特性,抑制软骨终末化趋势,本研究扫描电镜观察中亦发现通过推拿组软骨细胞内出现大量自噬体,粗面内质网和线粒体形态恢复正常,断裂的胶原纤维修复,初步证明推拿手法调控关节应力促进软骨细胞增殖和修复,缓解软骨损伤。限于研究深度和探索领域,本研究仅得出部分伸筋易骨法干预KOA的作用机制,未来将从肌肉、滑膜等膝关节周围软组织的力学性能角度完善我们的研究,为KOA防治技术的发展做出贡献。
| [1] |
JOSHUA S E, MONEER M A, DAVID C F. Role of full-thickness cartilage defects in knee osteoarthritis (OA) incidence and progression: Data from the OA Initiative[J]. Journal of Orthopaedic Surgery and Research, 2019, 37(1): 77-83. DOI:10.1002/jor.24140 |
| [2] |
VIRANT K I. Functional testing of primitive oocyte-like cells developed in ovarian surface epithelium cell culture from small VSEL-like stem cells: can they be fertilized one day?[J]. Stem Cell Reviews and Reports, 2018, 14(5): 715-721. DOI:10.1007/s12015-018-9832-y |
| [3] |
TOYODA M, HAMATANI T, OKADA H, et al. Defining cell identity by comprehensive gene expression profiling[J]. Current Medicinal Chemistry, 2010, 17(28): 3245-3252. DOI:10.2174/092986710792231932 |
| [4] |
TAVELLA S, BITICCHI R, SCHITO A, et al. Targeted expression of SHH affects chondrocyte differentiation, growth plate organization, and Sox9 expression[J]. Journal of Bone And Mineral Research, 2004, 19(10): 1678-1688. DOI:10.1359/JBMR.040706 |
| [5] |
PLATAS J, GUILLEN M I, GOMAR F. Anti-senescence and anti-inflammatory effects of the C-terminal moiety of PTHrP peptides in OA osteoblasts[J]. Journals of Gerontology Series a-Biological Sciences and Medical Science, 2017, 72(5): 624-631. |
| [6] |
ZHANG H, WANG H, ZENG C, et al. mTORC1 activation downregulates FGFR3 and PTH/PTHrP receptor in articular chondrocytes to initiate osteoarthritis[J]. Osteoarthritis Cartilage, 2017, 25(6): 952-963. DOI:10.1016/j.joca.2016.12.024 |
| [7] |
LIU Q, YANG H X, WAN X H, et al. Calcium-/calmodulin-dependent protein kinase Ⅱ in occlusion-induced degenerative cartilage of rat mandibular condyle[J]. Journal of Oral Rehabilitation, 2018, 45(6): 442-451. DOI:10.1111/joor.12629 |
| [8] |
王一洲, 赵强. 屈膝点按叩揉法调控L-型电压依赖性钙通道影响软骨细胞代谢的机制研究[J]. 天津中医药, 2017, 34(4): 262-265. WANG Y Z, ZHAO Q. Study on the mechanism of Quxi Dian'an Kourou method regulation of L-type calcium channel affect the metabolism of chondrocytes[J]. Tianjin Journal of Traditional Chinese Medicine, 2017, 34(4): 262-265. |
| [9] |
马铭华, 王一洲, 赵强. 伸筋易骨法调控软骨细胞内钙离子浓度干预细胞代谢的机制研究[J]. 天津中医药, 2019, 36(6): 591-594. MA M H, WANG Y Z, ZHAO Q. Mechanisms study of Shenjin Yigu method regulated calcium ion concentration in chondrocyte to intervene cell metabolism[J]. Tianjin Journal of Traditional Chinese Medicine, 2019, 36(6): 591-594. |
| [10] |
赵强, 王一洲. 伸筋易骨矫形手法对兔膝关节软骨细胞代谢及Sox9表达的影响[J]. 天津中医药, 2016, 33(2): 96-99. ZHAO Q, WANG Y Z. Effects of Shenjin Yigu orthopaedic manipulation on chondrocytes metabolism and the expression of Sox9 in rabbits[J]. Tianjin Journal of Traditional Chinese Medicine, 2016, 33(2): 96-99. |
| [11] |
赵强, 王一洲. 伸筋易骨法治疗膝关节骨性关节炎临床观察[J]. 天津中医药, 2014, 31(5): 275-277. ZHAO Q, WANG Y Z. Observation on the clinical curative effect of Shenjin Yigu method in the treatment of knee osteoar theritis[J]. Tianjin Journal of Traditional Chinese Medicine, 2014, 31(5): 275-277. |
| [12] |
HULTH A, LINDBERG L, TELHAG H. Experimental osteoarthritis in rabbits[J]. Acta Orthopaedica Scandinavica, 1970, 41(5): 522-530. DOI:10.3109/17453677008991540 |
| [13] |
YOUNG I C, CHUANG S T, HSU C H, et al. Protective effects of aucubin on osteoarthritic chondrocyte model induced by hydrogen peroxide and mechanical stimulus[J]. BMC Complementary and Alternative Medicine, 2017, 17(1): 91. DOI:10.1186/s12906-017-1581-y |
| [14] |
TONG W, ZENG Y, CHOW D H, et al. Wnt16 attenuates osteoarthritis progression through a PCP/JNK-mTORC1-PTHrP cascade[J]. Annals of the Rheumatic Diseases, 2019, 78(4): 551-561. DOI:10.1136/annrheumdis-2018-214200 |
| [15] |
WANG S T, GAO Y J, DUAN C C, et al. Effects of PTHrP on expression of MMP9 and MMP13 in sika deer antler chondrocytes[J]. Cell Biology International, 2013, 37(12): 1300-1307. DOI:10.1002/cbin.10168 |
| [16] |
THOMPSON C L, PLANT J C, WANN A K, et al. Chondrocyte expansion is associated with loss of primary cilia and disrupted hedgehog signalling[J]. European Cells & Materials, 2017, 34: 128-141. |
| [17] |
XIE Y, ZHANG C, JIANG W, et al. Quadriceps combined with hip abductor strengthening versus quadriceps strengthening in treating knee osteoarthritis: a study protocol for a randomized controlled trial[J]. BMC Musculoskeletal Disorders, 2018, 19(1): 147. DOI:10.1186/s12891-018-2041-7 |
 2021, Vol. 38
2021, Vol. 38