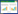文章信息
- 程芳, 武尚亮, 赵丽华
- CHENG Fang, WU Shangliang, ZHAO Lihua
- 白及颗粒对慢性阻塞性肺疾病模型大鼠肺组织α-1 antitrypsin、Neutrophil Elastase及MPO表达的影响
- Effect of Baiji Granule on expression of α-1 antitrypsin, Neutrophil Elastase and MPO in lung tissue of rats with chronic obstructive pulmonary disease
- 天津中医药, 2021, 38(2): 233-239
- Tianjin Journal of Traditional Chinese Medicine, 2021, 38(2): 233-239
- http://dx.doi.org/10.11656/j.issn.1672-1519.2021.02.20
-
文章历史
- 收稿日期: 2020-10-21
2. 天津红日康仁堂药业有限公司, 天津 301700;
3. 北京大学肿瘤医院暨北京市肿瘤防治研究所中心实验室, 北京 100142
慢性阻塞性肺病(COPD)是慢性气道阻塞性疾病的统称,是以呼吸气流受限为特征的肺部疾病。呼吸气流受限不完全可逆,呈进行性发展,与肺部对香烟的烟雾等有害气体或其他有害颗粒的异常炎症反应有关[1]。COPD与慢性支气管炎及肺气肿密切相关,呼吸道反复病毒感染和继发性细菌感染是导致慢性支气管炎病变发展的重要因素,长期接触工业粉尘、大气污染及过敏因素也是引起慢性支气管炎的重要原因,而机体抵抗力下降,呼吸系统防御受损则是发病的内在因素[2]。已有研究证明白及或白及颗粒对PM2.5、石英粉(矽肺)、盐酸等引起的肺损伤具有很好的疗效[3]。白及归肺、肝、胃经,功效为收敛止血,消肿生肌,说明书指明白及颗粒可用于慢性气管炎,肺气肿等肺部相关疾病[4]。在临床上,慢性支气管炎和肺气肿是导致COPD的最常见疾病,慢性支气管炎或肺气肿的早期,大多数患者有慢性咳嗽、咳痰症状,肺气肿常与慢性支气管炎并存,一般病程较长,当患者病情严重到一定程度,肺功能检査出现持续气流受限时,则诊断为慢阻肺[5]。本实验研究了白及颗粒对COPD模型的影响,为白及颗粒的临床应用提供了药效学实验研究基础。
1 材料与方法 1.1 仪器BX53型奥林巴斯显微镜。DHP-9082型电热恒温培养箱,上海合恒仪器设备有限公司。KD-PⅢ型摊片机,北京世纪科信科学仪器有限公司。KD-H型烤片机,北京世纪科信科学仪器有限公司。徕卡石蜡切片机,德国(徕卡)生产。酶标分析仪,北京普朗新技术有限公司。Alpha1502型紫外可见分光光度计,上海谱元仪器有限公司。DYCZ-24KS型双板垂直电泳仪,北京六一仪器厂。KB-900型智能脱色摇床,海门市其林贝尔仪器制造有限公司。
1.2 动物SPF级健康SD大鼠60只,体质量180~220 g,雄性,购于北京维通利华实验动物技术有限公司,许可证号:SCXK(京)2016-0011。
1.3 药品和试剂白及颗粒:云南永安制药有限公司,规格:10 g/袋(相当于10g生药),批号20171206,服用方法:开水冲服。每次10 g,每日2次。水合氯醛:北京市旭东化工厂,批号20160730。脂多糖(LPS),Sigma公司。多聚甲醛,批号:F20170503,国药集团化学试剂有限公司。无水乙醇,国药集团化学试剂有限公司,批号20170121。二甲苯,国药集团化学试剂有限公司,批号:20161125。枸橼酸,批号:20170621,国药集团化学试剂有限公司。TMS-P超敏试剂盒,批号:1703031405,福建迈新生物技术开发有限公司。枸橼酸钠,批号:20170713,国药集团化学试剂有限公司。磷酸盐缓冲液(PBS),批号:20170815,北京Solarbio科技有限公司。α-1抗胰蛋白酶抗体(α-1 antitrypsin),北京博奥森生物技术有限公司。中性粒细胞弹性蛋白酶抗体(Neutrophil Elastase),北京博奥森生物技术有限公司。髓过氧化物酶抗体(MPO),北京博奥森生物技术有限公司。
1.4 模型制备取60只SPF级健康雄性SD大鼠(180~220)g,除预留空白对照组大鼠10只外,其余50只均用于制备COPD大鼠模型。于实验第1、15天(每隔2周1次)以3.5%水合氯醛腹腔麻醉大鼠后,造模大鼠采用一次性气管插管法经气管注入0.2 mL LPS溶液(用生理盐水配制为1 mg/mL溶液)。第15天除外第2~28天每天给予烟熏,放入自制的有机玻璃密闭熏烟箱内,每次10只,用8支香烟,烟熏每天2次,每次30 min。将麻醉大鼠仰卧位固定在鼠板上,头高尾低呈45°角放置,暴露声门,在光源下将套管针迅速插入大鼠气管内,拔出套管针钢芯,以棉丝放在塑料套管外口插管成功后,先抽取空气0.3 mL后抽取LPS溶液0.2 mL,通过套管针快速注入气管。然后将大鼠固定板直立旋转,左右摇晃30次,使LPS液能够均匀分布于两肺[6]。
1.5 分组给药除10只空白对照组大鼠,另取50只造模大鼠,随机分为模型对照组、羧甲司坦片组(0.14 g/kg)、白及颗粒高剂量组(生药5.4 g/kg)、白及颗粒中剂量组(生药3.6 g/kg)、白及颗粒低剂量组(生药1.8 g/kg)。灌胃给药,每日1次,连续4周,末次给药1 h后使用动物呼吸功能测定仪测定大鼠第0.3秒呼气容积与肺活量比值(FEV 0.3/FVC%)。
1.6 样品提取与保存实验结束,取左肺4%多聚甲醛溶液固定,右肺各叶-80 ℃保存。
1.7 肺组织形态学检测[7]常规脱水、透明、浸蜡、包埋及切片。苏木精-伊红(HE)染色:观察肺组织炎性细胞浸润,进行炎症病理学评分。HE染色肺脏病理分级:0级,无炎症;1级,轻度炎症,炎性细胞浸润,病变范围小于10%;2级,中度炎症,肺泡间隔增厚,病变范围占10%~30%;3级,重度炎症,炎性细胞浸润,肺泡间隔增厚,病变范围大于30%。
1.8 免疫组化法测定肺组织α-1 antitrypsin、中性粒细胞弹性蛋白酶(NE)及MPO表达石蜡切片脱蜡至水。3% H2O2室温孵育10 min,10%山羊血清封闭10 min,滴加Ι抗(α-Antitrypsin 1∶400;NE 1∶450;MPO 1∶400[8]),37 ℃孵育2 h,滴加适量生物素标记Ⅱ抗,37 ℃孵育30 min。滴加适量的辣根酶标记的链霉卵白素工作液,37 ℃孵育30 min。DAB显色剂显色,冲洗,复染,脱水,透明,封片。免疫组化图片采用Image J软件进行灰度值分析,计算各组平均光密度值(IOD)。IOD=log[gv0/gv)],gv0为背景灰度值,gv为目标区灰度值。
1.9 Western Blot法测定肺组织Neutrophil Elastase、MPO表达取适量肺组织,提蛋白,取上清液,BCA法蛋白定量。将蛋白样品直接上样到SDS-PAGE胶加样孔内,开始时电压80 V,后增加到180 V,电泳到染料抵达分离胶底部。将蛋白后转印至PVDF膜上。封闭1 h,加Ι抗(中性粒细胞弹性蛋白酶抗体封闭液稀释浓度1∶650;髓过氧化物酶抗体封闭液稀释浓度1∶800)4 ℃孵化过夜。TBST清洗3次,加入辣根过氧化物酶标记的Ⅱ抗(封闭液稀释浓度1∶4 000),室温孵育2 h,ECL法显色曝光,使用Image J软件分析图像。结果以相对光密度值表示,相对光密度值=目的蛋白光密度值/β-action光密度值。
1.10 统计学方法所有数据采用SPSS 24.0软件进行统计处理,以均数±标准差(x±s)表示,多组间比较采用单因素方差分析,组间两两比较采用LSD法,P < 0.05为差异具有统计学意义。
2 结果 2.1 白及颗粒对大鼠COPD模型肺功能的影响与空白对照组相比,模型对照组FEV 0.3/FVC%显著降低(P < 0.01),与模型对照组相比,白及颗粒低剂量组、白及颗粒中剂量组、白及颗粒高剂量组、羧甲司坦片组FEV 0.3/FVC%显著升高(P < 0.05或P < 0.01)。见表 1。
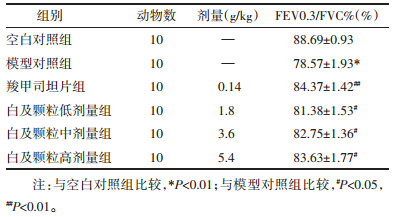
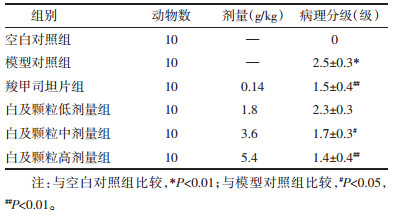
与空白对照组相比,模型对照组HE染色病理分级显著增加(P < 0.01),与模型对照组相比,白及颗粒中剂量组、白及颗粒高剂量组、羧甲司坦片组HE染色病理分级显著降低(P < 0.05或P < 0.01)。见表 2,图 1。
|
| 注:A.空白对照组,B.模型对照组,C.羧甲司坦片组,D.白及颗粒高剂量组,E.白及颗粒中剂量组,F.白及颗粒低剂量组。 图 1 大鼠肺组织HE结果(×200) Fig. 1 HE results of rat lung tissue (×200) |
与空白对照组相比,模型对照组肺脏细胞α-1 antitrypsin表达显著增加(P < 0.05),与模型对照组相比,白及颗粒低剂量组、白及颗粒中剂量组、白及颗粒高剂量组、羧甲司坦片组肺脏细胞α-1 antitrypsin表达显著增加(P < 0.05或P < 0.01)。见表 3,图 2。
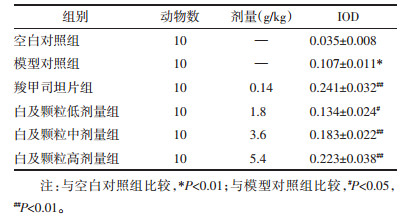
|
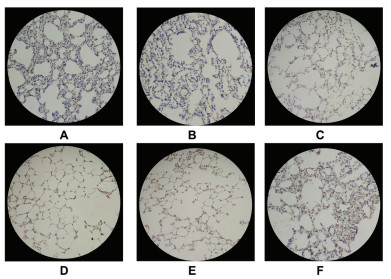
|
| 注:A.空白对照组,B.模型对照组,C.羧甲司坦片组,D.白及颗粒高剂量组,E.白及颗粒中剂量组,F.白及颗粒低剂量组。 图 2 大鼠肺组织α-1 antitrypsin表达的结果(×200) Fig. 2 Results of α-1 antitrypsin expression in rat lung (×200) |
与空白对照组相比,模型对照组肺脏细胞NE表达显著增加(P < 0.01),与模型对照组相比,白及颗粒中剂量组、白及颗粒高剂量组、羧甲司坦片组肺脏细胞NE表达显著降低(P < 0.05或P < 0.01)。见表 4,图 3。
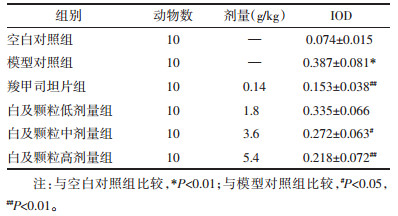
|
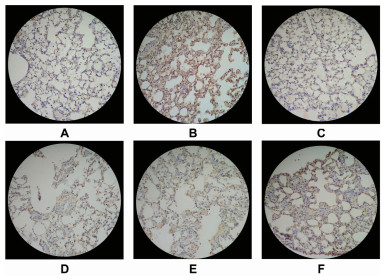
|
| 注:A.空白对照组,B.模型对照组,C.羧甲司坦片组,D.白及颗粒高剂量组,E.白及颗粒中剂量组,F.白及颗粒低剂量组。 图 3 大鼠肺组织NE表达的结果(×200) Fig. 3 Results of NE expression in rat lung tissue (×200) |
与空白对照组相比,模型对照组肺脏细胞MPO表达显著增加(P < 0.01),与模型对照组相比,白及颗粒低剂量组、白及颗粒中剂量组、白及颗粒高剂量组、羧甲司坦片组肺脏细胞MPO表达显著降低(P < 0.05或P < 0.01)。见表 5,图 4。
|
|
| 注:A.空白对照组,B.模型对照组,C.羧甲司坦片组,D.白及颗粒高剂量组,E.白及颗粒中剂量组,F.白及颗粒低剂量组。 图 4 大鼠肺组织NE表达的结果(×200) Fig. 4 Results of NE expression in rat lung tissue (×200) |
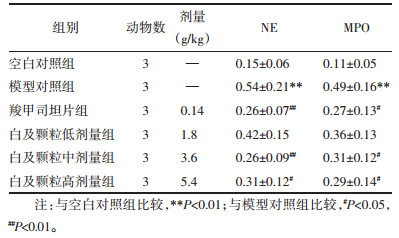
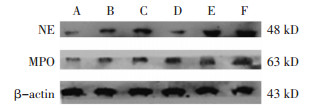
与空白对照组相比,模型对照组NE和MPO蛋白表达显著增高(P < 0.01),与模型对照组相比,白及颗粒中剂量组、白及颗粒高剂量组、羧甲司坦片组NE表达均显著降低(P < 0.05或P < 0.01),见表 6。与模型对照组相比白及颗粒中剂量组、白及颗粒高剂量组、羧甲司坦片组MPO表达均显著降低(P < 0.05),结果见图 5。
|
|
| 注:A.空白对照组,B.模型对照组,C.羧甲司坦片组,D.白及颗粒高剂量组,E.白及颗粒中剂量组,F.白及颗粒低剂量组。 图 5 Western blot法检测大鼠肺脏NE和MPO的水平结果 Fig. 5 Results of Western blot detection of NE and MPO in rat lungs |
COPD大多是由慢性支气管炎、支气管哮喘等发展而来。其主要病理改变是由于病原微生物造成支气管黏膜不同程度的纤维增生或溃疡,导致气道狭窄和阻塞以及细支气管周围炎,从而造成纤毛运动障碍和痰液分泌增多,痰液不易排出而阻塞,进一步发展为支气管壁溃疡,形成肉芽组织,小支气管塌陷,从而形成阻塞性肺气肿[9]。
COPD是以持续存在的呼吸道症状,气道黏液高分泌气道阻塞同时肺功能快速下降为特征。慢阻肺存在不完全可逆性气流受限是诊断慢阻肺的必备条件[10]。肺功能测定指标是诊断慢阻肺的金标准,FEV1 < 80%预计值可确定为不完全可逆性气流受限[11]。本研究结果表明白及颗粒低剂量组、白及颗粒中剂量组、白及颗粒高剂量组FEV0.3%显著增加。
黏蛋白是气道黏液的主要成分,是由储存在气道上皮杯状细胞及黏膜下腺的胞内颗粒分泌而来的。中性粒细胞弹性蛋白酶是目前已知的促黏蛋白分泌的最重要的诱导剂[12]。与肺气肿发生有关的内源性蛋白酶主要是中性粒细胞和单核细胞释放的弹性蛋白酶。中性粒细胞弹性蛋白酶能降解肺组织中的弹性硬蛋白及结缔组织基质中的胶原蛋白,破坏肺泡壁的结构。肺泡壁破坏、弹性减弱,更影响到肺的排气能力,末梢肺组织则因残气量不断增多而发生扩张,肺泡孔扩大,肺泡间隔也断裂,扩张的肺泡互相融合形成气肿囊腔。病变累及肺腺泡的各个部位,从终末呼吸细支气管直至肺泡囊和肺泡均呈弥漫性扩张,遍布于肺小叶内。如果肺泡间隔破坏较严重,气肿囊腔可融合成直径超过1 cm的大囊泡,形成大泡性肺气肿[13]。慢性支气管炎伴有肺感染,尤其是吸烟者,肺组织内渗出的中性粒细胞和单核细胞较多,可释放多量弹性蛋白酶。同时,中性粒细胞和单核细胞还可生成大量氧自由基,能氧化α-1 antitrypsin活性中心的蛋氨酸使之失活[14]。α-1 antitrypsin乃弹性蛋白酶的抑制物,失活后则增强了弹性蛋白酶的损伤作用。α-1 antitrypsin缺乏是引起原发性肺气肿的原因,α-1 antitrypsin缺乏的家族,肺气肿的发病率比一般人高15倍,主要是全腺泡型肺气肿。α-1 antitrypsin为呼吸系统的非特异性可溶因子,与呼吸道抵抗力关系密切,它可抑制多种酶的活性,包括细菌的酶,以及中性白细胞溶酶体分泌的蛋白酶、弹性蛋白酶、胶原酶、纤维蛋白溶酶和凝血酶。α-1 antitrypsin的缺乏与慢性阻塞性肺病的形成关系密切,因为它的缺乏,不能及时控制感染和炎症产生的多种蛋白酶,而造成肺组织破坏。
MPO是中性粒细胞的激活标志,其水平变化代表着嗜中性多形核白细胞的活性状态[15]。MPO的主要功能是在吞噬细胞内杀灭微生物,利用过氧化氢和氯离子产生次氯酸盐,并形成具有氧化能力的自由基。MPO不仅能杀灭吞噬于细胞内的微生物,而且可释放到细胞外,破坏多种靶物质,如肿瘤细胞、原虫、毒素等,对机体产生和调节炎症反应等多方面发挥作用。然而,在特定条件下,MPO催化反应生成的氧化剂超过局部抗氧化剂的防御反应时,就会导致氧化性组织损伤[16],炎症向管壁周围组织及肺泡扩展,导致细支气管周围炎,而且还可发生纤维闭塞性细支气管炎,是引起慢性阻塞性肺气肿的病变基础。阻塞性通气障碍慢性细支气管炎时,由于小气道的狭窄、阻塞或塌陷,导致了阻塞性通气障碍,使肺泡内残气量增多,肺泡扩张,间隔变窄,肺泡孔扩大,肺泡间隔断裂,扩张的肺泡融合成较大的囊腔。病理检测结果显示:白及颗粒中剂量组、白及颗粒高剂量组HE染色炎症分级显著降低;白及颗粒剂低剂量组、白及颗粒中剂量组、白及颗粒高剂量组大鼠肺脏细胞α-1 antitrypsin表达显著增加;白及颗粒中剂量组、白及颗粒高剂量组大鼠肺脏细胞NE表达显著降低;白及颗粒低剂量组、白及颗粒中剂量组、白及颗粒高剂量组大鼠肺脏细胞MPO表达显著降低。蛋白印迹检测结果显示:白及颗粒中剂量组、白及颗粒高剂量组大鼠肺组织内NE及MPO表达显著降低。
白及颗粒可能通过增加慢阻肺模型大鼠肺脏α-1 antitrypsin表达,降低NE及MPO的表达,起到减轻慢阻肺模型大鼠肺组织细胞炎症反应,最终产生改善慢阻肺模型大鼠肺功能的药理作用。
| [1] |
童夏生, 李昌崇, 范广民, 等. 髓过氧化物酶在大鼠哮喘中的作用及地塞米松对其的影响[J]. 中国免疫学杂志, 2006, 22(3): 267-271. TONG X S, LI C C, FAN G M, et al. The function and regulation by dexamethasone of myeloperoxidase in rat asthma[J]. Chinese Journal of Immunology, 2006, 22(3): 267-271. DOI:10.3321/j.issn:1000-484X.2006.03.021 |
| [2] |
仇煜, 钱晓君, 张雪, 等. 肺纤维化合并肺气肿和单纯慢阻肺肺气肿临床特点比较[J]. 临床肺科杂志, 2018, 23(9): 1634-1637. QIU Y, QIAN X J, ZHANG X, et al. Comparison of clinical characteristics between emphysema complicated with pulmonary interstitial fibrosis and simple emphysema[J]. Journal of Clinical Pulmonary Medicine, 2018, 23(9): 1634-1637. DOI:10.3969/j.issn.1009-6663.2018.09.020 |
| [3] |
辛田田, 杜玲玲, 张晓艳, 等. 白及颗粒对家兔盐酸吸入性肺损伤预防作用的研究[J]. 现代中西医结合杂志, 2018, 27(24): 2657-2660. XIN T T, DU L L, ZHANG X Y, et al. Study on preventive effect of Baiji granule on HCL-induced lung injury in rabbits[J]. Modern Journal of Integrated Traditional Chinese and Western Medicine, 2018, 27(24): 2657-2660. DOI:10.3969/j.issn.1008-8849.2018.24.010 |
| [4] |
孙乐乐, 杨永红, 刘军凯, 等. 白及的本草考证[J]. 中药材, 2010, 33(12): 1965-1968. SUN L L, YANG Y H, LIU J K, et al. Research on Baiji's materia medica[J]. Journal of Chinese Medicinal Materials, 2010, 33(12): 1965-1968. |
| [5] |
GREEN C E, TURNER A M. The role of the endothelium in asthma and chronic obstructive pulmonary disease (COPD)[J]. Respiratory Research, 2017, 18(1): 20. DOI:10.1186/s12931-017-0505-1 |
| [6] |
钟莲娣, 张春来, 左万里, 等. 罗格列酮抑制慢性阻塞性肺疾病模型大鼠炎性反应的机制研究[J]. 中国呼吸与危重监护杂志, 2018, 17(3): 230-236. ZHONG L D, ZHANG C L, ZUO W L, et al. The protective effects of rosiglitazone in chronic obstructive pulmonary disease rat models[J]. Chinese Journal of Respiratory and Critical Care Medicine, 2018, 17(3): 230-236. |
| [7] |
刘灵, 白丽, 陈慧婷. 牛黄对慢阻肺大鼠抗炎、抗凋亡的实验研究[J]. 光明中医, 2018, 33(6): 795-798. LIU L, BAI L, CHEN H T. Experimental study on anti-inflammatory and anti-apoptosis effects of bezoar on COPD rats[J]. Guangming Journal of Chinese Medicine, 2018, 33(6): 795-798. DOI:10.3969/j.issn.1003-8914.2018.06.019 |
| [8] |
熊小明, 童国强, 付云杰, 等. 支气管哮喘-慢性阻塞性肺疾病重叠综合征患者呼出气冷凝液和血清8-isoPG、MPO、LTB4、IL-6的测定及临床意义[J]. 实用医学杂志, 2018, 34(4): 649-652. XIONG X M, TONG G Q, FU Y J, et al. Clinical significance of exhaled breath condensate and serum 8-isoPG MPO, LTB4 and IL-6 in patients with bronchial asthma and chronic obstructive pulmonary disease overlap syndrome[J]. The Journal of Practical Medicine, 2018, 34(4): 649-652. DOI:10.3969/j.issn.1006-5725.2018.04.032 |
| [9] |
崔紫阳, 王红阳, 王昊辰, 等. 不同程度肺气肿表型慢阻肺患者血清同型半胱氨酸、趋化因子配体2水平与认知功能障碍的关系[J]. 中国呼吸与危重监护杂志, 2018, 17(1): 15-19. CUI Z Y, WANG H Y, WANG H C, et al. Relationship analysis of homocysteine and CCL2 serum levels with cognitive impairment in COPD patients with different degrees of emphysema[J]. Chinese Journal of Respiratory and Critical Care Medicine, 2018, 17(1): 15-19. |
| [10] |
刘亚茹, 刘玉静, 纪品川. 补肺活血汤治疗稳定期慢性阻塞性肺疾病的临床观察[J]. 天津中医药, 2019, 36(7): 650-654. LIU Y R, LIU Y J, JI P C. Clinical observation of Bufei Huoxue decoction in the treatment of stable chronic obstructive pulmonary disease[J]. Tianjin Journal of Traditional Chinese Medicine, 2019, 36(7): 650-654. |
| [11] |
陈燕, 钱伟. 慢性阻塞性肺病及吸烟人群血清MMP-9、NGAL、MMP-9/NGAL前体及中性白细胞弹性蛋白酶水平变化[J]. 临床肺科杂志, 2018, 23(1): 66-69. CHEN Y, QIAN W. Changes of serum MMP-9, NGAL, proMMP-9/NGAL and neutrophil elastase levels in smokers and chronic obstructive pulmonary disease patients[J]. Journal of Clinical Pulmonary Medicine, 2018, 23(1): 66-69. DOI:10.3969/j.issn.1009-6663.2018.01.019 |
| [12] |
杨金华, 赵叶, 李双, 等. 针刺对支气管哮喘大鼠肺组织P-AKT蛋白表达的调控[J]. 辽宁中医杂志, 2017, 44(10): 2190-2240. YANG J H, ZHAO Y, LI S, et al. Regulation of acupuncture on P-AKT expression in lung tissues of asthma rats[J]. Liaoning Journal of Traditional Chinese Medicine, 2017, 44(10): 2190-2240. |
| [13] |
李竹英, 邸宁, 何俊杰. 中西医对于哮喘-慢性阻塞性肺疾病重叠综合征的认识、诊断及治疗的研究进展[J]. 时珍国医国药, 2017, 28(8): 1985-1987. LI Z Y, DI N, HE J J. Research progress on the recognition, diagnosis and treatment of asthma-chronic obstructive pulmonary disease overlap syndrome in traditional Chinese and western medicine[J]. Lishizhen Medicine and Materia Medica Research, 2017, 28(8): 1985-1987. |
| [14] |
刘淑珍, 张卿, 郭爱莲, 等. Th17细胞相关因子在慢阻肺稳定期患者中的表达意义[J]. 临床肺科杂志, 2016, 21(9): 1596-1599. LIU S Z, ZHANG Q, GUO A L, et al. Expression and significance of related factors of Th17 cells in COPD patients at stable stage[J]. Journal of Clinical Pulmonary Medicine, 2016, 21(9): 1596-1599. DOI:10.3969/j.issn.1009-6663.2016.09.013 |
| [15] |
龙虹羽, 庞才双, 文富强. 血清视黄醇结合蛋白4与慢性阻塞性肺疾病相关性研究[J]. 中国实用内科杂志, 2015, 35(11): 938-940. LONG H Y, PANG C S, WEN F Q. Association between serum RBP4 and chronic obstructive pulmonary diseases[J]. Chinese Journal of Practical Internal Medicine, 2015, 35(11): 938-940. |
| [16] |
刘耀波. α1-抗胰蛋白酶和C反应蛋白水平改变在慢阻肺患者中的临床意义[J]. 社区医学杂志, 2015, 13(10): 45-46. LIU Y B. Clinical significance of changes in α1-antitrypsin and C-reactive protein levels in patients with COPD[J]. Journal of Community Medicine, 2015, 13(10): 45-46. |
2. Tianjin Hongri Kangrentang Pharmaceutical Co., Ltd, Tianjin 301700, China;
3. Central Laboratory, Beijing Institute of Cancer Prevention and Control Ministry of Education, Peking University Cancer Hospital&Institute, Beijing 100142, China
 2021, Vol. 38
2021, Vol. 38