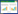文章信息
- 刘云, 郭洁, 张曼玲, 时昭红
- LIU Yun, GUO Jie, ZHANG Manling, SHI Zhaohong
- 葱白提取物诱导PGC-1α活化非酒精性脂肪性肝病大鼠线粒体代谢的研究
- Study of fistular onion stalk extract activating mitochondrial metabolism on non-alcoholic fatty liver disease rats by inducing PGC-1α
- 天津中医药, 2021, 38(2): 247-253
- Tianjin Journal of Traditional Chinese Medicine, 2021, 38(2): 247-253
- http://dx.doi.org/10.11656/j.issn.1672-1519.2021.02.22
-
文章历史
- 收稿日期: 2020-10-20
2. 武汉市第一医院, 武汉 430022
非酒精性脂肪性肝病(NAFLD)是一种与胰岛素抵抗(IR)和遗传易感密切相关的代谢应激性肝脏损伤,以弥漫性肝细胞大泡性脂肪变为主要特征,包括单纯性脂肪肝以及由其演变的脂肪性肝炎(NASH)和肝硬化[1]。NAFLD除直接或通过促进并存的其他肝病的进展,导致肝衰竭和肝细胞癌(HCC)外,还参与2型糖尿病和动脉硬化的发病,是导致慢性肝病的重要原因之一[2]。
本课题组前期通过动物实验发现,中剂量(50 mg/kg)葱白提取物每日灌胃可显著改善NAFLD大鼠脂肪肝变性[3],并通过上调过氧化物酶体增殖物激活受体α(PPARα)与过氧化物酶体增殖物受体γ辅助激活因子1α(PGC-1α)从而促进肝脏脂肪分解消耗[4]。近年来,随着线粒体功能障碍在NAFLD中的枢纽作用、转录辅助激活因子PGC-1α及其信号活化通路的发现[5],调控此线粒体代谢关键基因进而阻断NAFLD进展已成为治疗和新药研发的重点。前期研究已经表明辛温通阳中药葱白提取物能够上调NAFLD大鼠肝细胞内PGC-1α表达,而PGC-1α的上调能影响哪些线粒体代谢关键分子靶点,从而减少肝细胞内脂肪浸润及氧化损伤对揭示葱白提取物治疗NAFLD有重要意义。
1 材料与方法 1.1 动物及细胞系SPF级Sprague-Dawley雄性大鼠48只,6~8周龄,体质量180~220 g,由湖北省疾病控制中心提供。合格证编号:SCXK(鄂)2008-0005;293T细胞系,购于赛默飞公司。
1.2 药物与试剂葱白提取物来自于华夏小葱根茎,由武汉市第一医院药剂研究室采用超临界二氧化碳萃取工艺提取[6],为褐色粉末状,批号:20110902,以适量植物油调配成为悬混液,控制浓度为5 g/L;D12492高脂饲料(H10060),含60%能量,购于赛诺公司;由武汉巴菲尔生物有限公司提供空载腺病毒及PGC-1αRNAi腺病毒,PGC-1α RNAi腺病毒滴度:109 pfu/mL。PGC-1α抗体(PA5-22958)、线粒代谢相关蛋白细胞色素c氧化酶B(COX-B)抗体(ab15191)、线粒体转录因子(TFAM)抗体(sc-166965)、细胞色素c氧化酶合成蛋白(SCOX)抗体(sc-98499)、中链酰基辅酶A脱氢酶(MCAD)抗体(sc-98926)、核呼吸因子1(NRF-1)抗体(sc-54134)购于Santa Cruz公司,HRP标记羊抗兔二抗(BA1054)、HRP标记兔抗羊二抗(BA1060)、β-actin抗体(BM0627)购于武汉博士德生物工程有限公司。
1.3 主要仪器Sigma30高速低温离心机(法国,Sigma公司),HITACHI7160全自动生化检测仪(日本,HITACHI),微量移液器(Eppendorf公司),电泳仪电源(北京六一仪器厂,DYY-7C),垂直电泳槽(北京六一仪器厂,DYCZ-24DN),电转仪(北京六一仪器厂,DYCZ-40);水平摇床(江苏海门其林贝尔仪器制造有限公司,TS-1),pH计(德国Metter-Toledo GmbH公司,LP115),电子天平(北京赛多利斯仪器系统有限公司,CPA);P4000高效液相色谱仪(美国TSP公司),二极管陈列检测器(美国TSP公司,UV6000),荧光定量PCR仪(ABI7500,美国Temo公司)。
2 方法 2.1 造模方法48只SD大鼠饲养于武汉市第一医院动物房,昼夜节律12 h∶12 h,即晨6时开灯,晚6时关灯,20~24 ℃,25%相对湿度,自由饮水,适应性饲养7 d后,除外8只空白组大鼠给予维持饲料外,其余40只大鼠给予高脂饲料喂养12周。
2.2 造模后给药高脂饲料喂养12周后结束造模,空白组大鼠继续给予普通饲料持续喂养,另外40只大鼠随机分为模型组、葱白组、转染组、空转组及转染加葱白组,每组各8只,5组大鼠继续给予高脂饲料喂养;空白组大鼠每日生理盐水1 mL腹腔注射和3 mL生理盐水灌胃;葱白组大鼠每日葱白提取物灌胃1次,葱白提取物灌胃计量为50 mg/kg,同时生理盐水1 mL腹腔注射;转染组大鼠每日给予肠系膜上静脉(SMV)皮下置管给药0.05 mg/kg,同时予以3 mL生理盐水灌胃;空转组大鼠每日给予SMV皮下置管注射空载体病毒0.05 mg/kg,同时予以3 mL生理盐水灌胃;转染加葱白组大鼠每日给予SMV皮下置管给药0.05 mg/kg及50 mg/kg葱白提取物灌胃。各组操作固定每日下午,共持续进行4周。
2.3 标本采集药物处理4周后,大鼠禁食不禁水12 h,以3.5%水合氯醛腹腔注射麻醉大鼠,腹主动脉取血,静置一段时间,待血液分层后与4 ℃,3 000 r/min离心15 min,离心半径4 cm,分离血清,-80 ℃冻存备用。同时取出肝脏,称质量,用4 ℃生理盐水冲洗,常规进行苏木精-伊红(HE)及红油染色。
2.4 观察指标及方法观察大鼠进食、毛发、粪便、活动量情况。
2.4.1 化学合成的PGC-1α小干扰RNA的构建与应用化学合成的PGC-1α小干扰RNA(SiRNA)参照设计的序列:反义链5’-CCACCTAACTTCAC-CACATCT3-’,正义链5’-AGATGTGGTGAATTTA-GGTGG-3’,将化学合成的PGC-1αsiRNA转染至NAFLD进展期大鼠,采用经SMV皮下置管给药通路。麻醉大鼠后,腹中线切开,显露SMV,将24号穿刺导管针从SMV分支插入。固定后,以硬膜外导管续接引入皮下,外接肝素帽后固定,供siRNA注射用。采用荧光实时定量聚合酶链式反应(Realtime PCR)检测PGC-1α的表达,验证转染成功。
2.4.2 肝组织病理学检查在各组大鼠肝右叶相同处取适量肝组织,于10%甲醛溶液中固定,再经脱水后以石蜡包埋,最后进行HE及红油染色,在光学显微镜下观察肝脏的病理变化。并按照NAFLD活动性评分(NAS评分)标准进行打分[5]。
2.4.3 血清中高密度脂蛋白(HDL-C)、低密度脂蛋白(LDL-C)、血清总胆固醇(TC)、三酰甘油(TG)含量测定生化检测仪测定各组大鼠血清中HDL-C、LDL-C、TC、TG含量。
2.4.4 RNA的提取和逆转录聚合酶链反应引物设计见表 1,Trizol试剂一步反向引物法抽提肝组织总RNA,紫外分光光度仪检测其浓度及纯度,1%琼脂糖变性电泳检测RNA完整性。用M-MLV逆转录酶进行反转录,PCR扩增上述基因,同时扩增β-actin蛋白作内参照。取6~10 μL扩增产物于1.5%琼脂糖凝胶电泳,紫外投射仪上观察、照相。
取肝组织匀浆,磷酸盐缓冲液(PBS)洗涤离心3次,加蛋白提取液200 μL混匀,沸水煮10~15 min后,12 000 r/min离心30 min,离心半径4 cm,取上清液,测总蛋白浓度,-20 ℃保存备用。配制10%十二烷基硫酸钠(SDS)-聚丙烯酰胺凝胶,样品加热变性后每孔加80 μg蛋白,电泳分离,电转移至硝酸纤维素膜,脱脂奶粉4 ℃摇动封闭过夜,膜在一抗中室温下孵育2 h,TBS洗涤,二抗室温2 h。加显色液1 μL,X线底片曝光,显影、定影,并对底片上反应条带行计算机密度扫描定量分析。
2.5 统计学方法使用SPSS 24.0软件对所有数据进行统计学分析,计量资料以均数±标准差(x±s)表示。两组间比较采用独立样本t检验,多组间比较采用单因素方差分析,组间两两比较采用LSD法。P<0.05为差异有统计学意义。
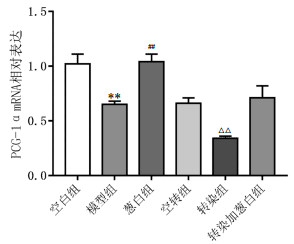
3 结果 3.1 PGC-1α RNAi腺病毒及空载体腺病毒包装及转染率实验在实验各组大鼠中进行PGC-1α RNAi腺病毒转染验证。结果显示空白组1.12±0.09,模型组0.65±0.03,葱白组1.04±0.07,转染组0.34±0.02,空转组0.66±0.05,转染加葱白组0.71±0.11。和空转组比,转染组PGC-1α mRNA的表达水平明显降低(P<0.01),证实转染成功。和空白组比,模型组PGC-1α mRNA的表达水平降低(P<0.01),证实NAFLD发生发展过程与PGC-1α失活相关。和模型组比,葱白组PGC-1α mRNA的表达水平增加(P<0.01),转染加葱白组差异无统计学意义。见图 1。
|
| 注:与空白组比较,**P<0.01;与模型组比较,##P<0.01;与空转组比较,△△P<0.01 图 1 PGC-1αRNAi腺病毒实验各组大鼠肝脏PGC-1α mRNA表达的影响(x±s,n=8) Fig. 1 Effect of PGC-1αRNAi adenovirus on PGC-1α mRNA expression of rat liver in each group (x±s, n=8) |
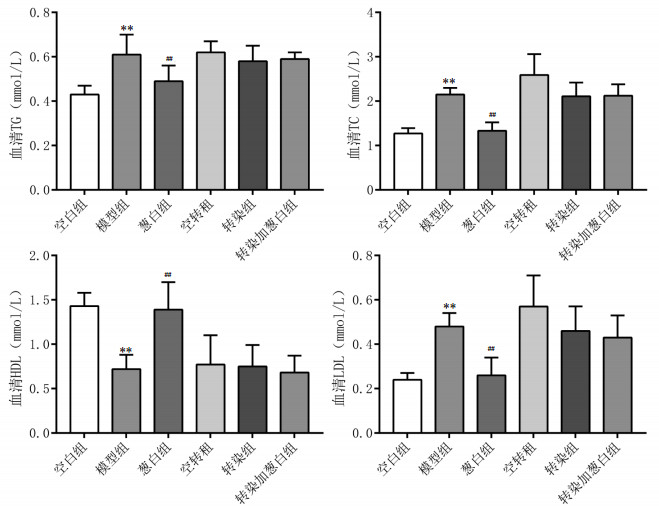
高脂饲料可显著影响大鼠血清TG、TC、HDL-C、LDL-C水平,与空白组比较,模型组NAFLD大鼠血清TC、TG、LDL-C的表达水平均升高,HDL-C水平下降(P<0.01);而葱白提取物可改善高脂饮食对血清TC、TG、HDL-C、LDL-C水平的影响,与模型组比较,通过葱白提取物灌胃后葱白组大鼠血清TC、TG、LDL-C表达水平均降低,HDL-C水平升高(P<0.01);转染组、空转组及转染加葱白组与模型组间的差异无统计学意义,见图 2。
|
| 注:与空白组比较,**P<0.01;与模型组比较,##P<0.01。 图 2 实验各组大鼠血清TG、TC、HDL-C、LDL-C浓度比较(mmol/L,x±s,n=8) Fig. 2 Comparison of serum concentrations of TG, TC, HDL-C and LDL-C of rats in each group (mmol/L, x±s, n=8) |
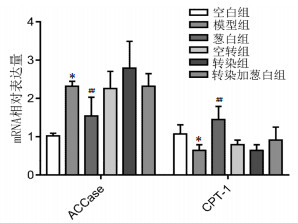
为验证葱白提取物对肝脏脂质合成的影响,我们检测了脂肪酸合成与分解关键限速酶ACCase与CPT-1 mRNA的表达。与空白组相比较,模型组大鼠ACCase mRNA表达升高(P<0.05),而CPT-1 mRNA表达降低(P<0.05);与模型组相比,葱白组ACCase mRNA表达明显降低(P<0.01),而CPT-1 mRNA表达明显升高(P<0.01),见图 3。与模型组相比,转染组和转染加葱白组未见明显异常。
|
| 注:与空白组比较,*P<0.05;与模型组比较,##P<0.01。 图 3 实验各组大鼠肝脏ACCase mRNA、CPT-1mRNA的表达(x±s,n=8) Fig. 3 Expression of ACCase and CPT-1 mRNA of rats in each group(x±s, n=8) |
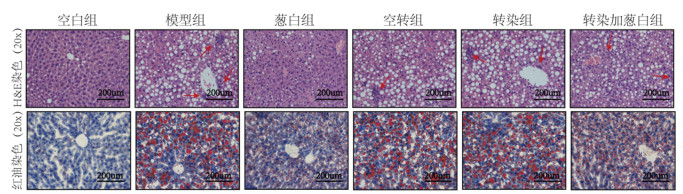
从肝脏外观来看,空白组大鼠肝脏色泽鲜红,表面光滑,边缘锐利;葱白组接近正常对照组,无明显油腻状,指压有弹性,体积大小接近正常对照组;其余4组大鼠肝脏肉眼观体积增大,颜色浅黄,质软,边缘变钝,表面带油腻感。
从HE染色结果来看,空白组细胞基本无异常变化,未见明显脂滴空泡;模型组,空转组,转染组及转染加葱白组细胞胞浆内充满大小不等的脂滴空泡,部分肝细胞核被挤到一边,细胞肿胀,同时可见用红色箭头标记的炎性细胞浸润;葱白组细胞内脂滴明显少于模型组。
从油红染色结果来看,空白组肝细胞边缘清晰,核大,细胞内未见红色脂滴聚集;模型组,空转组及转染组肝细胞边缘欠清晰,细胞间结合欠紧密,胞浆内充满大小不等的红色脂滴,细胞发生明显的肿胀;葱白组肝细胞内橘红色脂滴明显少于模型组,转染加葱白组肝细胞内红色脂滴介于模型组和葱白组之间。
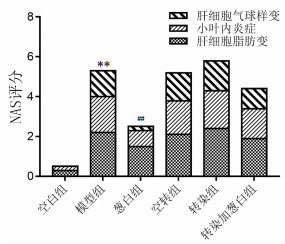
通过肝细胞气球样变、小叶内炎症及肝细胞脂肪变3方面进行NAS评分,其结果显示与空白组大鼠相比,高脂饮食造成的模型组大鼠的NAS评分显著升高(P<0.01);与模型组相比,经葱白提取物处理后的葱白组大鼠肝脏NAS评分有明显改善(P<0.01);空转组,转染组,转染加葱白组未见明显差异。见图 4,图 5。
|
| 图 4 实验各组大鼠肝脏组织HE及红油染色 Fig. 4 HE and red oil stain of rat liver tissue of rats in each group |
|
| 注:与空白组比较,**P<0.01;与模型组比较,##P<0.01。 图 5 实验各组大鼠肝脏NAS量表评分(x±s,n=8) Fig. 5 NAS scale scores of liver of rats in each group(x±s, n=8) |
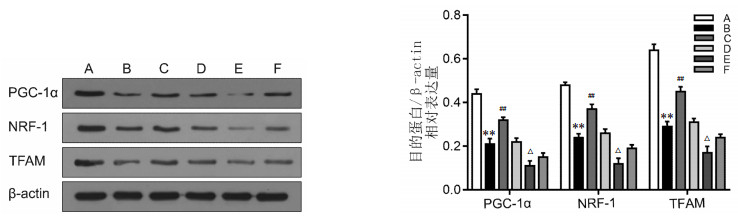
细胞凋亡是NAFLD疾病进展的最要标志之一,而肝细胞凋亡的途径主要有两种,即死亡受体通路及线粒体通路[7-8]。因此,本实验研究了葱白提取物对NAFLD大鼠肝脏线粒体合成的影响。在实验各组大鼠中,与空白组比较,模型组大鼠肝脏的PGC-1α、NRF-1、TFAM蛋白的表达明显降低(P<0.01);与模型组比较,葱白组大鼠肝脏的PGC-1α、NRF-1、TFAM蛋白表达升高(P<0.01);与空转组比较,转染了PGC-1αSiRNA的转染组大鼠中PGC-1α、NRF-1、TFAM蛋白表达明显降低(P<0.05)。见图 6。
|
| 注:A.空白组,B.模型组,C.葱白组,D.空转组,E.转染组,F.转染加葱白组。与空白组比较,**P<0.01;与模型组比较,##P<0.01;与空转组比较,△P<0.05。 图 6 大鼠肝脏PGC-1α、NRF-1、TFAM蛋白的表达水平条带图及灰度统计图(x±s,n=8) Fig. 6 Histogram and gray scale statistical map of the levels of PGC -1α, NRF -1, TFAM in rat liver tissue detected by Western Blot(x±s, n=8) |
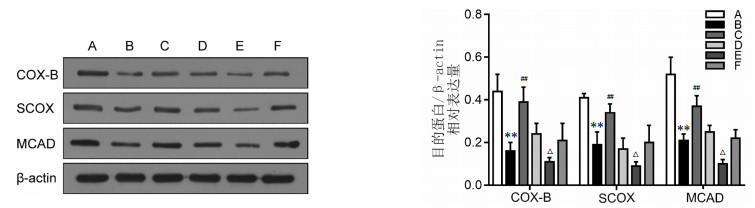
实验研究表明,线粒体呼吸连中关键限速酶的下降,可导致电子传递的紊乱,致使线粒体的肿胀、凋亡,进而引起“二次打击”[9-12]。因此,本实验对线粒体呼吸链关键分子靶点进行了研究,以验证葱白提取物对其影响。在实验各组大鼠中,与正常组比较,模型组的线粒体代谢功能相关蛋白COX-B、SCOX、MCAD的表达明显降低(P<0.01);与模型组比较,葱白组的COX-B、SCOX、MCAD蛋白表达升高(P<0.01);与空转组比较,转染组的COX-B、SCOX、MCAD蛋白表达明显降低(P<0.05)。见图 7。
|
| 注:A.空白组,B.模型组,C.葱白组,D.空转组,E.转染组,F.转染加葱白组。与空白组比较,**P<0.01;与模型组比较,##P<0.01;与空转组比较,△P<0.05。 图 7 大鼠肝脏COX-B、SCOX、MCAD蛋白的表达水平条带图及灰度统计图(x±s,n=8) Fig. 7 Histogram and gray scale statistical map of the levels of COX-B, SCOX, MCAD in rat liver tissue detected by Western Blot(x±s, n=8) |
NAFLD的发病机制虽尚未完全明了,但“二次打击”学说为目前医学界广泛接受。第1次打击是以胰岛素抵抗(IR)为中心的肝内脂肪的蓄积,第2次打击是氧化磷酸化的激活、呼吸链的损伤导致能量代谢障碍、细胞因子活化,从而引起炎症和纤维化[13]。
线粒体的合成和代谢功能的紊乱是NAFLD疾病进展的关键因素之一。线粒体被誉为“人体的化工厂”,在肝细胞线粒体中存在着多种代谢反应,它既是肝细胞三磷酸腺苷(ATP)合成的场所,又是脂肪酸β氧化和肝糖异生的主要场所[14]。线粒体代谢功能失调参与了NAFLD的发生发展。在NAFLD早期,肝糖异生增加与IR密切相关。随着病情进展,可使线粒体超微结构出现了损伤,其呼吸链复合物的量及活性下降,合成ATP的功能障碍。因此,线粒体代谢障碍与胰岛素抵抗,氧应激,脂质过氧化和ATP合成减少等均密切相关,是NAFLD发生发展的关键。保护肝细胞线粒体,提高肝细胞抗氧化能力,阻止过氧化应激反应,对于减少肝脏脂肪沉积并避免因“二次打击”而导致肝功能失代偿具有重要意义[15]。
通过血生化检查,证实葱白提取物能改善NAFLD大鼠血脂水平,可显著降低血清TG、TC、LDL-C浓度,升高血清HDL-C浓度。同时,葱白提取物可降低脂质合成基因ACCase[16]的表达,并升高促进脂肪酸氧化分解基因CPT-1[17]的表达。通过HE染色及红油染色,证实葱白提取物能改善NAFLD大鼠肝脏小叶内炎症、肝细胞气球样变及肝细胞脂肪变。
PGC-1α在肝脏中最重要的作用是通过促进NRF-1和2,雌激素相关受体α(ERRα)以及转录抑制蛋白阴阳1(YY1)的转录来增加肝细胞线粒体生物合成[18-20]。其中,NRFs可通过调节TFAM表达的,TFAM作为线粒体DNA转录因子,可控制线粒体内DNA复制、保存以及表达,虽然ERRα和YY1同样具有上述作用,但任然是NRFs占主导地位[21];同时,NRFs还可控制编码氧化磷酸化蛋白的核基因的表达[22]。因此,PGC-1α可同时上调线粒体DNA和线粒体DNA编码的蛋白的数量,进而增加脂肪酸氧化、柠檬酸循环和氧化磷酸化的能力。
通过比较模型组与葱白组NRF-1、TFAM蛋白的表达,实验发现葱白提取物是通过上调PGC-1α表达来增加肝细胞线粒体DNA及其编码蛋白的表达,对维持正常的线粒体功能有重要作用。
进一步的研究表明NRF-1,TFAM表达的下降可影响线粒体呼吸链的稳定[23]。线粒体呼吸链是由多种酶所共同构成,如SCOX,COX-B,MCAD[24]。
因此,在本次实验中验证了葱白提取物对线粒体呼吸链稳定性的影响。笔者发现在模型组大鼠中PGC-1α、SCOX、COX-B以及MCAD的表达共同下降,呈正相关性;与模型组大鼠相比,葱白组大鼠在运用葱白提取物后PGC-1α、SCOX、COX-B、MCAD蛋白表达上调,证实葱白提取物可通过上调PGC-1α,增加SCOX、COX-B、MCAD蛋白的表达,进而维持线粒体呼吸链稳定性。
综上所述,通过运用辛温通阳的葱白提取物可诱导PGC-1α的高表达,PGC-1α作为转录辅助因子可促进线粒体的生物合成相关蛋白NRF-1、TFAM上调,而NRF-1、TFAM上调可增加氧化还原反应关键蛋白SCOX、COX-B和MCAD,为维持呼吸链的稳定起到重要作用,使肝细胞维持正常的脂肪酸代谢及糖异生反应,从而减轻TG在肝脏的堆积,可达到治疗脂肪肝变性的目的。
| [1] |
YOUNOSSI Z M, KOENIG A B, ABDELATIF D, et al. Global epidemiology of nonalcoholic fatty liver disease: meta-analytic assessment of prevalence, incidence, and outcomes[J]. Hepatology, 2016, 64(1): 73. DOI:10.1002/hep.28431 |
| [2] |
LI Z, XUE J, CHEN P, et al. Prevalence of nonalcoholic fatty liver disease in mainland of China: a-meta-analysis of published studies[J]. Journal of Gastroenterology and Hepatology, 2014, 29(1): 42-51. DOI:10.1111/jgh.12428 |
| [3] |
时昭红, 王湘宁, 张长弓, 等. 葱白提取物对非酒精性脂肪肝大鼠的治疗作用[J]. 世界华人消化杂志, 2010, 18(27): 2863-2868. SHI Z H, WANG X N, ZHANG C G, et al. Therapeutic effects of fistular onion stalk extract on nonalcoholic fatty liver in rats[J]. World Chinese Journal of Digestology, 2010, 18(27): 2863-2868. |
| [4] |
时昭红, 张介眉, 林丽莉, 等. 葱白提取物对脂肪变性肝细胞模型PPAR-α及PGC-1表达的影响[J]. 中华中医药杂志, 2011, 26(9): 2042-2045. SHI Z H, ZHANG J M, LIN L L, et al. Effects of onion extract on PPAR-α and PGC-1 in steatosis liver cell[J]. Chinese Journal of Traditional Chinese Medicine, 2011, 26(9): 2042-2045. |
| [5] |
KOJIMA H, SAKURAI S, UEMURA M, et al. Mitoehondrial abnormality and oxidative stress in nonalcoholic steatohepatitis[J]. Alcoholism-clinical and Experimental Research, 2007, 31(1 Suppl): 561-566. |
| [6] |
程明, 温荣, 张长弓. 葱白超临界二氧化碳萃取工艺考察[J]. 医药导报, 2008, 27(2): 213-215. CHEN M, WEN R, ZHANG C G. Study on supercritical carbon dioxide extraction technology of scallion white[J]. Herald of Medicine, 2008, 27(2): 213-215. DOI:10.3870/j.issn.1004-0781.2008.02.039 |
| [7] |
ZHAI H L, WANG N J, HAN B, et al. Low vitamin D levels and nonalcoholic fatty liver disease, evidence for their independent association in men in East China: a cross-sectional study (survey on prevalence in East China for metabolic diseasesand risk factors (SPECT-China)[J]. British Journal of Nutrion, 2016, 115(8): 1352-1359. DOI:10.1017/S0007114516000386 |
| [8] |
KANDA T, MATSUOKA S, YAMAZAKI M, et al. Apoptosis and non-alcoholic fatty liver diseases[J]. World Journal of Gastroenterology, 2018, 24(25): 2661-2672. DOI:10.3748/wjg.v24.i25.2661 |
| [9] |
SPAHIS S, DELVIN E, BOVYS J M, et al. Oxidative stress as a critical factor in nonalcoholic fatty liver disease pathogenesis[J]. Antioxid Redox Signal, 2017, 26(10): 519-541. DOI:10.1089/ars.2016.6776 |
| [10] |
PIERANTONELLI I, SVEGLIATI B G. Nonalcoholic fatty liver disease: basic pathogenetic mechanisms in the progression from NAFLD to NASH[J]. Transplantation, 2019, 103(1): e1-e13. DOI:10.1097/TP.0000000000002480 |
| [11] |
LI Z, LI Y, ZHANG H X, et al. Mitochondria-mediated pathogenesis and therapeutics for non-alcoholic fatty liver disease[J]. Molecular Nutrition & Food Research, 2019, 63(16): e1900043. |
| [12] |
NASSIR F, IBDAH J A. Role of mitochondria in nonalcoholic fatty liver disease[J]. International Journal of Molecular Sciences, 2014, 15(5): 8713-8742. DOI:10.3390/ijms15058713 |
| [13] |
DAY C P. Pathogenesis of steatohepatitis[J]. Baillieres Best Practice and Research Clinical Gastroenterology, 2002, 16: 663-678. DOI:10.1053/bega.2002.0333 |
| [14] |
PEREZ C M, DEL H P, MARTIN M A, et al. Defective hepatic mitochondrial respiratory chain in patients with nonalcoholic steatohepatitis[J]. Hepatology, 2003, 384(4): 999-1007. |
| [15] |
BESSONE F, RAZORI M V, ROMA M G. Molecular pathways of nonalcoholic fatty liver disease development and progression[J]. Cellular and Molecular Life Sciences, 2019, 76(1): 99-128. DOI:10.1007/s00018-018-2947-0 |
| [16] |
RUDERMAN N, FLIER J S. Chewing the fat--ACC and energy balance[J]. Science, 2001, 291(5513): 2558-2559. DOI:10.1126/science.1060277 |
| [17] |
COOK G A, EDWARDS T L, JANSEN M S, et al. Differential regulation of Carnitine Palmitoyl transferase-I gene isoforms (CPT-I α and CPT-Iβ) in the rat heart[J]. Journal of Molecular and Cellular Cardiology, 2001, 33(2): 317-329. DOI:10.1006/jmcc.2000.1304 |
| [18] |
WU Z, PUIGSERVER P, ANDERSSON U, et al. Mechanisms controlling mitochondrial biogenesis and respiration through the thermogenic coactivator PGC-1[J]. Cell, 1999, 98(1): 115-124. DOI:10.1016/S0092-8674(00)80611-X |
| [19] |
SCHREIBER S N, EMTER R, HOCK M B, et al. The estrogen-related receptor α (ERRα) functions in PPARγ coactivator 1α (PGC-1α)-induced mitochondrial biogenesis[J]. Proceedings of the National Academy of Sciences, 2004, 101(17): 6472-6477. DOI:10.1073/pnas.0308686101 |
| [20] |
SCARPULLA R C. Nuclear control of respiratory chain expression by nuclear respiratory factors and PGC-1-related coactivator[J]. Annals of the New York Academy of Sciences, 2008, 1147: 321. DOI:10.1196/annals.1427.006 |
| [21] |
LARSSON N G, WANG J, WILLHELMSSON H, et al. Mitochondrial transcription factor A is necessary for mt DNA maintance and embryogenesis in mice[J]. Nature Genetics, 1998, 18(3): 231-236. DOI:10.1038/ng0398-231 |
| [22] |
SCARPULLA R C. Nuclear activators and coactivators in mammalian mitochondrial biogenesis[J]. Biochimica et Biophysica Acta (BBA)-Gene Structure and Expression, 2002, 1576(1-2): 1-14. DOI:10.1016/S0167-4781(02)00343-3 |
| [23] |
RICH P R, MAREHAL A. The mitochondrial respiratory chain[J]. Essays in Biochemistry, 2010, 47: 1-23. DOI:10.1042/bse0470001 |
| [24] |
STANICOVA J, SEDLAK E, MUSATOY A, et al. Differential stability of dimeric and monomeric cytochrome c oxidase exposed to elevated hydrostatic pressure[J]. Biochemistry, 2007, 4624(24): 7146-7152. |
2. Wuhan No.1 hospital, Wuhan 430022, China
 2021, Vol. 38
2021, Vol. 38