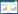文章信息
- 朱征, 金鑫瑶, 郑文科, 张明妍, 杨丰文, 王辉, 张俊华
- ZHU Zheng, JIN Xinyao, ZHENG Wenke, ZHANG Mingyan, YANG Fengwen, WANG Hui, ZHANG Junhua
- 药物治疗老年急性髓系白血病临床研究评价指标分析
- Analysis of clinical evaluation outcomes of drug treatment for elderly acute myeloid leukemia
- 天津中医药, 2021, 38(3): 344-349
- Tianjin Journal of Traditional Chinese Medicine, 2021, 38(3): 344-349
- http://dx.doi.org/10.11656/j.issn.1672-1519.2021.03.15
-
文章历史
- 收稿日期: 2020-11-25
急性髓系白血病(AML)是一种起源于造血干、祖细胞的髓系造血系统恶性肿瘤,占所有急性白血病的70%[1]。随着人口老龄化加重,化学毒物接触史增加,近年来老年(≥60岁)AML发病率显著增加,AML中位发病年龄已接近70岁[2]。由于老年患者器官退化,对化疗药耐受性差且多伴有基础疾病,加之疾病本身如高不良细胞遗传学频率、分子学改变、白血病细胞多药耐药等因素,老年AML患者的治疗较为棘手,目前尚未找到非常适合老年AML患者的标准治疗方案,整体预后差[3]。相比于年轻AML患者逐年提升的治愈率,老年AML患者长期生存时间仍很低,5年生存率仅5%~10%[4-5]。
中国、欧洲、美国的AML指南均将老年AML患者的治疗整体分为高强度化疗及非高强度化疗两大类,后者包括减低强度治疗、药物临床试验及最佳支持治疗等[6-8]。临床可耐受高强度化疗的老年AML患者占比极少,大部分老年AML患者选择减低强度治疗或药物临床试验,如加用粒细胞集落刺激因子(G-CSF)、人粒细胞巨噬细胞集落刺激因子(GM-CSF)等粒细胞刺激因子、减低化疗强度的预激方案或联合去甲基化药物如地西他滨、阿扎胞苷的新药临床试验方案。中医药辨证论治结合西医化疗方案在临床上治疗老年AML也较为常见,并取得了较好的疗效。目前较少有老年AML的高质量临床研究发表。药物治疗老年AML的评价指标如何选择尚缺乏共识。本研究通过分析国内外近5年药物治疗老年AML的随机对照试验(RCT),系统分析和梳理研究中采用的评价指标,以期为构建老年AML核心指标集奠定基础。
1 资料与方法 1.1 纳入排除标准 1.1.1 纳入标准1)研究类型:RCT。2)研究对象:明确符合AML诊断、年龄≥60岁的患者。3)干预措施:药物治疗,包括化学药物治疗、生物药物治疗,中医药治疗等治疗措施。4)评价指标:研究采用的所有指标,包括有效性评价指标和安全性评价指标。
1.1.2 排除标准1)合并其他疾病的研究。2)重复发表的研究。
1.2 检索方法计算机检索中国期刊全文数据库(CNKI)、万方数据库(WanFang Data)、中国生物医学文献数据库(SinoMed)、PubMed、The Cochrane Library和EMbase数据库,同时追踪已检出文献的参考文献,以提高查全率。检索时限为2015年1月1日—2020年11月1日。中文检索词为“老年白血病”“老年急性白血病”“老年急性髓系白血病”;英文检索词为“Elderly acute myeloid leukemia”。为了避免漏检,不对干预措施进行限定。
补充检索中国临床试验注册中心、美国临床试验数据库(ClinicalTrials.gov)平台中已注册临床试验方案,检索词为“老年急性髓系白血病”“Elderly acute myeloid leukemia”,检索时间为2015年1月1日—2020年11月1日。
1.3 文献筛选与资料提取由2名研究者按照纳入与排除标准独立进行文献筛选,如遇分歧,经讨论解决。采用预先设计的Excel表格提取资料,提取信息包括作者信息、干预措施、疗程、随访时间、评价指标、指标测量时点等。
2 结果 2.1 研究筛选流程初筛获得1 760篇文献,其中中文文献1 629篇,英文文献131篇。查重后共得到569篇文献,通过阅读标题及摘要获得文献84篇,阅读全文复筛,排除34篇,最终纳入文献50篇,其中中文文献41篇,英文文献9篇。临床试验注册平台检索获得临床试验注册方案56项,根据纳入与排除标准,最终纳入14项临床试验方案。文献、临床研究注册方案筛选流程见图 1。
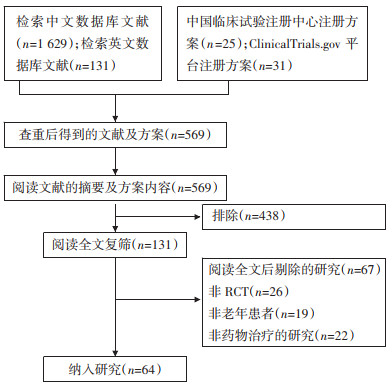
|
| 图 1 筛选流程图 Fig. 1 Literature search and selection process |
研究纳入50个RCT与14个临床试验注册方案,其中干预措施为化学药物的研究55项,包括经典化疗药物重组、去甲基化药物、减低强度预激化疗方案;生物免疫治疗3项,干预措施为吉妥珠单抗;中医药联合化疗的临床研究6项,中医药干预为香菇多糖、升麻鳖甲汤、口服中药汤剂等。
2.2.2 疗程及治疗时间62个研究(96.87 %)报告了试验疗程,每个治疗疗程7~14 d不等,累积治疗时间最短为7 d,最长为64 d。其中1个疗程的研究共36项(56.25 %),治疗时间为7~14 d,2个疗程的研究18项(28.13 %),治疗时间为14~28 d。≥3个疗程的研究共8项(12.50 %),治疗时间为42~64 d。结果见表 1。
30项(46.88 %)研究报告了随访时间,其中17项研究的随访时间<3年,13项随访时间≥3年,只有3项研究随访时间为5年。
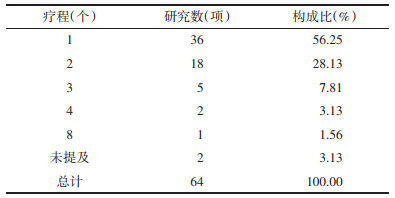
2.3 评价指标 2.3.1 指标总体情况纳入的64项研究,采用了168个评价指标,合计使用252次。单个研究评价指标数量最少为1个,最多达9个,采用≥5个评价指标的研究有20个(31.25 %)。
2.3.2 指标标化对提取的168个评价指标名称进行规范化处理,具体包括:1)在保证不影响原意的情况下,将细化的、模糊的分类统一为一个大类,进行规范表述,如通过阅读原文,发现文献中多使用“近期疗效”“临床疗效”“治疗效果”等来描述疾病缓解比例,根据具体内容,将其标化为“总缓解率”“完全缓解率”“部分缓解率”。2)对同一指标不同表达方式进行合并,如将“生存率”“生存时间”合并为“生存时间/率”,将“无进展生存期”“无进展生存率”合并为“无进展生存期/率”等。3)将同一指标的不规范表达进行统一规范,如将“外周血常规”“造血功能指标(HGB、PLT水平)”“治疗前后Hb、WBC和PLT比较”“血常规”等统一合并为“外周血常规”。最终将168个指标规范为38个指标。
2.3.3 指标域及归类以指标的功能属性为依据,按照临床疗效、生存状况、理化检查、生活质量、中医证候、安全性指标共分为6个域,并进行频次统计,见图 2、表 2。
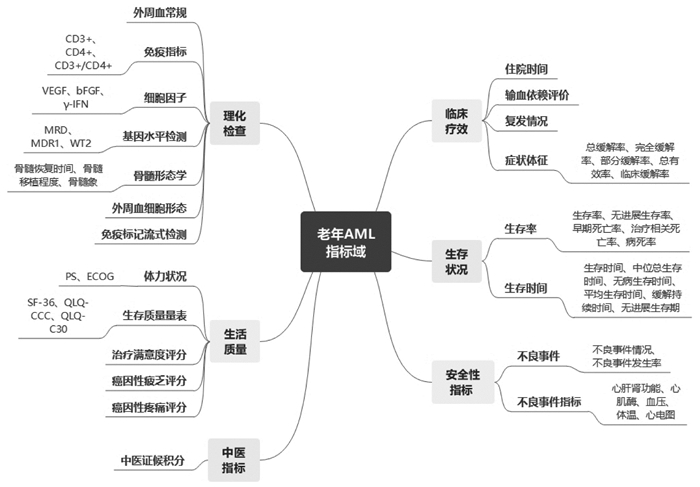
|
| 注: CD3+. T淋巴细胞总值; CD4+. T淋巴细胞亚群分析CD4+; CD3+/CD4+. T淋巴细胞亚群分析CD3+/CD4+比值; VEGF.血管内皮生长因子; bFGF. 碱性成纤维细胞生长因子; γ-IFN. γ-干扰素; MRD.白血病微小残留; MDR1. MDR1基因; WT2. WT2基因; PS.体力状况评分; EC0C.美国东部肿瘤协作组评分; SF-36.健康调查简表; QLQ-CCC.中国癌症患者化疗生活质量量表; QLQ-C30. EORTC生命质量测定量表。 图 2 老年AML临床研究评价指标域 Fig. 2 Classification of clinical evaluntion outcomes for elderly AML |
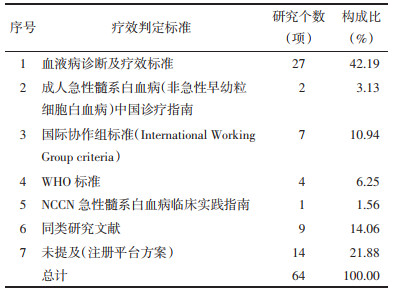
本次纳入的研究多采用疾病治疗缓解比例来描述干预措施的“临床疗效”,50篇文献报告了疗效判定标准,包括6种标准,具体如下:27篇中文研究采用《血液病诊断及疗效标准》[9],2篇中文研究采用《成人急性髓系白血病(非急性早幼粒细胞白血病)中国诊疗指南》标准,欧美国家发表的研究多采纳国际协作组标准(International Working Group criteria)[10]。此外9篇文章采用同类研究文献论述作为疗效评价标准。结果见表 3。
本次纳入的研究较少报告指标的测量时点,仅18项(28.13 %)研究报告了指标的测量时点,且测量时点多为疗程结束或生存期随访时点。4项(6.25 %)研究设置了多个测量时点,其中1项研究在进行生存期随访时设置了“3个月”“6个月”“9个月”“1年”4个测量时点。
3 讨论本研究通过对近5年药物治疗老年AML的RCT及临床试验注册方案评价指标进行汇总、梳理,发现评价指标的报告存在表述不规范、指标定义不清晰、有效性判定标准不统一、指标测量时点报告不规范、指标选取不当等问题。
3.1 指标表述的规范性问题1)报告指标的名称不具体,如仅概述为“外周血免疫细胞对比”或“炎症因子水平”,未明确具体评价项目。2)指标的表达不准确,如在表述患者近期疗效的指标中存在“近期疗效”“临床效果”“治疗效果”“临床疗效”等多个表达方式,不符合临床指南疗效判定时使用的“总缓解率”“完全缓解率”“部分缓解率”等临床疗效的表达。3)指标名称未使用规范术语,如存在“外周血常规”“血常规”“血象”等多个表达方式。指标使用不规范不利于临床研究的实施和统计分析,同时也不利于多项同类研究结果的合并分析。因此,建议临床试验指标选择时参考指南等规范性文件,选择公认的指标,并选择标准的报告名称。
3.2 指标定义问题本次纳入的研究对于近期疗效指标如“完全缓解率”的定义及判定标准差异较大,这使得各项研究的近期疗效无法比较及合并分析。此外,AML的疗效常结合患者生活质量、白细胞浸润所致症状体征、外周血常规、骨髓形态学进行综合判定。因此使用“总缓解率”“完全缓解率”“部分缓解率”等指标的研究应该从以上4个方面对患者的疗效进行评价。但从所纳入的研究来看,没有文章同时报告缓解率、生活质量、症状体征、骨髓形态学、外周血常规等指标,因此研究报告的缓解率的可信度将降低。若研究采集了以上指标而未报告,则造成了研究资源的浪费且不能保证研究的透明化[11]。
3.3 指标测量时点的合理性基于不同研究目的所选择的评价指标其测量时点的选择也应有所不同。成人急性髓系白血病(非急性早幼粒细胞白血病)中国诊疗指南推荐复查时点为化疗结束后7~14 d以及21~28 d,评价是否完全缓解最多不超过2个疗程[6]。AML确诊之日起存活时间达5年或5年以上视为长期存活,停止化疗5年或无病生存10年视为临床治愈[9]。本研究发现纳入研究在评价近期疗效时,极少提及评价时点,疗程数超过2个的研究有8项;评价远期疗效的38项研究中,明确随访时间的有25项,随访5年的研究仅3项。在1项为评估长期疗效的研究中,设置3个月、6个月等较短的评价时点是否有必要是需要讨论的问题。此外结合研究起止日期及文章发表日期可以发现,部分研究患者不能全部完成规定的随访时间,这使得长期疗效评价指标的可信度受到影响。
3.4临床研究的目的是回答临床最关切的或有争议的问题,而研究评价指标的选择是研究目的的直接体现[12]。对于老年AML而言,根据老年患者体能与脏器功能情况的差异,老年AML的治疗策略也存在侧重近期疗效或侧重远期疗效两种不同的治疗侧重,因此针对不同策略的研究选择的评价指标应有所区别。侧重于延长老年AML患者生存期的研究在选择评价指标时,可选择总生存期、无病生存期等远期疗效指标作为主要指标;提高骨髓缓解率等近期疗效的研究,可选择完全缓解率、免疫标记流式检测、基因检测等近期疗效指标作为主要评价指标。建议在今后老年AML临床研究设计时,根据研究目的有所侧重选择评价指标。
3.5 安全性指标选择的合理性45个研究报告了安全性评价指标,但部分研究未明确说明安全性相关指标的具体内容,仅描述为“不良反应情况”或“不良反应率”。AML治疗中常见不良反应为出血、乏力、感染等,这些在所纳入研究的安全性指标里并未完全体现。老年AML患者要综合考虑体力状况、脏器功能情况以及白血病化疗耐药相关因素,如细胞及分子遗传学特征,治疗反应、既往血液病史及放、化疗病史等来选择干预措施[13]。从纳入研究的干预措施分析来看,老年AML临床研究所使用的经典化疗药物重组、联合去甲基化药物、预激减量化疗方案、中西医结合治疗等几类干预措施独特的安全性情况并未报告,如以联合去甲基化药物为干预措施的研究,未评估骨髓抑制情况的安全性指标,以传统蒽环类药物联合阿糖胞苷经典“3+7”方案为干预措施的研究未报告评价心脏毒性、肝损害的安全性指标等。老年AML干预措施以化疗药物为主,WHO抗癌药物不良反应评估标准(CTCAE)对化疗药物的相关不良反应指标、症状体征制定了分级标准,建议对于类肿瘤疾病及化疗为干预措施的研究规范报告安全性指标。
4 小结本研究通过对近5年老年急性髓系白血病随机对照试验及临床试验方案进行系统检索与分析,发现目前老年AML临床研究的评价指标存在指标选择不合理,名称使用不规范,测量时点报告不清、选择不合理等问题,使得各项研究无法合并分析,难以进行二次研究。因此亟需按照核心指标集(COMET)工作组制定的核心指标集研制规范(COS-STAD)[15-16]要求,扩大样本量、年份、临床试验类型及干预类型,开展多轮德尔菲问卷调查,开展更全面完善的指标域研究。
| [1] |
MEDEIROS B C, SATRAM-HOANG S, HURST D, et al. Big data analysis of treatment patterns and outcomes among elderly acute myeloid leukemia patients in the United States[J]. Annals of Hematology, 2015, 94(7): 1127-1138. DOI:10.1007/s00277-015-2351-x |
| [2] |
VANDER HELM L H, SCHEEPERS E R, VEEGER N J, et al. Azacitidine might be beneficial in a subgroup of older AML patients compared to intensive chemotherapy: a single centre retrospective study of 227 consecutive patients[J]. Journal of Hematology & Oncology, 2013, 6(1): 29. |
| [3] |
OSSENKOPPELE G, LWENBERG B. How I treat the older patient with acute my eloid leukemia[J]. Blood, 2015, 125(5): 767-774. DOI:10.1182/blood-2014-08-551499 |
| [4] |
BURNETT, ALAN K. The challenge of AML in older patients[J]. Mediterranean Journal of Hematology & Infectious Diseases, 2013, 5(1): e2013038. |
| [5] |
ORAN B, WEISDORF D J. Survival for older patients with acute myeloid leukemia: a population-based study[J]. Haematologica, 2012, 97(12): 1916. DOI:10.3324/haematol.2012.066100 |
| [6] |
中华医学会血液学分会白血病淋巴瘤学组. 成人急性髓系白血病(非急性早幼粒细胞白血病)中国诊疗指南(2017年版)[J]. 中华血液学杂志, 2017, 38(3): 177-182. Leukemia and Lymphoma Group, Hematology Branch, Chinese Medical Association. Guidelines for diagnosis and Treatment of adult acute myeloid leukemia (Non-acute promyelocytic leukemia) in China (2017 edition)[J]. Chinese Journal of Hematology, 2017, 38(3): 177-182. |
| [7] |
DÖHNER H, ESTEY E, GRIMWADE D, et al. Diagnosis and management of AML in adults: 2017 ELN recommendations from an international expert panel[J]. Blood, 2017, 129(4): 424-447. DOI:10.1182/blood-2016-08-733196 |
| [8] |
TALLMAN M S, WANG E S, ALTMAN J K, et al. Acute myeloid leukemia, version 3[J]. Journal of the National Comprehensive Cancer Network: JNCCN, 2019, 17(6): 721-749. DOI:10.6004/jnccn.2019.0028 |
| [9] |
沈悌, 赵永强. 血液病诊断及疗效标准[M]. 4版. 北京: 科学出版社, 2018: 91-109. SHEN T, ZHAO Y Q. Diagnostic and therapeutic criteria of hematological diseases[M]. 4th edition. Beijing: Science Publishing House, 2018: 91-109. |
| [10] |
CHESON B D, BENNETT J M, KOPECKY K J, et al. Revised recommendations of the international working group for diagnosis, standardization of response criteria, treatment outcomes, and reporting standards for therapeutic trials in acute myeloid leukemia[J]. Journal of Clinical Oncology, 2003, 21(24): 4642-4649. DOI:10.1200/JCO.2003.04.036 |
| [11] |
金鑫瑶, 郑文科, 张俊华, 等. 推进真实世界研究的透明化[J]. 世界中医药, 2019, 14(12): 3106-3110. JIN X Y, ZHEN W K, ZHANG J H, et al. Promoting transparency in real-world research[J]. 2019, 14(12): 3106-3110. |
| [12] |
曾于珍, 陈世耀. 临床研究结局指标选择与样本量估计[J]. 协和医学杂志, 2018, 9(1): 87-92. ZENG Y Z, CHEN S Y. Outcome measure selection and sample size estimation for clinical research[J]. Medical Journal of Peking Union Medical College Hospital, 2018, 9(1): 87-92. |
| [13] |
魏辉, 杨秒, 李寿芸. 老年急性髓系白血病的整体治疗策略[J]. 临床血液学杂志, 2020, 33(3): 297-301. WEI H, YANG M, LI S Y. Holistic treatment strategy for elderly patients with acute myeloid leukemia[J]. Journal of Clinical Hematology, 2020, 33(3): 297-301. |
| [14] |
World Health Organization (Toxicity Grading Scale for Determining the Severity of Adverse Events) Available at:
http://www.icssc.org/documents/AE%20Manu?al%202003%20Appendices%20February_06_200?3%20final.pdf. Accessed April 10, 2007.
|
| [15] |
张明妍, 张俊华, 杜亮, 等. 译文: 核心指标集研制标准: COSSTAD推荐[J]. 中国循证医学杂志, 2018, 18(7): 753-757. ZHANG M Y, ZHANG J H, DU L, et al. Translation: Core indicatorset development criteria: the COS-STAD recommendation[J]. Chinese Journal of Evidence-Based Medicine, 2018, 18(7): 753-757. |
| [16] |
张明妍, 杨丰文, 李越, 等. 核心指标集报告规范(COS-STAR)介绍[J]. 中国循证医学杂志, 2017, 17(7): 857-861. ZHANG M Y, YANG F W, LI Y, et al. Introduction of the core indicator set reporting specification (COS-STAR)[J]. Chinese Journal of Evidence-Based Medicine, 2017, 17(7): 857-861. |
 2021, Vol. 38
2021, Vol. 38