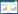文章信息
- 林宏远, 邓湘琴, 崔超宇, 任丽芝, 李宁, 梁慧
- LIN Hongyuan, DENG Xiangqin, CUI Chaoyu, REN Lizhi, LI Ning, LIANG Hui
- 肠复方对肠癌荷瘤小鼠MDSCs及免疫相关细胞因子表达的影响
- Effect of Changfufang on MDSCs and immune-related cytokines expression in colorectal cancer-bearing mice
- 天津中医药, 2021, 38(3): 369-374
- Tianjin Journal of Traditional Chinese Medicine, 2021, 38(3): 369-374
- http://dx.doi.org/10.11656/j.issn.1672-1519.2021.03.20
-
文章历史
- 收稿日期: 2020-12-16
2. 湖南省肿瘤医院, 长沙 410013
结直肠癌(CRC)是中国常见恶性肿瘤之一,近年来发病率明显升高。该病传统的治疗方法有手术、药物、放化疗等,但总体生存率仍不理想[1]。免疫治疗是继手术、放疗、化疗及靶向治疗后新兴的恶性肿瘤治疗手段,结直肠癌发生发展与免疫微环境密切相关。其中髓源抑制性细胞(MDSCs)是一群来源于骨髓异质性的未成熟细胞,介导机体的免疫抑制。据报道,大多数肿瘤可以观察到外周血和肿瘤组织中MDSCs比例升高,且与肿瘤的进展密切相关[2]。免疫相关细胞因子是由多种组织细胞产生的小分子蛋白质,参与调节机体免疫功能及肿瘤消长等。目前,针对局部肿瘤组织MDSCs表达与血清细胞因子的相关性研究较少。中医药辨证治疗结直肠癌具有抗复发和转移、提高生存质量、调节免疫力、延长生存期等作用的特点[3-4]。肠复方是湖南省肿瘤医院中西医结合科治疗大肠癌的协定方,临床应用肠复方诊治了大量患者,疗效较好。在笔者的前期研究中证实,肠复方可改善患者症状,提高生存质量;改善患者的细胞免疫功能[5]。在对肠癌荷瘤小鼠的干预中发现,肠复方可诱导肠癌原位移植裸鼠移植瘤细胞凋亡,抑制细胞增殖[6]。本实验在前期研究的基础上选择肠复方中剂量组(3.6 g/mL)为最佳给药浓度,检测MDSCs、细胞因子的表达,并分析局部肿瘤组织中MDSCs与血清免疫相关细胞因子的相关性研究,进一步探讨肠复方的免疫调节机制。
1 材料 1.1 动物和细胞株BALB/c小鼠,4~6周龄,40只(实验动物合格证号:4300470059729,实验动物使用编号:00190458),购自湖南斯莱克景达实验动物有限公司[SCXK(湘)2016-0002]。动物实验符合湖南省中医药研究院实验动物伦理委员会规定,在湖南省肿瘤医院动物实验中心无特定病原体(SPF)条件下饲养,予以自由饮食。小鼠结肠癌细胞株CT26,购自中国医学科学院细胞库,编号ZQ0190。
1.2 药物肠复方药物:党参10 g,黄芪30 g,白术15 g,陈皮10 g,麦芽15 g,鸡内金15 g,薏苡仁30 g,香附15 g,郁金15 g,莪术15 g,地鳖虫15 g,半枝莲30 g,白花蛇舌草30 g,壁虎10 g,茯苓10 g,女贞子10 g,甘草5 g。以上中药均购自湖南省肿瘤医院中药房,以上中药经湖南省肿瘤医院药剂科中药鉴定员鉴定后使用。温水浸泡1 h,水量超出药物3~5 cm,大火煮沸后转小火煎30 min,趁热过滤,药渣按前法再煎煮2次,将3次药液混匀、过滤,恒温水浴箱上浓缩为相当于含生药3.6 g/mL,4 ℃保存备用。
香菇菌多糖片(湖北广仁药业有限公司,规格:10 mg/片,批号:1903010),用蒸馏水配制成0.26 mg/mL药液冷藏备用。
1.3 实验试剂胎牛血清(以色列BI公司,批号:1922693);RPMI 1640(美国Sigma公司,批号:RNBH
5043);PBS液(美国Hyclone公司,批号:AE27749269);青霉素和链霉素混合液(上海碧云天生物技术有限公司,批号:SV30010);0.25% 胰蛋白酶(上海碧云天生物技术有限公司,批号:C0201);红细胞裂解液(美国eBioscience公司,批号:00-4333-57);CD11b流式抗体(美国eBioscience公司,批号:11-0112-81);GR-1流式抗体(美国eBioscience公司,批号:12-593-81);IL-2 ELISA试剂盒(美国Proteintech公司,批号:KE10004);TNF-αELISA试剂盒(美国Proteintech公司,批号:KE10002);IL-10 ELISA试剂盒(美国Proteintech公司,批号:KE10008);TGF-β ELISA试剂盒(美国Proteintech公司,批号:KE10005);Gr-1第一抗体(美国Santa公司,批号:sc-53515);二步法试剂盒(北京中杉金桥生物技术有限公司,批号:PV-9000);DAB试剂盒(北京中杉金桥生物技术有限公司,批号:ZLI-9018)。
1.4 实验仪器超净工作台(北京亚泰隆,型号YT-CJ-2NB);二氧化碳培养箱(上海三藤仪器厂,型号DH-160I);倒置生物显微镜(北京中显恒业仪器仪表有限公司,型号DSZ2000X);流式细胞分析仪(Beckman公司);台式高速冷冻离心机(湖南湘仪实验室仪器开发有限公司,型号:H1650R);全自动酶标洗板机(深圳市汇松科技发展有限公司,型号:PW-812);多功能酶标分析仪(深圳市汇松科技发展有限公司,型号:MB-530);摇床(其林贝尔公司,型号:TS-92);切片刀(莱卡公司,型号:M199);切片机(浙江金华益迪试验器材公司,型号:YD-315);包埋机(常州中威电子仪器公司,型号:BMJ-A);精密PH计(上海仪电科学仪器股份有限公司,型号:E-201-C);盖玻片、载玻片(海门远泰实验器材厂,型号:DY89-1,AY89-2)。
2 方法 2.1 肿瘤造模 2.1.1 单细胞悬液制备常规复苏CT26细胞,将细胞培养10 %胎牛血清RPMI 1640培养液中;置于37 ℃、含5 %的CO2培养箱内培养并传代。用0.25%胰蛋白酶消化收集对数生长期的细胞,使用PBS液配制成细胞密度为1×107/mL的单细胞悬液。
2.1.2 皮下移植瘤模型建立取细胞浓度为1×107/mL的CT26细胞悬液0.1 mL,即接种细胞数为1×106/mL,分别注射到30只BALB/c小鼠的右腋下,建立小鼠结肠癌皮下移植瘤模型。
2.2 动物分组及给药方法选取SPF级BALB/c小鼠40只,随机抽取10只为空白对照组,将其余30只小鼠采用动物移植性肿瘤实验法造模。按随机数字表法将造模成功的30只BALB/c小鼠随机分为3组,即肠复方组、香菇多糖组和模型组,每组10只。于造模后第7天皮下种植瘤生长至1 cm左右时开始干预,按70 kg人肠复方使用剂量给予小鼠相应等效剂量,小鼠肠复方按照每日使用剂量为36 g/kg灌胃给药,小鼠香菇菌多糖片使用剂量为5.2 mg/kg,模型组、空白对照组给予蒸馏水。以上药液每次灌胃0.2 mL,每天灌胃1次,每周5 d,连续干预4周。
2.3 常规观察每天记录小鼠精神状态、活动情况、饮食、大小便,每周测定小鼠体质量。
2.4 取材及处理干预结束后24 h水合氯醛麻醉小鼠,采取摘除眼球法收集小鼠血液,抗凝、离心分离并收集血清、血细胞备用;脱颈处死小鼠,剥离肿瘤,称质量并记录。计算各组小鼠的抑瘤率。抑瘤率=(1-实验组平均瘤质量/模型组平均瘤质量)×100%。
2.5 ELISA检测荷瘤小鼠血清IL-2、TNF-α、TGF-β、IL-10表达取小鼠血液约0.8 mL,3 000 r/min,离心半径10 cm,离心10 min后取上清液,ELISA法评估血中TNF-α、IL-2、TGF-β、IL-10血浆因子含量。具体操作方法按ELISA试剂盒说明书进行。
2.6 免疫组化检测荷瘤小鼠瘤体MDSCs表达从上述移植瘤标本取癌组织,按常规程序脱水、固定、切片制成组织切片。滴加I抗(抗Gr-1)孵育后PBS清洗4次,Ⅱ抗孵育25 min后PBS清洗4次,DAB显色,封片,拍照。显微镜下阳性表达定位于细胞核,以每张切片超过10 %或呈棕黄色者为阳性表达。显微镜下每张切片选择3个视野,放大400倍下观察视野中阳性细胞表达个数。免疫组化染色图像结果使用IPP(Image-Pro Plus 6.0)软件进行分析。测量集成光密度及面积,计算平均光密度(IOD)=集成光密度/面积,用平均光密度评价MDSCs的表达水平。
2.7 流式细胞仪检测瘤体中MDSCs浸润情况将小鼠瘤体取出,研磨消化制成单细胞悬液,200目尼龙网过滤,加入CD11b、Gr-1流式抗体染色,避光孵育30 min,300 r/min,离心半径10 cm,离心5 min,弃上清液后用PBS清洗2次;用1 %多聚甲醛定容至300 μL,过350目滤网。4℃避光保存,流式上机检测。CD11b+和Gr-1+双阳性的为MDSCs细胞。
2.8 统计学分析采用SPSS 25.0统计学软件进行分析,实验数据以均数±标准差(x±s)表示,多组间比较采用单因素方差分析,组间两两比较采用LSD法,相关性分析行Spearman相关分析,以P<0.05为差异有统计学意义。
3 结果 3.1 对小鼠一般状态、体征的影响模型组小鼠精神状态较差,进食减少。香菇多糖组小鼠精神状态一般,稍有消瘦,饮食量稍减少。肠复方组小鼠饮食量未见减少,精神、活动、二便正常。
3.2 各组荷瘤小鼠的抑瘤率比较模型组平均瘤体质量为4.342 g;肠复方组平均瘤体质量为3.176 g,与模型组相比,抑瘤率为26.9 %,差异具有统计学意义(P<0.01);香菇多糖组平均瘤体质量为3.723 g,与模型组相比,抑瘤率为14.3 %,差异具有统计学意义(P<0.05)。见表 1。
|
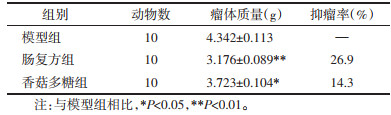
与空白对照组相比,模型组中IL-2、TNF-α、IL-10、TGF-β的表达均明显升高(P<0.01)。与模型组相比,肠复方组、香菇多糖组荷瘤小鼠外周血中TNF-α、IL-2的表达显著升高(P<0.01),同时IL-10、TGF-β的表达则明显降低(P<0.01,P<0.05),且肠复方组均优于香菇多糖组(P<0.01)。见表 2。
|
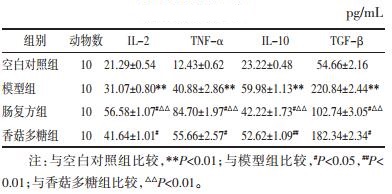
在对荷瘤小鼠瘤体的检测中发现,与模型组相比,肠复方组、香菇多糖组均能够显著下调MDSCs的表达(P<0.01),且肠复方组优于香菇多糖组,差异具有统计学意义(P<0.01)。见图 1。

|
| A: 模型组, B: 肠复方组, C: 香菇多糖组, HE染色, ×400;与模型组相比, *P<0.01;与香菇多糖组相比, ▲P<0.01。 图 1 免疫组化检测CT26荷瘤小鼠瘤体中MDScs(Gr-1)在各组的表达(x±s, n=10) Fig. 1 Expression of MDSCs (Gr-1) in tumor of CT26 tumor-bearing mice in each group detected by IHC(x±s, n=10) |
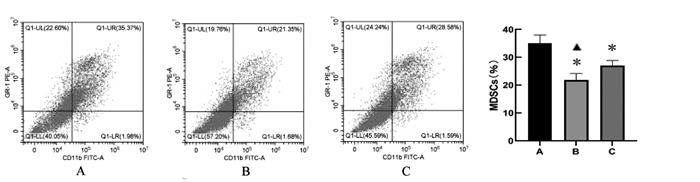
模型组、肠复方组、香菇多糖组MDSCs比例分别为为35.02 %、21.88 %、27.19 %,较模型组相比,肠复方组MDSCs比例显著下降(P<0.01),香菇多糖组也可抑制MDSCs的增殖(P<0.01),但作用不及肠复方组显著(P<0.01)。见图 2。
|
| A: 模型组, B: 肠复方组, C: 香菇多糖组; 与模型组相比, *P<0.01;与香菇多糖组相比, ▲P<0.01。 图 2 流式细胞仪检测CT26荷瘤小鼠瘤体中MDSCs在各组的表达(x±s, n=10) Fig. 2 Expression of MDSCs in tumor of CT26 tumor一bearing mice in each group detected by Flow cytometry(x±s, n=10) |
对模型组小鼠瘤体称质量记录后,将MDSCs与瘤体质量进行Spearman等级相关分析发现,MDSCs与瘤体质量呈正相关(r=0.719,P=0.044)。即说明随着瘤体负荷的增加,瘤体中MDSCs的表达亦随之升高。
3.7 瘤体中MDSCs与相关免疫因子的相关性分析针对模型组小鼠瘤体中MDSCs表达含量与模型组小鼠血清免疫因子表达含量进行Spearman相关性分析。分析发现,MDSCs与IL-10、TGF-β、TNF-α均具有相关性(P<0.05),与IL-2不具有相关性(P>0.05)。其中MDSCs与IL-10呈正相关(r=0.725,P < 0.05),与TGF-β亦呈正相关(r=0.813,P < 0.05);MDSCs与TNF-α呈负相关(r=-0.757,P < 0.05)。
4 讨论本研究在既往临床及实验证实肠复方有效性基础上,进一步研究肠复方对于结直肠癌的免疫调节机制。研究发现,肠复方可抑制结直肠癌荷瘤小鼠瘤体的生长,同时对小鼠的一般状态、体征等有积极影响。
从中医角度,在大肠癌的发生发展中,脾气虚弱为本,而又水停湿聚,酿成痰湿毒瘀蕴结肠腑,聚成为积。魏聪等[7]提出“脾肾亏虚”是恶性肿瘤的发病基础。此外,痰瘀气火毒相夹是大肠癌发生发展的的重要病机。肠复方是治疗结直肠癌的专方,具有健脾益气、祛湿化瘀解毒之功效。现代药理表明,健脾益气类方药可通过提高机体免疫状态、改善肿瘤上皮间质转化达到抗肿瘤的目的[8-9];活血化瘀解毒类中药可通过抑制肿瘤血管生成、改善机体免疫力状态发挥抗肿瘤作用[10]。故肠复方全方配伍既能抑制肠癌瘤体生长,又能稳定小鼠的一般状态,疗效最佳。既往研究显示[11-12],香菇多糖可以拮抗结直肠癌发生发展,并且具有一定的免疫调节功能,作为免疫调节剂广泛运用于临床,故本实验研究采用香菇多糖作为阳性对照。
MDSCs作为结直肠癌肿瘤微环境中重要的免疫抑制细胞,在接种肿瘤后,会大量扩增和活化,募集到肿瘤和外周血中,从而对机体的免疫系统起到抑制作用,导致肿瘤细胞发生免疫逃逸[13-15]。在结直肠癌发生发展的过程中,MDSCs与肿瘤细胞都可高表达TGF-β、IL-10等免疫抑制因子参与肿瘤细胞的免疫耐受和免疫抑制。研究发现[16],TGF-β可直接或间接地作用于免疫细胞,从而诱导其功能丧失,帮助肿瘤细胞逃避机体的免疫监视,促进肿瘤的发展。IL-10作为免疫逃逸的重要免疫抑制性因子,能抑制肿瘤浸润炎症细胞,使这些细胞在肿瘤组织中的浸润、分化、和成熟受到抑制,同时也可以抑制这些炎症细胞对肿瘤的杀伤作用[17-18]。TNF-α、IL-2是由T淋巴细胞分泌的、具有免疫调节作用的细胞因子,可反映肿瘤的生长状况,也能体现肿瘤相关的免疫调节活动水平[19]。IL-2、TNF-α均可以拮抗免疫抑制效应,特定情况下,其可诱导肿瘤细胞凋亡,调控机体免疫反应。
本研究发现,肠癌荷瘤小鼠瘤体质量与瘤体中MDSCs表达具有相关性。扩增和募集的MDSCs促进了肿瘤进展。肠复方、香菇多糖可显著下调荷瘤小鼠局部肿瘤组织MDSCs细胞增殖,肠复方组优于香菇多糖组,提示肠复方可能从虚湿瘀毒方面改善肿瘤微环境的病理状态进而抑制MDSCs的扩增。小鼠荷瘤后,外周血中细胞因子表达均显著提高,证实肿瘤状态下可刺激细胞因子产生或分化,且小鼠局部瘤体组织中MDSCs细胞与血清IL-10、TGF-β呈正相关,与血清TNF-α呈负相关,提示MDSCs与IL-10、TGF-β等免疫抑制因子具有协同作用,从而促进了肿瘤的发生发展。未发现MDSCs与IL-2有相关性,后续可进一步扩大样本量继续探讨并深入探究。此外,肠复方可下调血清IL-10、TGF-β的表达,并上调血清IL-2、TNF-α的表达,由此推测,肠复方可增强全身免疫调节,改善全身虚湿瘀毒的内环境,通过调节全身的免疫相关细胞因子可能调控了局部肿瘤组织中MDSCs的募集,从而拮抗结直肠癌的发生发展,有效逆转肿瘤相关炎症微环境的免疫抑制状态。同时也提示,上调TNF-α、IL-2表达,且下调MDSCs、TGF-β、IL-10表达,可能是肠复方发挥免疫调控作用的重要作用机制之一。在本次实验结果中发现,香菇多糖不仅可以上调IL-2、TNF-α的表达,亦对免疫抑制因子有明显的抑制作用,可推测香菇对多糖于正向、负向免疫调控方面都具有一定的优势。
本研究基于中药方剂的基础理论,从扶正祛邪两方面对肠癌免疫微环境进行干预,研究肠复方对肠癌免疫调节机制的影响,结论具有临床指导意义。但本研究仅探讨了MDSCs及细胞因子的表达变化,且未从细胞层面进行功能验证,后续可进一步完善。
| [1] |
SIEGEL R L, MILLER K D, JEMAL A. Cancer statistics, 2020[J]. CA: a cancer journal for clinicians, 2020, 70(1): 7-30. DOI:10.3322/caac.21590 |
| [2] |
WANG P F, SONG S Y, WANG T J, et al. Prognostic role of pretreatment circulating MDSCs in patients with solid malignancies: A meta-analysis of 40 studies[J]. Oncoimmunology, 2018, 7(10): e1494113. DOI:10.1080/2162402X.2018.1494113 |
| [3] |
崔晓茹, 侯勇, 于庆生. 中医药辅助治疗结直肠癌研究进展[J]. 安徽中医药大学学报, 2017, 36(2): 94-96. CUI X R, HOU Y, YU Q S. Research progress of traditional Chinese medicine in the treatment of colorectal cancer[J]. Journal of Anhui University of Chinese Medicine, 2017, 36(2): 94-96. |
| [4] |
卢冬雪, 刘沈林. 中医药防治结直肠癌术后复发转移的概况[J]. 世界中西医结合杂志, 2017, 12(11): 1620-1623, 1628. LU D X, LIU S L. Prevention and treatment of postoperative recurrence and metastasis of colorectal cancer with traditional Chinese medicine[J]. World Journal of Integrated Traditional Chinese and Western Medicine, 2017, 12(11): 1620-1623, 1628. |
| [5] |
梁慧, 谢胜军, 曾伟. "肠复方"治疗晚期难治性大肠癌30例临床研究[J]. 江苏中医药, 2017, 49(5): 36-39. LIANG H, XIE S J, ZENG W. Clinical study of "Changfufang" in the treatment of 30 cases of advanced refractory colorectal cancer[J]. Jiangsu Journal of Traditional Chinese Medicine, 2017, 49(5): 36-39. |
| [6] |
曾伟, 梁慧, 王云启. 肠复方对裸鼠人大肠癌原位移植瘤增殖和凋亡影响[J]. 辽宁中医药大学学报, 2017, 19(7): 53-56. ZENG W, LIANG H, WANG Y Q. Effect of Changfufang on proliferation and apoptosis of orthotopic transplantation tumor of human colorectal cancer in nude mice[J]. Journal of Liaoning University of Traditional Chinese Medicine, 2017, 19(7): 53-56. |
| [7] |
魏聪, 袁国强, 常丽萍, 等. 改善证候——肿瘤治疗新策略[J]. 中医杂志, 2014, 55(7): 555-557. WEI C, YUAN G Q, CHANG L P, et al. Improving syndromes-A new strategy for tumor treatment[J]. Journal of Traditional Chinese Medicine, 2014, 55(7): 555-557. |
| [8] |
董琴晖, 金剑英, 朱健, 等. 益气健脾化积方对晚期结肠癌患者免疫功能和生活质量的影响[J]. 浙江中西医结合杂志, 2019, 29(12): 994-996. DONG Q H, JIN J Y, ZHU J, et al. Effect of Yiqijianpihuaji Recipe on immune function and quality of life of patients with advanced colon cancer[J]. Zhejiang Journal of Integrated Traditional Chinese and Western Medicine, 2019, 29(12): 994-996. |
| [9] |
吴坚, 陈彦臻, 张星星, 等. 益气健脾化瘀方协同5-FU对胃癌的抑制作用及机制[J]. 中国实验方剂学杂志, 2020, 26(7): 65-72. WU J, CHEN Y Z, ZHANG X X, et al. Inhibitory Effect and Mechanism of Yiqi Jianpi Huayu Recipe Combined with 5-FU on Gastric Cancer[J]. Chinese Journal of Experimental Traditional Medical Formulae, 2020, 26(7): 65-72. |
| [10] |
汤芷妮, 骆云鹏, 葛菲, 等. 活血化瘀抗肿瘤中草药作用机制的研究进展[J]. 中国药房, 2016, 27(8): 1146-1149. TANG Z N, LUO Y P, GE F, et al. Researchprogress on the mechanism of anti-tumor Chinese herbal medicine by promoting blood circulation and removing blood stasis[J]. China Pharmacy, 2016, 27(8): 1146-1149. |
| [11] |
陈灿, 申龙海, 刘芳. 香菇多糖辅助治疗对老年晚期结直肠癌转移浸润及新生血管形成的影响[J]. 航空航天医学杂志, 2019, 30(9): 1113-1114. CHEN C, SHEN L H, LIU F. Effect of lentinan adjuvant therapy on metastatic invasion and neovascularization of advanced colorectal cancer in the elderly[J]. Journal of Aerospace Medicine, 2019, 30(9): 1113-1114. |
| [12] |
芮雯, 游思远, 吴小清, 等. 香菇多糖对人结直肠癌上皮细胞SW837免疫原性死亡相关分子表达的影响[J]. 中国免疫学杂志, 2019, 35(8): 948-952. RUI W, YOU S Y, WU X Q, et al. Effect of lentinan on the expression of SW837 immunogenic death-related molecules in human colorectal cancer epithelial cells[J]. Chinese Journal of Immunology, 2019, 35(8): 948-952. |
| [13] |
SCENEAY J, GRIESSINGER C M, HOFFMANN S H L, et al. Tracking the fate of adoptively transferred myeloid-derived suppressor cells in the primary breast tumor microenvironment[J]. PlOS one, 2018, 13(4): e0196040. DOI:10.1371/journal.pone.0196040 |
| [14] |
SAFARZADEH E, ORANGI M, MOHAMMADI H, et al. Myeloid derived suppressor cells: Important contributors to tumor progression and metastasis[J]. Journal of Cellular Physiology, 2018, 233(4): 3024-3036. DOI:10.1002/jcp.26075 |
| [15] |
路娜, 李文涛, 温晓燕, 等. 灸法对结直肠癌癌因性疲乏的疗效及免疫功能的影响[J]. 天津中医药, 2020, 37(9): 65-68. LU N, LI W T, WEN X Y, et al. Effect of moxibustion on cancer-related fatigue and immune function in colorectal cancer[J]. Tianjin Journal of Traditional Chinese Medicine, 2020, 37(9): 65-68. |
| [16] |
CLAUDIA B, LAIA C, ARISTIDIS M. Transforming growth factor β as regulator of cancer stemness and metastasis[J]. British Journal of Cancer, 2016, 115(7): 761-9. DOI:10.1038/bjc.2016.255 |
| [17] |
王佳丽, 刘丽华. IL-10对肿瘤免疫双向调节的研究进展[J]. 中国肿瘤生物治疗杂志, 2016, 23(1): 130-134. WANG J L, LIU L H. Research progress on bi-directional regulation of tumor immunity by IL-10[J]. Chinese Journal of Cancer Biotherapy, 2016, 23(1): 130-134. |
| [18] |
赵晨翔, 张雅敏, 刘宏胜, 等. 山茱萸总苷对小鼠免疫性肝损伤治疗作用的初步研究[J]. 天津中医药, 2017(2): 120-124. ZHAO C X, ZHANG Y M, LIU H S, et al. Preliminary study on the effect of total glycosides from Cornus Officinalis on treatment of acute immunologic liver injury induced by ConA in mice[J]. Tianjin Journal of Traditional Chinese Medicine, 2017(2): 120-124. |
| [19] |
史翠珍, 史大祝, 姜坤. 枸杞多糖对胃癌模型大鼠免疫功能的影响[J]. 湖南师范大学学报(医学版), 2018, 15(2): 114-117. SHI C Z, SHI D Z, JIANG K. Effect of Lycium barbarum polysaccharides on immune function of gastric cancer model rats[J]. Journal of Hunan Normal University(Medical Sciences), 2018, 15(2): 114-117. |
2. Hunan Cancer Hospital, Changsha 410013, China
 2021, Vol. 38
2021, Vol. 38