文章信息
- 王一洲, 赵强
- WANG Yizhou, ZHAO Qiang
- 摇法对KOA兔滑膜MMPs分泌功能的作用研究
- Study on the secretion function of MMPs in KOA rabbit synovial membrane by rocking manipulation
- 天津中医药, 2021, 38(3): 383-386
- Tianjin Journal of Traditional Chinese Medicine, 2021, 38(3): 383-386
- http://dx.doi.org/10.11656/j.issn.1672-1519.2021.03.22
-
文章历史
- 收稿日期: 2020-12-17
2. 天津中医药大学第一附属医院, 天津 300193
膝骨性关节炎(KOA)是在生物力学驱动下,各种生物介质单独或通过网络互作形成的关节组织炎性反应。世界范围内50岁以上人群中的KOA患病率高达42.8%[1],KOA已经成为最重要的慢性致残因素。KOA严重的危害性迫切的要求研究者们加强其防治手段的研究。
推拿手法是临床最常用的KOA保守治疗方案,推拿手法通过带动施术部位规律地摆动或拉伸,刺激组织中机械敏感受体将力学信号转导为生物信号,进而产生不同的手法效应[2-3]。研究表明,调节滑膜组织的异常应力是KOA的有效治疗策略[4-5],推拿手法的力学效应诱导组织细胞产生不同的界面行为,包括改变细胞的形态、黏附、增殖以及凋亡,进而产生不同层次的作用效果,影响相关组织功能[6-7]。滑膜组织病理状态下出现向相邻软骨表层的迁移和滑膜内层的增生[8],导致滑膜处于异常的力学环境,摇法是重要的运动关节类手法,其主要作用是通过多向单轴拉伸应力作用于关节,研究表明适度的拉伸应力可以诱导滑膜细胞应力重构,调控滑膜细胞的分泌功能[9],因此,将摇法作为干预手段,研究摇法对KOA滑膜病变的作用效果,笔者制备以滑膜炎为主要表现的KOA兔模型,比较摇法和指南一线药物塞来昔布的作用效果[10-11],分析摇法减轻滑膜炎症,缓解关节软骨损伤的作用机制。
1 材料与方法 1.1 试剂Rabbit MMP1 ELISA KIT(BG公司,中国);Rabbit MMP13 ELISA KIT(BG公司,中国);木瓜蛋白酶(Sigma公司,美国);载玻片(碧云天公司,中国);L-半胱氨酸(北京索莱宝科技有限公司,中国)。
1.2 仪器MULTISKAN MK3全自动多功能酶标仪(Thermo,美国);ⅠX71型倒置相差显微镜(OLMPUS,日本);AU480全自动生化仪(OLMPUS,日本);MDF-382E超低温冰箱(SANYO,日本);RM2135石蜡切片机(Leica,德国);YJ-875型超净工作台(苏州净化设备厂);NP-P生物组织摊烤片机(孝感诺普电子科技有限责任公司);EC-350石蜡包埋机(Microm international GmbH,德国);洗板机(thermo,美国)。
1.3 模型制备[12]正常饮食、饮水,适应性饲养7 d,按照分组情况分别于第1、4、7天实施造模操作:按照体质量1 mL/kg,耳缘静脉缓慢推注3%戊巴比妥钠,待动物安静后,仰卧位固定一侧肢体,另一侧膝关节周围备皮,安尔碘消毒3遍,铺孔巾,手持兔膝关节下段,令其屈髋屈膝外展位,将髌骨稍向内推,针头从髌韧带外缘向股骨髁间窝骨面刺入,直至骨面,稍退针即可开始注射。模型组、塞来昔布组、摇法组分别注入4%木瓜蛋白酶生理盐水溶液0.3 mL,注射后屈伸关节使药液充斥关节腔。假模型组注入等量的生理盐水溶液,正常组不做干预,同条件、同期饲养。
1.4 治疗方法塞来昔布组:予20 mg/kg药物水溶液灌胃,1次/d,共治疗21 d。摇法组等体积除菌过滤水灌胃后行手法操作,模型组、假模型组、正常组均等体积除菌过滤水灌胃。
摇法组[13]:1)助手协助将兔仰卧位固定。2)施术者一手固定股骨,一手握住足踝部,使患肢呈屈髋屈膝位。3)持足踝部手带动膝关节行环转摇动。手法治疗每次5 min,1次/日,共治疗21 d。
手法操作依据:通过前项国家自然基金研究,课题组发现单一手法的力学特性更易复制并移植到动物平台,笔者团队提取了具有丰富临床经验的高年资医师在摇法操作时的特点,并比对文献,膝关节摇法的操作特点在于:屈髋屈膝状态下,操作者持肢体末端带动治疗部位做全关节的环转运动,才能实现多向单轴拉伸的内应力,因此,课题组将动物模型的治疗手法调整并设计如上。
1.5 组织样本提取和切片空气栓塞处死实验动物,沿股直肌外缘肌腱走行打开1 cm术窗,逐层分离直至打开关节腔,剪断髌韧带,暴露关节,注射器吸取黏稠关节液,移入冻存管。将所有采集的标本置于-80℃冰箱中冻存备用。提取关节腔内层滑膜组织,生理盐水冲洗3遍,4%多聚甲醛固定,梯度乙醇脱水,常规石蜡包埋,石蜡切片,厚4 μm切片、展片,苏木精-伊红(HE)染色,制成病理切片。
1.6 ELISA检测滑囊液基质金属蛋白酶1(MMP1)、基质金属蛋白酶3(MMP13)取预处理滑囊液,加裂解液后进行匀浆,直至充分裂解,离心取上清液备用。采用蛋白质定量(BCA)法对组织上清液进行总蛋白定量,操作步骤严格按试剂盒说明进行。反应结束20 min内。使用酶标仪在570 nm下读取OD值,绘制标准曲线并计算样品中的总蛋白浓度。采用ELISA法检测上清液中MMP1、MMP13含量,操作步骤严格按试剂盒说明书。反应终止后30 min内,使用酶标仪在450 nm下读取OD值,绘制标准曲线并计算样品中的MMP1、MMP13浓度。
1.7 统计学方法采用SPSS 18.0统计软件对相关数据进行统计学分析,计量资料使用均数±标准差(x±s)表示,各组滑囊液中MMP1、MMP13浓度比较采用单因素方差分析,组间两两比较采用LSD法,检验水准为α=0.05,P < 0.05为差异具有统计学意义。
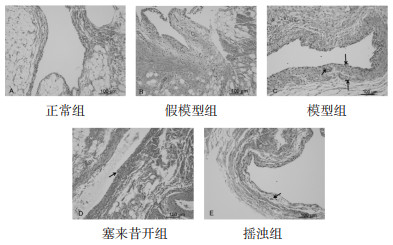
2 结果 2.1 HE染色显示正常组、假模型组滑膜衬里细胞呈单层或双层规整的平行分布,滑膜衬里下层是疏松的网状组织和脂肪组织,组织内可见少量淋巴细胞,无炎性细胞;模型组滑膜基质明显增厚,可见7~8层滑膜衬里细胞,外层细胞排列致密,内层细胞排列紊乱,滑膜下层可见大量炎性细胞浸润,以淋巴细胞、浆细胞为主,箭头所指可见毛细血管增生、血管翳形成;塞来昔布组箭头所指处可见滑膜衬里细胞扁平,滑膜细胞增生控制良好,滑膜细胞4~5层,部分细胞形态异常,基质内少量炎性细胞,炎性浸润明显好于模型组;摇法组可见3~4层滑膜衬里细胞,滑膜炎性增生控制良好,细胞形态规整,箭头所指可见少量淋巴细胞,炎性浸润明显好于模型组。见图 1。
|
| 图 1 各组滑膜组织HE染色(x100) Fig. 1 Synovial tissues of each group were stained with HE (×100) |
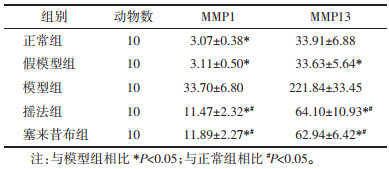
ELISA法检测各组滑膜液中MMP1、MMP13的表达,假模型组与正常组MMP1、MMP13的表达经统计学比较,无统计学意义(P>0.05),模型组与正常组比较,差异具有统计学意义(P<0.05),塞来昔布组与模型组比较,差异具有统计学意义(P<0.05),摇法组与模型组比较,具有统计学差异(P<0.05),塞来昔布组与摇法组相比,无统计学意义(P>0.05)。提示摇法和塞来昔布均可以通过调控滑膜液中基质金属蛋白酶的分泌,参与修饰KOA的分解代谢活动。见表 1。
|
KOA属于中医“骨痹”“厉节风”“骨痹痿”“膝痛”等范畴,《金匮要略》记载“中风历节病”,临床主要表现为“历节痛,不可屈伸”,清楚描述KOA的症状和体征,并指出寒客分肉之间,即解剖学中筋膜的位置,导致经脉运行不畅产生“气血郁滞,为肿为痛”的症状。摇法是推拿治疗KOA的常用手法,尤其在肢体部关节如:膝关节、髋关节、肩关节等,中医推拿以整体观、筋骨并重为指导思想,辨证施术,标本同治,缓急兼顾,动静结合。研究发现,摇法在KOA的临床治疗中取得了良好的疗效,相比扳法、拔伸等运动关节类手法,摇法关节活动范围大、刺激相对和缓,在改善关节活动功能、减轻滑膜炎症方面具有独特优势。
在正常软骨中,细胞外基质主要由椭圆型及圆型软骨细胞合成,其成分主要为Ⅱ型胶原和蛋白聚糖,能够形成纤维网络样结构,对软骨细胞起支撑、保护作用,软骨细胞分布于其中。而MMPs是软骨中细胞外基质分解的重要酶类,能对其有高效的降解。生理情况下,MMPs和其特异性抑制剂金属蛋白酶组织抑制剂(TIMPs)保持一定得合成和降解的比例,从而保证软骨细胞外基质的降解能维持在一个正常的动态平衡中[14]。MMP-1是一种间质胶原酶,能够降解间质胶原蛋白(Ⅰ,Ⅱ和Ⅲ型),被认为是一种多功能分子,在多种生理过程中具有重要作用,MMP1表达和活性水平受成纤维样滑膜细胞的机械应变调控[15]。MMP13是Ⅱ型胶原蛋白的主要水解酶,是调控软骨细胞外纤维结构的重要因子,其表达受众多细胞因子和其抑制剂的调控,研究表明,一些炎症因子如:白细胞介素-1β(IL-1β)、IL-6、肿瘤坏死因子-α(TNF-α)等可以通过不同途径活化MMPs[16-17],KOA早期的滑膜组织呈慢性炎性反应,B型滑膜细胞增殖,大量淋巴细胞和单核细胞沿滑膜内增殖的血管渗出并释放炎症因子,IL-1β和TNF-α作为滑膜内炎性反应的启动子,参与关节内环境的调控,激活T细胞吞噬趋化释放溶酶体酶,IL-1β通过诱导型一氧化氮合酶(iNOS)产生的一氧化氮(NO),活化MMP13并抑制TIMPs,联合TNF-α诱导的软骨细胞凋亡,炎症反应和细胞凋亡共同介导滑膜内环境和软骨基质的重构。另有研究显示,MMP-13和血管内皮生长因子(VEGF)水平之间存在很强的正关联[18-19],这也符合笔者观察到的KOA兔滑膜内层的血管侵入现象。基于本研究的结果以及前期探索,笔者倾向于认为摇法对滑膜产生的多轴拉伸应力有利于滑膜应力环境的改善,减轻滑膜炎症,刺激滑膜调控MMPs的分泌,缓解KOA软骨基质分解。未来将深入探索摇法干预KOA滑膜应力环境,调控软骨代谢的机制,为推拿手法防治KOA的研究提供依据。
| [1] |
ALI MOBASHERI, MARK BATT. An update on the pathophysiology of osteoarthritis[J]. Annals of Physical and Rehabilitation Medicine, 2016, 59(6): 333-339. |
| [2] |
王一洲, 赵强. 屈膝点按叩揉法调控L-型电压依赖性钙通道影响软骨细胞代谢的机制研究[J]. 天津中医药, 2017, 34(4): 262-265. WANG Y Z, ZHAO Q. Study on the mechanism of Quxi Dian'an Kourou method regulation of L-type calcium channel affect the metabolism of chondrocytes[J]. Tianjin Journal of Traditional Chinese Medicine, 2017, 34(4): 262-265. |
| [3] |
马铭华, 王一洲, 赵强. 伸筋易骨法调控软骨细胞内钙离子浓度干预细胞代谢的机制研究[J]. 天津中医药, 2019, 36(6): 591-594. MA M H, WANG Y Z, ZHAO Q. Mechanisms study of Shenjin Yigu method regulated calcium ion concentration in chondrocyte to intervene cell metabolism[J]. Tianjin Journal of Traditional Chinese Medicine, 2019, 36(6): 591-594. |
| [4] |
ZHENG W, LI X, LIU D, et al. Mechanical loading mitigates osteoarthritis symptoms by regulating endoplasmic reticulum stress and autophagy[J]. The Faseb Journal, 2019, 33(3): 4077-4088. DOI:10.1096/fj.201801851R |
| [5] |
HUANG Z, ZHOU M, WANG Q, et al. Mechanical and hypoxia stress can cause chondrocytes apoptosis through over-activation of endoplasmic reticulum stress[J]. Archives of Oral Biology, 2017, 12(84): 125-132. |
| [6] |
BELLUZZI E, STOCCO E, POZZUOLI A, et al. Contribution of infrapatellar fat pad and synovial membrane to knee osteoarthritis pain[J]. Biomed Research International, 2019, 4(31): 63-82. |
| [7] |
LI X, FU X, GAO Y, et al. Expression of tissue inhibitor of metalloproteinases-1 and B-cell lymphoma-2 in the synovial membrane in patients with knee osteoarthritis[J]. Experimental and Therapeutic Medicine, 2018, 15(1): 885-889. |
| [8] |
AKANO S, UCHIDA K, INOUE G, et al. Vascular endothelial growth factor expression and their action in the synovial membranes of patients with painful knee osteoarthritis[J]. Bmc Musculoskeletal Disorders, 2018, 19(1): 204. DOI:10.1186/s12891-018-2127-2 |
| [9] |
S UN, I Y, L IU, TANAKA, et al. Effects of high-impact mechanical loading on synovial cell cultures[J]. Journal of Sports Science and Medicine, 2004, 3(1): 37-43. |
| [10] |
ZHANG W, MOSKOWITZ RW, NUKI G, et al. Oarsi recommendations for the management of hip and knee osteoarthritis, Part Ⅱ: Oarsi evidence-based, expert consensus guidelines[J]. Osteoarthritis Cartilage, 2008, 16(2): 137-162. DOI:10.1016/j.joca.2007.12.013 |
| [11] |
BANNURU R R, OSANI M C, VAYSBROT E E, et al. Oarsi guidelines for the non-surgical management of knee, hip, and polyarticular osteoarthritis[J]. Osteoarthritis and Cartilage, 2019, 27(11): 1578-1589. DOI:10.1016/j.joca.2019.06.011 |
| [12] |
KITOH Y, KATSURAMAKI T, TANAKA H, et al. Effect of SL-1010(sodium hyaluronate with high molecular weight) on experimental osteoarthritis induced by intra-articularly applied papain in rabbits[J]. Nihon Yakurigaku Zasshi, 1992, 100(1): 67-76. DOI:10.1254/fpj.100.67 |
| [13] |
严隽陶. 推拿学[M]. 北京: 中国中医药出版社, 2003: 107. YAN J T. Massage[M]. Beijing: China Press of Traditional Chinese Medicine, 2003: 107. |
| [14] |
LIN J, WU G, ZHAO Z, et al. Bioinformatics analysis to identify key genes and pathways influencing synovial inflammation in osteoarthritis[J]. Molecular Medicine Reports, 2018, 18(6): 5594-5602. |
| [15] |
MALEMUD C J. Matrix metalloproteinases and synovial joint pathology[J]. Progress in Molecular Biology and Translational Science, 2017, 3(148): 305-325. |
| [16] |
HALTMAYER E, RIBITSCH I, GABNER S, et al. Co-culture of osteochondral explants and synovial membrane as in vitro model for osteoarthritis[J]. PLoS One, 2019, 14(4): e0214709. |
| [17] |
CHARLIER E, DEROYER C, CIREGIA F, et al. Chondrocyte dedifferentiation and osteoarthritis (OA)[J]. Biochemical Pharmacology, 2019, 3(165): 49-65. |
| [18] |
CHELESCHI S, GALLO I, BARBARINO M, et al. MicroRNA mediate visfatin and resistin induction of oxidative stress in human osteoarthritic synovial fibroblasts via NF-κB pathway[J]. International Journal of Molecular Sciences, 2019, 20(20): 5200. DOI:10.3390/ijms20205200 |
| [19] |
KIM H R, LEE J H, KIM K W, et al. The relationship between synovial fluid VEGF and serum leptin with ultrasonographic findings in knee osteoarthritis[J]. International Journal of Rheumatic Diseases, 2016, 19(3): 233-240. DOI:10.1111/1756-185X.12486 |
2. First Teaching Hospital of Tianjin University of Traditional Chinese Medicine, Tianjin 300193, China
 2021, Vol. 38
2021, Vol. 38