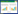文章信息
- 陈鹏, 瞿晶田, 王婧斯
- CHEN Peng, QU Jingtian, WANG Jingsi
- 迷迭香酸干预PI3K/Akt信号通路保护缺氧/复氧损伤血脑屏障功能的影响
- Effect of rosmarinic acid on PI3K/Akt signal pathway in protecting blood-brain barrier function by hypoxia/reoxygenation injury
- 天津中医药, 2021, 38(3): 387-392
- Tianjin Journal of Traditional Chinese Medicine, 2021, 38(3): 387-392
- http://dx.doi.org/10.11656/j.issn.1672-1519.2021.03.23
-
文章历史
- 收稿日期: 2020-09-15
2. 盈科瑞(天津)创新医药研究有限公司, 天津 300385
血脑屏障(BBB)是脑毛细血管阻止某些物质由血液进入脑组织的结构[1]。神经元在正常活动时,需要非常稳定的内环境,而这种稳定性的实现,有赖于BBB的存在。研究显示,脑缺血再灌注损伤时,BBB不仅有结构的损伤和改变,也出现功能异常,即通透性改变、转运功能破坏等[2]。同时,BBB功能性开放又导致外周有害物质的渗入,引起继发性脑损伤[3]。脑微血管内皮细胞(BMEC)是构成血脑屏障的主要结构[4],BMEC一面与血液接触,一面与脑细胞连接,保护神经元免受血液中潜在有害物质的损害,其细胞间的紧密连接是BBB模型的一个重要特征[5]。目前BMEC体外培养模型已经被广泛应用于BBB的研究。
迷迭香酸(RA)是一种水溶性的天然酚酸类化合物,广泛存在于唇形科、紫草科、葫芦科、椴树科、伞形科的多种植物中,具有较强的抗氧化、抗炎、抗肿瘤等活性[6]。目前,对RA在脑缺血后的保护作用报道较少,尤其在RA维持脑缺血后BBB功能方面尚未见报道。因此,本研究体外原代培养大鼠BMEC,以氧糖剥夺/复氧复糖(OGD/R)损伤,模拟在体脑缺血再灌注损伤的BBB模型。通过检测细胞活力、乳酸脱氢(LDH)漏出、跨细胞间电阻(TEER)值,异硫氰酸荧光素(FITC)-葡聚糖透过,罗丹明123(Rh123)蓄积等指标,明确RA对OGD/R损伤BMEC的保护作用;通过检测紧密连接蛋白ZO-1、Claudin-5和转运蛋白P-gp、MRP1 mRNA表达,证实RA可以维持脑缺血后BBB的功能;通过p-Akt/Akt蛋白表达及抑制剂的应用,初步考察RA对BBB功能影响的可能的上游机制。
1 材料 1.1 药物与试剂迷迭香酸(RA,质量分数>98%),上海源叶生物科技有限公司;DMEM培养基、胎牛血清(FBS),北京索莱宝科技有限公司;Ⅱ型胶原酶、胶原酶/分散酶、内皮细胞生长因子(ECGF),Roche公司;CCK-8试剂盒,同仁化学;LDH试剂盒,Promega公司;异硫氰酸荧光素(FITC)-葡聚糖,Sigma公司;PrimeScript TMRT试剂盒、SYBRⓇPremix Ex TaqTM,TaKaRa公司;p-Akt、Akt抗体,CST公司;β-actin、ZO-1、Claudin-5、P-gp、MRP1引物由上海生物工程技术服务有限公司合成;LY294002抑制剂,Calbiochem公司。
1.2 动物Wistar大鼠,20日龄,体质量(40±5)g,雌雄不限,共计购自北京维通利华实验动物技术有限公司。
1.3 仪器低温离心机,美国Beckman公司,酶标仪,美国,MD公司,PCR扩增仪,美国,Bio-rad公司,实时荧光定量系统,美国,Bio-rad公司,凝胶成像系统,美国,Bio-rad公司。
2 方法 2.1 脑微血管内皮细胞培养参考文献[4],将Wistar大鼠脱颈处死,置于75%乙醇中浸泡3~5 min消毒。取出全脑,置于冷的D-Hank’s液中,去除小脑、间脑、血管、软脑膜等,保留大脑皮质。用眼科剪将脑组织剪成约1 mm3碎片,加入0.7 mg/mL Ⅱ型胶原酶,37 ℃消化1 h,1 000×g离心10 min,弃上清液,加20% BSA混匀,1 000×g离心20 min,保留底层沉淀。再加入1 mg/mL胶原酶/分散酶,37 ℃消化1 h,700×g离心6 min,弃上清液,DMEM液漂洗2次,加入DMEM全培基(含20% FBS、2 mM L-谷氨酰胺、30 μg/mL ECGF、100 μg/mL肝素钠)重悬细胞,接种于75 cm2培养瓶中,2 d后换液,单层BMEC融合至70%~80%时传代。用消化液(0.25%胰酶和0.02% EDTA组成)消化,轻轻吹打成细胞悬液,1 000×g离心5 min,弃上清液,加入DMEM全培基重悬,种于培养板中。
2.2 分组及处理将传代的BMEC密度调至4×105/mL,根据实验需要分别种于96孔板、6孔板及Transwell套筒上,置于37 ℃、5% CO2培养箱中培养,每2 d换液1次。待细胞融合时分为5组:对照组(Con),加入全培基,正常孵育24 h;模型组(OGD/R),加入平衡盐溶液,置于95% N2-5% CO2条件下缺氧培养6 h后,置换为全培基,正常孵育18 h;RA组,分别加入终浓度2.5、5、10 μmol/L RA的平衡盐溶液,置于95% N2-5% CO2条件下缺氧培养6 h后,置换含2.5、5、10 μmol/L RA的全培基,正常孵育18 h。抑制剂组,提前给予20 μmol/L LY294002孵育1 h后,处理方法同其他组。
2.3 CCK-8试剂盒检测细胞活力细胞分组处理后,弃上清液,培养板中每孔加入100 μL含10% CCK-8的DMEM培养液,37 ℃孵育30 min,酶标仪450 nm波长检测各孔吸光度(A)。
2.4 LDH试剂盒检测乳酸脱氢酶漏出量细胞分组处理后,吸取25 μL的上清液于96孔板中,加入25 μL CytoTox-ONETM Reagent,于22 ℃孵育10 min后,加入12.5 μL Stop Buffer,振荡10 s,于激发波长560 nm,发射波长590 nm处检测荧光值。
2.5 跨细胞间电阻的测量BMEC种于套筒内侧,每天固定时间测定细胞间电阻值,即将电阻仪电极分别插入Transwell小室内外侧,待电阻值达到稳定后可用于实验。细胞分组给药处理后,再测量每组TEER值。
2.6 FITC-葡聚糖通过量的测定细胞处理24 h后,用D-Hanks洗2遍,Transwell套筒内侧加入1 mg/mL FITC-葡聚糖,外侧加入1.5 mL平衡盐溶液,孵育4 h后,Transwell套筒内外侧分别取液体100 μL,加入到96孔板,酶标仪检测,激发波长为494 nm,发射波长为520 nm,计算FITC-葡聚糖透过量。
2.7 Rh123摄取实验细胞分组处理后,弃上清液,每孔加入含有终浓度为5 μmol/L的Rh123,37 ℃避光孵育120 min,用冷HEPES溶液终止转运并漂洗细胞3遍后,加入0.2%Triton吹打细胞,细胞裂解后吸取上清液于激发波长485 nm,发射波长530 nm处检测荧光强度。并按照BCA蛋白定量试剂盒说明书测定蛋白质含量。
2.8 紧密连接蛋白ZO-1、Claudin-5和耐药蛋白P-gp、MRP1 mRNA检测BMEC接种于6孔培养板中,培养至80%融合,分组加药处理。各组用Trizol提取细胞总RNA,按Two-Step RT-PCR试剂盒说明书反转录合成cDNA。检测ZO-1、Claudin-5、P-gp、MRP1 mRNA表达水平,以β-actin为内参,各基因进行相对定量分析。
2.9 Western blot法检测p-Akt、Akt蛋白表达BMEC分组加药处理后,弃掉上清液,用预冷D-Hanks洗2遍,加入RIPA裂解液,超声裂解细胞,混悬液低温离心15 min,吸取上清液,蛋白定量、变性。蛋白样品经SDS-PAGE电泳后,转至聚偏二氟乙烯(PVDF)膜,5%脱脂牛奶室温封闭1 h,加入一抗p-Akt、Akt,4 ℃孵育过夜,TBST洗膜5 min×3次,加入辣根过氧化酶标记的二抗免疫球蛋白G(IgG),室温孵育1 h,TBST洗膜10 min×3次,增强化学发光法显影。采用ImageJ软件分析,记录灰度值,进行定量分析。
2.10 统计学处理采用SPSS 19.0统计软件进行数据分析,实验数据以均数±标准差(x±s)表示,各组间比较采用单因素方差分析,组间两两比较采用LSD法。以P < 0.05为差异有统计学意义。
3 结果 3.1 RA对OGD/R损伤BMEC细胞活力及LDH漏出量的影响与Con组相比,OGD/R组BMEC细胞活力明显下降(P < 0.001),LDH漏出量明显升高(P < 0.001),RA在2.5、5、10 μmol/L时能显著升高缺氧损伤BMEC细胞活力(P < 0.05,P < 0.001,P < 0.001),降低LDH漏出量(P < 0.05,P < 0.01,P < 0.001)。见表 1。
|
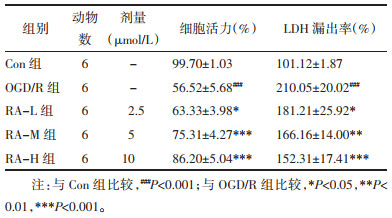
跨细胞间电阻值是最简单、直观的体现BBB完整性的方法。本研究所培养BMEC细胞在种于套筒内侧7 d后TEER值可达到170~180 Ω/cm2,证明细胞屏障生成,可用于后续实验。OGD/R处理后,TEER值明显降低(P < 0.001),而给予5、10 μmol/L RA后可抵消ODG/R损伤造成的TEER降低(P < 0.01,P < 0.001)。见表 2。
|
FITC-葡聚糖透过、Rh123摄取实验,是检测BBB屏障功能的常用指标。BMEC在经过OGD/R处理后,FITC-葡聚糖通过率、胞内Rh123蓄积量明显增加(P < 0.001,P < 0.001),而给予5、10 μmol/L RA处理后能降低FITC-葡聚糖透过率(P < 0.05,P < 0.001),给予10 μmol/L RA能降低胞内Rh123蓄积量(P < 0.01),提示RA不仅能维持内皮细胞间的紧密连接,而且能维护内皮细胞的转运功能。见表 2。
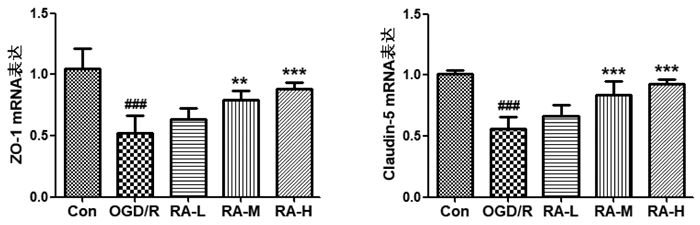
3.3 RA对OGD/R损伤BMEC ZO-1、Claudin-5、P-gp和MRP1 mRNA表达的影响紧密连接是BBB通透性的中心环节,ZO-1、Claudin-5是紧密连接的主要结构蛋白,其表达水平的变化与BMEC通透性的改变程度密切相关。本实验通过Real time RT-PCR法检测OGD/R损伤BMEC紧密连接ZO-1、Claudin-5 mRNA表达,结果显示,OGD/R损伤后,与Con组比较,OGD/R组BMEC中ZO-1、Claudin-5 mRNA表达显著降低(P < 0.001,P < 0.001);与OGD/R组比较,5、10μmol/L RA能显著增加ZO-1(P < 0.01,P < 0.001)、Claudin-5(P < 0.001,P < 0.001)mRNA表达。见图 1。
|
| OGD/R损伤后, 与Con组比较, ###P<0.001; 与OGD/R组比较,**P<0.01, ***P<0.001。 图 1 RA对OGD/R损伤BMECZO-1、Claudin-5 mRNA表达的影响(n=6) Fig. 1 Effect of RA on mRNA expression of Zo -1 andclaudin-5 of BMEC injured by OGD/R(n=6) |
BBB的主要功能是阻止外源和有害物质进入脑内,BBB上存在多种转运蛋白,参与物质的吸收和外排。本实验进一步检测RA对转运蛋白P-gp、MRP1 mRNA表达的影响。结果显示,OGD/R损伤后BMEC转运蛋白P-gp、MRP1 mRNA表达显著降低,而给予5、10 μmol/L RA干预可以显著增加P-gp(P < 0.05,P < 0.001)、MRP1(P < 0.05,P < 0.01)mRNA表达。见图 2。
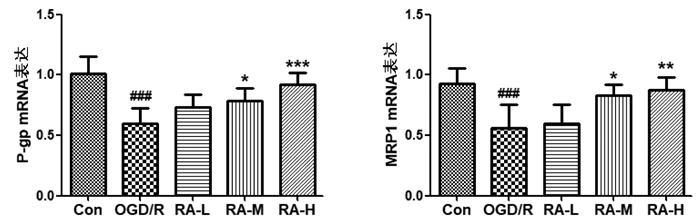
|
| 与Con组比较, ###P<0.001;与OGD/R组比较, *P<0.05, **P<0.01, ***P<0.001。 图 2 RA对OGD/R损伤BMEC P-gp.MRP1 mRNA表达的影响(n=6) Fig. 2 Effect of RA on mRNA expression of P-gp and MRP1 of BMEC injured by OGD/R(n=6) |
血脑屏障的生物化学和构象改变可受多条信号通路调节,本研究从与中枢神经系统损伤保护机制密切相关的PI3K/Akt信号通路,考察RA对BBB的调节作用。与Con组相比,OGD/R组BMEC细胞的p-Akt蛋白表达明显降低(P < 0.001),给予5、10 μmol/L RA后能不同程度的升高p-Akt表达(P < 0.001,P < 0.001),提示RA可能通过Akt信号通路发挥BBB的保护作用。见图 3。
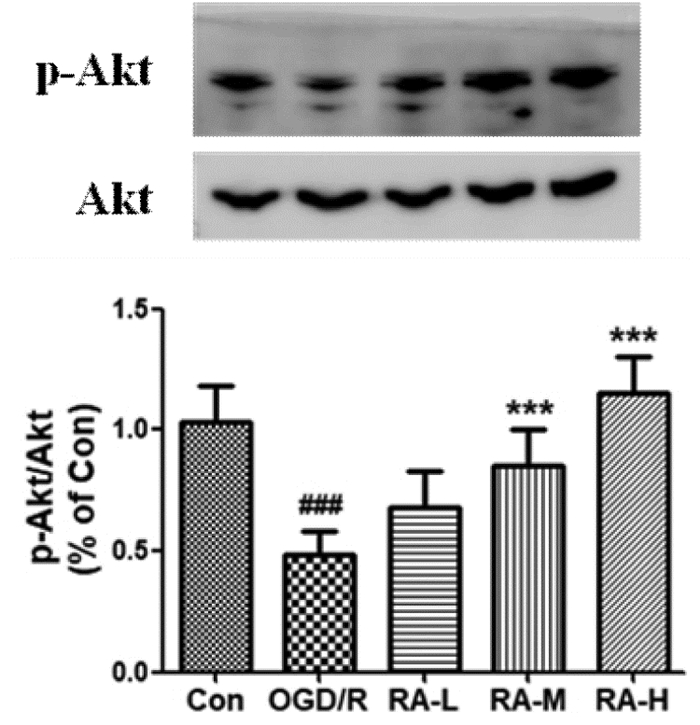
|
| 与Con组比较, ###P<0.001; 与OGD/R组比较, ***P<0.001。 图 3 RA对OGD/R损伤BMEC p-Ak蛋白表达的影响(n=3) Fig. 3 Effect of RA on p-Ak protein expression of BMEC injured by OGD/R(n=3) |
与Con组相比,OGD/R组BMEC细胞TEER值降低(P < 0.001),FITC透过率、胞内Rh123量增加(P < 0.001,P < 0.001);与OGD/R组相比,10 μmol/L RA能够显著升高TEER值(P < 0.01),降低FITC透过率、胞内Rh123量(P < 0.01,P < 0.05);提前给予PI3K/Akt特异性抑制剂LY294002可以明显拮抗RA对BBB的上述保护作用(P < 0.01,P < 0.05,P < 0.05)。见图 4。
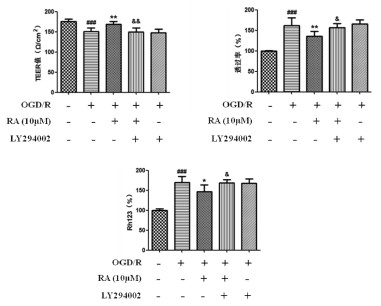
|
| 与Con组比较, ###P<0.001;与OGD/R组比较, *P<0.05, **P<0.01; 与RA比较, &P<0.05, &&P<0.01。 图 4 RA通过PI3K/Akt通路调节OGD/R损伤BMEC BBB功能(n=3) Fig. 4 RA regulates BMEC BBB function induced byoGD/R through PI3K/Akt pathway(n=3) |
BBB结构和功能的损害,使BBB通透性增加,影响脑缺血的病理生理过程,两者之间密切相关。脑缺血损伤后,快速保护并维持BBB功能,是预防继发性神经元损伤的关键[5-6]。RA广泛分布于多种植物中,尤以唇型科和紫草科植物中含量最高,具有较强的抗氧化、抗炎、抗肿瘤等活性[7-9]。目前,对RA的神经保护作用多关注于神经退行性疾病的治疗[10-11],对脑缺血后神经系统的作用,尤其是对BBB的影响尚未见报道。查阅文献不难发现,丹参水溶性成分可以维持脑缺血后BBB稳定性,增强紧密连接蛋白表达[12]。因此,推测RA作为丹参中重要的水溶性成分,可能对BBB具有一定保护作用,其可能是丹参水溶性成分发挥BBB保护作用的物质基础之一。本研究利用原代培养大鼠BMEC细胞,建立体外BBB模型,考察RA对缺血缺氧损伤BBB功能的保护作用及机制。结果发现,RA可以显著逆转OGD/R诱导的BMEC TEER值降低,FITC-葡聚糖透过率增加,胞内Rh123蓄积,证实RA对BBB功能具有保护作用。
BBB的功能指通过其特有的紧密连接结构和多种药物外排转运体表达,以达到限制外周物质进入脑内,保持脑内环境稳态的作用[13]。跨膜蛋白,胞质附着蛋白及细胞骨架蛋白共同组成紧密连接,各种信号通路通过调控这些蛋白达到对BBB的调节[14]。ZO-1蛋白是胞质附着蛋白,将跨膜蛋白和细胞骨架蛋白连接在一起,并能识别紧密连接位置及传递各种信号,是紧密连接支持结构的基础,ZO-1缺失会导致紧密连接结构的破坏[15]。Claudins是组成紧密连接的跨膜蛋白,其种类的组成直接决定BBB的功能[16]。研究表明,在脑缺血后,BBB通透性的改变与其紧密连接蛋白Claudin-5密切关联[17]。脑缺血损伤后,脑毛细血管内皮细胞不仅紧密连接蛋白被破坏,同时转运蛋白亦受影响。转运蛋白能识别特定分子,使糖类、氨基酸类等营养物质顺利通过到达脑内,同时阻止外源和有害物质进入脑内,以维持神经系统内环境的相对稳定[18-19]。P-gp和MRP1是脑毛细血管内皮细胞膜上重要的转运蛋白,P-gp主要存在于脑毛细血管内皮的管腔侧,可将其底物从脑中外排到血液中,从而限制了这些物质向脑内的转运[20]。MRP家族主要介导多种有机阴离子的外排转运,如氧化谷胱甘肽等。研究发现,小鼠经大脑中动脉闭塞(MCAO)处理[21],或体外内皮细胞经OGD处理后[22],脑内皮细胞P-gp、MRP1转录水平均呈下调状态。且MRP1缺陷小鼠表现出更大的脑卒中病变,提示转录蛋白是预防中风的保护因子,具有神经保护作用[23]。本研究在评价RA对BBB通透性及转运能力的基础上,对紧密连接蛋白ZO-1、Claudin-5和转运蛋白P-gp、MRP1的mRNA表达进行考察,进一步证实RA可以影响BBB紧密连接蛋白及转运蛋白的表达。韦立群发现,RA衍生物能有效下调MCF-7/ADM细胞中多药耐药基因的表达水平,从而降低MCF-7/ADM的耐药性诱导其凋亡[24]。这似乎与本研究结果相反,究其原因是由于实验目的并不相同,这也正体现中药对不同疾病的广泛应用。
PI3K/Akt通路是由磷脂酰肌醇3-激酶(PI3K)始动的生物信号转导通路,近来发现与中枢神经系统损伤的保护机制密切相关。研究显示,脑缺血损伤后,诱导激活PI3K/Akt信号通路,可对神经凋亡产生抑制作用,促进干细胞增殖,发挥神经保护作用[25-26]。外源性药物通过PI3K/Akt信号通路可减轻脑损伤大鼠的神经炎症和BBB破坏,改善神经功能缺损[27]。本研究结果发现,OGD/R损伤后,BMEC细胞Akt表达水平明显降低,给予RA后可以显著升高Akt表达。提前给予抑制剂LY29004,可以明显拮抗RA对BMEC细胞的通透性及转运功能,进一步证实了RA发挥BBB保护作用与PI3K/Akt信号通路相关。
基于以上结果提示,RA对缺氧/复氧诱导的体外BBB功能具有保护作用,可以影响脑微血管内皮细胞紧密连接蛋白、转运蛋白表达,其机制可能与促进PI3K/Akt信号激活有关。这一结果为RA在神经保护方面的进一步研究提供了实验基础。
| [1] |
OBERMEIER B, VERMA A, RANSOHOFF R M. The blood-brain barrier[J]. Handbook of Clinical Neurology, 2016, 3(133): 39-59. |
| [2] |
ABBOTT N J. Blood-brain barrier structure and function and the challenges for CNS drug delivery[J]. Journal of Inherited Metabolic Disease, 2013, 36(3): 437-449. DOI:10.1007/s10545-013-9608-0 |
| [3] |
HALEY M J, LAWRENCE C B. The blood-brain barrier after stroke: Structural studies and the role of transcytotic vesicles[J]. Journal of Cerebral Blood Flow and Metabolism, 2017, 37(2): 456-470. DOI:10.1177/0271678X16629976 |
| [4] |
ROSAS-HERNANDEZ H, CUEVAS E, LANTZ S M, et al. Isolation and culture of brain microvascular endothelial cells for in vitro blood-brain barrier studies[J]. Methods in Molecular Biology, 2018, 12(1727): 315-331. |
| [5] |
SWEENEY M D, ZHAO Z, MONTAGNE A, et al. Blood-Brain Barrier: from physiology to disease and back[J]. Physiological Reviews, 2019, 99(1): 21-78. DOI:10.1152/physrev.00050.2017 |
| [6] |
曹雯, 张文娟, 潘金凤, 等. 迷迭香酸药理作用的研究进展[J]. 广西中医药, 2019, 42(1): 54-58. CAO W, ZHANG W J, PAN J F, et al. The advances in research on the pharmacological effects of rosmarinic acid[J]. Guangxi Journal of Traditional Chinese Medicine, 2019, 42(1): 54-58. |
| [7] |
TSAI C F, WU J Y, HSU Y W. Protective effects of rosmarinic acid against selenite-induced cataract and oxidative damage in rats[J]. International Journal of Medical Sciences, 2019, 16(5): 729-740. DOI:10.7150/ijms.32222 |
| [8] |
彭珂毓, 顾俊菲, 宿树兰, 等. 丹参茎叶酚酸组分对溃疡性结肠炎模型小鼠的干预作用[J]. 中国药理学通报, 2020, 36(3): 334-341. PENG K Y, GU J F, SU S L, et al. The intervention effect of phenolic acid components of stems and leaves of Salvia miltiorrhiza on ulcerative colitis in mice[J]. Chinese Pharmacological Bulletin, 2020, 36(3): 334-341. |
| [9] |
MA Z, YANG J, YANG Y, et al. Rosmarinic acid exerts an anticancer effect on osteosarcoma cells by inhibiting DJ-1 via regulation of the PTEN-PI3K-Akt signaling pathway[J]. Phytomedicine, 2020, 4(68): 153186. |
| [10] |
江欣, 牛翠, 王建波, 等. 迷迭香酸乙酯对6-羟基多巴胺所致帕金森大鼠保护作用[J]. 辽宁中医药大学学报, 2019, 21(11): 57-60. JIANG X, NIU C, WANG J B, et al. Neuroprotective effect of ethyl rosmarinate in rats with parkinson's disease induced by 6-hydroxydopamine[J]. Journal of Liaoning University of Traditional Chinese Medicine, 2019, 21(11): 57-60. |
| [11] |
杨国威, 苏海翔. 迷迭香酸对阿尔茨海默病作用机制的研究进展[J]. 甘肃医药, 2015, 34(4): 267-271. YANG G W, SU H X. Research progress on the mechanism of rosmarinic acid on Alzheimer's disease[J]. Gansu Medical Joumal, 2015, 34(4): 267-271. |
| [12] |
ZHAO C, LI X, LI X, et al. Salvianolate lyophilized injection (SLI) strengthens blood-brain barrier function related to ERK1/2 and Akt signaling pathways[J]. Brain Research, 2019, 6(1720): 146295. |
| [13] |
ABBOTT N J, PATABENDIGE A A, DOLMAN D E, et al. Structure and function of the Blood-brain barrier[J]. Neurobiology of Disease, 2010, 37(1): 13-25. DOI:10.1016/j.nbd.2009.07.030 |
| [14] |
ABDULLAHI W, TRIPATHI D, RONALDSON P T. Blood-brain barrier dysfunction in ischemic stroke: targeting tight junctions and transporters for vascular protection[J]. American Journal of Physiology-Cell Physiology, 2018, 315(3): 343-356. DOI:10.1152/ajpcell.00095.2018 |
| [15] |
GRAY K M, KATZ D B, BROWN E G, et al. Quantitative phenotyping of cell-cell junctions to evaluate zo-1 presentation in brain endothelial cells[J]. Annals of Biomedical Engineering, 2019, 47(7): 1675-1687. DOI:10.1007/s10439-019-02266-5 |
| [16] |
HASHIMOTO Y, TACHIBANA K, KRUG S M, et al. Potential for tight junction protein-directed drug development using claudin binders and angubindin-1[J]. International Journal of Molecular Sciences, 2019, 20(16): 4016. DOI:10.3390/ijms20164016 |
| [17] |
BERNDT P, WINKLER L, CORDING J, et al. Tight junction proteins at the blood-brain barrier: far more than claudin-5[J]. Cellular and Molecular Life Sciences, 2019, 76(10): 1987-2002. DOI:10.1007/s00018-019-03030-7 |
| [18] |
ABDULLAHI W, TRIPATHI D, RONALDSON P T. Blood-brain barrier dysfunction in ischemic stroke: targeting tight junctions and transporters for vascular protection[J]. American Journal of Physiology-Cell Physiology, 2018, 315(3): 343-356. DOI:10.1152/ajpcell.00095.2018 |
| [19] |
BRZICA H, ABDULLAHI W, IBBOTSON K, et al. Role of transporters in central nervous system drug delivery and blood-brain barrier protection: relevance to treatment of stroke[J]. Journal of Central Nervous System Disease, 2017, 9(9): 117-129. |
| [20] |
DING Y, WANG R, ZHANG J, et al. Potential regulation mechanisms of P-gp in the blood-brain barrier in hypoxia[J]. Current Pharmaceutical Design, 2019, 25(10): 1041-1051. DOI:10.2174/1381612825666190610140153 |
| [21] |
JUAN CEN, LU LIU, MING-SHAN LI, et al. Alteration in P-glycoprotein at the blood-brain barrier in the early period of MCAO in rats[J]. Journal of Pharmacy and Pharmacology, 2013, 65(5): 665-672. DOI:10.1111/jphp.12033 |
| [22] |
ERICA TORNABENE, HANS CHRISTIAN CEDERBERG HELMS, STINE FALSIG PEDERSEN, et al. Effects of oxygen-glucose deprivation (OGD) on barrier properties and mRNA transcript levels of selected marker proteins in brain endothelial cells/astrocyte co-cultures[J]. PLoS One, 2019, 14(8): e0221103. DOI:10.1371/journal.pone.0221103 |
| [23] |
HAN-A PARK, NATALIA KUBICKI, SURYA GNYAWALI, et al. Natural vitamin E α-tocotrienol protects against ischemic stroke by induction of multidrug resistance-associated protein 1[J]. Stroke, 2011, 42(8): 2308-2014. DOI:10.1161/STROKEAHA.110.608547 |
| [24] |
韦立群. 迷迭香酸衍生物RAD-9诱导耐阿霉素乳腺癌细胞株MCF-7/ADM凋亡及其机制的研究[D]. 南宁: 广西医科大学, 2018. WEI L Q. Study on apoptosis of adriamycin-resistant breast cancer cell line McF-7/ADM induced by Rosmarinic acid derivative RAD-9 and its mechanisms[D]. Nanning: Guangxi Medical University, 2018. |
| [25] |
ZHEYI ZHOU, LINGLU DUN, BINGXIN WEI, et al. Musk ketone induces neural stem cell proliferation and differentiation in cerebral ischemia via activation of the PI3K/Akt signaling pathway[J]. Neuroscience, 2020, 435(2): 1-9. |
| [26] |
YINGQIAO PANG, SHAOZHI ZHU, HAITAO PEI. Pachymic acid protects against cerebral ischemia/reperfusion injury by the PI3K/Akt signaling pathway[J]. Metabolic Brain Disease, 2020, 35(4): 673-680. DOI:10.1007/s11011-020-00540-3 |
| [27] |
QIQUAN ZHU, BUDBAZAR ENKHJARGAL, LEI HUANG, et al. Aggf1 attenuates neuroinflammation and BBB disruption via PI3K/Akt/NF-κB pathway after subarachnoid hemorrhage in rats[J]. Journal of Neuroinflammation, 2018, 15(1): 178. |
2. Increasepharm(Tianjin) Institnte Co. Ltd, Tianjin 300385, China
 2021, Vol. 38
2021, Vol. 38