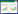文章信息
- 张瑶, 许月梅, 李家合, 郭姗琦, 李小江, 贾英杰
- ZHANG Yao, XU Yuemei, LI Jiahe, GUO Shanqi, LI Xiaojiang, JIA Yingjie
- 基于PI3K/AKT/eNOS信号通路探讨健脾利湿化瘀方抑制前列腺癌血管生成的实验研究
- An experimental study on the inhibition of angiogenesis in prostate cancer by Jianpi Lishi Huayu Prescription based on PI3K/AKT/eNOS signaling pathway
- 天津中医药, 2021, 38(4): 522-527
- Tianjin Journal of Traditional Chinese Medicine, 2021, 38(4): 522-527
- http://dx.doi.org/10.11656/j.issn.1672-1519.2021.04.24
-
文章历史
- 收稿日期: 2020-11-05
2. 天津市河西区中医医院, 天津 300201;
3. 天津中医药大学, 天津 301617
前列腺癌(PCa)是临床发病率较高的恶性肿瘤之一,2019年美国癌症中心统计数据显示,前列腺癌发病率位居第一,病死率位居第二[1]。尽管大多数患者能从内分泌治疗中获益,但同时内分泌治疗也伴随着诸多不良反应,且几乎所有患者在经过18~36个月的治疗后,最终进展成抵抗性前列腺癌[2]。中药健脾利湿化瘀方是天津中医药大学第一附属医院肿瘤科贾英杰教授基于经典古籍的挖掘[3],结合多年临证经验[4-7],临床应用疗效确切,已申请专利,基本方由黄芪、补骨脂、刺五加、姜黄、王不留行、炙甘草组成,其中黄芪健脾以补先天、实脾利湿为君药,刺五加、补骨脂补肾以助利水为臣药,姜黄、王不留行化瘀消癥散积,共为佐药,甘草补脾和胃,调和诸药为使药。前期研究表明,健脾利湿化瘀方能够抑制人前列腺癌PC-3细胞裸鼠移植瘤的生长,有效改善裸鼠生存状态,组方中化瘀散结药物组能够有效抑制细胞增殖、迁移侵袭[8-10]。目前,课题组围绕着方剂抑制血管生成方面展开了新的实验研究,方案设计根据组方不同侧重作用以君臣佐使划分,抗血管靶向药人血管内皮抑制素作为西药组,用以阳性对照[11],观察全方组与空白对照组、西药组之间的比较结果,以及3组拆方之间的对比结果,现介绍如下。
1 材料 1.1 实验细胞及动物人源前列腺癌PC-3细胞由南开大学生命科学院分子所惠赠。SPF级6~8周龄的雄性裸鼠36只,由中国医学科学院放射医学研究所提供。
1.2 实验试剂及仪器胎牛血清、RPMI1640培养基、二甲基亚砜、青霉素/链霉素、磷酸盐缓冲液(PBS)均为美国Thermor Fisher公司产品;血管内皮生长因子(VEGF)抗体、血管生成素1(ANG1)抗体、二抗、酶联免疫吸附实验(ELISA)试剂盒均为天津安诺瑞康公司产品;GAPDH、磷脂酰肌醇3-激酶(PI3K)、丝氨酸/苏氨酸激酶(AKT)、磷酸化的AKT(p-AKT)、内皮型一氧化氮合成酶(eNOS)抗体均为美国CST。仪器设备:二氧化碳(CO2)恒温培养箱、台式离心机、倒置显微镜、Trans-Blot小型转印槽转膜仪均由天津中医药大学第一附属医院中医肿瘤实验室提供。
1.3 实验药品及制备重组人血管内皮抑制素注射液:国药准字S20050088;健脾利湿化瘀方的制备及质控由天津中医药大学第一附属医院中药房提供。中药浓缩液制备方法参照《中药药理实验方法学》[12],具体用药剂量参考《药理实验方法学》[13],根据成人每日需要的生药量105 g换算为小鼠每日生药量约16 g/kg体质量,旋转蒸发仪浓缩为1.5 g/mL。
2 方法 2.1 实验分组及给药按照随机数字表将36只裸鼠分为空白对照组、西药组、全方组、君药组(生黄芪、炙甘草)、臣药组(刺五加、补骨脂)、佐药组(姜黄、王不留行),各6只。实验设计按照健脾利湿化瘀方君臣佐使配伍分配,由于炙甘草有补脾和胃的功效,与生黄芪归为君药组。模型组生理盐水灌胃20 mL;西药组腹腔注射,每日1次,药物浓度为8 mg/kg;中药各给药组给予中药汤剂灌胃10 mL/kg,每日2次,共给药14 d。
2.2 细胞培养及造模将冻存的细胞复苏后,以1640培养基(内含10%胎牛血清、1%青霉素-链霉素)悬重移至培养瓶中,放入37 ℃,5%CO2培养箱中培养,5~6 d进行传代。将培养好的(约5×106个)PC-3细胞用250 μL含10%FBS的培养液重悬,注射到裸鼠前肢右侧皮下1点注射以造模,并确认造模成功。
2.3 观察健脾利湿化瘀方对荷瘤小鼠抑瘤作用14 d后取血、脱颈处死。将瘤块组织剥离称质量、测量体积,计算抑瘤率[14]=(空白组平均瘤质量-各实验组平均瘤质量)/空白组平均瘤质量×100%。
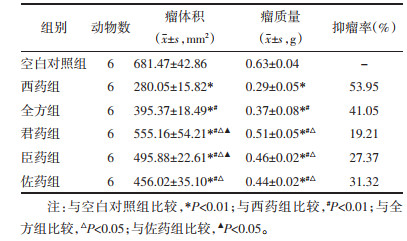
2.4 观察健脾利湿化瘀方对荷瘤小鼠血管生成作用 2.4.1 使用ELISA法检测小鼠血清VEGF、eNOS的含量ELISA试剂盒检测血清中VEGF和eNOS含量,取出样本及试剂盒后,于室温平衡30 min。根据待测样本的数量和标准品数量选择96孔板,每个标准品孔、空白孔、样品孔都做3个复孔。经加样、温育、配液、洗涤、加酶、温育、洗涤显色、终止后,应用酶标仪,空白孔调零,450 nm波长依序测量各孔的OD值。
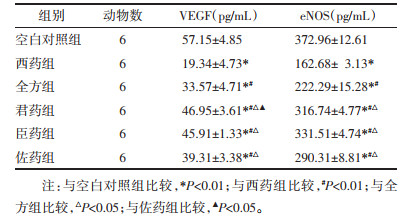
2.4.2 免疫组化检测VEGF、ANG1表达经过固定、脱水、包埋、切片、脱腊、修复、封闭等过程,将封闭好的切片去除水分,每张标本滴加30 μL一抗VEGF、ANG1,放入4 ℃冰箱过夜;添加二抗,染色后脱水、封片,进行镜下观察。以棕褐色细胞核为阳性表现,随机观察5个视野(×100),每个视野计数100个细胞,根据阳性细胞染色强度进行评分:未染色为0分,淡黄色为1分,棕黄色为2分,棕褐色为3分。两项评分结果相加后进行结果判定。0~1分为阴性(-);1~3分为弱阳性(+);3~5分为中度阳性(++);5~7分为强阳性(+++)[15]。
2.5 Western Blot检测PI3K、AKT、p-AKT、eNOS蛋白的表达从组织中提取蛋白后计算出样品浓度,与缓冲液混匀,蛋白变性后冰浴5 min。电泳、转模后封闭,将转过膜后的PVDF膜放入浓度为5%的脱脂奶粉溶液中,置摇床上等待2 h。孵育一抗、加二抗,回收一抗,洗脱一抗10 min,3次,加入二抗5 mL。显影后TBST洗脱二抗10 min,分析各条带的亮度值,与对应内参(GAPDH)条带亮度值进行比值。
2.6 统计学方法应用SPSS 23.0软件进行统计学分析,计量资料以均值±标准差(x±s)表示。多组间比较采用单因素方差分析(One-Way ANOVA),组间两两比较采用LSD法,P < 0.05表示差异有统计学意义。
3 结果 3.1 瘤体积、瘤质量与抑瘤率各给药组分别与空白对照组对比,瘤体积均小于空白对照组,差异具有统计学意义(P < 0.01),说明西药组、全方组及3组拆方均具有一定抑瘤作用;各给药组间比较,西药组瘤体积最小(P < 0.05),全方组次之(P < 0.05);3组拆方之间比较,具有化瘀消癥散结作用的佐药组瘤体积最小,与君药组(益气健脾)对比,差异具有统计学意义(P < 0.05),与臣药组(温肾助阳)对比无统计学差异(P>0.05)。瘤质量方面,各给药组瘤质量均明显低于空白对照组,差异具有统计学意义(P < 0.01);各给药组间对比,西药组瘤质量最轻(P < 0.05),其次是全方组(P < 0.05),3组拆方两两比较,差异均无统计学意义(P>0.05)。西药组、全方组、君药组、臣药组、佐药组的抑瘤率分别为:53.95%、41.05%、19.21%、27.37%、31.32%。见表 1。
各给药组VEGF含量与空白对照组比较,均呈不同程度降低,差异具有统计学意义(P < 0.05);各给药组间比较,西药组最低(P < 0.01),全方组次之(P < 0.05);3组拆方间比较,具有化瘀散结作用的佐药组VEGF含量最低,君药组含量最高,君药组和臣药组比较(P>0.05),君药组佐药组比较(P < 0.05),君药组和佐药组比较(P>0.05)。各给药组eNOS含量与模型组比较,均呈不同程度降低,差异具有统计学意义(P < 0.01);各给药组间比较,西药组含量最低(P < 0.01),全方组次之(P < 0.05);3组拆方之间比较,佐药组eNOS含量最低,臣药组含量最高,君臣两组比较差异尚无统计学意义(P>0.05),君佐两组、臣佐两组差异具有统计学意义(P < 0.05),见表 2。
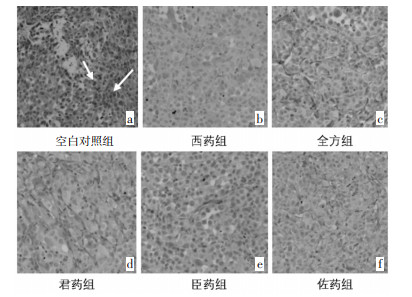
各组瘤组织均不同程度的表达了VEGF、ANG1,与空白对照组相比,各给药组VEGF中度阳性以上表达率均较弱(P < 0.05);各给药组间,西药组阳性率最低(P < 0.01),全方组阳性率表达次之(P < 0.05);3组拆方间比较,佐药组VEGF中度阳性以上的表达较君药组和臣药组两组减弱,(P < 0.05)。ANG1中度阳性以上表达率均不同程度减弱,但各组差异尚无统计学意义(P>0.05);单比较佐药组与空白对照组、西药组与空白对照组,ANG1中度阳性以上的表达率明显减弱,其差异具有统计学意义(P < 0.05)。见图 1、2。
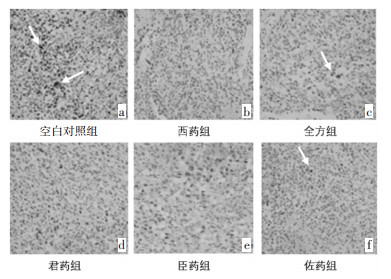
|
| 注:指示位置为抗体的阳性表达。 图 1 各组瘤组织VEGF蛋白表达(SP,×100) Fig. 1 Expression of VEGF proteinin tumor tissues of each group(SP, ×100) |
|
| 注:指示位置为抗体的阳性表达。 图 2 各组瘤组织ANG1表达(SP,×100) Fig. 2 Expression of ANG1 proteinin tumor tissues of each group(SP, ×100) |
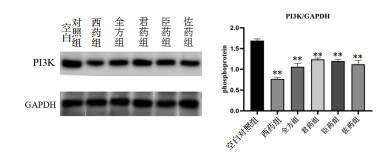
与空白对照组相比,各组小鼠肿瘤组织中PI3K的蛋白表达水平均显著降低(P < 0.01);各给药组间比较,西药组表达最低、全方组次之(P>0.05);3组拆方组间比较,佐药组PI3K表达有低于其他两组趋势,但尚无统计学意义(P>0.05),见图 3。
|
| 注:与空白对照组比较,**P < 0.01。 图 3 各组PI3K蛋白的表达(x±s) Fig. 3 Expression of PI3Kof each group(x±s) |
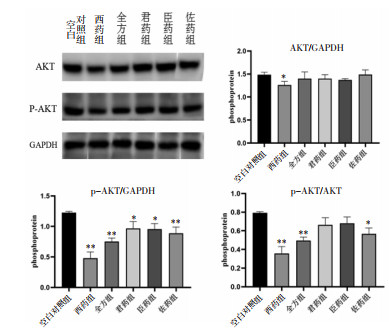
与空白对照组比较,各组AKT蛋白表达并无明显差异(P>0.05),其中西药组稍有降低,然而p-AKT表达均呈降低趋势(P < 0.05),其中西药组、全方组、佐药组与模型组对比有统计学差异(P < 0.01);3组拆方间比较暂无意义。见图 4。
|
| 注:与空白对照组比较,*P < 0.05,**P < 0.01。 图 4 各组AKT、p-AKT蛋白的表达(x±s) Fig. 4 Expression of AKT、p-AKT of each group(x±s) |
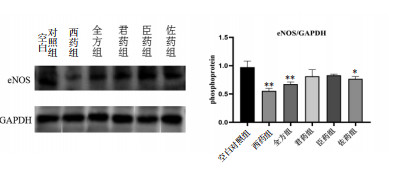
与空白对照组比较,西药组、全方组和佐药组小鼠肿瘤组织中eNOS的蛋白表达均呈现降低水平(P < 0.05);各给药组间,西药组、全方组下降水平显著(P < 0.01),尽管佐药组eNOS蛋白表达低于君药组、臣药组,但差异无统计学意义(P>0.05)。见图 5。
|
| 注:与空白对照组比较,*P < 0.05,**P < 0.01。 图 5 各组eNOS蛋白的表达(x±s) Fig. 5 Expression of eNOSof each group(x±s) |
前列腺癌在中国的发病率呈日益增长的趋势,逐渐成为严重影响中国男性健康的泌尿系恶性肿瘤之一[16]。肿瘤血管新生对于肿瘤的发生发展有着重要作用,良好的血供为肿瘤的转移、侵袭提供了必要条件,而影响肿瘤血管生成的分子成分包括细胞因子、生长因子、趋化因子以及相关信号通路的传导[17]。目前,研究表明有两条调节途径参与了血管生成过程,一条是VEGF及其受体(flt-1)调节通路,另一条是ANG及其受体(Tie)调节通路,这两条途径协同作用,共同促进机体血管形成。相关研究表明[18-22],阻断PI3K-AKT-eNOS信号通路能够有效地抑制前列腺癌细胞的增殖,阻碍肿瘤血管形成。
既往文献显示,部分具有活血化瘀消癥作用的中药如姜黄、丹参、川芎等,在抑制肿瘤血管生成方面具有一定作用,前期研究发现,健脾利湿化瘀方对肿瘤血管生成可能存在一定影响,故本实验为进一步探讨其对肿瘤血管的作用,尽管目前没有任何一个临床指南将抗血管生成药物用于前列腺癌的治疗,但重组人血管内皮抑制剂作为抗血管生成药物在临床应用广泛,其作用机制很多种,主要在于直接阻断VEGF与内皮细胞结合,发挥抗血管生成作用,且作用是广谱性的。大量文献表明,人血管内皮抑制剂在抗肿瘤细胞生成实验中具有明确作用,实验研究的目的在于探索,因此将其作为本课题探索性实验的阳性对照。
同时,为进一步明确作用靶点,以中药配伍组成作为拆方依据,分为君药组(黄芪、甘草以健脾益气)、臣药组(刺五加、补骨脂以补肾助阳以利水)、佐药组(姜黄、王不留行以化瘀消癥散结)3个拆方组。结果显示,尽管健脾利湿化瘀方作用弱于西药组,但全方以及各拆方组均具有一定的抑瘤作用,实验观察指标VEGF为血管内皮生长因子,是判断肿瘤血管生成的重要指标,ANG1和eNOS均为影响血管生成的重要因子,进一步证实了健脾利湿化瘀方的抗血管生成作用,这也与前期关于健脾利湿化瘀方的研究结果相一致,提示中西医联合治疗可起到协同作用。
3组拆方间对比,具有益气健脾作用的君药组在抑瘤、抗血管生成方面稍弱于臣药组、佐药组,但实验过程中该组小鼠生存质量较好,这可能与各拆方扶正与攻邪作用侧重不同相关。包含姜黄、王不留行的佐药组具有化瘀消癥散结作用,在3组拆方中显示出较好的抑瘤作用和抗血管生成作用,尽管部分数据尚不具有统计学意义,这可能与实验裸鼠数量偏少相关,但已呈现出组间差距。课题组发现,姜黄、王不留行药物其化瘀消癥散结作用和能与抑制肿瘤血管生长存在某种关联,方药能够下调PI3K、eNOS表达,虽然各组AKT的表达无明显差异,但活化后的p-AKT组间存在统计学差异,说明佐药组中某种作用成分能够干扰AKT入核而抑制其磷酸化,进而影响PI3K/AKT/eNOS信号通路。
目前针对中医药及其拆方抑制前列腺癌肿瘤血管生成方面的研究甚少,课题组只是将刚得到的检测结果进行公布,有阴性也有阳性,重组人血管内皮抑制剂的作用机制与中药汤剂抗血管生成的机制可能不会完全一致,这也是未来前列腺癌课题组需要深入展开研究的方向,在实验设计中还应不断完善,将重组人血管内皮抑制剂联合化疗作为对照,以求更为科学严谨。未来进一步深入研究有效拆方中具有药物靶点,进行血管形态学方面的研究,以寻求更确切的抗肿瘤生成、抑制血管生成相关证据。
| [1] |
SIEGEL R L, MILLER K D, JEMAL A. Cancer statistics, 2019[J]. CA: A Cancer Journal for Clinicians, 2019, 4(69): 7-34. |
| [2] |
冯小兰, 黄喜健. 去势抵抗性前列腺癌形成机制的研究进展[J]. 医学综述, 2019, 25(15): 3019-3023. FENG X L, HUANG X J. Research progress in formation mechanism of castration resistant prostate cancer[J]. Medical Recapitulate, 2019, 25(15): 3019-3023. DOI:10.3969/j.issn.1006-2084.2019.15.020 |
| [3] |
贾英杰, 陈军, 李小江, 等. 前列腺癌中医证候研究的文献分析[J]. 辽宁中医杂志, 2014, 41(9): 1850-1852. JIA Y J, CHEN J, LI X J, et al. Literature analysis of traditional Chinese medicine syndrome in prostate cancer[J]. Liaoning Journal of Traditional Chinese Medicine, 2014, 41(9): 1850-1852. |
| [4] |
赵林林, 陈亮, 李小江, 等. 贾英杰治疗前列腺癌经验管窥[J]. 辽宁中医杂志, 2013, 40(8): 1539-1540. ZHAO L L, CHEN L, LI X J, et al. A glimpse at Professor JIA's academic experience in treatment of prostatic cancer[J]. Liaoning Journal of Traditional Chinese Medicine, 2013, 40(8): 1539-1540. |
| [5] |
邓仁芬, 姚杨, 李小江, 等. 贾英杰"守方微调"治疗前列腺癌经验[J]. 中医杂志, 2019, 60(20): 1724-1727. DENG R F, YAO Y, LI X J, et al. JIA Yingjie's experience in treating prostate cancer: "sticking to laws and modifying slightly"[J]. Journal of Traditional Chinese Medicine, 2019, 60(20): 1724-1727. |
| [6] |
牟睿宇, 李小江. 贾英杰运用"截断疗法"治疗前列腺癌[J]. 辽宁中医杂志, 2017, 44(11): 2296-2298. MOU R Y, LI X J. JIA Yingjie treating prostate cancer by "truncation therapy"[J]. Liaoning Journal of Traditional Chinese Medicine, 2017, 44(11): 2296-2298. |
| [7] |
董新刚, 孙彬栩, 李小江, 等. 贾英杰治疗晚期前列腺癌经验[J]. 山东中医杂志, 2015, 34(1): 56-57. DONG X G, SUN B X, LI X J, et al. JIA Yingjie's experience in the treatment of advanced prostate cancer[J]. Shandong Journal of Traditional Chinese Medicine, 2015, 34(1): 56-57. |
| [8] |
孙彬栩, 李小江, 贾英杰, 等. 基于IGF/MMP信号通路研究健脾利湿化瘀方有效拆方对前列腺癌细胞侵袭、迁移的影响[J]. 天津中医药, 2020, 37(4): 450-456. SUN B X, LI X J, JIA Y J, et al. Influence of the effective decomposed in Nourishing Spleen Removing Dampness and Eliminating Blood-stasis decoction on the invasion, migration and apoptosis of the human prostate cancer cells based on the IGF/MMP signaling pathway[J]. Tianjin Journal of Traditional Chinese Medicine, 2020, 37(4): 450-456. |
| [9] |
孙彬栩, 贾英杰, 陈军, 等. "健脾利湿化瘀方"对人前列腺癌PC-3细胞荷瘤小鼠的抑瘤作用研究[J]. 中华中医药学刊, 2016, 34(10): 2468-2471. SUN B X, JIA Y J, CHEN J, et al. Nourishing Spleen and Removing Dampness and Eliminating Blood Stasis decoctionon anti-tumor effect of tumor-bearing by human prostate cancer PC-3 cells[J]. Chinese Archives of Traditional Chinese Medicine, 2016, 34(10): 2468-2471. |
| [10] |
牟睿宇, 贾英杰, 李小江, 等. 健脾利湿化瘀方对人前列腺癌C4-2细胞雄激素非依赖性生长的影响[J]. 中医杂志, 2019, 60(11): 964-968. MOU R Y, JIA Y J, LI X J, et al. Effects of Jianpi Lishi Huayu Recipe on androgen-independentgrowth of human prostate cancer C4-2 cells[J]. Journal of Traditional Chinese Medicine, 2019, 60(11): 964-968. |
| [11] |
叶庆, 秦叔逵, 殷晓进, 等. 重组人血管内皮抑素对血管新生的影响研究[J]. 临床肿瘤学杂志, 2014, 19(12): 1062-1068. YE Q, QIN S K, YIN X J, et al. Influences of recombinant human endostatin on angiogenesis[J]. Chinese Clinical Oncology, 2014, 19(12): 1062-1068. |
| [12] |
陈奇. 中药药理研究方法学[M]. 北京: 人民卫生出版社, 2011: 229-237. CHEN Q. Pharmacological research methodology of traditional Chinese medicine[M]. Beijing: People's Medical Publishing House, 2011: 229-237. |
| [13] |
魏伟, 吴希美, 李元建. 药理实验方法学[M]. 北京: 人民卫生出版社, 2010: 1566-1623. WEI W, WU X M, LI Y J. Pharmacological experimental methodology[M]. Beijing: People's Medical Publishing House, 2010: 1566-1623. |
| [14] |
郭冬梅, 田菲, 陈立伟, 等. 扶正消癌方对Lewis肺癌模型小鼠的抑瘤作用[J]. 中医杂志, 2012, 53(18): 1585-1587. GUO D M, TIAN F, CHEN L W, et al. Tumor inhibitory of Fuzheng Xiaoai formula on Lewis lung cancer model mice[J]. Journal of Traditional Chinese Medicine, 2012, 53(18): 1585-1587. |
| [15] |
张爱建. 姜黄素对前列腺癌PC-3细胞株裸鼠移植瘤的抑制作用及机制探讨[D]. 昆明: 昆明医科大学, 2013. ZHANG A J. Inhibitory effect of curcumin on pc-3 cell line transplanted tumor in nude mice and its mechanism[D]. Kunming: Kunming Medical University, 2013. |
| [16] |
韩苏军, 张思维, 陈万青, 等. 中国前列腺肿瘤发病现状和流行趋势分析[J]. 临床肿瘤学杂志, 2013, 18(4): 330-334. HAN S J, ZHANG S W, CHEN W Q, et al. Analysis of the status and trends of prostate cancer incidence in China[J]. Chinese Clinical Oncology, 2013, 18(4): 330-334. DOI:10.3969/j.issn.1009-0460.2013.04.009 |
| [17] |
刘倩, 唐丽萍, 任晓霞. 肿瘤血管生成的分子机制与临床治疗研究进展[J]. 中国肿瘤, 2016, 25(11): 898-903. LIU Q, TANG L P, REN X X. Research progress on molecular mechanism of tumor angiogenesis and its relation to clinical treatment[J]. China Cancer, 2016, 25(11): 898-903. DOI:10.11735/j.issn.1004-0242.2016.11.A013 |
| [18] |
NAN J, LIU Y, XU C, et al. Effects of eNOS gene polymorphisms on individual susceptibility to cancer: a meta-analysis[J]. Nitric Oxide, 2019, 84: 1-6. DOI:10.1016/j.niox.2018.12.006 |
| [19] |
SUN S, GONG F, LIU P, et al. Metformin combined with quercetin synergistically repressed prostate cancer cells via inhibition of VEGF/PI3K/Akt signaling pathway[J]. Gene, 2018, 664: 50-57. DOI:10.1016/j.gene.2018.04.045 |
| [20] |
HAKRYUL J, SUBHANJAN, DEWAR T, et al. Small moleculeinduced cytosolic activation of protein kinase Akt rescues ischemia-elicited neuronal death[J]. Proceedings of the National Academy of Sciences, 2012, 109(26): 10581-10586. DOI:10.1073/pnas.1202810109 |
| [21] |
高杉, 王鹏伟, 于春泉, 等. 基于PI3K/Akt通路的冠心病痰瘀互结证大鼠发病机制研究[J]. 天津中医药, 2020, 37(2): 209-213. GAO S, WANG P W, YU C Q, et al. Pathogenesis research of coronary heart disease with phlegm-stasis syndrome rat model based on PI3K/Akt pathway[J]. Tianjin Journal of Traditional Chinese Medicine, 2020, 37(2): 209-213. |
| [22] |
DIMMELER S, ZEIHER A M. Akt takes center stage in angiogenesis signaling[J]. Circulation Research, 2000, 86(1): 4. DOI:10.1161/01.RES.86.1.4 |
2. Tianjin Hexi District Hospital of Traditional Chinese Medicine, Tianjin 300201, China;
3. Tianjin University of Traditional Chinese Medicine, Tianjin 301617, China
 2021, Vol. 38
2021, Vol. 38