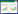文章信息
- 郭子右, 刘葭, 余玲, 兰海, 刘玉娟, 吴清
- GUO Ziyou, LIU Jia, YU Ling, LAN Hai, LIU Yujuan, WU Qing
- 当归汤多糖对溃疡性结肠炎的改善作用及机制初步研究
- Preliminary study on the improvement effect and mechanism of Danggui Decoction polysaccharide eextracts on ulcerative colitis
- 天津中医药, 2021, 38(4): 528-534
- Tianjin Journal of Traditional Chinese Medicine, 2021, 38(4): 528-534
- http://dx.doi.org/10.11656/j.issn.1672-1519.2021.04.25
-
文章历史
- 收稿日期: 2020-11-30
溃疡性结肠炎(UC)是一种肠道非特异性炎性疾病,发病多与遗传、环境及免疫反应异常有关,病因和发病机制至今尚未被完全阐明[1]。UC临床表现为腹痛腹泻和黏液脓血便,常反复发作[2]。目前普遍认为UC是结直肠癌发生发展的重要危险因素[3-4]。近年来,越来越多的研究表明,中医药在缓解UC患者的病情、改善生活质量、减少毒副作用等方面有明显优势[5-6]。
当归汤为中医治疗结肠炎的经典方,首载于《外台秘要·卷第二十五·数十年痢方一十一首》,文中记载“当归汤,疗三十年下痢,止诸痛方”[7]。当归汤由当归、大枣、生姜组成,3药合用,温中止泻、补脾益气、和血止痛,且现代药理学研究表明,3药对UC具有改善作用[8-10]。多糖类成分是当归汤中的主要化学成分,且具有抗炎抗氧化、调节免疫等药理作用[11-12],其是否是改善UC的有效物质有待研究。
RAW264.7细胞和脾细胞是免疫相关的药物活性评价常用细胞模型[13]。TNBS模型于1984年由Morris等首次成功建立[14],该法操作简单,持续时间长且组织学变化与人类UC相似,是目前常用的UC模型之一[15]。因此,文章旨在通过体内外药理学研究手段,探讨当归汤多糖对UC的作用及其机制,以期为UC的药物研发和临床治疗提供一定的实验依据。
1 材料 1.1 药品及试剂红细胞裂解液、青链霉素(北京索莱宝科技有限公司);RPMI 1640培养基、高糖DMEM培养基、刀豆蛋白A(Con-A,美国Corning公司);大鼠白细胞介素(IL)-2、干扰素-γ(IFN-γ)酶联免疫吸附法(ELISA)试剂盒(美国Raybiotech公司);胎牛血清(FBS,以色列Biological Industries公司);脂多糖(LPS)、二甲基亚砜(DMSO,美国Sigma公司);NO检测试剂盒(北京拜尔迪生物技术有限公司);2,4,6-三硝基苯磺酸(TNBS,P2297-10 mL,美国Sigma-Aldrich公司);艾迪莎美沙拉秦缓释颗粒(中国上海爱的发制药有限公司,批号:1810106);髓过氧化物酶(MPO)试剂盒(A044-1-1)、超氧化物歧化酶(SOD)试剂盒(WST-1法,A001-3-2)、丙二醛(MDA)试剂盒(A003-1-2,南京建成生物工程研究所);BCA蛋白含量检测试剂盒(江苏凯基生物技术股份有限公司);其余试剂为分析纯。
1.2 实验动物及细胞SPF级雄性SD大鼠(体质量180~200 g),购自斯贝福(北京)生物技术有限公司,许可证号:SCXK(京)2016-0002。实验动物饲养于北京中医药大学动物实验中心,温度为(25±2)℃,湿度50%±10%,12 h循环光照。小鼠单核巨噬细胞RAW264.7(中国医学科学院基础医学研究所细胞中心)。
1.3 实验仪器BJ-2CD型净化工作台(上海博讯实业有限公司医疗设备厂);311型二氧化碳培养箱、ST8R高速冷冻离心机(美国Thermo公司);SPECTROstar Nano全波长酶标仪(德国BMG LABTECH公司);紫外可见分光光度计(北京普析通用仪器有限责任公司);TS2-S-SM光学显微镜(日本尼康公司);80-2型离心机(巩义市科瑞仪器有限公司)。
2 方法 2.1 当归汤多糖的提取采用实验室前期优化的提取工艺制备:30倍量水回流提取3次,每次1 h,滤过,合并滤液,减压浓缩至相对密度为1.15~1.20(60 ℃),加乙醇使醇浓度为70%,冷藏12 h,4 000 r/min离心15 min(r=7.9 cm,下同),取沉淀,干燥备用。经苯酚-硫酸法检测,当归汤多糖含量为(634.79±3.10)mg/g。
2.2 动物实验 2.2.1 模型建立与实验分组36只SD大鼠适应性饲养后,随机分为6组,对照组(Control)、模型组(TNBS)、美沙拉嗪组(Mesalazine)、当归汤多糖低剂量组、中剂量组和高剂量组。采用TNBS单次灌肠法制备大鼠UC模型:SD大鼠10%水合氯醛(3 mL/kg)麻醉,取石蜡润滑的灌胃针插入肛门约8 cm,灌注TNBS溶液,灌肠后倒立3 min,对照组采用相同操作方法灌注生理盐水。造模第2天开始给药,连续给药7 d。美沙拉嗪组灌胃美沙拉嗪(400 mg/kg),当归汤多糖低、中、高剂量组灌胃给药的剂量分别为0.5、1、2 g/kg,对照组与模型组均灌胃去离子水。实验结束后,10%水合氯醛(3 mL/kg)腹腔注射麻醉,腹主动脉取血,取脾脏置于无菌PBS缓冲液中备用;取出肛门至盲肠末端的整个肠段,测量长度;沿纵轴剖开结直肠,观察大体形态并进行评分;结直肠组织分段后部分用10%中性福尔马林固定液固定,其余置于-80 ℃保存,用于后续指标检测。
2.2.2 一般状态观察与疾病活动指数(DAI)实验期间,每天对大鼠的一般情况进行观察,包括体质量、大便性状与便血情况,进行DAI评分,评分标准参考文献[16]标准。
2.2.3 结直肠宏观损伤评分沿纵轴剪开结直肠,冰生理盐水洗净后,立即肉眼观察结直肠组织大体形态,并进行宏观损伤评分,评分标准参考文献[17]标准。
2.2.4 苏木精-伊红(HE)染色及结直肠组织病理学分析取结直肠组织固定于10%中性福尔马林固定液中,石蜡包埋,切片,HE染色,显微镜下观察结直肠组织的病理变化,进行组织病理学评分,评分标准参考[18]的标准。
2.2.5 氧化应激指标的测定取结直肠组织加入生理盐水制备组织匀浆,使用BCA试剂盒测量组织匀浆蛋白浓度,参照试剂盒说明书检测并计算结直肠组织中SOD活力、MDA含量和MPO活力。
2.2.6 Con-A刺激下脾细胞增殖检测及IL-2与IFN-γ的测定脾细胞悬液按2.4.1项下方法制备,将各组大鼠的脾细胞悬浮于RPMI1640完全培养基中,在37 ℃、5% CO2条件下培养2 h后,除去贴壁细胞,台盼蓝染色计数后以5×105个/mL的密度接种于96孔板中,每孔加入Con-A使终浓度为5 μg/mL刺激细胞,孵育24 h。同时设置不加Con-A的对照组。收集每孔的细胞悬液,1 000 r/min离心3 min,收集上清液用于细胞因子IL-2和IFN-γ检测,细胞重新添加含MTT的培养基,继续培养4 h。1 000 r/min离心3 min,弃去上清液,加入150 μL DMSO,振摇溶解后,转移至96孔板中,550 nm处测量OD值,按公式1计算刺激指数。取与Con-A共孵育24 h的脾细胞上清液,按照ELISA试剂盒说明书检测上清液中的IL-2和IFN-γ。
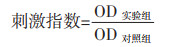 |
公式1 |
取对数生长期的RAW264.7细胞以1×105个/mL接种于96孔板中,每孔100 μL,培养24 h后,弃上清液,加入不同浓度(50、100、200、400、800 μg/mL)当归汤多糖的DMEM培养基,每组设置5个复孔。设置溶剂对照组(0.5%DMSO的培养基)和空白对照组。继续培养24 h,避光条件下每孔加入10 μL MTT溶液(5 mg/mL),培养4 h,弃上清液,每孔加入100 μL DMSO,摇床摇晃10 min,酶标仪490 nm处测量OD值,按公式2计算细胞存活率(%)。
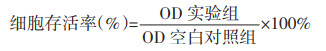 |
公式2 |
取对数生长期的RAW264.7细胞以1×105个/mL接种于96孔板中,每孔100 μL,培养24 h后,弃上清液,加入不同浓度(50、100、200、400、800 μg/mL)当归汤多糖的DMEM培养基,每组3个复孔。设置空白对照组和阳性对照组(1 μg/mL LPS刺激)。培养24 h。收集细胞上清液,按NO试剂盒测定方法检测,计算NO抑制率(%)。
2.4 当归汤多糖对Con-A刺激下正常和UC大鼠脾细胞增殖的影响 2.4.1 脾细胞悬液的制备采用如下方法制备[19]:牺牲SD大鼠,无菌条件下取脾脏,用RPMI1640培养基漂洗后,采用200目筛网研磨制备组织匀浆,经红细胞裂解液裂解并用PBS清洗后,RPMI1640培养液重悬,37 ℃、5% CO2条件下培养2 h后除去贴壁细胞,即得脾细胞悬液,使用台盼蓝染色,活细胞数高于95%方可用于后续实验。
UC大鼠脾细胞:造模方法同2.2.1,造模后饲养7 d,期间自由饮水摄食。大鼠牺牲后,脾细胞悬液的制备方法同上。
2.4.2 当归汤多糖给药范围筛选取按2.3.1项下制备的脾细胞悬液,以5×106个/mL接种于96孔板,每孔100 μL,加入不同浓度(50、100、200、400、800 μg/mL)当归汤多糖的RPMI1640培养基,每组设置6个复孔,给药后培养48 h。并设置空白对照组。收集每孔的细胞悬液,以1 000 r/min离心3 min,弃去上清液,细胞重新添加含MTT的RPMI1640培养基,继续培养4 h。再次以1 000 r/min离心3 min,弃去上清液,加入150 μL DMSO,振摇溶解后,转移至96孔板中,在550 nm处测量OD值,计算细胞存活率(%)。
2.4.3 Con-A刺激下的脾细胞增殖检测取按2.4.1项下制备的脾细胞悬液,以5×106个/mL接种于96孔板,每孔100 μL。每孔加入Con-A使终浓度为5 μg/mL。加入不同浓度(200、400、800 μg/mL)当归汤多糖的RPMI1640培养基,每组设置6个复孔,给药后培养48 h。同时设置仅加Con-A的模型组(Con-A组)。检测方法同2.4.2。当给药组OD大于模型组时按公式3计算;当给药组OD小于模型组时按公式4计算。
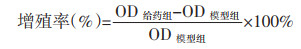 |
公式3 |
 |
公式4 |
使用Graphpad 6.0进行分极及绘图,实验数据用均数±标准差(x±s)表示,多组间比较采用单因素方差分析(one-way ANOVA),组间多重比较采用Dunnett检验。P < 0.05被认为具有统计学意义。
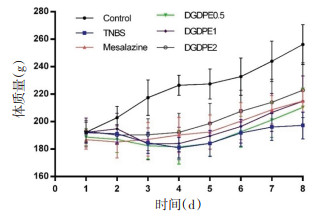
3 实验结果 3.1 当归汤多糖对TNBS诱导的UC大鼠模型的干预研究 3.1.1 大鼠体质量及DAI评分实验期间的体质量变化与对照组相比,模型组体质量明显下降。经当归汤多糖治疗后,大鼠体质量逐渐升高。见图 1。实验第8天,与对照组相比,模型组DAI评分显著升高;与模型组相比,美沙拉嗪组与当归汤多糖高剂量组的DAI评分显著降低(P < 0.05或P < 0.01)。见表 1。
|
| 注:Control.对照组;TNBS.模型组;Mesalazine.美沙拉嗪组;DGDPE 0.5.当归汤多糖低剂量组;DGDPE 1.当归汤多糖中剂量组;DGDPE 2.当归汤多糖高剂量组。 图 1 各组大鼠体质量变化曲线(n=6) Fig. 1 Weight change curves of rats in each group (n=6) |
与对照组相比,模型组大鼠结直肠显著缩短(P < 0.01)。与模型组相比,美沙拉嗪组大鼠的结直肠长度显著增加(P < 0.01)。当归汤多糖低、中、高剂量组大鼠的结直肠长度虽然有所恢复,但差异无统计学意义。
宏观损伤评分结果中,对照组大鼠的结直肠形态完好,可见清晰纹理,肠壁厚度均匀,无肉眼可见溃疡和坏死。模型组大鼠的结直肠有水肿和充血现象,肠壁明显增厚,有大面积溃疡和黑色坏死。与对照组相比,模型组的宏观评分显著升高。与模型组相比,美沙拉嗪组和当归汤多糖高剂量组大鼠的宏观评分显著降低(P < 0.01)。见表 2。
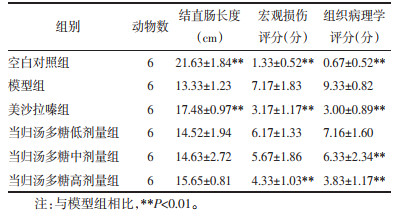 |
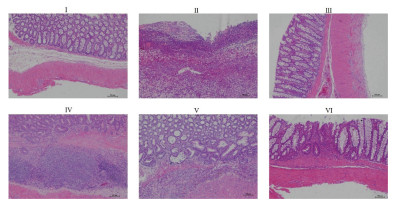
对照组大鼠的结直肠组织结构完整,细胞及腺体排列有序。模型组大鼠结肠结构紊乱,腺体受到破坏,炎症细胞浸润明显,与对照组相比,组织病理学评分显著提高。美沙拉嗪组和当归汤多糖中、高剂量组大鼠结直肠上皮组织较模型组显著改善,组织病理学评分显著降低(P < 0.01)。见图 2、表 2。
|
| 注:Ⅰ.对照组;Ⅱ.模型组;Ⅲ.美沙拉嗪组;Ⅳ.当归汤多糖低剂量组;Ⅴ.当归汤多糖中剂量组;Ⅵ.当归汤多糖高剂量组。 图 2 各组大鼠结直肠组织HE染色切片图像(× 100) Fig. 2 Images of HE staining slices from colorectal tissues (× 100) of rats in each group |
与对照组比较,模型组大鼠结直肠组织SOD活力显著减弱,MDA含量明显升高,MPO活力显著增强(P < 0.01)。与模型组相比,美沙拉嗪组和当归汤多糖高剂量组SOD活力均显著增强(P < 0.01);与模型组相比,美沙拉嗪组和当归汤多糖低、中、高剂量组MDA含量显著下降(P < 0.05或P < 0.01);与模型组相比,美沙拉嗪组和当归汤多糖中、高剂量组MPO活力显著减弱(P < 0.05)。见表 3。
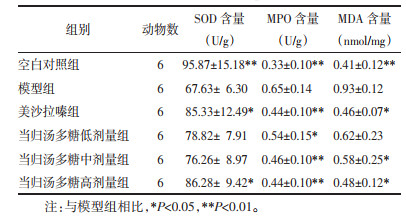 |
与对照组比较,模型组脾细胞刺激指数显著升高(P < 0.01)。各给药组脾细胞刺激指数与模型组相比显著降低(P < 0.05或P < 0.01)。见表 4。采用ELISA法检测Con-A刺激下脾细胞上清液中免疫相关细胞因子IL-2和IFN-γ。与对照组相比,模型组IL-2和IFN-γ浓度显著升高(P < 0.01);当归汤多糖能够剂量依赖地抑制IL-2和IFN-γ生成,与模型组相比差异有统计学意义(P < 0.05或P < 0.01)。见表 4。
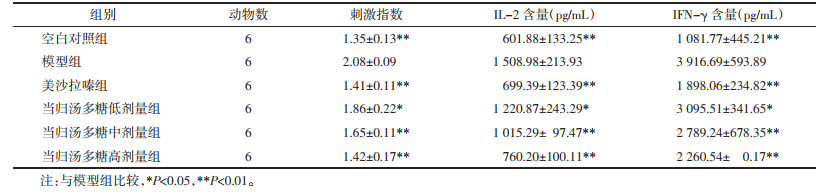 |
当归汤多糖在0~800 μg/mL范围内对RAW264.7细胞的增殖无明显抑制作用,说明在实验浓度下没有细胞毒性,可以用于后续研究。见表 5。
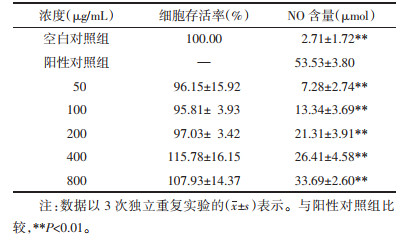 |
随着当归汤多糖浓度的增大,RAW264.7细胞的NO水平剂量依赖性地增加,但显著低于阳性对照组(P < 0.01)。见表 5。
3.3 当归汤多糖对Con-A刺激下正常和UC大鼠脾细胞增殖的影响 3.3.1 当归汤多糖给药浓度范围当归汤多糖在0~800 μg/mL范围内对正常和UC大鼠脾细胞的增殖没有明显抑制作用,说明在实验浓度下没有细胞毒性,可以用于后续研究。见表 6。
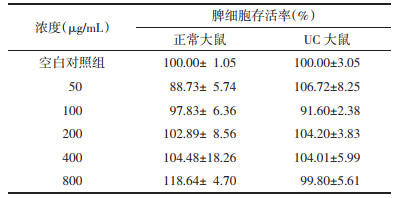 |
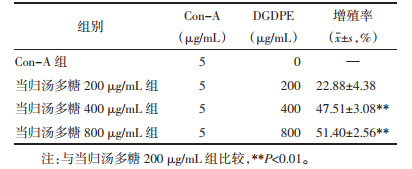
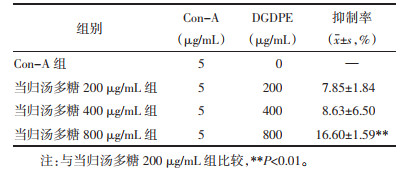
当归汤多糖对Con-A刺激下正常大鼠脾细胞增殖具有明显促进作用,表现出剂量依赖性,浓度为800 μg/mL时增殖率为51.40%±2.56%;对Con-A刺激下UC大鼠的脾细胞增殖表现出轻微的抑制作用,浓度为800 μg/mL时抑制率为16.60%±1.59%。见表 7、8。
 |
 |
临床上常采用控制炎症,抑制自身免疫反应,改善肠道粘膜屏障等措施治疗UC。研究表明,中药多糖治疗UC可能的作用机制有调节免疫失衡、修复肠黏膜损伤、改善肠道菌群失调、抗氧化和抗炎等[20]。
多糖普遍具有调节免疫的作用。NO由受外界刺激而活化的巨噬细胞所分泌,参与免疫调节,能够杀伤肿瘤细胞、微生物等,起到保护机体的作用[21]。当归汤多糖能够剂量依赖地促进RAW264.7细胞释放NO,同时NO水平低于阳性对照组,提示当归汤多糖具有温和的免疫调节能力,适宜作为免疫调节剂[22]。同时,当归汤多糖能够促进Con-A刺激下正常大鼠脾细胞增殖,抑制Con-A刺激下TNBS诱导的UC大鼠的脾细胞增殖,在一定程度上体现了当归汤多糖双向免疫调节能力。通过动物实验发现模型组大鼠Con-A刺激下脾细胞刺激指数显著高于其他组,且Th1免疫应答相关细胞因子IL-2和IFN-γ呈现高表达,表明TNBS诱导的UC大鼠免疫异常[23]。当归汤多糖能够剂量依赖地抑制Con-A刺激下的脾细胞增殖、IL-2和IFN-γ产生,表明对于TNBS诱导UC大鼠,当归汤多糖可能通过调节异常的免疫应答从而达到改善作用。
氧化应激反应是UC发病的另一个重要因素,MDA、SOD和MPO是反映氧化应激水平的重要指标。UC会产生大量的氧自由基,致脂质过氧化,产生大量MDA,其含量升高会引起细胞毒性,MDA水平能够反映氧化损伤程度[24]。当体内氧自由基增多时,可产生SOD清除氧自由基,所以,SOD活性间接反映组织损伤程度[25]。氧化应激会导致中性粒细胞浸润,中性粒细胞浸润是UC最突出的组织学特征之一[26],MPO是富含于中性粒细胞中的一种血红素蛋白,外界刺激下中性粒细胞聚集释放MPO,因此MPO活性可用于评估中性粒细胞浸润程度,从而间接反映氧化应激和炎症性肠病的严重程度[27]。本研究显示,给予高剂量的当归汤多糖,UC大鼠MDA含量和MPO活力降低,SOD活力升高,表明当归汤多糖可以抑制UC大鼠氧化应激,从而改善UC。
综上所述,当归汤多糖对TNBS诱导的大鼠UC具有改善作用,其作用机制可能与免疫调节,抗氧化有关。
| [1] |
马清林, 杜丽东, 臧凯宏, 等. 溃疡性结肠炎研究进展概述[J]. 医药论坛杂志, 2020, 41(1): 175-177. MA Q L, DU L D, ZANG K H, et al. Overview of research progress in ulcerative colitis[J]. Journal of Medical Forum, 2020, 41(1): 175-177. |
| [2] |
吴开春, 梁洁, 冉志华, 等. 炎症性肠病诊断与治疗的共识意见(2018年, 北京)[J]. 中华消化杂志, 2018, 38(5): 292-311. WU K C, LIANG J, RAN Z H, et al. Chinese consensus on diagnosis and treatment of inflammatory bowel disease (Beijing, 2018)[J]. Chinese Journal of Digestion, 2018, 38(5): 292-311. DOI:10.3760/cma.j.issn.0254-1432.2018.05.002 |
| [3] |
何晓生, 陈泽贤, 兰平. 炎症性肠病癌变研究进展[J]. 中国实用外科杂志, 2013, 33(7): 604-606. HE X S, CHEN Z X, LAN P. Advances in cancer research of inflammatory bowel disease[J]. Chinese Journal of Practical Surgery, 2013, 33(7): 604-606. |
| [4] |
SERGEI I G. Inflammation and colorectal cancer: colitis-associated neoplasia[J]. Seminars in Immunopathology, 2013, 35(2): 229-244. DOI:10.1007/s00281-012-0352-6 |
| [5] |
胡占起, 隋楠, 田振国. 辨证应用中药灌肠治疗溃疡性结肠炎[J]. 辽宁中医药大学学报, 2016, 18(6): 76-78. HU Z Q, SUI N, TIAN Z G. Effect of enema with traditional Chinese medicine on treating ulcerative colitis[J]. Journal of Liaoning University of Traditional Chinese Medicine, 2016, 18(6): 76-78. |
| [6] |
顾思臻, 薛艳, 张玉丽, 等. 口服中药复方治疗溃疡性结肠炎临床疗效Meta分析[J]. 中国中西医结合消化杂志, 2018, 26(12): 981-986. GU S Z, XUE Y, ZHANG Y L, et al. Meta-analysis of the efficacy of oral traditional Chinese medicine in the treatment of ulcerative colitis[J]. Chinese Journal of Integrated Traditional and Western Medicine on Digestion, 2018, 26(12): 981-986. |
| [7] |
王焘. 外台秘要方[M]. 北京: 中国医药科技出版社, 2011. WANG T. Outside secret prescription in differentiating[M]. Beijing: China Health Media Group, 2011. |
| [8] |
SHAYESTEH F, HAIDARI F, SHAYESTEH A A, et al. Ginger in patients with active ulcerative colitis: a study protocol for a randomized controlled trial[J]. Trials, 2020, 21(1): 278. DOI:10.1186/s13063-020-4193-7 |
| [9] |
JONG C J, MIN L K, SEONG G K. Angelica acutilobakitagawaextract attenuates DSS-induced murine colitis[J]. Mediators of Inflammation, 2016, 2016: 9275083. |
| [10] |
TANIDEH N, JAMSHIDZADEH A, SAGHESLOO A G, et al. Effects of hydroalcoholic extract of Ziziphus jujuba on acetic acid induced ulcerative colitis in male rat (Rattus norvegicus)[J]. Journal of Coloproctology, 2016. |
| [11] |
赵文竹, 李思慧, 宋宝雯, 等. 生姜多糖类物质的提取及抗氧化活性研究[J]. 食品安全质量检测学报, 2017, 8(4): 1357-1362. ZHAO W Z, LI S H, SONG B W, et al. Extraction and antioxidant activity of polysaccharides from ginger[J]. Journal of Food Safety & Quality, 2017, 8(4): 1357-1362. |
| [12] |
HSU B Y, KUO Y C, CHEN B H. Polysaccharide Isolated from Zizyphus jujuba (Hong Zao) inhibits Interleukin-2 production in jurkat T cells[J]. Journal of Traditional and Complementary Medicine, 2014, 4(2): 132-135. DOI:10.4103/2225-4110.124360 |
| [13] |
李芬芬, 黄丹菲, 江乐明, 等. 大粒车前子多糖对脂多糖刺激RAW264.7巨噬细胞的免疫调节作用[J]. 食品科学, 2014, 35(23): 249-252. LI F F, HUANG D F, JIANG L M, et al. Immunoregulatory effect of polysaccharide from the seeds of plantago asiatica L. on RAW264.7 cells stimulated with lipopolysaccharide[J]. Food Science, 2014, 35(23): 249-252. DOI:10.7506/spkx1002-6630-201423048 |
| [14] |
MORRIS G P, BECK P L, HERRIDGE M S, et al. Hapten-induced model of chronic inflammation and ulceration in the rat colon[J]. Gastroenterology, 1989, 96(3): 795-803. DOI:10.1016/0016-5085(89)90904-9 |
| [15] |
贺海辉, 沈洪, 朱宣宣, 等. 2, 4, 6-三硝基苯磺酸/乙醇法诱导建立溃疡性结肠炎大鼠模型[J]. 中国老年学杂志, 2015, 35(15): 4138-4140. HE H H, SHEN H, ZHU X X, et al. Establishment and stability of ulcerative colitis rat model induced by 2, 4, 6-trinitrobenzene sulfonic acid[J]. Central South Pharmacy, 2015, 35(15): 4138-4140. DOI:10.3969/j.issn.1005-9202.2015.15.012 |
| [16] |
HAN F, ZHANG H, XIA X, et al. Porcine beta-defensin 2 attenuates inflammation and mucosal lesions in dextran sodium sulfate-induced colitis[J]. The Journal of Immunology, 2015, 194(4): 1882-1893. DOI:10.4049/jimmunol.1402300 |
| [17] |
LUK H H, KO J K, FUNG H S, et al. Delineation of the protective action of zinc sulfate on ulcerative colitis in rats[J]. European Journal of Clinical Pharmacology, 2002, 443(1-3): 197-204. DOI:10.1016/S0014-2999(02)01592-3 |
| [18] |
DARSIGNY M, ST J S, BOUDREAU F. Cux1 transcription factor is induced in inflammatory bowel disease and protects against experimental colitis[J]. Inflammatory Bowel Disease, 2010, 16(10): 1739-1750. DOI:10.1002/ibd.21274 |
| [19] |
潘琦虹, 李燕珍, 刘端勇, 等. 当归多糖对结肠炎小鼠peyer's patches结T淋巴细胞亚群水平的调控作用[J]. 江西中医药, 2015, 46(10): 37-38. PAN Q H, LI Y Z, LIU D Y, et al. Regulation of Angelica polysaccharide on lymphocyte subsets in peyer's patches t of colitis mice[J]. Jiangxi Journal of Traditional Chinese Medicine, 2015, 46(10): 37-38. |
| [20] |
冯文林, 伍海涛. 中药多糖治疗溃疡性结肠炎作用机制的研究进展[J]. 辽宁中医杂志, 2019, 46(4): 878-882. FENG W L, WU H T. Research progress on mechanism of traditional Chinese medicine polysaccharides in treatment of ulcerative colitis[J]. Guiding Journal of Traditional Chinese Medicine and Pharmacy, 2019, 46(4): 878-882. |
| [21] |
谢燕霞, 安利国, 杨桂文. 植物多糖对巨噬细胞的免疫调节作用[J]. 中国生物化学与分子生物学报, 2008, 24(4): 307-314. XIE Y X, AN L G, YANG G W. Immunomodulatory activity of botanical polysaccharides on macrophage[J]. Chinese Journal of Biochemistry and Molecular Biology, 2008, 24(4): 307-314. DOI:10.3969/j.issn.1007-7626.2008.04.004 |
| [22] |
吴静, 胡居吾, 熊伟, 等. 樟树果实多糖对巨噬细胞RAW264.7的免疫调节作用[J]. 现代食品科技, 2018, 34(9): 12-18. WU J, HU J W, XIONG W, et al. Immunomodulatory effect of polysaccharide isolated from Cinamomumcamphorafruits on macrophage RAW264.7[J]. Modern Food Science and Technology, 2018, 34(9): 12-18. |
| [23] |
ESILVA F G D, PAIATTO L N, YAMADA A T, et al. Intake of protein hydrolysates and phenolic fractions isolated from flaxseed ameliorates TNBS-induced colitis[J]. Molecular nutrition & Food Research, 2018, 62: e1800088. |
| [24] |
XING J, SUN J, YOU H, et al. Anti-inflammatory effect of 3, 4-oxo-isopropylidene-shikimic acid on acetic acid-induced colitis in rats[J]. Inflammation, 2012, 35(6): 1872-1879. |
| [25] |
LI Y, SHEN L, LUO H. Luteolin ameliorates dextran sulfate sodium-induced colitis in mice possibly through activation of the Nrf2 signaling pathway[J]. International Immunopharmacology, 2016, 40: 24-31. |
| [26] |
DEFF M, LUIZ-FERREIRA A, SOCCA E A, et al. Effects of Rhizophora mangle on experimental colitis induced by TNBS in rats[J]. Evidence-based Complementary and Alternative Medicine, 2012, 2012: 753971. |
| [27] |
RASHIDIAN A, MUHAMMADNEJAD A, DEHPOUR A R, et al. Atorvastatin attenuates TNBS-induced rat colitis: the involvement of the TLR4/NF-κB signaling pathway[J]. Inflammopharmacology, 2016, 24(2-3): 109-118. |
 2021, Vol. 38
2021, Vol. 38