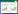文章信息
- 肖扬, 刘莹, 徐亚洁, 李国政, 耿彤, 徐津鹏, 王怡
- XIAO Yang, LIU Ying, XU Yajie, LI Guozheng, GENG Tong, XU Jinpeng, WANG Yi
- 通脉养心丸对ApoE-/-小鼠动脉斑块形成的影响及机制研究
- Study of the effect and related mechanism of Tongmai Yangxin Pill on atherosclerosis in ApoE-/- mice
- 天津中医药, 2021, 38(6): 776-781
- Tianjin Journal of Traditional Chinese Medicine, 2021, 38(6): 776-781
- http://dx.doi.org/10.11656/j.issn.1672-1519.2021.06.22
-
文章历史
- 收稿日期: 2021-03-26
2. 天津中新药业集团股份有限公司, 天津 300457;
3. 天津中医药大学, 天津 301617
通脉养心丸源于汉代医圣张仲景《伤寒论》的名方“炙甘草汤”,经天津名医董晓初精心钻研,加减化裁而来。通脉养心丸在临床上对气阴两虚型及气阴两虚合并血瘀型冠心病均具有较好的改善作用[1-2]。药理实验研究表明,在细胞水平通脉养心丸对缺氧损伤的心肌细胞具有一定的保护作用,其可能的机制为减轻心肌细胞钙超载[3]、抗炎、抗氧化[4]等。整体实验方面,通脉养心丸能够改善肾上腺素所致的大鼠心律失常[5]。从整合药理学的角度分析其治疗冠心病心绞痛及心律不齐的分子机制,研究结果表明通脉养心丸能通过线粒体途径、能量代谢等多条途径发挥药效的[6]。动脉粥样硬化(AS)是冠心病的主要病理学基础,基于通脉养心丸显著的临床疗效及上述基础研究结果,推测其可能对AS具有一定的改善作用。本实验将以此为研究切入点,考察通脉养心丸对载脂蛋白E基因敲除(ApoE-/-)小鼠斑块形成的影响及可能的作用机制。
AS发病机制极其复杂,涉及多个病理环节[7]。目前对于AS发病机制的各种学说各有侧重,都不十分完善,因此预测药效发生机制必然存在较大困难。考虑到上述情况,本实验采用Affymetrix Mouse Genome对小鼠动脉组织基因谱进行检测,并进行深入数据分析,对产生药效的可能机制进行预测。根据预测结果,采用实时定量聚合酶链式反应(RT-PCR)及酶联免疫吸附剂测定(ELISA)法对有代表性的作用靶点进行验证,在明确药效的基础上对通脉养心丸抗AS作用机制进行探索,为拓展通脉养心丸的临床使用范围提供数据支持,同时也为中药复方机制研究提供新思路。
1 实验材料与方法 1.1 实验动物ApoE-/-小鼠,雄性,4周龄,常规条件(小鼠维持饲料,自由饮水,温度24~26 ℃,相对湿度40%~60%)饲养6周后开始药物干预;给药同时开始采用高脂饲料(基料78.8%、蛋黄粉10%、猪油10%、胆固醇1.0%、猪胆盐0.2%)饲养。C57BL/6J小鼠,雄性,4周龄,始终保持常规条件饲养。以上实验动物购于北京大学医学部中心,许可证编号:SCXK(京)2011-0012。
1.2 分组及给药方法将72只ApoE-/-小鼠随机分为4组,分别为模型组、通脉养心丸2.0 g/kg组、通脉养心丸1.0 g/kg组、通脉养心丸0.5 g/kg组,6只C57BL/6J小鼠为空白对照组。
1.3 主要实验试剂及仪器通脉养心丸(天津中新药业集团股份有限公司乐仁堂制药厂);油红O(Chroma进口分装);总胆固醇(TC)测定试剂盒、三酰甘油(TG)测定试剂盒(中生北控生物科技股份有限公司);逆转录试剂盒Prime Script TMRT Reagent Kit(TaKaRa Biotechnology);SYBY® PremixExTaqTM(TaKaRa Biotechnology);磷酸化核转移因子(p-NF-κB)ELISA试剂盒、肿瘤坏死因子-α(TNF-α)ELISA试剂盒(R&D Systems);白介素-6(IL-6)ELISA试剂盒,白介素-1β(IL-1β)ELISA试剂盒,武汉华美生物工程有限公司;引物序列由http://bioinfo.ut.ee/primer3-0.4.0/获得,由金唯智生物科技公司合成。微型旋涡混合仪(上海沪西分析仪器厂有限公司XW-80A型);微量振荡器(天津市华北实验仪器有限公司,ZW-A型);组织包埋机(日本樱花VAP15JR组织包埋机);切片机(日本樱花CRM-60推拉式组织切片机);正置显微镜(日本Olympus公司,CH30型);正置显微镜及成像系统(日本Olympus公司,BX41型);图像分析软件(美国Image-Pro Plus Version 6.0(IPP));Allegra-64RCentrifuge低温高速离心机(美国BECKMAN);DU-530紫外分光光度计(美国DNA/ProteinAnalyzer,BECKMAN);ABI® 7300实时荧光定量系统(美国AppliedBiosystems);扫描仪(Scanner 3000 Hybridization,Affymetrix);杂交炉(Hybridization Oven 640,Affymetrix)等。
1.4 检测指标 1.4.1 通脉养心丸对ApoE-/-小鼠血脂及斑块形成的影响采用生化法测定实验动物血清中TC及TG的水平。每组随机取6只小鼠,将主动脉至髂动脉分叉处的整条动脉,进行油红O染色。采用Image J 6.0软件将红染部位标记,并计算斑块面积占总面积的比值。每组取6只小鼠分别取主动脉弓、胸主动脉、腹主动脉,用10%甲醛溶液固定,采用苏木精-伊红(HE)染色法,观察斑块(横切)情况,并采用Image J 6.0软件标记并分别计算主动脉弓、胸主动脉及腹主动脉斑块面积与管腔面积的比值。
1.4.2 通脉养心丸对ApoE-/-小鼠动脉基因表达的影响按照试剂盒说明书提取小鼠动脉组织中的总RNA,样品总RNA利用NanoDrop ND-2100(Thermo Scientific)定量并经Agilent Bioanalyzer 2100(Agilent Technologies)检测RNA完整性。RNA质检合格后,样本的标记、芯片的杂交以及洗脱参照芯片标准流程。洗脱和染色后利用Affymetrix Scanner 3000(Affymetrix)扫描得到原始图像。原始图像采用Affymetrix GeneChip Command Console软件(version4.0,Affymetrix)处理提取原始数据。接着利用Genespring软件(version 12.5;Agilent Technologies)进行MAS5标准化和后续处理。标准化后的数据进行过滤,将每组差异筛选中至少有1组样本75%标记为P的探针留下进行后续分析。
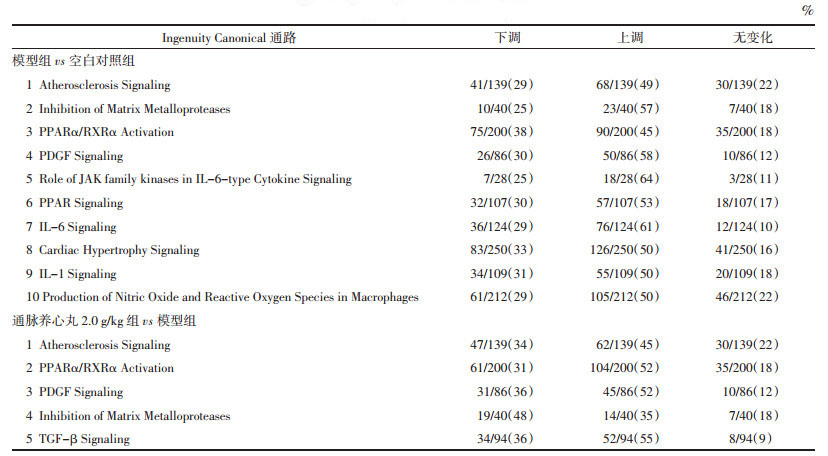
1.4.3 通脉养心丸对ApoE-/-小鼠动脉组织中PPARα mRNA表达的影响根据试剂盒说明,提取小鼠动脉组织中的mRNA,测定mRNA浓度,逆转录合成cDNA。按照反转录试剂盒说明冰上操作,合成cDNA于-80 ℃保存备用。荧光定量PCR实验:应用ABI®7300实时荧光定量PCR仪分析软件测定PPARα mRNA的表达。反应以GAPDH作为内参。
1.4.4 通脉养心丸对ApoE-/-小鼠血浆中p-NF-κB、TNF-α、IL-6、IL-1β水平的影响严格按照ELISA试剂盒说明书检测步骤进行检测。
1.5 统计学方法使用SPSS 23.0软件进行数据统计分析。实验数据以均数±标准差(x±s)表示,多组间比较使用单因素方差分析(One-Way ANOVA),组间两两比较采用LSD法,P < 0.05表示差异有统计学意义。差异基因利用t检验的P值和倍数变化值进行筛选,筛选的标准为上调或者下调倍数变化值≥2.0且P值≤0.05。将标准化的数据进行聚类分析,Ingenuity Canonical通路分析。
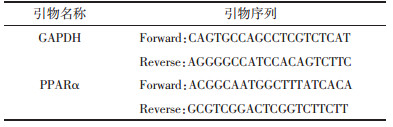
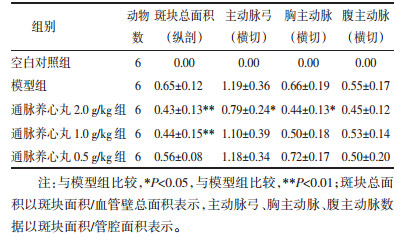
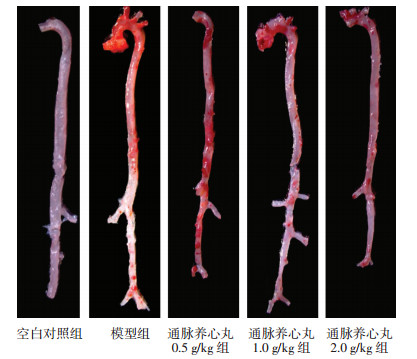
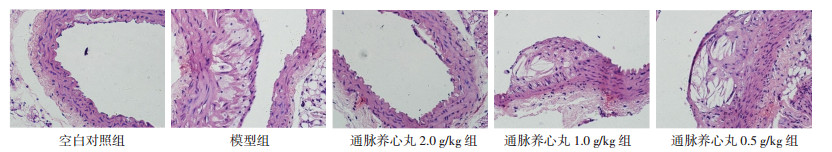
2 实验结果 2.1 通脉养心丸对小鼠血脂及斑块形成的影响模型组小鼠血清中TC、TG水平显著升高,与空白对照组比较差异有统计学意义(P < 0.01),通脉养心丸各剂量组TC水平显著低于模型组(P < 0.01);通脉养心丸高剂量组TG水平显著低于模型组(P < 0.01),中、低剂量组与模型组比较无统计学差异(P>0.05);经油红O染色,对照组小鼠动脉无明显红染,模型组小鼠动脉壁有大面积红染,说明有大面积斑块形成,并且在主动脉弓分支部位较为集中。低剂量组斑块面积与血管壁总面积的比值与模型组比较无统计学差异(P>0.05);高、中剂量组斑块面积与血管壁总面积的比值明显小于模型组(P < 0.01),说明高、中剂量对斑块的形成具有一定的抑制作用;经HE染色,镜下观察,模型组小鼠动脉管壁内膜大面积粥样斑块形成,管腔变窄,局部血管内膜大量炎性细胞浸润;高剂量组可见局灶性斑块形成,血管内皮增厚,表面可见少量炎细胞浸润;中剂量组管壁内膜粥样斑块形成,管腔变窄,内皮增厚,局部血管内膜大量灶性炎细胞浸润。低剂量组管壁内膜大面积粥样斑块形成,内皮增厚,管腔变窄,局部血管内膜大量灶性炎细胞浸润。采用Image J 6.0软件分别计算主动脉弓部、胸主动脉部和腹主动脉斑块面积与管腔面积比值发现,高剂量对主动脉弓及胸主动脉狭窄具有一定的改善作用(P < 0.05),中、低剂量组对以上3个部分动脉管腔狭窄具有改善趋势,但与模型组比较无统计学差异(P>0.05)。具体结果见表 1、2及图 1、2。
|
|
|
| 图 1 通脉养心丸对ApoE-/-小鼠斑块形成的影响(油红O染色) Fig. 1 Effect of Tongmai Yangxin pill on plaque formation in ApoE-/- mice (oil red O staining) |
|
| 图 2 通脉养心丸对胸主动脉弓部斑块的影响(HE,×400) Fig. 2 Effect of Tongmai Yangxin Pill on plaque of thoracic aortic arch (HE, ×400) |
使用Welch t test检验,以P < 0.05,abs_fc > 2,bad flag < 5为筛选条件,模型组与空白对照组比较,共筛选出253个差异探针。其中上调基因157个探针(对应128个基因),下调96个探针(对应79个基因),其中下调最为显著的是ApoE基因,与动物模型相符。在相同条件下,通脉养心丸2.0 g/kg组与模型组比较,共筛选出100条差异基因,其中74个探针(对应60个基因)上调,49个探针(对应40个基因)下调。将数据标准化后,将进行聚类分析和Ingenuity Canonical通路分析。
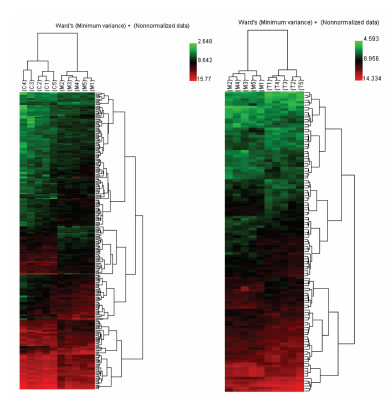
2.2.2 聚类分析由于本研究中空白对照组与模型组采用的实验动物存在品系上的差异,因此对于差异基因的聚类分析采用两组间独立比较,即模型组与空白对照组比较,给药组与模型组比较;将差异基因进行聚类分析,结果如图 3。
|
| 注:红色表示相对高表达,绿色表示相对低表达。 图 3 差异基因聚类分析 Fig. 3 Cluster analysis of differential genes |
将标准化数据导入https://apps.ingenuity.com/进行相关通路分析,模型组与空白对照比较发生变化的通路有359条,输入atherosclerosis作为限定条件,筛选出动脉粥样硬化发生机制相关的通路主要有10条。相同条件下,通脉养心丸2.0 g/kg组与模型组比较,相关通路主要有5条,见表 3。通脉养心丸可能通过影响Atherosclerosis Signaling中的PPARα/RXRα Activation、Inhibition of Matrix Metalloproteases、PDGF Signaling发挥药理作用。根据上述实验结果和PPARα活化在斑块形成过程中的重要作用,在后续实验中将对PPARα mRNA表达及下游的部分炎症因子表达进行验证。
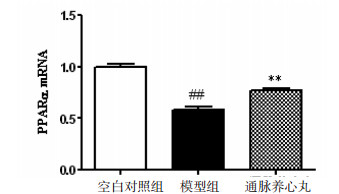
实验结果表明,模型组小鼠PPARα mRNA表达显著降低(P < 0.01),通脉养心丸高剂量组能显著上调小鼠动脉组织中PPARα mRNA表达。引物序列见表 4,实验结果见图 4。
|
| 注:与空白组比较,##P < 0.01;与模型组比较,**P < 0.01。 图 4 通脉养心丸对ApoE-/-小鼠PPARα mRNA表达的影响(x±s) Fig. 4 Effect of Tongmai Yangxin Pill on PPARα mRNA expression in ApoE-/- mice (x±s) |
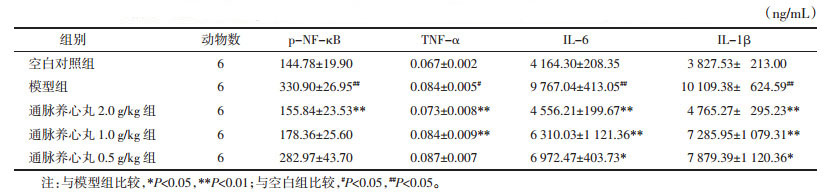
采用ELISA法对小鼠血清中部分炎性因子水平进行检测,实验结果表明,模型组小鼠血清中p-NF-κB、TNF-α、IL-1β及IL-6均显著升高,与对照组比较差异有统计学意义(P < 0.01)。高剂量组小鼠上述分子均显著降低(P < 0.01);中剂量对TNF-α、IL-1β及IL-6具有显著降低作用(P < 0.01),对p-NF-κB无明显影响(P>0.05);低剂量能显著降低IL-1β及IL-6水平(P < 0.05),对p-NF-κB和TNF-α无明显影响(P>0.05)。见表 5。
|
AS是一种较为复杂慢性炎性疾病[8],是心脑血管疾病的主要病理基础,受基因、饮食、环境等多因素的影响,能够累积到多器官,多靶点,与高血压病、糖尿病、肥胖等多种疾病相互影响,互为因果。目前对于AS的研究已经进入了系统生物学研究的层面[9-10],更加注重分子间的相互作用对疾病进程的影响,更加注重整体观念。本研究利用高通量、高集成的基因芯片技术,试图阐明通脉养心丸的药效作用机制,同时考虑了疾病与药物多个变量对生物体的影响,与单一通路探索实验比较,更具有实际意义。本实验在明确所有差异基因的基础上,利用现有数据库进行分析,预测出通脉养心丸产生药效的关键信号通路为PPARα/RXRα Activation、Inhibition of Matrix Metalloproteases、PDGF Signaling等,这对进一步印证其作用机制极为重要。本实验也为中药复方机制研究提供了新的思路。
Ingenuity Canonical通路分析结果显示,PPARα活化可能是通脉养心丸产生药效的关键环节,并且对PPARα/RXRα通路上表达发生变化的分子数目最多,因此选择了对PPARα mRNA表达进行验证,实验结果显示,ApoE-/-小鼠PPARα mRNA表达显著下降,而通脉养心丸能够显著上调其表达,说明通脉养心丸对PPARα具有显著的活化作用。有研究表明PPARα能够通过与其配体结合调节多种靶基因的转录水平,进而对脂代谢、糖代谢、炎症反应等过程产生影响[11]。同时还能够通过抑制NF-кB亚基p65的迁移,降低炎症因子的表达[12]。上述研究结果说明PPARα活化能够直接和间接抑制炎症因子的表达,减轻炎症反应对血管内皮的损伤,抑制AS斑块的形成。因此,本研究对小鼠血清中的部分炎症因子水平进行了验证,结果表明,通脉养心丸对于p-NF-κB、TNF-α、IL-6、IL-1β水平均具有较为明显的抑制作用。综上所述,通脉养心丸对ApoE-/-小鼠动脉斑块的形成具有显著的抑制作用,活化PPARα进而抑制下游炎症因子的表达是其发挥药物疗效的途径之一。
| [1] |
李珂, 孙兰军, 高克俭, 等. 通脉养心丸治疗冠心病室性早搏(气阴两虚证)多中心临床研究[J]. 中西医结合心脑血管病杂志, 2010, 8(4): 401-403. LI K, SUN L J, GAO K J, et al. Tongmai Yangxin Pill for treatment of ventricular premature in coronary heart disease with deficiency syndrome of both qi and yin: a multi-center clinical trial[J]. Chinese Journal of Integrative Medicine on Cardio-Cerebrovascular Disease, 2010, 8(4): 401-403. DOI:10.3969/j.issn.1672-1349.2010.04.011 |
| [2] |
朱凌华, 王惠. 通脉养心丸治疗气阴两虚血瘀型冠心病室性早搏的疗效评价[J]. 中西医结合心脑血管病杂志, 2014, 12(3): 274-275. ZHU L H, WANG H. Effect of Tongmai Yangxin Pill on premature ventricular contractions of coronary heart disease with deficiency of both qi and yin and blood stasis[J]. Chinese Journal of Integrative Medicine on Cardio-Cerebrovascular Disease, 2014, 12(3): 274-275. DOI:10.3969/j.issn.1672-1349.2014.03.010 |
| [3] |
肖扬, 张家福, 张玲, 等. 从钙超载角度探讨通脉养心丸心肌保护作用的机制[J]. 中西医结合心脑血管病杂志, 2011, 9(5): 562-563. XIAO Y, ZHANG J F, ZHANG L, et al. Investigation of protection mechanism of Tongmai Yangxin Pill on myocardium from the perspective of calcium overload[J]. Chinese Journal of Integrative Medicine on Cardio-Cerebrovascular Disease, 2011, 9(5): 562-563. DOI:10.3969/j.issn.1672-1349.2011.05.030 |
| [4] |
王怡, 张玲, 肖扬, 等. 通脉养心丸对缺氧诱导心肌细胞损伤炎症因子及氧化应激的影响[J]. 中医杂志, 2011, 52(4): 326-328. WANG Y, ZHANG L, XIAO Y, et al. Effect of Tongmai Yangxin Pill on inflammatory factors and oxidative stress of cardiomyocyte injury induced by hypoxia[J]. Journal of Traditional Chinese Medicine, 2011, 52(4): 326-328. |
| [5] |
蔡小军, 王怡, 胡利民, 等. 通脉养心丸抗肾上腺素急性心律失常作用[J]. 天津中医药大学学报, 2009, 28(3): 133-135. CAI X J, WANG Y, HU L M, et al. Effect of Tongmai Yangxin Pill in treating adrenaline-induced acute arrhythmia[J]. Journal of Tianjin University of Traditional Chinese Medicine, 2009, 28(3): 133-135. |
| [6] |
陈婷, 王天琪, 张砚, 等. 基于整合药理学分析通脉养心丸治疗冠心病心绞痛及心律不齐的分子机制[J]. 中华中医药杂志, 2018, 33(12): 5553-5558. CHEN T, WANG T Q, ZHANG Y, et al. Molecular mechanism of Tongmai Yangxin Pill for angina and arrhythmia of the coronary heart disease based on integrative pharmacology[J]. China Journal of Traditional Chinese Medicine and Pharmacy, 2018, 33(12): 5553-5558. |
| [7] |
TEDGUI A, MALLAT Z. Cytokines in atherosclerosis: pathogenic and regulatory pathways[J]. Physiological Review, 2006, 86(2): 515-581. DOI:10.1152/physrev.00024.2005 |
| [8] |
KOENEN R R, WEBER C. Therapeutic targeting of chemokine interactions in atherosclerosis[J]. Nature Reviews Drug Discovery, 2010, 9(2): 141-153. DOI:10.1038/nrd3048 |
| [9] |
LI J, YAO Q, FENG F, et al. Systematic identification of rabbit LncRNAs reveals functional roles in atherosclerosis[J]. Biochimica et Biophysica Acta (BBA)-Molecular Basis of Disease, 2018, 1864(6PtB): 2266-2273. |
| [10] |
LIN K, CHEN H, CHEN X, et al. Efficacy of curcumin on aortic atherosclerosis: a systematic review and Meta-analysis in mouse studies and insights into possible mechanisms[J]. Oxidative Medicine and Cellular Longevity, 2020, 2020: 1520747. |
| [11] |
CESAR F A, RUDNICKI M, DE L H B, et al. New indolethiazolidine attenuates atherosclerosis in LDLr-/- mice[J]. Vascular Pharmacology, 2015, 71(8): 174-180. |
| [12] |
TALEB S. Inflammation in atherosclerosis[J]. Archives of Cardiovascular Diseases, 2016, 109(12): 708-715. DOI:10.1016/j.acvd.2016.04.002 |
2. Tianjin Zhongxin Pharmaceutical Group Co., Ltd., Tianjin 300457, China;
3. Tianjin University of Traditional Chinese Medicine, Tianjin 301617, China
 2021, Vol. 38
2021, Vol. 38