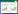文章信息
- 刘宏根, 杨佩颖, 李小江, 贾英杰
- LIU Honggen, YANG Peiying, LI Xiaojiang, JIA Yingjie
- 姜黄素抑制胃癌淋巴管生成相关因子的机制研究
- Mechanism of anti-lymphangiogenesis related factors by curcumin in gastric cancer
- 天津中医药, 2021, 38(6): 794-798
- Tianjin Journal of Traditional Chinese Medicine, 2021, 38(6): 794-798
- http://dx.doi.org/10.11656/j.issn.1672-1519.2021.06.25
-
文章历史
- 收稿日期: 2021-04-19
胃癌是常见的恶性肿瘤之一,中国胃癌患者就诊时多伴有淋巴转移,淋巴转移与胃癌预后密切相关[1]。淋巴管生成在肿瘤淋巴转移中发挥作用,是淋巴转移的重要前提。淋巴管生成相关因子血管内皮生长因子(VEGF)-C和VEGF-D是调控淋巴管内皮细胞增殖和促进新生淋巴管生成的最重要分子,是反映淋巴管生成的重要指标[2]。前期研究发现SMYD3(SET and MYND domain-containing protein 3)与淋巴转移密切相关[3]。目前对于胃癌淋巴转移患者,多采用局部联合全身治疗。然而现有治疗方法对患者身体损伤很大,因此寻找新的抑制淋巴转移药物至关重要。姜黄素是从姜黄根茎中提取的一种酚性色物质,具有抗炎、抗氧化、调节血脂、调节机体免疫功能及保护肝肾等生理功能[4]。近些年发现姜黄素具有潜在抗肿瘤作用,目前报道在诱导细胞凋亡、改变细胞周期、抑制肿瘤细胞增殖及减少肿瘤侵袭转移中姜黄素都发挥重要作用。近些年有学者通过体内外实验发现姜黄素能够发挥抗淋巴管生成的作用[5]。然而姜黄素抑制胃癌淋巴管机制尚不明确。本实验在前期研究的基础上探索姜黄素抑制淋巴管生成相关因子的可能分子机制。
1 实验材料与方法 1.1 细胞培养和药物MGC803细胞和稳定低表达SMYD3的细胞(MGC803-sh-SMYD3)购于天津时域科技有限公司。细胞培养在RPMI 1640培养基(美国Gibco BRL公司)中,添加10%胎牛血清(美国Gibco公司)和1%青霉素链霉素(美国Gibco BRL公司),孵育在5%的37 ℃ CO2培养箱中。
SMYD3抑制剂BCI-121(产品号M01404)和姜黄素(产品号BP11090)购于北京百奥莱博科技有限公司。BCI-121最佳干预浓度为120 μmol/L[6],姜黄素浓度为10、30和50 μmol/L[7]。
1.2 MTT选对数生长期的细胞,消化计数后以3 000个/孔接种于96孔板。24 h待细胞贴壁以后,加药物处理,24、48、72和96 h弃药物培养基,加入200 μL普通培养基,同时每孔加入MTT溶液(5 g/L)20 μL,温箱内培养4 h,弃培养液,加入二甲基亚砜150 μL/孔,摇床震荡10 min,至紫色结晶充分溶解后,酶标仪检测OD值。
1.3 实时定量聚合酶链式反应(qRT-PCR)总RNA提取试剂盒、DNA第一链合成试剂盒均购自天津时域科技有限公司。RNA完整性采用琼脂糖凝胶电泳检测,其透过率与纯度采用紫外分光光度计检测。以Oligo-dT15为引物,参照20 μL反应体系合成cDNA第一链。引物序列由北京百奥莱博科技有限公司合成并提供。反应条件为95 ℃预变性10 s;95 ℃ 5 s,64 ℃ 34 s,40个循环。每对引物设3个复孔。结果用ABI PRISM 7500分析,最后计算2-ΔΔCT值引物序列如下:SMYD3(5′-TCGCAACCGCCAACAGGGGAA-ACGG/TCCCGAGAAGGCAGCGGTCGCAGAC-3′);VEGF-C(5'-GCCCCAAACCAGTAACAATCA/CAG-CATCCGAGGAAAACATAAA-3');VEGF-D(5'-CTGCCTGATGTCAACTGCTTAG/AGATGATCGCTTCACTGGTCC-3');GAPDH:(5′-GAAGGTGAAGGTCGGAGTC/GAAGATGGTGATGGGATTTC-3')。
1.4 蛋白质免疫印迹(Western Blot)将细胞在RIPA裂解缓冲液中均匀化30 min,在4 ℃下,12 000 r/min,离心半径10 cm,离心15 min,将裂解液清除15 min,用10%十二烷基硫酸钠聚丙烯酰胺凝胶电泳分离总蛋白提取物,电转移至PVDF。用5%脱脂牛奶阻断非特异性结合位点60 min后,在4 ℃下与抗SMYD3(ab187149;Abcam)、VEGF-C(ab135506;Abcam)和VEGF-D(ab155288;Abcam)多克隆抗体孵育隔夜。用磷酸盐吐温缓冲液(PBST)洗涤膜3 min,用辣根过氧化物酶(HRP)偶联抗兔免疫球蛋白抗体(SP-9001;中山生物技术)在室温下检测60 min。然后用PBST对膜进行3次洗涤10 min,用增强化学发光系统观察免疫复合物。
1.5 统计学方法所有数据均用SPSS 20.0进行统计学分析与处理。实验数据用均数±标准差(x±s)表示,两组均数的比较采用两独立样本t检验,P < 0.05为差异有统计学意义。
2 结果 2.1 SMYD3和淋巴管生成相关因子表达胃癌MGC803细胞株中加入120 μmol/L SMYD3抑制剂BCI-121,进一步检测了SMYD3、VEGF-C和VEGF-D表达,结果发现MGC803细胞株中SMYD3、VEGF-C和VEGF-D mRNA和蛋白表达明显降低(P < 0.05)。
在稳定低表达SMYD3的细胞株(MGC803-sh-SMYD3)检测SMYD3、VEGF-C和VEGF-D mRNA和蛋白的表达,显示MGC803-sh-SMYD3细胞株中SMYD3、VEGF-C和VEGF-D mRNA和蛋白明显低于MGC803细胞株(P < 0.01)。见图 1。
|
| 注:a-c. qRT-PCR和Western Blot检测BCI-121干预MGC803细胞株中SMYD3、VEGF-C和VEGF-DmRNA和蛋白的表达情况(与未干预组比较,*P<0.05);d-f. qRT-PCR和Western Blot检测MGC803和MGC803-sh-SMYD3细胞株中SMYD3、VEGF-C和VEGF-D mRNA和蛋白的表达情况(与MGC803组比较,*P<0.05)。 图 1 不同SMYD3表达细胞株中淋巴管生成因子的差异 Fig. 1 The expression of anti-lymphangiogenesis related factors in different SMYD3 expression cell lines |
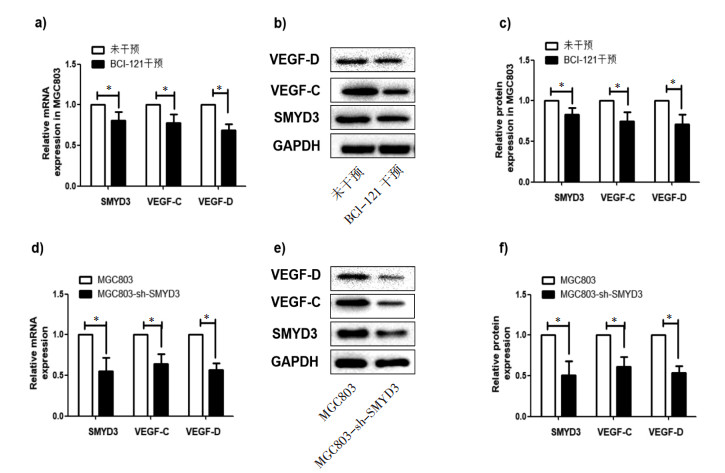
MTT检测不同时间节点不同浓度姜黄素作用MGC803细胞株细胞增殖的差异。与未加姜黄素相比,10 μmol/L姜黄素在72 h和96 h明显抑制细胞增殖(P < 0.05);30 μmol/L姜黄素在48、72和96 h明显抑制细胞增殖(P < 0.05);而30 μmol/L姜黄素在24、48、72和96 h明显抑制细胞增殖(P < 0.05)(图 2a)。50 μmol/L姜黄素对胃癌细胞抑制作用最强,因此我们选用50 μmol/L姜黄素进一步实验研究。
|
| 注:a. MTT检测不同浓度不同时间节点MGC803细胞增殖情况;b-d. qRT-PCR和Western Blot检测姜黄素处理MGC803细胞株VEGF-C和VEGF-D mRNA和蛋白的表达情况(与未干预组比较,*P < 0.05) 图 2 姜黄素对细胞增值及淋巴管生成因子的影响 Fig. 2 The proliferation of cells and the expression of anti-lymphangiogenesis related factors affected by curcumin |
50 μmol/L姜黄素处理MGC803细胞96 h后,检测VEGF-C和VEGF-D表达变化。qRT-PCR和Western Blot结果显示与未用姜黄素处理相比,姜黄素干预MGC803细胞中VEGF-C和VEGF-DmRNA和蛋白明显降低(P < 0.05),见图 2b-d,差异具体统计学意义。
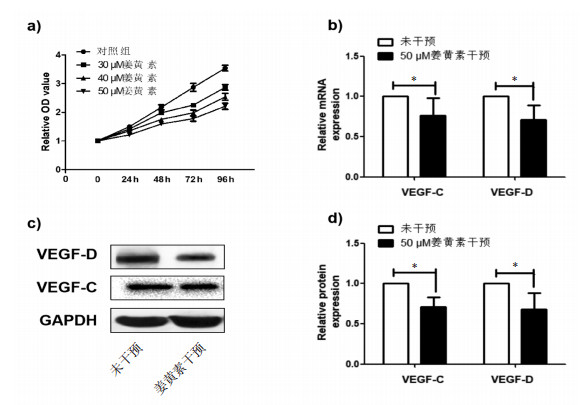
2.3 姜黄素抑制淋巴管生成相关因子可能机制探索120 μmol/L BCI-121联合50 μmol/L姜黄素处理MGC803细胞96 h后,检测VEGF-C和VEGF-D表达变化,结果显示较50 μmol/L姜黄素处理,联合处理组MGC803细胞中VEGF-D mRNA和蛋白的表达降低(P < 0.05),而VEGF-C变化无统计学差异。
50 μmol/L黄素处理MGC803细胞和MGC803-sh-SMYD3细胞96 h后,检测VEGF-C和VEGF-D表达变化,结果显示较MGC803-sh-SMYD3细胞中VEGF-D mRNA和蛋白的表达明显低于MGC803细胞(P < 0.05),而VEGF-C mRNA和蛋白变化不明显。见图 3。
|
| 注:a-c. qRT-PCR和Western Blot检测BCI-121联合姜黄素处理MGC803细胞株中VEGF-C和VEGF-D mRNA和蛋白的表达情况(与姜黄素干预组比较,*P<0.05);d-f. qRT-PCR和Western Blot检测姜黄素处理MGC803和MGC803-sh-SMYD3细胞株中VEGF-C和VEGF-D mRNA和蛋白的表达情况(与MGC803组比较,*P<0.05)。 图 3 姜黄素干扰不同SMYD3表达细胞株中淋巴管生成因子的差异 Fig. 3 The expression of anti-lymphangiogenesis related factors in different SMYD3 expression cell lines affected by curcumin |
淋巴管生成在肿瘤淋巴转移中发挥至关重要的作用[8]。淋巴管生成相关因子VEGF-C和VEGF-D通过结合VEGFR-3后引起下游分子Shc、Grb2磷酸化,导致MARK信号途径促使淋巴内皮细胞增生、迁移和存活而形成新生的淋巴管道,从而为肿瘤细胞发生淋巴转移提供有利条件。淋巴管生成相关因子VEGF-C和VEGF-D与淋巴管生成和淋巴转移密切相关[9]。SMYD3是近年来发现的与肿瘤密切相关的一种具有组蛋白甲基化功能的蛋白,功能上通过影响下游基因起到抑制肿瘤细胞凋亡、促进细胞增殖及侵袭、扩散作用[10]。SMYD3在多种肿瘤中发挥癌基因作用。前期临床研究中发现SMYD3与胃癌预后密切相关,进一步发现伴有淋巴转移胃癌患者中SMYD3阳性率较高,因此推测SMYD3与淋巴转移密切相关[11]。为证实SMYDE3与淋巴管生成相关因子VEGF-C和VEGF-D关系,在胃癌细胞株中加入SMYD3抑制剂BCI-121,结果发现干扰SMYD3表达后VEGF-C和VEGF-D表达发生降低;进一步在稳定低表达SMYD3细胞株MGC803-sh-SMYD3中检测VEGF-C和VEGF-D表达,同样发现MGC803-sh-SMYD3细胞中VEGF-C和VEGF-D表达低于正常细胞。结合前期研究,笔者认为胃癌中高表达的SMYD3能够促进淋巴管生成相关因子VEGF-C和VEGF-D表达。
传统中医药具有多靶位,多机制,多方向,并且不良反应少的优点。姜黄素作为姜黄重要组成部分,有着极其广泛的药理作用。近些年姜黄素发现在多种恶性肿瘤中有抑制肿瘤生长的作用[12]。在胃癌中,姜黄素通过抑制c-Myc/H19、PAK1/cyclin D1、11和对磷酸鸟苷醇-3激酶(PI3K)信号通路抑制胃癌细胞增殖的作用[13]。近些年许多学者发现姜黄素能够抑制胃癌淋巴结转移[14],本研究同样发现姜黄素可以降低淋巴管生成相关因子VEGF-C和VEGF-D表达进而影响淋巴管生成。但目前机制尚不清楚。为探索姜黄素抑制胃癌淋巴管生成相关因子是否与SMYD3相关,首先将SMYD3抑制剂BCI-121和姜黄素联合干预胃癌细胞株,结果发现与单独姜黄素干预,联合组VEGF-D表达明显降低。进一步通过姜黄素干扰MGC803细胞和MGC803-sh-SMYD3,发现MGC803-sh-SMYD3细胞中VEGF-D表达明显降低,而VEGF-C表达无差异。因此推测姜黄素可能通过抑制SMYD3通路进而抑制淋巴管生成相关因子VEGF-D。
4 结论本研究证实SMYD3与淋巴管生成相关因子VEGF-C和VEGF-D密切相关,姜黄素可能通过抑制SMYD3通路进而抑制淋巴管生成相关因子VEGF-D,进而影响胃癌淋巴管的生成。
| [1] |
STRONG V E. Progress in gastric cancer[J]. Updates in Surgery, 2018, 70(2): 157-159. DOI:10.1007/s13304-018-0543-3 |
| [2] |
SRAREK I, SALZMAN R, KUCEROVA L, et al. Expression of VEGF-C/-D and lymphangiogenesis in salivary adenoid cystic carcinoma[J]. Pathology Research and Practice, 2015, 211(10): 759-765. DOI:10.1016/j.prp.2015.07.001 |
| [3] |
LIU Y, LUO X, DENG J, et al. SMYD3 overexpression was a risk factor in the biological behavior and prognosis of gastric carcinoma[J]. Tumor Biology, 2015, 36(4): 2685-2694. DOI:10.1007/s13277-014-2891-z |
| [4] |
李小江, 贾英杰, 张文治, 等. 姜黄素对A549细胞亚群SP和NON-SP的NF-kB、VEGF及Notch通路的影响[J]. 天津中医药, 2016, 33(3): 164-168. LI X J, JIA Y J, ZHANG W Z, et al. Curcumin extract influence on tumor angiogenesis of A549 cell subsets SP and NON-SP cells[J]. Tianjin Journal of Traditional Chinese Medicine, 2016, 33(3): 164-168. |
| [5] |
DA W, ZHU J, WANG L, et al. Curcumin suppresses lymphatic vessel density in an in vivo human gastric cancer model[J]. Tumor Biology, 2015, 36(7): 5215-5223. DOI:10.1007/s13277-015-3178-8 |
| [6] |
JIANG Y, LV T, CHE X, et al. Overexpression of SMYD3 in ovarian cancer is associated with ovarian cancer proliferation and apoptosis via methylating H3K4 and H4K20[J]. Journal of Cancer, 2019, 10(17): 4072-4084. DOI:10.7150/jca.29861 |
| [7] |
DA W, ZHANG J, ZHANG R, et al. Curcumin inhibits the lymphangiogenesis of gastric cancer cells by inhibition of HMGB1/VEGF-D signaling[J]. International Journal of Pharmacology, 2019, 33(3): 2058738419861600. |
| [8] |
GAO P, ZHOU G Y, ZHANG Q H, et al. Lymphangiogenesis in gastric carcinoma correlates with prognosis[J]. Journal of Pathology, 2009, 218(2): 192-200. DOI:10.1002/path.2523 |
| [9] |
ZHAO G, ZHU G, HUANG Y, et al. IL-6 mediates the signal pathway of JAK-STAT3-VEGF-C promoting growth, invasion and lymphangiogenesis in gastric cancer[J]. Oncology Reports, 2016, 35(3): 1787-1795. DOI:10.3892/or.2016.4544 |
| [10] |
HUANG L, XU A M. SET and MYND domain containing protein 3 in cancer[J]. American Journal of Translational Research, 2017, 9(1): 1-14. |
| [11] |
LIU H, LIU Y, KONG F, et al. Elevated levels of SET and MYND domain-containing protein 3 are correlated with overexpression of transforming growth factor-β1 in gastric cancer[J]. Journal of the American College of Surgeons, 2015, 221(2): 579-590. DOI:10.1016/j.jamcollsurg.2015.02.023 |
| [12] |
DEVASSY J G, NWACHUKWU I D, JONES P J. Curcumin and cancer: barriers to obtaining a health claim[J]. Nutrition Reviews, 2015, 73(3): 155-165. DOI:10.1093/nutrit/nuu064 |
| [13] |
BARATI N, MOMTAZI B A A, MAJEED M, et al. Potential therapeutic effects of curcumin in gastric cancer[J]. Journal of Cellular Physiology, 2019, 234(3): 2317-2328. DOI:10.1002/jcp.27229 |
| [14] |
DA W, ZHU J, WANG L, et al. Curcumin suppresses lymphatic vessel density in an in vivo human gastric cancer model[J]. Tumor Biology, 2015, 36(7): 5215-5223. DOI:10.1007/s13277-015-3178-8 |
 2021, Vol. 38
2021, Vol. 38