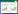文章信息
- 袁捷, 王肃, 姜云生, 胡忠慧
- YUAN Jie, WANG Su, JIANG Yunsheng, HU Zhonghui
- 丹酚酸B干预PI3K/AKT通路对STZ诱导大鼠胰岛细胞凋亡的影响
- Effect of Salvianolic acid B on PI3K/Akt pathway on STZ induced apoptosis of rat islets cells
- 天津中医药, 2021, 38(6): 799-803
- Tianjin Journal of Traditional Chinese Medicine, 2021, 38(6): 799-803
- http://dx.doi.org/10.11656/j.issn.1672-1519.2021.06.26
-
文章历史
- 收稿日期: 2021-01-27
胰岛β细胞合成和分泌的胰岛素是维持人血糖稳态、新陈代谢、生殖、生理所必须的内分泌激素。在糖尿病的发生发展进程中,胰岛细胞的功能不断下降。不管是在糖尿病的发生机制中还是在糖尿病的进展过程中都会发生胰岛β细胞的凋亡。研究发现,不论是Ⅰ型糖尿病[1]还是Ⅱ型糖尿病[2],患者胰腺内的胰岛细胞数量都会发生异常的减少。因此,如果能够有效阻止糖尿病患者胰腺内的胰岛细胞的异常凋亡,可延缓糖尿病进程。
丹酚酸B(SalB)是一种从唇形科植物丹参中纯化的天然产物,有抗氧化、抗炎、神经保护等[3-4]多种药理活性。有报道表明,SalB对胰岛细胞系的损伤有保护作用[5],然而其作用机制尚不明确。本研究制备链脲佐菌素(STZ)损伤的大鼠胰岛团体外模型,考察SalB是否抑制STZ诱导的胰岛凋亡,并且进一步探讨PI3K/Akt通路在这一现象中的可能机制,为进一步将SalB开发为治疗糖尿病的药物提供基础研究的数据。
1 实验材料及方法 1.1 仪器NU-4750E二氧化碳培养箱(美国NUAIRE公司);TG16-WS/TG16WS台式高速离心机(中国湘仪集团);Nikon Eclipse E600倒置荧光显微镜(日本尼康公司);Bio-rad Gel Doc XR+ 凝胶成像系统(美国Bio-Rad Laboratories公司)。
1.2 药品与试剂链尿佐菌素(STZ,Lot:WXBC2044V)、胶原酶V(Lot No. SLBL6045V)购自Sigma公司;荧光素二乙酸盐(FDA,Lot No.1028A025)活细胞染料、碘化丙锭(PI,Lot No.326C047)购自北京索莱宝科技有限公司;TUNEL凋亡检测试剂盒(Cat.NO:KGA7062,Lot:20171102)购自江苏凯基生物技术股份有限公司,Rat/Mouse Insulin ELISA试剂盒(96 test,Lot No. 2707840)购自EMD Millipore公司,兔抗大鼠PI3Kβ抗体(Lot:AG0933936),购自北京博奥森生物技术有限公司,兔抗Akt抗体和兔抗Phospho-Akt(Ser473)抗体(Lot#2854035)购自Cell Signaling Technology公司;小鼠抗大鼠mouse anti β-actin mAb抗体(17AV0409)、horseradish peroxidase(HRP)标记山羊抗兔IgG、HRP标记山羊抗小鼠IgG,购自北京中杉金桥生物技术有限公司;聚偏二氟乙烯膜(PVDF,0.45 μm),购自罗氏公司;RPMI-1640培养基(Lot No:ABA211779)、Histopaque 1077(Lot:RNBD9297),均购自Hyclone公司;青霉素链霉素(Pen/Strep 100×,Lot No. 510210101100)购自GENVIEW公司;TBD优级胎牛血清(FBS,Lot:QW20171105-0372)购自天津市灏洋公司;Clarity Western ECL Substrate化学发光试剂盒(Control 102030903)购自BioRad公司。
1.3 动物健康雄性SD大鼠(清洁级),体质量180~220 g,由天津医科大学实验动物中心提供。自然光照,自由饮食。适应性喂养1周。
1.4 大鼠胰岛团的分离和纯化取体质量范围为200~230 g的正常SD大鼠(雄性),腹腔注射10%乌拉坦麻醉,打开胸腔,以D-Hank’s缓冲液心脏灌流至肺叶变白,打开腹腔,暴露胰腺找到胆总管,经胆总管内插管并逆行注入预冷的胶原酶V(1 g/L)溶液8 mL,使胰腺充分膨胀后,迅速取出整个胰腺,在37 ℃水浴中静止消化15 min,直接振摇后加入含有10% FBS的D-Hank’s缓冲溶液终止消化。离心半径8 cm,1 000 r/min离心10 min后,弃上清液,加入Histopaque 1077溶液5 mL混匀,再缓慢加入Histopaque 1077溶液10 mL和D-Hank’s液10 mL,离心半径8 cm,2 000 r/min离心15 min,吸出D-Hank’s和Histopaque 1077层面的胰岛团用RPMI-1640完全培养基培养(RPMI-1640完全培养基含有10% FBS和1% P/S)。
1.5 分组和给药参考文献SalB给药剂量[6],体外培养的胰岛团分为5组:空白对照组(Control),STZ处理组,STZ+SalB低剂量(15 μmol/L)组,STZ+SalB中剂量(30 μmol/L)组,STZ+SalB高剂量(60 μmol/L)组。空白对照组的细胞以柠檬酸-柠檬酸钠缓冲溶液处理;STZ处理组以8 μmol/L的STZ处理4 h之后换成普通完全培养基;STZ+SalB各剂量组先以STZ处理4 h,换掉STZ溶液,以不同浓度的SalB继续培养72 h。
1.6 荧光二乙脂/碘丙啶(FDA/PI)双染检测胰岛细胞活力SD大鼠胰岛团分别用低、中、高剂量SalB处理72 h,各剂量浓度分别为15、30、60 μmol/L,通过荧光二乙脂/碘丙啶(FDA/PI)双染检测SalB对胰岛活性的影响,在荧光显微镜下用490 nm激发光滤光片检测绿色的FDA荧光(活细胞),用510 nm激发光滤光片后检测红色的PI荧光(死细胞)。以冷CCD成像系统采集图像。
1.7 胰岛素水平检测各组胰岛团处理72 h后取上清液,用ELISA法测定,测定方法根据ELISA试剂盒说明书操作。
1.8 TUNEL法检测胰岛细胞凋亡各组胰岛团于包埋盒中以OCT包埋剂包埋,置入-80 ℃冰箱中速冻。冰冻切片机切片,切片厚度为10 μm。取冰冻切片TUNEL法进行染色。冰冻切片以4%多聚甲醛固定30 min,磷酸缓冲盐溶液(PBS)洗3次后,3%BSA+0.3%Triton X-100于室温下固定、透明1 h,根据TUNEL试剂盒说明书操作,图片用Image J软件分析处理。每张图片在高倍镜下取一定视野,计算胰岛细胞凋亡率(胰岛细胞凋亡率=胰岛细胞凋亡数/胰岛细胞总数×100%)。记录切片大鼠胰岛团的凋亡率。
1.9 蛋白质免疫印迹法(Western blot)蛋白分析以RIPA(50 mmol/L Tris(pH 7.4),150 mmol/L NaCl,1%Triton X-100,1%脱氧胆酸钠,0.1%SDS)于4 ℃裂解胰岛30 min,离心半径10 cm,12 000 r/min离心10 min,取上清蛋白将其分装后储存于-80 ℃冰箱中保存。BCA法测定蛋白浓度,样品蛋白按比例稀释后加蛋白上样缓冲液(5×)于干式恒温加热器上100 ℃变性10 min。聚丙烯酰胺凝胶电泳。浓缩胶用60 V电压电泳1 h,将电压调到110 V电泳2 h后湿转法将蛋白转至PVDF膜,一抗4 ℃孵育过夜。次日以TBST洗3次后,以HRP标记的二抗室温孵育1 h,TBST洗3次后加上ECL发光液于BioRad凝胶成像仪曝光获得蛋白印记。
1.10 统计学方法采用SPSS 20.0软件进行数据分析,数据均以均数±标准差(x±s)表示。多组间比较采用单因素方差分析(One-way ANOVA)组间两两比较采用LSD法,P < 0.05为差异具有统计学意义。
2 结果 2.1 SalB降低STZ诱导的胰岛细胞凋亡率大鼠胰岛团以STZ(8 mmol/L)处理4 h,换掉STZ溶液,以不同浓度的SalB(15、30、60 μmol/L)处理72 h。TUNEL凋亡染色法检测SalB对STZ诱导的胰岛凋亡的保护作用。如图 1A所示,DAPI(蓝色)标记胰岛团的细胞核,TUNEL(红色)标记凋亡的细胞核。对染色结果进行定量分析,与空白对照组(Control)比较,STZ处理的胰岛团凋亡率显著上升(12.96±1.53% vs. 5.12±0.63%,P < 0.01)。见图 1B。与STZ处理组比较,STZ+SalB中剂量组和高剂量组显著降低STZ诱导的胰岛细胞凋亡(9.44±0.92% vs.12.96±1.53%,7.7±0.91% vs.12.96±1.53%,P < 0.01。见图 1B。
|
| 注:1.空白对照组(Control);2.STZ处理组;3.STZ+SalB低剂量组;4.STZ+SalB中剂量组;5.STZ+SalB高剂量组。A.胰岛团冰冻切片TUNEL凋亡染色,DAP(I蓝色),TUNEL(红色)。B.TUNEL染色定量分析,与空白对照组(Control)比较,##P < 0.01,与STZ处理组比较,**P < 0.01。 图 1 大鼠胰岛团TUNEL凋亡染色 Fig. 1 TUNEL apoptotic staining on rat islets |
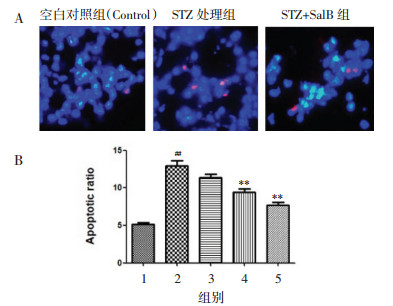
为了验证SalB是否对正常的胰岛细胞有损伤作用,以不同SalB浓度(15、30、60 μmol/L)处理大鼠胰岛团72 h。SalB处理过的胰岛团以FDA/PI双染,FDA(绿色)染色活细胞,PI(红色)染色凋亡细胞。与空白对照组(Control)比较,各剂量SalB组的胰岛细胞存活率无统计学差异(P > 0.05),表明SalB(15~60 μmol/L)对大鼠胰岛细胞无损伤作用。见图 2。
|
| 注:1.空白对照组(Control);2.SalB低剂量组;3.SalB中剂量组;4.SalB高剂量组。A.胰岛团FDA/PI染色,空白对照组(Control)和SalB处理下大鼠胰岛团FDA(绿色)和P(I红色)双染。B.FDA/PI双染定量分析,组间无统计学意义,P>0.05(n=5) 图 2 大鼠胰岛团FDA/PI染色 Fig. 2 FDA/PI staining on rat islets |
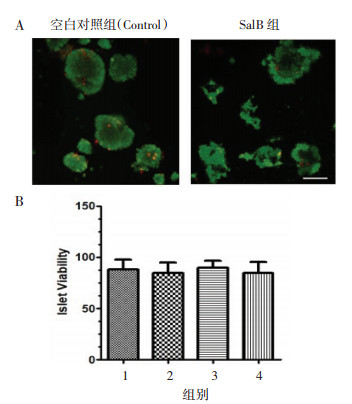
以不同SalB浓度(15、30、60 μmol/L)处理大鼠胰岛团72 h,ELISA法检测胰岛团上清液中的胰岛素水平。与空白对照组(Control)比较,STZ处理组胰岛团上清液胰岛素水平显著降低(P < 0.01)。与STZ处理组比较,30、60 μmol/L SalB组的胰岛团上清液胰岛素水平显著升高(P < 0.05)。见图 3。
|
| 注:1.空白对照组(Control);2.STZ处理组;3.STZ+SalB低剂量组;4. STZ+SalB中剂量组;5.STZ+SalB高剂量组。与空白对照组(Control)比较,##P < 0.01,与STZ处理组比较,*P < 0.05。 图 3 ELISA法检测大鼠胰岛团的胰岛素释放水平 Fig. 3 Insulin levels in supernatant of root islets tested by ELISA |
与空白对照组(Control)比较,STZ处理组PI3K、Akt和p-Akt水平显著下降(P < 0.01)。与STZ处理组比较,SalB(30 μmol/L)组PI3K水平升高(P < 0.05),Akt水平无显著变化(P > 0.05),p-Akt水平显著升高(P < 0.05);SalB(60 μmol/L)组PI3K水平升高(P < 0.01),Akt水平无显著变化(P > 0.05),p-Akt水平显著升高(P < 0.01)。见图 4。
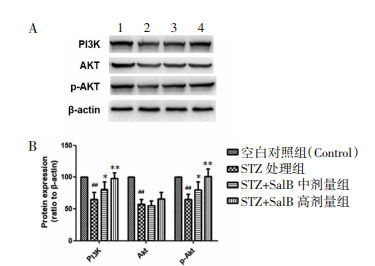
|
| 注:1.空白对照组(Control);2.STZ处理组;3.STZ+SalB中剂量组;4. STZ+SalB高剂量组。与空白对照组(Control)比较,##P < 0.01,与STZ处理组比较,*<italic>P < 0.05,**P < 0.01。 图 4 丹酚酸B对大鼠PI3K、Akt和p-Akt蛋白表达的作用 Fig. 4 Effect of Salvianolic acid B on the expression of rat PI3K, Akt and p-Akt proteins |
SalB有多种药理学活性,对血糖波动的糖尿病大鼠胰岛有保护作用[7],并且可以改善2型糖尿病大鼠的胰岛素抵抗[8]。最近的研究表明,SalB对高糖诱导的INS-1细胞凋亡有保护作用[5, 9]。INS-1细胞是一种大鼠胰岛β细胞系,可用作检测胰岛素分泌。SalB对间歇性高糖诱导的INS-1细胞凋亡有抑制作用,并且提高葡萄糖刺激的INS-1细胞胰岛素释放。无论是Ⅰ型糖尿病还是Ⅱ型糖尿病,共同的病理改变是胰岛β细胞的凋亡和逐渐缺失。基于SalB抑制INS-1细胞凋亡的报道,本研究直接提取、纯化大鼠胰岛团,以STZ处理制备体外的胰岛团损伤模型,并以不同浓度的SalB处理研究其对胰岛团的整体作用。实验结果表明,SalB在一定浓度(30、60 μmol/L)下对STZ损伤的大鼠胰岛团有保护作用,主要表现为胰岛细胞凋亡率的下降。值得关注的是,30和60 μmol/L的SalB直接处理胰岛团,对胰岛团无损伤作用,表明SalB有胰岛保护作用的同时对胰岛细胞没有伤害。此外,两种浓度的SalB对胰岛团分泌胰岛素的能力有促进作用。
Huang M等[10]研究了SalB对高脂饮食联合STZ注射制备的Ⅱ型糖尿病大鼠模型的影响。与模型组比较,口服SalB(100和200 mg/kg)显著降低血糖并增加胰岛素敏感性指数,然而SalB却降低了Ⅱ型糖尿病大鼠的胰岛素水平。而Raoufi S等[11]的研究中,研究者制备了多次低剂量STZ注射的糖尿病大鼠模型。与模型组比较,腹腔注射SalB(40 mg/kg)可以降低糖尿病大鼠血糖水平之外还可以提高血清胰岛素水平,与Huang M等的研究在SalB对胰岛素水平的结论上相反。本研究中,提取纯化了大鼠的胰岛团进行体外培养,以STZ处理制备胰岛团损伤模型,再以不同浓度的SalB处理胰岛团,观察其对胰岛团凋亡、胰岛素分泌的效应。实验结果表明,SalB对大鼠体外培养的胰岛团的胰岛素分泌水平有促进作用,与Raoufi S等的结论一致。此外,与在体内模型的研究比较,本研究基于离体培养的胰岛团,便于探索对SalB对胰岛抗凋亡作用的机制。
PIK3/Akt信号通路参与调控细胞的凋亡过程。该通路的激活促进下游cIAP-2和XIAP的转录,参与Caspase介导的细胞凋亡过程。cIAP-2和XIAP是Caspase的抑制剂,因此PIK3/Akt通路的激活可以有效抑制凋亡程序[12]。本研究发现,STZ损伤的大鼠胰岛团在凋亡水平升高的同时,PI3K、Akt和p-Akt水平下降。与STZ处理组比较,中剂量和高剂量SalB升高PI3K和p-Akt的水平,表明SalB在一定浓度范围内可以上调PI3K和p-Akt的水平激活PI3K/Akt通路。然而,SalB对Akt的水平没有影响,表明SalB对PI3K/Akt通路的上调并不通过直接升高Akt蛋白的水平来实现。
综上所述,SalB促进Akt磷酸化水平激活PIK3/Akt信号通路,从而抑制大鼠胰岛团细胞凋亡。SalB的制备工艺成熟,是一种有潜力治疗糖尿病的化合物。
| [1] |
MORGAN N G, RICHARDSON S J. Fifty years of pancreatic islet pathology in human type 1 diabetes: insights gained and progress made[J]. Diabetologia, 2018, 61(12): 2499-2506. DOI:10.1007/s00125-018-4731-y |
| [2] |
LYTRIVI M, IGOILLO E M, CNOP M. Inflammatory stress in islet β-cells: therapeutic implications for type 2 diabetes?[J]. Current Opinion in Pharmacology, 2018, 21(43): 40-45. |
| [3] |
LIU Q, SHI X, TANG L, et al. Salvianolic acid B attenuates experimental pulmonary inflammation by protecting endothelial cells against oxidative stress injury[J]. European Journal of Pharmacology, 2018, 840(3): 9-19. |
| [4] |
ZHANG N, KANG T, XIA Y, et al. Effects of salvianolic acid B on survival, self-renewal and neuronal differentiation of bone marrow derived neural stem cells[J]. European Journal of Pharmacology, 2012, 697(1-3): 32-39. DOI:10.1016/j.ejphar.2012.10.008 |
| [5] |
TAO S, REN Y, ZHENG H, et al. Salvianolic acid B inhibits intermittent high glucose-induced INS-1 cell apoptosis through regulation of Bcl-2 proteins and mitochondrial membrane potential[J]. European Journal of Pharmacology, 2017, 814(11): 56-62. |
| [6] |
CHENG B, GONG H, LI X, et al. Salvianolic acid B inhibits the amyloid formation of human islet amyloid polypeptide and protects pancreatic beta-cells against cytotoxicity[J]. Proteins, 2013, 81(4): 613-621. DOI:10.1002/prot.24216 |
| [7] |
陶善珺, 任尤楠, 赵梦秋, 等. 丹酚酸B对糖尿病血糖波动模型大鼠胰岛细胞的保护作用[J]. 中草药, 2016, 47(17): 3058-3063. TAO S J, REN Y N, ZHAO M Q, et al. Protective effect of salvianolic acid B on pancreatic islet cells in diabetic rats with fluctuating blood glucose[J]. Chinese Traditional and Herbal Drugs, 2016, 47(17): 3058-3063. DOI:10.7501/j.issn.0253-2670.2016.17.016 |
| [8] |
周才杰, 黄鸣清, 陈长青, 等. 丹酚酸B改善2型糖尿病大鼠糖脂代谢及胰岛素抵抗的实验研究[J]. 中国实验方剂学杂志, 2012, 18(13): 233-237. ZHOU C J, HUANG M Q, CHEN C Q, et al. Salvianolic acid B improves glucose and lipid metabolism and insulin resistance in rat models with type 2 diabetes[J]. Chinese Journal of Experimental Traditional Medical Formulae, 2012, 18(13): 233-237. DOI:10.3969/j.issn.1005-9903.2012.13.062 |
| [9] |
郑书国, 朱元美, 陶善珺, 等. 丹酚酸B对间歇性高糖诱导的JNK活化和INS-1细胞凋亡的影响[J]. 中国药理学通报, 2017, 33(1): 68-73. ZHENG S G, ZHU Y M, TAO S J, et al. Effect of salvianolic acid B on intermittent high glucose induced JNK activation and INS-1 cell apoptosis[J]. Chinese Pharmacological Bulletin, 2017, 33(1): 68-73. DOI:10.3969/j.issn.1001-1978.2017.01.013 |
| [10] |
HUANG M, WANG P, XU S, et al. Biological activities of salvianolic acid B from Salvia miltiorrhiza on type 2 diabetes induced by high-fat diet and streptozotocin[J]. Pharmaceutical Biology, 2015, 53(7): 1058-1065. DOI:10.3109/13880209.2014.959611 |
| [11] |
RAOUFI S, BALUCHNEJADMOJARAD T, ROGHANI M, et al. Antidiabetic potential of salvianolic acid B in multiple low-dose streptozotocin-induced diabetes[J]. Pharmaceutical Biology, 2015, 53(12): 1803-1809. DOI:10.3109/13880209.2015.1008148 |
| [12] |
HU P, HAN Z, COUVILLON A D, et al. Critical role of endogenous Akt/IAPs and MEK1/ERK pathways in counteracting endoplasmic reticulum stress-induced cell death[J]. Journal of Biological Chemistry, 2004, 279(47): 49420-49429. DOI:10.1074/jbc.M407700200 |
 2021, Vol. 38
2021, Vol. 38