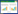文章信息
- 陈志勇, 张金平, 李连瑞, 刘静, 李天祥
- CHEN Zhiyong, ZHANG Jinping, LI Lianrui, LIU Jing, LI Tianxiang
- 基于网络药理学和分子对接的乾坤丹Ⅵ号治疗糖尿病肾脏疾病的机制研究
- Study on the mechanism of Qiankundan Ⅵ in the treatment of diabetic kidney disease based on network pharmacology and molecular docking
- 天津中医药, 2021, 38(7): 921-928
- Tianjin Journal of Traditional Chinese Medicine, 2021, 38(7): 921-928
- http://dx.doi.org/10.11656/j.issn.1672-1519.2021.07.22
-
文章历史
- 收稿日期: 2021-03-22
2. 天津市北辰区中医医院, 天津 300400
糖尿病肾脏疾病(DKD)以持续性白蛋白尿、血压升高、肾小球滤过率下降等为主要临床表现,是糖尿病最常见的微血管并发症[1],约30%的1型糖尿病(T1DM)和40%的2型糖尿病(T2DM)患者在10~20年内会进展为DKD[2],是导致终末期肾脏病疾病(ESRD)的主要原因[3]。DKD的病死率呈逐年上升趋势。有研究发现,到2040年全球将有2.4亿人口罹患糖尿病[4],与糖尿病相关的肾脏疾病将是导致糖尿病患者死亡的重要原因。
乾坤丹Ⅵ号为天津市北辰区中医医院治疗DKD的常用院内中药复方制剂[批准文号:津药制字(2001)Z第0792号],以黄芪、山药、苍术、续断、瓜蒌、枸杞子6味中药为核心药组,具有健脾补肾、祛湿化痰之效。通过近三十年的临床实践表明,乾坤丹Ⅵ号在改善DKD患者的临床症状,降低DKD患者尿蛋白的排泄,延缓DKD肾功能进展方面疗效显著[5-6]。然而目前关于乾坤丹Ⅵ号的作用机制研究相对较少,乾坤丹Ⅵ号防治DKD的机制尚未明确。
中药网络药理学研究方法是以高通量组学数据分析、计算机虚拟计算及网络数据库检索为基础,从系统生物学和生物网络平衡角度预测中药组方中化合物的靶点特征和药理作用,并阐述中药复方组合规则和对疾病网络调节效果的分析方法[7]。因此,本研究拟基于网络药理学分析方法从系统层面揭示和挖掘乾坤丹Ⅵ号防治糖尿病肾病的有效成分、作用靶点和作用信号通路,以全面阐释乾坤丹Ⅵ号治疗DKD的可能机制,以期为乾坤丹Ⅵ号的临床应用和研究开发提供科学依据。
1 材料和方法 1.1 材料中药系统药理学数据库和分析平台(TCMSP,http://tcmspw.com/tcmsp.php),Pubchem数据库(https://pubchem.ncbi.nlm.nih.gov),GeneCards数据库(https://www.genecards.org),人类孟德尔遗传数据库(OMIM,https://www.omim.org),String数据库(http://stringdb.org),Cytoscape(Version 3.7.0)软件,RCSB PDB数据库(http://www.rcsb.org),autodock(Version1.5.6)软件。
1.2 乾坤丹Ⅵ号有效化学成分及对应靶点的筛选基于TCMSP数据库检索乾坤丹Ⅵ号中6味核心药组中药的活性成分,并保留口服利用度(OB)≥30%和类药性(DL)≥0.18的活性成分,利用TCMSP数据库查找所得到的活性成分对应的靶点。通过Pubchem数据库查找乾坤丹Ⅵ号活性成分的3D结构,并进行能量最小化处理。
1.3 收集糖尿病肾病的疾病靶点以“diabetic kidney disease”“diabetic nephropathy”为关键词,分别在GeneCards数据库和OMIM数据库检索与DKD相关的疾病靶点,剔除各数据库重复的疾病相关靶点。
1.4 蛋白-蛋白相互作用网络的构建及关键靶点的分子对接将得到的乾坤丹Ⅵ号中药活性成分预测的靶点和DKD相关疾病靶点的交集作为关键靶点,基于String数据库对关键靶点进行蛋白-蛋白相互作用(PPI)网络分析,基于Cytoscape软件的MCODE插件对PPI网络进行聚类分析,构建功能模块,设置K-Core为2。同时基于Cytoscape软件的cytNCA插件对PPI网络数据进行拓扑分析,限定物种为人,选取度中心性(DC)、中介中心性(BC)、接近中心性(CC)和特征向量中心性(EC)均大于均值的节点作为核心靶点,利用RCSB PDB数据库检索核心靶点的蛋白晶体结构,并进行去水、去氢处理。基于autodock软件对乾坤丹Ⅵ号活性成分和关键靶点蛋白进行模拟分子对接,并计算分子对接的最低结合,最低结合能的绝对值越大,说明活性成分与靶点蛋白结合的活性越高[8]。
1.5 基因功能和信号通路富集分析基因本体(GO)功能分析是生物学领域广泛用于基因功能分类的系统,主要用于描述基因产物的生物过程(BP)、分子功能(MF)和细胞组分(CC)。基于Cytoscape软件的clueGO插件对关键靶点进行GO功能富集分析和京都基因与基因组百科全书(KEGG)信号通路富集分析,设置筛选阈值为P<0.05,Q<0.05,分析乾坤丹Ⅵ号防治DKD的靶标基因、蛋白质分子功能、细胞内定位及其所参与的生物学反应和通路。借助Cytoscape软件构建乾坤丹Ⅵ号防治DKD的“药物-活性成分-关键靶点-关键通路”的多层次关联网络,对乾坤丹Ⅵ号通过多成分、多靶点、多信号途径协同防治DKD的机制进行可视化分析。
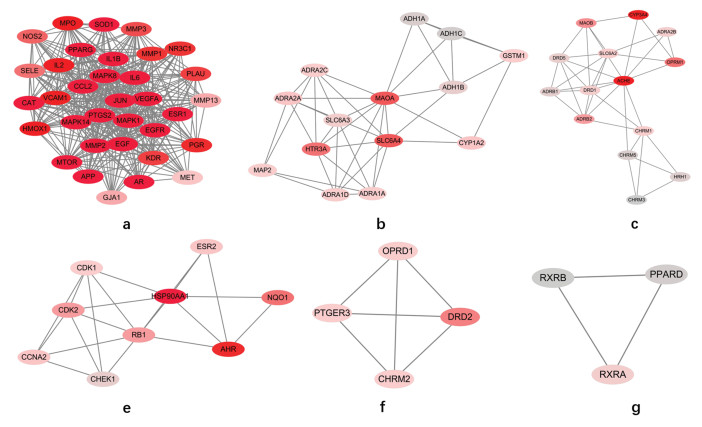
2 结果 2.1 乾坤丹Ⅵ号有效化学成分及对应的靶点通过TCMSP数据库共收集到符合筛选条件的乾坤丹Ⅵ号中药活性成分109种,其中黄芪20种,山药16种,枸杞子45种,苍术9种,瓜蒌11种,续断8种,剔重后得到乾坤丹Ⅵ号活性成分103种。共得到对应的预测靶点1 165个,剔重后得到预测靶点137个,其中预测靶点高于25个的化合物有12种,见表 1。

|
在GeneCards数据库和OMIM数据库以关键词“diabetic kidney disease”“diabetic nephropathy”进行检索,共收集到DKD相关疾病靶点12 003个,其中11 345个来自Genecard数据库,658个来自OMIM数据库,剔重后共得到疾病相关靶点11 809个。
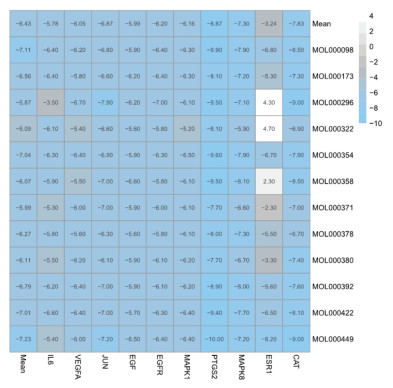
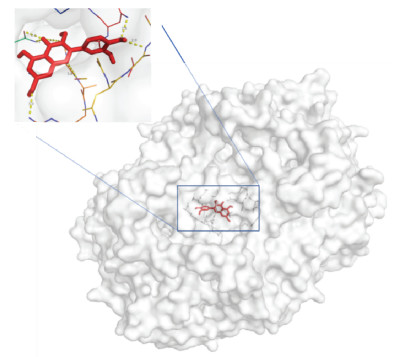
2.3 网络构建及关键靶点的分子对接对乾坤丹Ⅵ号的化学成分靶点和DKD调控的靶点蛋白进行映射并取交集作为关键靶点,共得到乾坤丹Ⅵ号防治DKD的关键靶点128个,说明乾坤丹Ⅵ号的潜在活性成分中存在防治DKD的作用靶点。基于String数据库进行PPI网络分析,共得到128个节点,1 273条边,各节点的平均度值为19.9。基于Cytoscape软件的MCODE插件对PPI网络进行聚类分析,共得到6个功能模块,模块中每个节点的颜色深浅代表靶点的受调控度值,见图 1。根据平均DC、BC、CC和EC值对PPI网络进行拓扑分析,共得到核心靶点14个,包括白细胞介素-6(IL-6)、血管内皮生长因子(VEGFA)、转录因子(JUN)、表皮生长因子(EGF)、表皮生长因子受体(EGFR)等,见表 2。基于autodock软件对乾坤丹Ⅵ号活性成分和核心靶点蛋白进行分子对接,结果显示乾坤丹Ⅵ号的12个活性成分和前10个核心靶点蛋白的平均结合能为-6.43 kcal/mol,提示乾坤丹Ⅵ号对DKD有直接的治疗作用,见图 2,其中槲皮素和前列腺素内过氧化物合酶-2(PSGT2)的结合能最高,分子对接模式展示见图 3。
|
| 图 1 乾坤丹Ⅵ号防治DKD关键靶点PPI网络的聚类分析模块 Fig. 1 Cluster analysis module of PPI network of key targets of DKD prevention and control with Qiankundan Ⅵ |
|
|
| 图 2 乾坤丹Ⅵ号化学成分与核心靶点对接结合能热图 Fig. 2 Heat diagram of docking binding energy between chemical composition and core target of Qiankundan Ⅵ |
|
| 图 3 槲皮素与PSGT2分子对接模式图 Fig. 3 Molecular docking pattern of quercetin and PSGT2 |
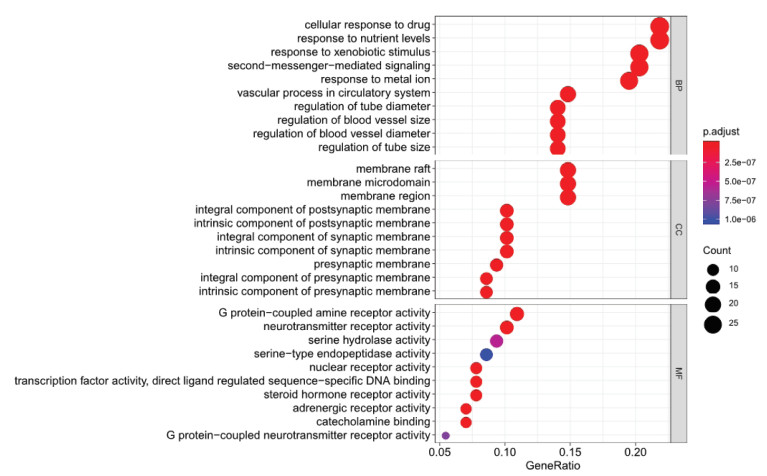
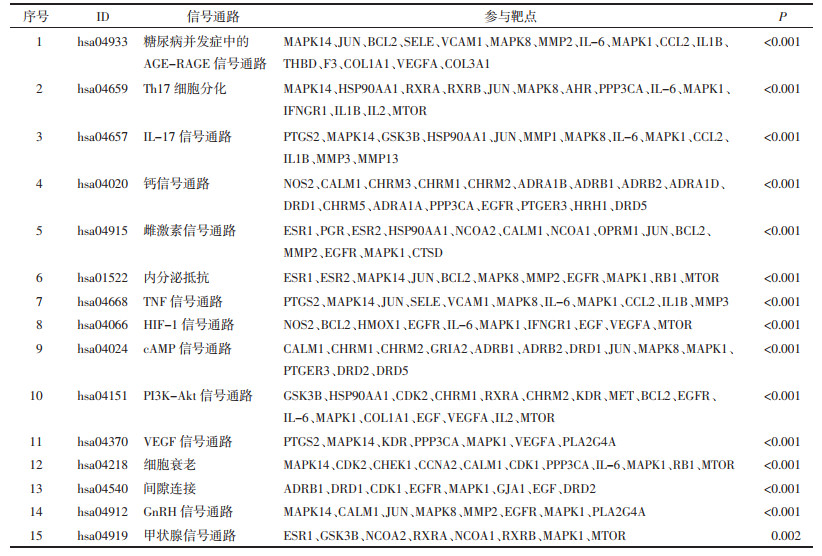
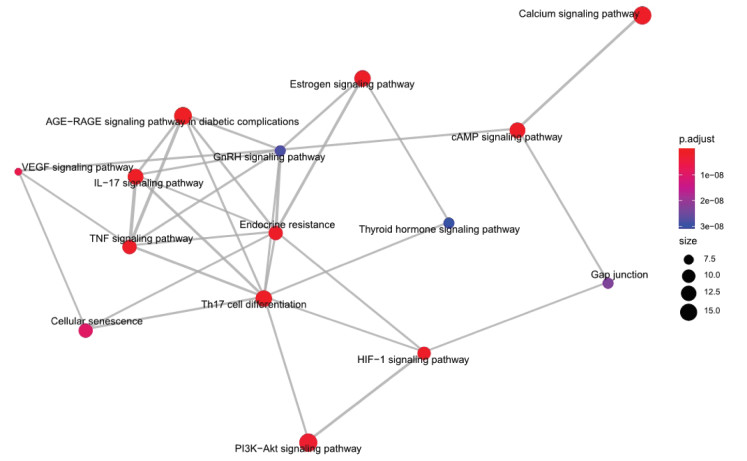
基于Cytoscape软件中的ClueGO插件对乾坤丹Ⅵ号治疗DKD的128个潜在作用靶点进行GO和KEGG信号通路富集分析,共得到2 140个GO富集结果,包括1 919个BP,96个CC,125个MF,主要的生物过程包括:细胞对药物的反应、对金属离子的响应、对营养水平的反应、管径调节、血管大小的调节等,见图 4。共得到KEGG信号通路132条,其中与DKD特异性相关的信号通路主要包括:糖尿病并发症中的AGE-RAGE信号通路、Th17细胞分化、IL-17信号通路、钙信号通路、雌激素信号途径、内分析抵抗等,见表 3。核心靶点与信号通路间的相互联系网络,见图 5,6。可见乾坤丹Ⅵ号防治DKD涉及多种成分、多个靶标和多条通路,乾坤丹Ⅵ号防治DKD的“药物-活性成分-关键靶点-关键通路”网络图,见图 7。
|
| 图 4 乾坤丹Ⅵ号防治DKD关键靶点的GO富集分析 Fig. 4 GO enrichment analysis of key targets of DKD prevention and control with Qiankundan Ⅵ |
|
|
| 图 5 乾坤丹Ⅵ号防治DKD的信号通路相互联系图 Fig. 5 Interaction of signal pathways of DKD prevention and control with Qiankundan Ⅵ |

|
| 图 6 乾坤丹Ⅵ号防治DKD关键靶点与信号通路网络图 Fig. 6 Key targets and signal pathways network of DKD prevention and control with Qiankundan Ⅵ |
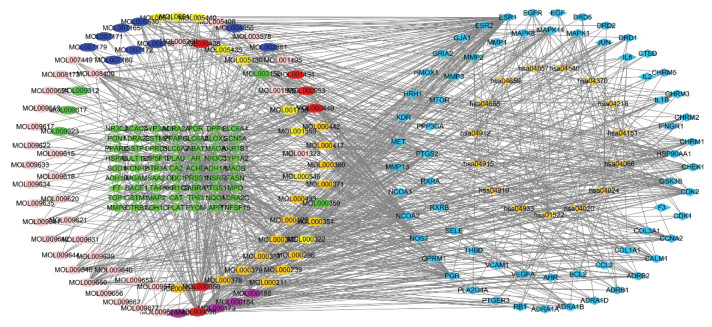
|
注:●代表乾坤丹Ⅵ号化学成分(粉色为枸杞子,紫色为苍术,绿色为续断,杏黄色为黄芪,黄色为山药,深蓝色为瓜蒌,红色为共有靶点),◆代表靶点(蓝色为关键靶点,绿色为非关键靶点); 代表信号通路。
图 7 乾坤丹Ⅵ号防治DKD的“药物-活性成分-关键靶点-关键通路”网络图
Fig. 7
Network diagram of"drug-active component-key target-key pathway" of DKD prevention and control with 代表信号通路。
图 7 乾坤丹Ⅵ号防治DKD的“药物-活性成分-关键靶点-关键通路”网络图
Fig. 7
Network diagram of"drug-active component-key target-key pathway" of DKD prevention and control with
|
DKD是DM晚期较为常见的微血管并发症之一,DM导致的肾脏血流动力学变化,机体缺氧、氧化应激反应和炎症反应激活等协同参与了DKD的发生和发展[9]。研究发现,DKD的早期诊断和有效的管理心血管危险因素对延缓DKD进展具有重要意义[10]。然而,当前的临床治疗方法仍不能完全有效地防止DKD演变为ESRD。多数研究证明,中医药复方在减少DKD炎症反应和氧化应激反应,改善肾脏纤维化等方面具有较好的疗效和安全性[11]。DKD属于中医“消渴”“尿浊”“肾劳”等病的范畴,其病机复杂,属虚实夹杂,本虚标实之证,涉及本虚、痰浊、湿热、肾络虚损、三焦失司等多个角度及层次[12-13]。乾坤丹Ⅵ号以黄芪、山药、续断、枸杞子、苍术、瓜蒌为核心药组,方中黄芪、山药健脾益气,苍术、瓜蒌燥湿化痰,续断、枸杞子滋阴补肾,诸药合伍共奏健脾补肾,祛湿化痰之功。
本研究共检索出乾坤丹Ⅵ号中药有效成分103种,得到预测靶点137个,其中预测靶点数目较多的乾坤丹Ⅵ号活性成分有槲皮素、山奈酚、β-谷甾醇等,药理学研究发现,槲皮素可以抑制肾脏细胞的增殖和活性氧(ROS)的过度生成,并减轻炎性小体的激活以及防止高糖环境对肾纤维化相关蛋白表达细胞的刺激,从而实现对肾脏的保护作用,减少尿液微量白蛋白的排泄[14];山奈酚可以抑制糖尿病高血糖环境诱导的肾脏氧化应激反应和相关炎症信号传导的级联反应,从而改善肾脏组织的损伤[15]。与乾坤丹Ⅵ号防治DKD相关的关键靶点有128个,包括IL-6、VEGFA、JUN、EGF、EGFR、MAPK1、PTGS2等,说明乾坤丹Ⅵ号基于多成分、多靶点的特点实现对DKD的防治作用。分子对接结果显示,乾坤丹Ⅵ号有效活性成分和DKD疾病相关靶点蛋白对接良好,其中槲皮素与PTGS2的结合能最高,说明槲皮素可以作用于PTGS2靶点蛋白。PTGS2是糖尿病足细胞损伤的重要介质,高糖导致PTGS2在肾脏中高表达可引起血管收缩和肾脏炎症,从而介导肾小球屏障受损,形成糖尿病的肾脏损伤[16]。
GO和KEGG信号通路富集分析结果显示,细胞对药物的反应、对金属离子的响应、对营养水平的反应、管径调节、血管大小的调节等生物过程和糖尿病并发症中的AGE-RAGE信号通路、Th17细胞分化、IL-17信号通路、钙信号通路、TNF信号通路、HIF-1信号通路等相关作用信号通路参与了乾坤丹Ⅵ号防治DKD的作用过程。晚期糖基化终产物受体(RAGE)在DKD的发生发展中发挥着重要的作用[17]。有研究发现,在因高糖而导致的各类病变的肾组织细胞中均发现RAGE的高表达效应[17]。DM的高糖环境诱导晚期糖基化终末产物(AGEs)的大量生成,AGEs可与RAGE特异性结合[18],使RAGE的表达显著性上调,导致RAGE下游的IL-17信号通路、钙信号通路、TNF信号通路等复杂的炎症信号通路激活[19],介导了转化生长因子-β1(TGF-β1)[20]和肿瘤坏死因子-α(TNF-α)[21]等炎症因子在肾脏组织的级联化效应,从而介导了糖尿病的肾小球基膜增厚、系膜细胞增殖、肾组织纤维化等肾脏病理改变。糖尿病肾脏组织的缺氧是导致DKD的重要途径[22]。糖尿病的高糖水平诱导低氧诱导因子(HIFs)活性,导致机体氧稳态破坏,HIF-1信号通路激活,肾小球细胞中HIFs活性升高会促进肾小球硬化和蛋白尿[23]。
综上所述,乾坤丹Ⅵ号调控DKD的作用机制涉及多种活性成分、多个靶点和多条信号通路,各活性成分、靶点和信号通路间协同作用,突出了乾坤丹Ⅵ号防治DKD标本兼治、多向调节的特点,揭示了乾坤丹Ⅵ号多靶点多通路综合干预DKD的治疗特色,为后续进一步临床和实验研究等提供了重要的科学依据,也为DKD的治疗指明了新的方向。后续研究将结合上述结果和前期研究数据对关键靶点和信号通路进行更深一步的研究及临床验证。
| [1] |
FURUICHI K, SHIMIZU M, OKADA H, et al. Clinico-pathological features of kidney disease in diabetic cases[J]. Clinical and Experimental Nephrology, 2018, 22(5): 1046-1051. DOI:10.1007/s10157-018-1556-4 |
| [2] |
ANDERS H J, HUBER T B, ISERMANN B, et al. CKD in diabetes: diabetic kidney disease versus nondiabetic kidney disease[J]. Nature Reviews Nephrology, 2018, 14(6): 361-377. DOI:10.1038/s41581-018-0001-y |
| [3] |
JHA V, GARCIA-GARCIA G, ISEKI K, et al. Chronic kidney disease: global dimension and perspectives[J]. The Lancet, 2013, 382(9888): 260-272. DOI:10.1016/S0140-6736(13)60687-X |
| [4] |
TUTTLE K R. Diabetic kidney disease (c.2018)[J]. Advances in Chronic Kidney Disease, 2018, 25(2): 119-120. DOI:10.1053/j.ackd.2018.01.006 |
| [5] |
薛艳晖, 梁金荣. 耳穴贴压联合乾坤丹Ⅵ号治疗早期糖尿病肾病42例临床观察[J]. 湖南中医杂志, 2016, 32(6): 99-101. XUE Y H, LIANG J R. Clinical observation on 42 cases of early diabetic nephropathy treated by auricular point sticking combined with Qiankun Dan Ⅵ[J]. Hunan Journal of Traditional Chinese Medicine, 2016, 32(6): 99-101. |
| [6] |
马国海. 乾坤丹Ⅵ号治疗糖尿病肾病62例疗效观察[J]. 中国全科医学, 2006, 9(20): 1730-1731. MA G H. Observation on curative effect of Qiankun Dan Ⅵ in treating 62 cases of diabetic nephropathy[J]. Chinese General Practice, 2006, 9(20): 1730-1731. DOI:10.3969/j.issn.1007-9572.2006.20.037 |
| [7] |
LI S, ZHANG B. Traditional Chinese medicine network pharmacology: theory, methodology and application[J]. Chinese Journal of Natural Medicines, 2013, 11(2): 110-120. DOI:10.1016/S1875-5364(13)60037-0 |
| [8] |
何堃, 燕波, 孙梦盛, 等. 基于网络药理学和分子对接法预测楮实子防治阿尔茨海默病的分子机制[J]. 中国药学杂志, 2019, 54(7): 549-557. HE K, YAN B, SUN M S, et al. Prediction of molecular mechanism of fructus broussonetifera against Alzheimer's disease based on network pharmacology and molecular docking[J]. Chinese Pharmaceutical Journal, 2019, 54(7): 549-557. |
| [9] |
LIN Y C, CHANG Y H, YANG S Y, et al. Update of pathophysiology and management of diabetic kidney disease[J]. Journal of the Formosan Medical Association, 2018, 117(8): 662-675. DOI:10.1016/j.jfma.2018.02.007 |
| [10] |
ZAC-VARGHESE S, WINOCOUR P. Managing diabetic kidney disease[J]. British Medical Bulletin, 2018, 125(1): 55-66. DOI:10.1093/bmb/ldx047 |
| [11] |
LU Z Z, ZHONG Y F, LIU W Y, et al. The efficacy and mechanism of chinese herbal medicine on diabetic kidney disease[J]. Journal of Diabetes Research, 2019, 2019: 2697672. |
| [12] |
路建饶, 陈  , 陈杰. 传统医学对糖尿病肾病发病机制的研究进展[J]. 时珍国医国药, 2018, 29(2): 415-417. , 陈杰. 传统医学对糖尿病肾病发病机制的研究进展[J]. 时珍国医国药, 2018, 29(2): 415-417.LU J R, CHEN X, CHEN J. Research progress of traditional medicine on the pathogenesis of diabetic nephropathy[J]. Lishizhen Medicine and Materia Medica Research, 2018, 29(2): 415-417. |
| [13] |
张向伟, 柳红芳, 张先慧. 糖尿病肾病病机层次分析与辨治[J]. 中医杂志, 2017, 58(5): 390-393. ZHANG X W, LIU H F, ZHANG X H. Pathogenesis hierarchy analysis and differentiation and treatment of diabetic nephropathy[J]. Journal of Traditional Chinese Medicine, 2017, 58(5): 390-393. |
| [14] |
DING T, WANG S, ZHANG X, et al. Kidney protection effects of dihydroquercetin on diabetic nephropathy through suppressing ROS and NLRP3 inflammasome[J]. Phytomedicine, 2018, 41(1): 45-53. |
| [15] |
SHARMA D, GONDALIYA P, TIWARI V, et al. Kaempferol attenuates diabetic nephropathy by inhibiting RhoA/Rho-kinase mediated inflammatory signalling[J]. Biomedicine & Pharmacotherapy, 2019, 109: 1610-1619. |
| [16] |
SYED S Q, SILAS A C, CAIXIA L, et al. Interaction of the renin angiotensin and cox systems in the kidney[J]. Frontiers in Bioscience, 2016, 8: 215-226. DOI:10.2741/s459 |
| [17] |
DAVOUD S, AMIR G H, HASSAN A, et al. AGE-RAGE axis blockade in diabetic nephropathy: Current status and future directions[J]. European Journal of Pharmacology, 2018, 833: 158-164. DOI:10.1016/j.ejphar.2018.06.001 |
| [18] |
孙伟翔, 许惠琴. RAGE与糖尿病肾病[J]. 西北药学杂志, 2017, 32(1): 115-118. SUN W X, XU H Q. RAGE and diabetic nephropathy[J]. Northwest Pharmaceutical Journal, 2017, 32(1): 115-118. |
| [19] |
KEIICHIRO M, YUSUKE T, YOSUKE N, et al. Unraveling the role of inflammation in the pathogenesis of diabetic kidney disease[J]. International Journal of Molecular Sciences, 2019, 20(14): 1-15. |
| [20] |
HUANG C, LIN M Z, CHENG D, et al. KCa3.1 mediates dysfunction of tubular autophagy in diabetic kidneys via PI3k/Akt/mTOR signaling pathways[J]. Scientific Reports, 2016, 6: 23884. DOI:10.1038/srep23884 |
| [21] |
CHUNG C H, FAN J, LEE E Y, et al. Effects of tumor necrosis factor-α on podocyte expression of monocyte chemoattractant protein-1 and in diabetic nephropathy[J]. Nephron Extra, 2015, 5(1): 1-18. DOI:10.1159/000369576 |
| [22] |
FRANK J G, XIE C, JIANG C T. The role of hypoxia-inducible factors in metabolic diseases[J]. Nature Reviews Endocrinology, 2018, 15(1): 21-32. |
| [23] |
PERSSON P, PALM F. Hypoxia-inducible factor activation in diabetic kidney disease[J]. Current Opinion in Nephrology and Hypertension, 2017, 26(5): 345-350. |
2. Tianjin Beichen District Hospital of Traditional Chinese Medicine, Tianjin 300400, China
 2021, Vol. 38
2021, Vol. 38