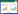文章信息
- 王子延, 吴丹, 牛璐, 王跃飞, 柴欣
- WANG Ziyan, WU Dan, NIU Lu, WANG Yuefei, CHAI Xin
- 美洲大蠊粪便提取物抗氧化活性及其化学成分研究
- Study on antioxidant activity and chemical components of excreta extracts from Periplaneta americana L.
- 天津中医药, 2021, 38(8): 1056-1061
- Tianjin Journal of Traditional Chinese Medicine, 2021, 38(8): 1056-1061
- http://dx.doi.org/10.11656/j.issn.1672-1519.2021.08.23
-
文章历史
- 收稿日期: 2021-03-24
美洲大蠊(Periplaneta americana L.),俗称蟑螂,为昆虫纲有翅亚纲蜚蠊目蜚蠊科大蠊属昆虫。美洲大蠊入药始载于《神农本草经》,主要用于治疗癥瘕积聚、小儿疳积和疮痈肿毒[1]。目前,以美洲大蠊为主要原料制成的上市药物有康复新液、心脉隆、肝龙胶囊等。现代药理研究表明,美洲大蠊具有创伤修复、抗菌、抗病毒、抗肿瘤[2-4]等良好的生物活性,其化学成分研究主要聚焦氨基酸、核酸类、酚类、神经肽、信息素等,但从提取物中分离的有效成分很少[5]。有研究认为中肠是昆虫解毒代谢和应激反应的中心[6],丰富的肠道菌群及其代谢产物可能是美洲大蠊具有极强的环境适应性和生存能力的重要原因。近年来,随着肠道微生物研究的兴起与深入,粪菌移植疗法发展迅速,这与传统中医的粪便入药殊途同归,两者均利用粪便达到治疗疾病的目的。为阐明美洲大蠊的化学物质基础,本研究首次以粪便为载体,开展美洲大蠊肠道菌群代谢产物的富集制备,从全新角度寻找美洲大蠊的活性成分。采用1,1-二苯基-2-三硝基苯肼(DPPH)法对美洲大蠊粪便提取物进行初步的抗氧化活性研究,半抑制浓度(IC50)为44.53 μg/mL,显示其具有良好的抗氧化活性。采用75%甲醇对美洲大蠊粪便进行超声提取,减压浓缩后经大孔吸附树脂富集有效成分,通过制备高效液相色谱法分离得到12个化合物,分别鉴定为:邻苯二酚(1)、苯甲酸(2)、羟吲哚(3)、5-羟基吲哚啉-2-酮(4)、8-羟基喹啉-2-羧酸(5)、6-羟基-2-喹啉酮(6)、8-羟基-2-喹啉酮(7)、2-喹啉酮(8)、6-羟基-3,4-二氢-2-喹啉酮(9)、5-羟基-3,4-二氢-2-喹啉酮(10)、8-羟基-3,4二氢-2-喹啉酮(11)、3,4-二氢-2-喹啉酮(12)。化学结构见图 1。
|
| 图 1 化合物1~12的化学结构 Fig. 1 Chemical structures of compounds 1~12 |
BRUKER AV Ⅲ核磁共振波谱仪(瑞士Bruker公司),SHIMADZU LC-MS-IT-TOF液质联用仪(日本SHIMADZU公司),Agilent 1260制备液相色谱仪(美国Agilent公司),METTLER TOLEDO万分之一天平(瑞士METTLER TOLEDO公司),R-215旋转蒸发仪(日本东京理化器械株式会社),SCIENTZ 25-12超声波清洗器(宁波新芝生物科技股份有限公司),Milli-Q超纯水仪(美国Milli-Q公司),TGL-16C台式离心机(上海安亭科学仪器厂),D101大孔吸附树脂(天津海光化工有限公司),ZORBAX DB-C18色谱柱(21.2 mm×250 mm,7 μm),Sun Fire C18 OBD色谱柱(10 mm×250 mm,5 μm),FDU-1110/2110冷冻干燥机(日本东京理化器械株式会社),Costar 96孔细胞培养板(美国Corning公司),FlexStation®3多功能读板机(美国Molecular Devices公司)。
氘代二甲基亚砜(DMSO-d6)购自美国Cambridge Isotope Laboratories公司,甲醇(分析纯、质谱纯)、乙腈(质谱纯)、甲酸(质谱纯)均购自美国Fisher公司,其余试剂均为分析纯。DPPH购自美国Sigma-Aldrich公司,维生素C购自天津市风船化学试剂科技有限公司。
本研究所用美洲大蠊粪便为云南腾药制药股份有限公司石头山美洲大蠊GAP养殖基地提供的成虫期美洲大蠊粪便,美洲大蠊的饲养条件严格按照GAP标准执行。将清扫的美洲大蠊中的虫体、虫皮和虫卵筛除后,进行拣选、漂洗和晾晒,低温运输,储存于-20 ℃冰箱中。
2 实验方法 2.1 美洲大蠊粪便提取物的制备美洲大蠊成虫粪便2.1 kg,加入21 L 75%甲醇水溶液,超声提取1 h,过滤,提取液减压回收溶剂得总浸膏(168 g)。总浸膏用10倍量的水混悬,采用大孔吸附树脂分离,依次用水、甲醇洗脱,收集甲醇洗脱液,减压回收溶剂,得甲醇洗脱液的浸膏(40 g);加入10倍量的70%甲醇溶液溶解浸膏,置于4 ℃冰箱,静置12 h,收集上清液;上清液加入等体积水,置于4 ℃冰箱,再静置12 h,4 000 g离心30 min,重新收集美洲大蠊粪便提取物上清液(750 mL)。
2.2 DPPH自由基的清除实验取美洲大蠊粪便提取物上清液,减压回收溶剂,真空干燥得提取物粉末。
精密称定美洲大蠊粪便提取物粉末20 mg,置于5 mL容量瓶中,加适量甲醇,超声处理10 min,取出,放冷至室温,用甲醇定容至刻度,摇匀,得到浓度为4 048.00 μg/mL的储备液。将储备液用甲醇逐级稀释为系列工作溶液,浓度依次为:2 024.00、1 012.00、506.00、269.87、202.40、101.20、40.48、20.24、10.12、5.06 μg/mL。
精密称定DPPH 25.00 mg,置于250 mL棕色容量瓶中,用少量甲醇溶解后,定容至刻度,摇匀,得100 μg/mL DPPH甲醇工作溶液。以维生素C作为阳性对照,精密称定维生素C 2.8 mg,置于25 mL容量瓶中,用适量甲醇溶解,超声处理10 min后取出,放冷至室温,并定容至刻度,得到浓度为111.60 μg/mL的维生素C储备液。用甲醇将储备液逐级稀释为工作溶液,浓度分别为:89.28、74.40、55.80、37.20、27.90、18.60、11.16、5.58、2.23 μg/mL。
药物组加入50 μL不同浓度提取物溶液和150 μL DPPH甲醇溶液,阳性对照组以50 μL不同浓度的维生素C溶液替代美洲大蠊粪便提取物溶液,空白对照组加入50 μL样品溶液和150 μL甲醇溶液,DPPH对照组加入50 μL甲醇溶液和150 μL DPPH甲醇溶液。各组均平行3个复孔,取其平均值。将加入溶液的96孔细胞培养板置于多功能读板机中,在512 nm(37 ℃)处检测其动力学过程,每45 s读数1次,连续记录45 min,记录最终A值。所有实验平行操作3次。DPPH清除活性(%)=[1-(A药物-A空白)/A对照]×100%,其中A药物为DPPH+样品吸光度值;A空白为甲醇+样品吸光度值;A对照为DPPH+甲醇吸光度值。分别计算系列浓度的阳性药维生素C和测试样品美洲大蠊粪便样品供试品溶液的DPPH清除活性。采用OriginPro 8.5.1软件绘制剂量-效应曲线,计算IC50。
2.3 美洲大螊粪便提取物的分离纯化采用制备液相色谱(ZORBAX DB-C18,21.2 mm×250 mm,7 μm),通过0.05%甲酸水-甲醇梯度洗脱(0~40 min,5%~80%甲醇;40~50 min,80%~100%甲醇),从美洲大蠊粪便提取物上清液中初步得到19份样品组分(按保留时间顺序依次编号为Fr 1~19,0~6 min为Fr 1,6~40 min每2 min收集1个流分,40~50 min为Fr 19)。将7、9~16号共9个组分别采用制备液相色谱(Sun Fire C18 OBD Prep Column,10 mm×250 mm,5 μm)经过0.05%甲酸水-甲醇梯度洗脱,进一步分离纯化,共得到12个化合物。Fr 7(40 mg)经梯度洗脱(0~15 min,15%~26%甲醇)制备得到化合物4(10 mg)。Fr 9(85 mg)经梯度洗脱(0~30 min,17%甲醇)制备得到化合物1(1 mg)和化合物9(9.8 mg)。Fr 10(100 mg)经梯度洗脱(0~35 min,20%甲醇)制备得到化合物6(2 mg)和化合物10(2 mg)。Fr 13(100 mg)经梯度洗脱(0~25 min,32%甲醇)制备得到化合物7(10 mg)、化合物3(6 mg)和化合物11(10 mg)。Fr 14(95 mg)通过梯度洗脱(0~25 min,38%甲醇)制备得到化合物8(6 mg)。Fr 15(95 mg)通过梯度洗脱(0~35 min,40%甲醇)制备得到化合物12(10 mg)和化合物2(1.7 mg)。Fr 16(47 mg)经过梯度洗脱(0~20 min,20%~80%甲醇;20~23 min,80%甲醇)制备得到化合物5(15 mg)。
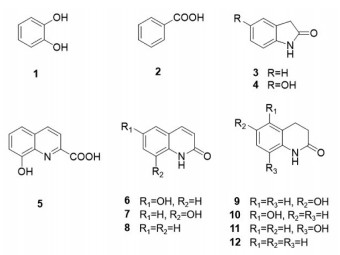
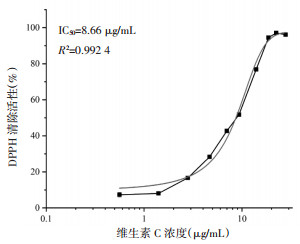
3 结果 3.1 美洲大蠊粪便提取物对DPPH自由基的清除活性DPPH自由基清除能力可以作为抗氧化活性的衡量指标,本研究采用分光光度法对DPPH自由基清除率进行计算并衡量美洲大蠊粪便提取物的抗氧化活性。由于样品工作溶液和DPPH甲醇溶液以1∶3体积比加入96孔细胞培养板中,因此,维生素C溶液和美洲大蠊粪便提取物样品溶液测试终浓度为样品工作液浓度的1/4;以终浓度计算样品溶液的DPPH清除活性。维生素C和美洲大蠊粪便提取物的DPPH清除活性的剂量-效应曲线见图 2及图 3。在DPPH终浓度为75.00 μg/mL条件下,维生素C清除DPPH的IC50为8.66 μg/mL。美洲大蠊粪便提取物清除DPPH自由基的IC50值为44.53 μg/mL,说明其具有一定的抗氧化能力。
|
| 图 2 不同浓度的维生素C对DPPH自由基的清除能力 Fig. 2 Scavenging ability of DPPH free radical of vitamin C in different concentrations |
|
| 图 3 美洲大蠊粪便提取物对DPPH自由基的清除能力 Fig. 3 Scavenging ability of DPPH free radical of the extract of feces of the Periplaneta americana L. in different concentrations |
化合物1为黄色粉末,C6H6O2;ESI-MS:[M-H]-,m/z 109.033 7;1H-NMR(600 MHz,DMSO-d6)δ:8.93(2H,brs,-OH),6.71~6.73(2H,m,H-3,6),6.58~6.61(2H,m,H-4,5);13C-NMR(150 MHz,DMSO-d6)δ:145.8(C-1,2),119.7(C-4,5),116.2(C-3,6)。以上理化性质以及数据与参考文献[7]相符,可以确定化合物1为邻苯二酚。
化合物2为白色结晶,C7H6O2;ESI-MS:[M-H]-,m/z 121.032 7;1H-NMR(600 MHz,DMSO-d6)δ:7.96(2H,d,J=7.8 Hz,H-2,6),7.63(1H,dd,J=7.8,7.8 Hz,H-4),7.50(2H,dd,J=7.8,7.8 Hz,H-3,5);13C-NMR(150 MHz,DMSO-d6)δ:167.8(-COOH),133.3(C-4),131.2(C-1),129.7(C-2,6),129.0(C-3,5)。以上理化性质以及数据与参考文献[8]相符,可以确定化合物2为苯甲酸。
化合物3为白色针状结晶,C8H7NO;ESI-MS:[M+H]+,m/z 134.0577;1H-NMR(600 MHz,DMSO-d6)δ:10.36(1H,brs,-NH),7.20(1H,d,J=7.8 Hz,H-4),7.16(1H,dd,J=7.8,7.8 Hz,H-6),6.92(1H,dd,J=7.8,7.8 Hz,H-5),6.81(1H,d,J=7.8 Hz,H-7),3.46(2H,s,H-3);13C-NMR(150 MHz,DMSO-d6)δ:176.8(C-2),144.2(C-8),127.9(C-6),126.2(C-4),124.8(C-5),121.6(C-9),109.6(C-7),36.2(C-3)。以上理化性质以及数据与参考文献[9]相符,可以确定化合物3为羟吲哚。
化合物4为白色无定形粉末,C8H7NO2;ESI-MS:[M+H]+,m/z 150.052 9;1H-NMR(400 MHz,DMSO-d6)δ:10.05(1H,brs,-NH),8.92(1H,brs,-OH),6.67(1H,brs,H-4),6.60(1H,d,J=8.0 Hz,H-7),6.55(1H,dd,J=8.0,2.4 Hz,H-6),3.38(2H,s,H-3);13C-NMR(150 MHz,DMSO-d6)δ:176.5(C-2),152.7(C-5),136.0(C-8),127.4(C-9),113.8(C-6),112.9(C-4),109.9(C-7),36.7(C-3)。以上理化性质以及数据与参考文献[10]相符,可以确定化合物4为5-羟基吲哚啉-2-酮。
化合物5为黄色颗粒状结晶,C10H7NO3;ESI-MS:[M+H]+,m/z 190.045 7,[M-H]-,m/z 188.0362;1H-NMR(400 MHz,CD3OD)δ:8.43(1H,d,J=8.4 Hz,H-4),8.18(1H,d,J=8.4 Hz,H-3),7.59(1H,dd,J=7.6,8.4 Hz,H-6),7.45(1H,d,J=8.4 Hz,H-5),7.19(1H,d,J=7.6 Hz,H-7);13C-NMR(150 MHz,CD3OD)δ:166.5(-COOH),154.0(C-8),144.9(C-2),137.8(C-4),137.4(C-9),130.3(C-6),130.1(C-10),120.3(C-3),117.5(C-5),111.8(C-7)。以上理化性质以及数据与参考文献[11]相符,可以确定化合物5为8-羟基-2-喹啉酸。
化合物6为黄色无定形粉末,C9H7NO2;ESI-MS:[M+H]+,m/z 162.052 6,[M-H]-,m/z 160.042 1;1H-NMR(600 MHz,DMSO-d6)δ:11.53(1H,brs,-OH),8.27(1H,brs,-NH),7.77(1H,d,J=9.6 Hz,H-4),7.15(1H,d,J=9.0 Hz,H-8),7.00(1H,d,J=2.4 Hz,H-5),6.98(1H,dd,J=9.0,2.4 Hz,H-7),6.43(1H,d,J=9.6 Hz,H-3)。以上理化性质以及数据与参考文献[12]相符,可以确定化合物6为6-羟基-1H-2-喹啉酮。
化合物7为白色颗粒,C9H7NO2;ESI-MS:[M+H]+,m/z 162.052 2,[M-H]-,m/z 160.042 0;1H-NMR(600 MHz,DMSO-d6)δ:10.47(1H,s,-NH),10.28(1H,s,-OH),7.85(1H,d,J=9.6 Hz,H-4),7.11(1H,dd,J=8.4,1.2 Hz,H-5),7.00(1H,dd,J=8.4,7.8 Hz,H-6),6.96(1H,d,J=7.8 Hz,H-7),6.49(1H,d,J=9.6 Hz,H-3);13C-NMR(150 MHz,DMSO-d6)δ:161.8(C-2),144.0(C-8),140.9(C-4),128.5(C-9),122.6(C-3),122.3(C-6),120.5(C-10),118.7(C-5),115.0(C-7)。以上理化性质以及数据与参考文献[13]相符,可以确定化合物7为8-羟基-2-喹啉酮。
化合物8为白色针状结晶,C9H7NO;ESI-MS:[M+H]+,m/z 146.058 2;1H-NMR(600 MHz,DMSO-d6)δ:11.75(1H,brs,-NH),7.90(1H,d,J=9.6 Hz,H-4),7.66(1H,d,J=7.8 Hz,H-5),7.50(1H,dd,J=7.8,7.8 Hz,H-7),7.31(1H,d,J=7.8 Hz,H-8),7.17(1H,dd,J=7.8,7.8 Hz,H-6),6.50(1H,d,J=9.6 Hz,H-3);13C-NMR(150 MHz,DMSO-d6)δ:162.4(C-2),140.7(C-9),139.4(C-4),130.8(C-5),128.3(C-7),122.4(C-6),122.2(C-3),119.6(C-10),115.6(C-8)。以上理化性质以及数据与参考文献[14]相符,可以确定化合物8为2-喹啉酮。
化合物9为白色针状结晶,C9H9NO2;ESI-MS:[M+H]+,m/z 164.068 4,[M-H]-,m/z 162.056 7;1H-NMR(600 MHz,DMSO-d6)δ:9.80(1H,brs,-OH),9.05(1H,brs,-NH),6.66(1H,d,J=8.4 Hz,H-8),6.58(1H,d,J=8.4 Hz,H-5),6.53(1H,dd,J=8.4,2.4 Hz,H-7),2.77(2H,t,J=7.8 Hz,H-4),2.37(2H,t,J=7.8 Hz,H-3);13C-NMR(150 MHz,DMSO-d6)δ:170.1(C-2),152.8(C-6),130.7(C-9),125.2(C-10),116.3(C-8),115.0(C-5),113.9(C-7),30.9(C-3),25.6(C-4)。以上理化性质以及数据与参考文献[15]相符,可以确定化合物9为6-羟基-3,4-二氢-1H-2-喹啉酮。
化合物10为黄色无定形粉末,C9H9NO2;ESI-MS:[M+H]+,m/z 164.069 5,[M-H]-,m/z 162.057 5;1H-NMR(600 MHz,DMSO-d6)δ:9.94(1H,brs,-OH),8.25(1H,brs,-NH),6.90(1H,dd,J=8.4,7.8 Hz,H-7),6.44(1H,d,J=8.4 Hz,H-8),6.32(1H,d,J=7.8 Hz,H-6),2.76(2H,t,J=7.2 Hz,H-4),2.39(2H,t,J=7.8 Hz,H-3)。以上理化性质以及数据与参考文献[16]相符,可以确定化合物10为5-羟基-3,4-二氢-2-喹啉酮。
化合物11为白色颗粒,C9H9NO2;ESI-MS:[M+H]+,m/z 164.068 7,[M-H]-,m/z 162.056 6;1H-NMR(600 MHz,DMSO-d6)δ:9.83(1H,brs,-OH),8.80(1H,s,-NH),6.75(1H,dd,J=7.8,7.2 Hz,H-6),6.70(1H,d,J=7.8 Hz,H-7),6.63(1H,d,J=7.2 Hz,H-5),2.83(2H,t,J=7.2 Hz,H-4),2.43(2H,t,J=7.8 Hz,H-3);13C-NMR(150 MHz,DMSO-d6)δ:170.0(C-2),144.4(C-8),126.3(C-9),125.2(C-10),122.6(C-6),118.7(C-5),114.1(C-7),31.1(C-3),25.5(C-4)。以上理化性质以及数据与参考文献[17]相符,可以确定化合物11为8-羟基-3,4-二氢-2-喹啉酮。
化合物12为白色结晶,C9H9NO;ESI-MS:[M+H]+,m/z 148.073 1;1H-NMR(600 MHz,DMSO-d6)δ:10.05(1H,brs,-NH),7.15(1H,d,J=7.8 Hz,H-5),7.12(1H,dd,J=7.8,7.8 Hz,H-7),6.91(1H,dd,J=7.8,7.8 Hz,H-6),6.87(1H,d,J=7.8 Hz,H-8),2.86(2H,t,J=7.8 Hz,H-4),2.44(2H,t,J=7.8 Hz,H-3);13C-NMR(150 MHz,DMSO-d6)δ:170.7(C-2),138.8(C-9),128.2(C-10),127.5(C-8),124.0(C-7),122.4(C-6),115.5(C-5),30.9(C-3),25.3(C-4)。以上理化性质以及数据与参考文献[15]相符,可以确定化合物12为3,4-二氢-2-喹啉酮。
4 讨论自由基性质不稳定、活性强,机体受内、外环境影响而产生大量的自由基损伤组织细胞的结构和功能,被认为是引起机体衰老、诱发肿瘤等疾病的重要原因[18]。研究表明,美洲大蠊抗衰老活性部位提取物对DPPH自由基具有较好的清除作用[19],而美洲大蠊抗肿瘤活性成分对DPPH自由基的清除率也具有明显的浓度依赖性[20]。但美洲大蠊的活性成分尚不明确,相关化学成分研究多集中于小分子肽、氨基酸和短链脂肪酸[21-23]。本研究以美洲大蠊粪便为研究对象,在明确其提取物具有明显的DPPH自由基清除作用的基础上,从中分离并鉴定了12个化合物,并且多为喹啉酮类化合物,文献报道的此类化合物主要为化学合成产物,天然产物报道较少。该研究为美洲大蠊的深入研究以及合理开发提供了基础数据。
| [1] |
孙星衍. 神农本草经[M]. 北京: 商务印书馆, 1955: 90. SUN X Y. Sheng Nong's herbal classic[M]. Beijing: The Commercial Press, 1955: 90. |
| [2] |
REN P, YANG W, WANG D, et al. Kangfuxinye enema combined with mesalamine for ulcerative colitis: asystematic review and GRADE approach[J]. Evidence-Based on Complementary Alternative, 2017, 20(17): 1-15. |
| [3] |
GAO J Y, JIANG Y L, NIU L L, et al. Novel isoflavone from the cockroach Periplaneta americana[J]. Chemistry Natural Compounds, 2016, 52(3): 413-416. DOI:10.1007/s10600-016-1661-0 |
| [4] |
ZENG C, LIAO Q, HU Y, et al. The role of Periplaneta americana (Blattodea: Blattidae) in modern versus traditional Chinese medicine[J]. Journal of Medical Entomology, 2019, 56(6): 1522-1526. DOI:10.1093/jme/tjz081 |
| [5] |
何正春, 彭芳, 宋丽艳, 等. 美洲大蠊化学成分及药理作用研究进展[J]. 中国中药杂志, 2007, 32(21): 2326-2331. HE Z C, PENG F, SONG L Y, et al. Review on investigations related to chemical constituents and biological activities of Periplaneta americana[J]. China Journal of Chinese Materia Medica, 2007, 32(21): 2326-2331. DOI:10.3321/j.issn:1001-5302.2007.21.031 |
| [6] |
ZHANG J, ZHANG Y, LI J. Midgut transcriptome of the cockroach Periplaneta americana and its microbiota: digestion, detox et al. ification and oxidative stress response[J]. Plos One, 2016, 11(5): e155254. |
| [7] |
梁文娟, 马青云, 蒋合众, 等. 红毛丹果壳的化学成分研究[J]. 中草药, 2011, 42(7): 1271-1275. LIANG W J, MA Q Y, JIANG H Z, et al. Chemical constituents from hulls of Nephelium lappaceum[J]. Chinese Traditional and Herbal Drugs, 2011, 42(7): 1271-1275. |
| [8] |
尹伟, 宋祖荣, 刘金旗, 等. 桂花的化学成分研究[J]. 中国中药杂志, 2015, 40(4): 679-685. YIN W, SONG Z R, LIU J Q, et al. Chemical constituents of Osmanthus fragrans[J]. China Journal of Chinese Materia Medica, 2015, 40(4): 679-685. |
| [9] |
王晓良, 陈明华, 王芳, 等. 板蓝根水提取物的化学成分研究[J]. 中国中药杂志, 2013, 38(8): 1172-1182. WANG X L, CHEN M H, WANG F, et al. Chemical consitituents from root of Isatis indigotica[J]. China Journal of Chinese Materia Medica, 2013, 38(8): 1172-1182. |
| [10] |
CABALLERO J, MUNOZ C, ALZATE M J H, et al. Synthesis, in silico, in vitro, and in vivo investigation of 5-[11C] methoxy-substituted sunitinib, a tyrosine kinase inhibitor of VEGFR-2[J]. European Journal of Medical Chemistry, 2012, 58(2): 272-280. |
| [11] |
SHRADER W D, CELEBUSKI J, KLINE S J, et al. Synthesis of a novel hexadentate chelating agent based on 8-hydroxyquinoline[J]. Tetrahedron Letters, 1988, 29(12): 1351-1354. DOI:10.1016/S0040-4039(00)80294-4 |
| [12] |
WANG T, CHEN Y, LEE K, et al. Lewis acid catalyzed reaction of Cinnamanilides: competition of intramolecular and intermolecular Friedel-Crafts reaction[J]. Synthesis, 1997, 19(1): 87-90. |
| [13] |
孙莉, 孙会, 吕雪皓, 等. 在离子液体中6-羟基-2(1H)喹啉酮的合成及反应性研究[J]. 有机化学, 2007, 27(12): 1577-1581. SUN L, SUN H, LYU X H, et al. Synthesis and reactions of 6-Hydroxy-2 (1H)-quinolin-2-one in ionic liquid[J]. Chinese Journal of Organic Chemistry, 2007, 27(12): 1577-1581. |
| [14] |
杨萨娜. 光促进锌催化2-喹啉酮类化合物的合成[D]. 大连: 大连理工大学, 2018. YANG S N. Photoinduced Zinc-Catalyzed Synthesis of 2-Quinolinone derivatives[D]. Dalian: Journal of Dalian University of Technology, 2018. |
| [15] |
CHEN L, WANG T C, CHEN Y L, et al. Aluminium chloride-catalyzed intermolecular vs intramolecular friedel-crafts reaction of acrylanilides and 3-Chloropropanamides[J]. Journal of the Chinese Chemical Society, 2000, 47(1): 155-162. DOI:10.1002/jccs.200000018 |
| [16] |
周婉珍. 含氮稠杂环药物及其中间体合成的研究[D]. 杭州: 浙江工业大学, 2004. ZHOU W Z. Study on synthesis of nitrogenous polyheterocyclic com-pounds and its intermediates[D]. Hangzhou: Journal of Zhejiang University of Technology, 2004. |
| [17] |
袁征, 李国玉, 曾毅梅, 等. 丹参酚酸B的代谢产物研究[J]. 中国现代中药, 2008, 10(12): 29-31, 51. YUAN Z, LI G Y, ZENG Y M, et al. Studies on the metabolites of Salvianolic Acid B[J]. Modern Chinese Medicine, 2008, 10(12): 29-31, 51. DOI:10.3969/j.issn.1673-4890.2008.12.009 |
| [18] |
HARMAN D. Aging: atheory based on free radical and radiation chemistry[J]. Journal of Gerontology, 1956, 11(3): 298-300. DOI:10.1093/geronj/11.3.298 |
| [19] |
焦春香, 张成桂, 刘光明, 等. 美洲大蠊提取物中抗衰老活性部位抗氧化活性的初步分析[J]. 时珍国医国药, 2011, 22(6): 1389-1391. JIAO C X, ZHANG C G, LIU G M, et al. Preliminary analysis of antioxidant activity of anti-aging active parts in extracts of Periplaneta americana[J]. Lishizhen Medicine and Materia Medica Research, 2011, 22(6): 1389-1391. |
| [20] |
张成桂, 何正春, 焦春香, 等. 美洲大蠊抗癌活性成分体外抗氧化活性分析[J]. 时珍国医国药, 2010, 21(9): 2249-2250. ZHANG C G, HE Z C, JIAO C X, et al. Analysis of antioxidant activity of anti-cancer active components of Periplaneta americanain vitro[J]. Lishizhen Medicine and Materia Medica Research, 2010, 21(9): 2249-2250. DOI:10.3969/j.issn.1008-0805.2010.09.058 |
| [21] |
李旸, 王芳, 张普照, 等. 美洲大蠊化学成分研究[J]. 中药材, 2015, 38(10): 2038-2041. LI Y, WANG F, ZHANG P Z, et al. Chemical constituents from Periplaneta americana[J]. Journal of Chinese Medicinal Materials, 2015, 38(10): 2038-2041. |
| [22] |
高允, 梁柳春, 王瑞, 等. 美洲大蠊化学成分的研究[J]. 中成药, 2018, 40(2): 375-378. GAO Y, LIANG L C, WANG R, et al. Chemical constituents from Periplaneta americana[J]. Chinese Traditional Patent Medicine, 2018, 40(2): 375-378. DOI:10.3969/j.issn.1001-1528.2018.02.025 |
| [23] |
司金光, 张涛, 李凌宇, 等. 美洲大蠊的化学成分研究[J]. 中国药学杂志, 2018, 53(3): 178-181. SI J G, ZHANG T, LI L Y, et al. Chemical constituents from Periplaneta americana[J]. Chinese Pharmaceutical Journal, 2018, 53(3): 178-181. |
 2021, Vol. 38
2021, Vol. 38