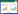文章信息
- 王立新, 张彤, 刘秀婵, 王毅
- WANG Lixin, ZHANG Tong, LIU Xiuchan, WANG Yi
- 雷公藤甲素对RA患者T-bet/GATA3及CXCL10/CXCR3表达的影响
- Effect of triptolide on the expression of T-bet/GATA3 and CXCL10/CXCR3 in rheumatoid arthritis patients
- 天津中医药, 2021, 38(8): 1071-1076
- Tianjin Journal of Traditional Chinese Medicine, 2021, 38(8): 1071-1076
- http://dx.doi.org/10.11656/j.issn.1672-1519.2021.08.25
-
文章历史
- 收稿日期: 2021-02-27
类风湿关节炎(RA)是一种以关节炎、滑膜增生和骨质破坏为特征的慢性自身免疫性疾病,受累滑膜组织中常有大量淋巴细胞和巨噬细胞浸润,其中T细胞在RA的发病中处于中心地位[1]。雷公藤是治疗关节肿痛的传统中药,是治疗RA药物中疗效得到肯定的单味中药。雷公藤及其提取物对RA的调节机制主要涉及对T淋巴细胞、B淋巴细胞、巨噬细胞、树突状细胞以及多种细胞因子表达的影响[2]。雷公藤甲素(TP)是从雷公藤中分离获得的最主要的抗炎、免疫抑制活性成分[3]。研究显示TP可以降低T细胞对多种细胞因子如白细胞介素(IL)-2、干扰素-γ(IFN-γ)、IL-4、肿瘤坏死因子-α(TNF-α)、IL-17等的分泌,以及抑制T细胞增殖分化从而缓解RA炎症反应[4]。从Th1相关的基因调控和趋化因子表达等方面考察TP的作用机制还值得深入探索和研究。
T-bet和GATA3分别是Th1/Th2细胞的转录因子[5],Th1细胞分泌的IFN-γ通过JAK1/JAK2信号途径激活、诱导T-bet基因表达,而T-bet又可以诱导Th1分化继续产生IFN-γ,形成正反馈环路。与T-bet作用相反,GATA3促进Th0向Th2细胞分化,这两个基因参与Th1/Th2细胞分化平衡[6]。此外,IFN-γ诱导的趋化因子(CXCL)10通过CXCL受体3(CXCR3)介导活化T细胞,尤其是Th1细胞迁移[7-8]。在RA患者的血清、滑液(SF)和滑膜组织(ST)中,CXCL10表达水平升高,因此CXCL10升高也成为宿主发生免疫反应,尤其是Th1细胞主导的免疫反应发生的标志[9]。与CXCL9和CXCL11相比,CXCL10与CXCR3亲和力更高,CXCL10不仅对T细胞的发育、迁移、黏附起着重要作用,还能活化单核细胞及自然杀伤细胞参与自身免疫疾病的发生过程[10]。以CXCL10/CXCR3为靶标调节免疫细胞的活化和定位用于RA治疗的研究也取得一定进展[11]。
TP对IFN-γ表达具有明确的抑制作用,但TP对RA患者的免疫调节是否也会影响T-bet/GATA3和CXCL10/CXCR3的表达值得探索。本研究欲通过CD3抗体诱导活化RA患者T细胞,在分析TP对Th1、Th2细胞分化及相关细胞因子分泌影响基础上,进一步考察TP对T-bet/GATA3以及CXCL10/CXCR3表达的影响,旨在为TP治疗RA的作用机制进行更深入的补充。
1 材料与方法 1.1 材料、主要试剂及仪器 1.1.1 临床资料本研究经天津市天津医院伦理委员会审核通过(2019医伦审103号),所有研究对象均签署知情同意书。选取2019年11月—2020年1月在天津市天津医院感染风湿免疫科就诊的21例RA患者作为研究对象,其中女性16例,男性5例。患者年龄为17~89岁,平均年龄(56.15±17.66)岁,诊断参照美国风湿病学会(ACR)/欧洲抗风湿病联盟(EULAR)2009年RA诊断标准。
1.1.2 试剂和仪器GT-T551无血清培养基购自Takara公司,重组人IL-2(rhIL-2)购自北京双鹭药业股份有限公司,TP购自成都曼思特生物科技有限公司,人外周血淋巴细胞分离液购自天津市灏洋生物制品科技有限公司,CCK-8试剂盒购自东仁化学科技(上海)有限公司,cDNA合成试剂盒、微量样本总RNA提取试剂盒、荧光定量检测试剂盒均购自天根生化科技有限公司。anti-human CD3抗体、异硫氰酸荧光素(FITC)anti-human CD4抗体、PE anti-human IL-4、APC anti-human IFN-γ、PerCP-Cy5.5 anti-human CXCR3、细胞固定剂、破膜剂、1 000×布雷菲德菌素A(BFA)均购自Biolegend公司。L929成纤维细胞由中国医学科学院生物医学工程研究所提供,Luminex细胞因子检测试剂由国典医药提供,引物合成由上海生工提供。倒置显微镜型号为Olympus CKX41SF,流式细胞仪型号为美国BD Calibur,聚合酶链反应(PCR)扩增仪型号为美国伯乐CFX-96,Luminex检测仪器型号为Luminex 200,酶标仪型号为奥地利Tecan Sunrise。
1.2 实验方法 1.2.1 考察TP细胞毒性本研究选取体外细胞毒性分析模型细胞L929评价TP的细胞毒性。取对数生长期的L929细胞,以1×104个/mL密度接种于96孔板,实验分为空白组(单纯培养基)、对照组(TP浓度为0 nmol/L)、实验组(TP浓度分别为2.5、5、10、25和50 nmol/L),每组5个复孔,分别培养48、72 h。去掉培养上清,用磷酸缓冲盐溶液(PBS)洗涤细胞两遍,每孔加入含有10%的CCK-8新鲜培养基100 μL,37 ℃、5%二氧化碳(CO2)孵育2 h,采用酶标仪检测450 nm的吸光度(A)值。细胞存活率= [(As-Ab)/(Ac-Ab)]×100%,其中As为实验孔(细胞+TP),Ac为对照孔(细胞),Ab为空白孔(单纯培养基)。
1.2.2 TP对RA患者单个核细胞(PBMC)增殖活性的影响收集10 mL肝素抗凝全血,无菌条件下与PBS缓冲液1∶1混合,将细胞悬液缓慢转移至等体积的淋巴细胞分离液上层,室温条件下490×g离心30 min。吸取中间白膜层单个核细胞,用10倍体积PBS洗涤(490×g,离心10 min)两遍。用含1%双抗、1 000 U rhIL-2的GT-T551培养基调整细胞浓度为1×106个/mL,每孔200 μL接种于CD3单抗(0.5 μg/mL)包被的96孔板中,分为对照组(TP浓度0 nmol/L)、实验组(TP浓度分别为2.5、5nmol/L),每组4个复孔。在37 ℃、5% CO2条件下培养48 h后,用CCK-8检测细胞增殖情况。
1.2.3 流式细胞仪检测Th、Th1、Th2细胞亚群变化和CXCR3表达情况取培养48 h的PBMC细胞,向培养孔内加入终浓度为1×BFA,在37 ℃条件下孵育4 h,用于阻止细胞内因子的释放。离心收集细胞并用PBS洗涤(350×g离心5 min)两遍。每组分别加入FITC anti-human CD4和PerCP-Cy5.5 anti-human CXCR3抗体各5 μL,室温避光孵育20 min;1 mL PBS洗涤两遍后,加入0.5 mL固定液室温避光固定20 min;PBS洗涤两遍后加入1×破膜剂1 mL重悬细胞,350×g离心5 min,重复2次。最后分别加入5 μL的PE anti-human IL-4和APC anti-huma IFN-γ抗体,室温避光孵育20 min,PBS洗涤后置于流式细胞仪检测。
1.2.4 Luminex检测细胞因子表达水平收集PBMC细胞培养上清,分别取50 μL标准品和待测样本,各加入50 μL抗体标记微球,铝箔纸封板,(800±50)r/min震荡条件下室温孵育2 h;洗板两次,在所有孔中加入50 μL的Biotin-检测抗体,室温条件下震荡避光孵育1 h;洗板两次,在所有孔中加PE-链霉亲和素,50 μL/孔,室温条件下震荡避光孵育0.5 h。在所有孔中加100 μL洗液,室温震荡2 min使微球悬浮,在Luminex 200仪器上检测。
1.2.5 实时荧光定量PCR(RT-qPCR)检测基因表达变化离心收集培养的PBMC细胞沉淀,PBS洗涤后按照试剂盒说明书提取样本RNA;用反转录试剂盒37 ℃水浴60 min,将RNA反转录为cDNA模板。引物序列检索自Primerbank,使用Pubmed blast分析引物的特异性。具体序列见表 1。检测T-bet、GATA3、CXCL10和CXCR3基因的表达情况,内参基因为GAPDH。每个样本重复检测3次。

|
数据采用Graphpad Prism 8.0软件进行处理,实验结果以均数±标准差(x±s)表示,多组间比较采用单因素方差分析,多个实验组与对照组之间的两两比较采用Dunnett法,P<0.05为差异有统计学意义。
2 结果 2.1 TP细胞毒性考察在TP浓度 < 2.5nmol/L,培养48 h条件下对L929细胞存活率没有影响(P>0.05),当浓度升高到50 nmol/L时,细胞存活率为(90.93±2.56)%。随着作用时间延长至72 h,TP浓度在10 nmol/L以上时,细胞存活率降低至90%以下,见图 1。以上结果表明浓度在25 nmol/L以内,药物作用时间为48 h时TP无显著细胞毒性(P>0.05)。后续实验在此培养时间及安全剂量范围内进行。
|
| 注:A. 培养48 h;B. 培养72 h;与TP浓度0 nmol/L比较,*P < 0.05,#P < 0.01。 图 1 TP对L929细胞存活率的影响(x±s,n=5) Fig. 1 Effect of TP on L929 cell survival rate (x±s, n=5) |
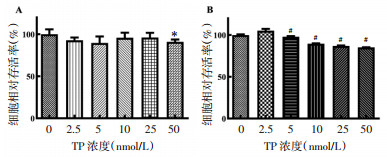
经CD3抗体刺激培养48 h后,细胞形成显著增殖团,显示出CD3抗体可以有效刺激PBMC细胞增殖,见图 2。经CCK-8检测,TP浓度为2.5 nmol/L和5 nmol/L时,PBMC细胞存活率受到显著抑制(P<0.05),两组细胞存活率分别为(82.7±27.57)%、(55.76±21.99)%,并且TP对PBMC细胞的增殖抑制作用具有显著的剂量依赖性。见图 3。

|
| 注:A. 无CD3抗体刺激;B. CD3抗体刺激。 图 2 倒置显微镜观察PBMC细胞增殖情况(×50) Fig. 2 Inverted microscope observation of the cell proliferation of PBMC (×50) |
|
| 注:与TP浓度0 nmol/L比较,*P < 0.001。 图 3 不同实验条件下PBMC细胞存活率比较(x±s,n=4) Fig. 3 Comparison of survival rate of PBMC in different experimental condition(x±s, n=4) |
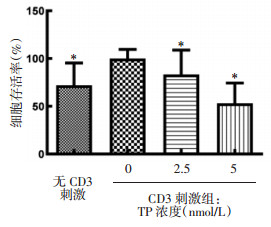
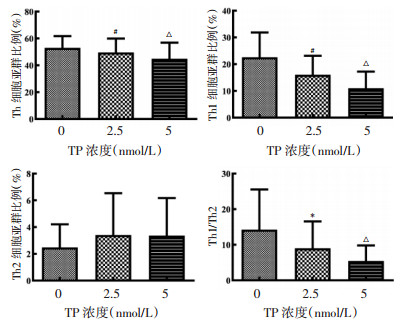
实验组在TP浓度为2.5和5 nmol/L时细胞亚群比例分别为(47.17±10.34)%和(44.91±11.89)%,均低于对照组Th细胞亚群比例[(51.34±8.75)%],两组与对照组比较差异具有统计学意义(P<0.01或P < 0.001),且Th1细胞亚群受抑制程度高于Th细胞亚群,相反Th2细胞亚群有升高趋势,但与对照组比较差异无统计学意义(P>0.05)。而Th1与Th2比值在TP调节下显著降低(P<0.05或P < 0.001),见图 4。以上结果提示,TP可以抑制Th、Th1细胞增殖,降低Th1与Th2比值来调节Th1和Th2亚群比例,减少促炎细胞。本研究结果提示TP可能会提高Th2细胞亚群比例,进而抑制Th1细胞的炎症反应发挥对RA的免疫调节作用。
|
| 注:与TP浓度0 nmol/L比较,*P < 0.05,#P < 0.01,△P < 0.001。 图 4 TP对Th细胞及Th1和Th2细胞亚群的影响(x±s) Fig. 4 Effect of TP on Th, Th1 and Th2 cell subpopulation (x±s) |
表达CXCR3受体的细胞亚群在TP作用下比例显著降低(P < 0.05),且TP对CXCR3+细胞亚群的抑制同样具有剂量依赖性,见图 5。CXCR3通过与CXCL9、CXCL10、CXCL11等因子相互作用引导炎症细胞向炎症部位趋化,参与RA疾病的发生、发展,因此抑制CXCR3受体表达同样可以减少免疫细胞向炎症部位聚集。
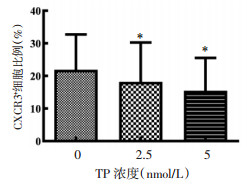
|
| 注:与TP浓度0 nmol/L比较,*P < 0.05。 图 5 TP对CXCR3受体表达的影响(x±s) Fig. 5 Effect of TP on the expression of CXCR3 (x±s) |
本研究中除TNF-α外,TP对其余细胞因子的表达抑制作用均具有剂量依赖性,见图 6。在考察的细胞因子中不仅包括促炎因子,也包括抗炎因子。由此可见TP对细胞因子表达的抑制作用是非特异性的,显示出TP具有很强的抑制细胞因子表达的作用。对于TNF-α,当TP浓度为2.5 nmol/L时可以显著降低TNF-α表达水平,随着浓度升高为5 nmol/L时,TNF-α浓度与对照组比较无统计学差异(P>0.05)。在此浓度下,PBMC细胞存活率显著降低,因此TNF-α表达没有变化可能是TP对免疫细胞活性抑制所致。随着TP浓度升高,在表现出抑制作用的同时,也会对免疫细胞产生一定毒性。
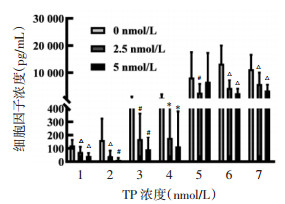
|
| 注:1. IL-4;2. IL-10;3. IL-17;4. CXCL10;5. TNF-α;6. IFN-γ;7. IL-6;与TP浓度0 nmol/L比较,*P < 0.05,#P < 0.01,△P < 0.001。 图 6 TP对细胞因子表达的影响(x±s) Fig. 6 Effect of TP on the expression of cytokines (x±s) |
与对照组比较,两个浓度的TP对T-bet和GATA3基因表达及T-bet/GATA3比值均无影响(P > 0.05),所以在本研究中并未观察到TP对这两种基因表达的调节作用。
CXCL10的基因相对表达量在TP浓度为5 nmol/L时受到了抑制(P < 0.05),见图 7,这与其蛋白表达水平变化趋势一致,并且CXCL10蛋白表达受IFN-γ诱导,在TP作用下IFN-γ表达显著下降,也可能是诱导CXCL10表达降低的原因之一。
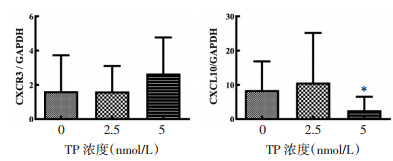
|
| 注:与TP浓度0 nmol/L比较,*P < 0.05。 图 7 TP对CXCR3和CXCL10基因表达的影响(x±s) Fig. 7 Effect of TP on the expression of CXCR3, CXCL10 (x±s) |
RA是一种以滑膜炎症为主的慢性自身免疫性疾病。中药雷公藤具有活血化瘀、去湿止痛的作用,是治疗关节肿痛的传统药物,TP是其最主要的抗炎与免疫抑制活性成分[12]。本研究通过体外实验,从细胞、细胞因子和基因水平分别考察了TP对RA患者PBMC的调节作用。低浓度TP对L929细胞没有毒性,但对活化的PBMC细胞增殖具有剂量依赖的抑制作用,这与之前报道TP治疗窗口窄、毒性大相一致[13]。
Th1和Th2免疫反应失衡是RA发病的重要原因[14]。分泌IL-2、TNF-α、IFN-γ等促炎细胞因子的效应细胞Th1在TP作用下百分比降低,然而Th2细胞没有受到显著调节,因此并未观察到TP抑制Th1同时会促进Th2细胞的特异性调节作用。这种现象可能与药物剂量、作用时间以及免疫微环境中细胞因子、趋化因子等的影响相关,有待进一步研究。Th1/Th2比值显著降低,表明TP可以减少PBMC中效应细胞比例从而缓解RA中的炎症反应。
TNF-α和IL-6被认为是RA滑膜细胞因子网络的中心枢纽[15],TNF-α不仅会诱导Th1型细胞因子的大量产生,使Th1/Th2细胞的比例进一步失调,也能诱发关节结构和软骨的破坏,参与滑膜炎症反应[16]。现有研究报道靶向TNF-α和IL-6的中和抗体可以有效抑制滑膜炎症反应[17],因此对TNF-α和IL-6表达的抑制也是TP参与RA免疫调节的重要机制。具有免疫调节作用的IL-4可以诱导巨噬细胞向M2型转化,促进IL-10分泌,并可以将细胞毒T细胞(CTL)转化为分泌IL-4的无细胞毒性细胞,抑制IFN-γ的表达[18]。尽管IL-4和IL-10作为抗炎因子可以协同抑制Th1细胞分化,减少相关炎症因子的分泌及炎性细胞浸润[15],但本研究中这两种细胞因子在TP作用下表达水平同时降低,可能是因为TP使具有调节作用的如Th2、Treg等免疫细胞活性受到抑制所致。
CXCR3与CXCL10主要参与调节T细胞、NK细胞和巨噬细胞的迁移、分化与激活。CXCR3是体内分泌IFN-γ的Th1细胞所必需的[19]。抗CXCR3抗体AMG487可以降低RA CIA小鼠体内Th1、Th17以及Th22细胞百分比并提高Treg细胞比例[20]。CXCL10可与表达在T细胞表面的CXCR3受体结合促进其活化并向Th1细胞方向分化,在炎症细胞向滑膜组织迁移及活化过程中发挥了关键作用[21]。Lee等[7]研究强调了CXCL10在RA发病机制中的重要性,并提供了先前尚未确定的CXCL10促进关节炎发展机制的细节。因此TP对CXCL10和CXCR3表达的抑制,可以进一步缓解Th1介导的炎症反应,也丰富了其对RA免疫调节的作用机制。
与Th1和Th2细胞分化相关的T-bet和GATA3基因[22]表达没有显著变化,一方面可能是经TP抑制后表达该基因的细胞活性降低,或者由于这两种基因具有复杂多样的生物学功能,如T-bet不仅是Th1型免疫的关键调节因子,在T淋巴细胞、B淋巴细胞、树突状细胞、NK细胞效应细胞的建立和维持中也发挥着极其重要的作用[23]。而GATA3基因也会调控Treg细胞的分化[24],因此在TP作用下并未体现出明显变化。
本研究显示TP对RA具有显著且广泛的非特异性免疫抑制作用。与体外培养细胞系不同,实验中各组样本间统计数据相对离散,正如李彦等[25]对雷公藤肝毒性的评价所述,造成这种现象的原因与每个个体免疫状态、对药物的敏感性以及基因表达差异有关。因此TP作为临床用药还需进一步提高其靶向性,降低毒副作用,如何用于RA临床治疗还有很大研究空间。
| [1] |
COPE A P, SCHULZE K H, ARINGER M. The central role of T cells in rheumatoid arthritis[J]. Clinical and Experimental Rheumatology, 2007, 25(12): 4-11. |
| [2] |
LI J M, JIANG Q, TANG X P, et al. Study advances in regulation effect of Tripterygium wilfordii and its extracts on innate immune system in rheumatoid arthritis cases[J]. China Journal of Chinese Materia Medica, 2019, 44(16): 3384-3390. |
| [3] |
YUAN K, LI X, LU Q, et al. Application and mechanisms of Triptolide in the treatment of inflammatory diseases: a review[J]. Frontiers in Pharmacology, 2019, 10(5): 1469-1481. |
| [4] |
李清宋, 邓晓霞, 林色奇, 等. 雷公藤甲素治疗类风湿关节炎作用机制研究进展[J]. 江西中医药, 2015, 65(6): 73-76. LI Q S, DENG X X, LIN S Q, et al. Research progress on the mechanism of triptolide in the treatment of rheumatoid arthritis[J]. Jiangxi Journal of Traditional Chinese Medicine, 2015, 65(6): 73-76. |
| [5] |
KAWASHIMA M, MIOSSEC P. mRNA quantification of T-bet, GATA-3, IFN-gamma, and IL-4 shows a defective Th1 immune response in the peripheral blood from rheumatoid arthritis patients: link with disease activity[J]. Journal of Clinical Immunology, 2005, 25(3): 209-214. DOI:10.1007/s10875-005-4092-4 |
| [6] |
谢娟, 任明山. T-bet对免疫细胞分化的调节及其与自身免疫病的关系[J]. 安徽医药, 2009, 13(2): 12-14. XIE J, REN M S. Transcription factor T-bet in immunocyte and autoimmune diseases[J]. Anhui Medical and Pharmaceutical Journal, 2009, 13(2): 12-14. |
| [7] |
LEE J H, KIM B, JIN W J, et al. Pathogenic roles of CXCL10 signaling through CXCR3 and TLR4 in macrophages and T cells: relevance for arthritis[J]. Arthritis Research & Therapy, 2017, 19(1): 1-14. |
| [8] |
RAHIMI R A, LUSTER A D. Chemokines: critical regulators of memory T cell development, maintenance, and function[J]. Advances in Immunology, 2018, 13(8): 71-98. |
| [9] |
ANTONELLI A, FERRARI S M, GIUGGIOLI D, et al. Chemokine (C-X-C motif) ligand (CXCL)10 in autoimmune diseases[J]. Autoimmunity Reviews, 2014, 13(3): 272-280. DOI:10.1016/j.autrev.2013.10.010 |
| [10] |
MIEKE M, VINCENT V, RIK J, et al. Overview of the mechanisms that may contribute to the non-redundant activities of interferon-inducible CXC chemokine receptor 3 ligands[J]. Frontiers in Immunology, 2017, 8(5): 1970-1991. |
| [11] |
ASQUITH D L, BRYCE S A, NIBBS R J B. Targeting cell migration in rheumatoid arthritis[J]. Current Opinion in Rheumatology, 2015, 27(2): 204-211. DOI:10.1097/BOR.0000000000000150 |
| [12] |
DANPING F, QING Q G, JIA W S, et al. The effect of triptolide in rheumatoid arthritis: from basic research towards clinical translation[J]. International Journal of Molecular Sciences, 2018, 19(2): 376-393. DOI:10.3390/ijms19020376 |
| [13] |
ZHOU Z L, YANG Y X, DING J, et al. Triptolide: structural modifications, structure-activity relationships, bioactivities, clinical development and mechanisms[J]. Natural Product Reports, 2012, 29(4): 457-475. DOI:10.1039/c2np00088a |
| [14] |
WANG Z, ZHUO F, CHU P, et al. Germacrone alleviates collagen-induced arthritis via regulating Th1/Th2 balance and NF-κB activation[J]. Biochemical and Biophysical Research Communications, 2019, 518(3): 560-564. DOI:10.1016/j.bbrc.2019.08.084 |
| [15] |
ZHU C, ALINE B, ANDREAS R, et al. Anti-inflammatory and immune-regulatory cytokines in rheumatoid arthritis[J]. Nature Reviews Rheumatology, 2019, 15(1): 9-17. DOI:10.1038/s41584-018-0109-2 |
| [16] |
RADNER H, ALETAHA D. Anti-TNF in rheumatoid arthritis: an overview[J]. Wiener Medizinische Wochenschrift, 2015, 165(1-2): 3-9. DOI:10.1007/s10354-015-0344-y |
| [17] |
MCINNES I B, SCHETT G. Pathogenetic insights from the treatment of rheumatoid arthritis[J]. Lancet, 2017, 389(10): 2328-2337. |
| [18] |
BROWM M A, HURAL J. Functions of IL-4 and control of its expression[J]. Critical Review Immunology, 2017, 37(2-6): 181-212. DOI:10.1615/CritRevImmunol.v37.i2-6.30 |
| [19] |
GRIFFITH J W, SOKOL C L, LUSTER A D. Chemokines and chemokine receptors: positioning cells for host defense and immunity[J]. Annual Review of Immunology, 2014, 32(10): 659-702. |
| [20] |
BAKHEET S A, ANSARI M A, NADEEM A, et al. CXCR3 antagonist AMG487 suppresses rheumatoid arthritis pathogenesis and progression by shifting the Th17/Treg cell balance[J]. Cell Signal, 2019, 64(25): 109395-109405. |
| [21] |
PAPARO S R. Rheumatoid arthritis and the Th1 chemokine MIG[J]. Clinical Therapeutics, 2019, 170(6): e472-e477. |
| [22] |
GAGLIANI N, HUBER S. Basic aspects of T helper cell differentiation[J]. Methods in Molecular Biology, 2017, 15(14): 19-30. |
| [23] |
PRITCHARD G H, KEDL R M, HUNTER C A. The evolving role of T-bet in resistance to infection[J]. Nature Review Immunology, 2019, 19(6): 398-410. |
| [24] |
YU F, SHARMA S, EDWARDS J, et al. Dynamic expression of transcription factors T-bet and GATA-3 by regulatory T cells maintains immunotolerance[J]. Nature Immunology, 2015, 16(2): 197-206. |
| [25] |
李彦, 付滨, 梁丙楠. 雷公藤肝毒性作用机制研究进展[J]. 天津中医药, 2017, 34(5): 358-360. LI Y, FU B, LIANG B N. Research progress of liver toxicity mechanism in tripterygium[J]. Tianjin Journal of Traditional Chinese Medicine, 2017, 34(5): 358-360. |
 2021, Vol. 38
2021, Vol. 38