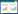文章信息
- 熊桅, 朱振刚, 刘超武, 狄冠麟
- XIONG Wei, ZHU Zhengang, LIU Chaowu, DI Guanlin
- 疏风通络方调控哮喘小鼠Eotaxin/CCR3通路相关因子的实验研究
- Experimental study of Shufeng Tongluo Decoction regulating Eotaxin/CCR3 pathway related factors in asthmatic mice
- 天津中医药, 2021, 38(9): 1185-1190
- Tianjin Journal of Traditional Chinese Medicine, 2021, 38(9): 1185-1190
- http://dx.doi.org/10.11656/j.issn.1672-1519.2021.09.20
-
文章历史
- 收稿日期: 2021-04-08
支气管哮喘(简称哮喘)作为一种复杂的慢性异质性气道疾患,在中国总体发病率为4.2%,患者已超过4 000万人,且发病率有逐年上升趋势[1],严重影响了人类健康。虽然哮喘发病机制尚未完全明确,但嗜酸性粒细胞(EOS)已被广泛接受为参与哮喘发病过程的重要细胞,一些证据表明,哮喘严重程度的加剧与呼吸道黏膜的持续性EOS增多及其产生的细胞因子等多种介质相关[2]。而EOS趋化因子(Eotaxin)-1(CCL11)、Eotaxin-2(CCL24)和Eotaxin-3(CCL26)同作为CC亚家族中的EOS活化趋化因子,三者具有相似的生物学作用,即通过与EOS表面的CC趋化因子受体3(CCR3)相结合,进而趋化并激活EOS。有研究证明,Eotaxin和CCR3的结合在哮喘炎症反应过程中发挥着重要作用,其可能参与EOS从骨髓游走至炎症器官的过程[3-4]。研究发现CCR3受体介导的经CCL11、CCL24诱导的人与小鼠嗜酸细胞活化需要特殊的信号转导通路,在CCL11或CCL24与细胞表面受体结合条件下,G蛋白αi亚基激活,并可能通过结合三磷酸鸟苷(GTP)偶联蛋白释放的β-γ亚基的方式激活磷酶肌醇3-激酶(PLK3),进一步激活其下游信号通路细胞外调节蛋白激酶(ERK)及丝裂原活化蛋白激酶(P38MAPK),并且用特异性的CCR3受体拮抗剂、G蛋白阻抑剂、PLK3、P38MAPK、ERK通路拮抗剂可以明显减少CCL11、CCL24诱导嗜酸细胞脱颗粒活性。
对于哮喘的治疗,现代医学以药物控制为主,而中医学以“若因风者,辛平解之”为原则[5]“疏风通络”为治法,常可取得显著疗效。前期研究发现,本科院内制剂疏风通络方不仅可以诱导EOS凋亡,从而减轻炎症反应,同时对哮喘大鼠肺组织中的EOS跨膜迁移具有干预作用[6-9]。基于对嗜酸细胞Eotaxin/CCR3通路的认识,本实验以Ga蛋白拮抗剂(PTX)、CCR3受体拮抗剂(SB328437)、PLK3蛋白拮抗剂(LY294002)、P38蛋白激酶拮抗剂(SB203580)、丝裂原活化细胞外信号调节激酶抑制剂(PD98059)作为阳性对照药,以观察疏风通络方对哮喘模型小鼠Eotaxin/CCR3通路各阶段相关因子的调控,探讨疏风通络方治疗哮喘的多靶点分子机制,并验正其可通过调控Eotaxin/CCR3通路抑制哮喘炎症,为临床应用疏风通络方治疗哮喘提供理论依据。
1 材料和方法 1.1 实验动物70只野生型、体质量为(20±2)g的SPF级雄性C57BL/6小鼠(北京维通利华实验动物公司),将所有小鼠置于中国医学科学院放射医学研究所动物中心饲养,采用标准的实验鼠饲料喂养,水和饲料均自由摄取,给予持续灯光照射12 h,保证室温和相对湿度适宜,适应性喂养1周后正式实验。
1.2 实验药物疏风通络方组成:蝉蜕6 g,地龙10 g,白僵蚕10 g,炙麻黄6 g,荆芥穗6 g,半夏10 g,杏仁10 g,黄芩10 g,丹参30 g,甘草6 g等,饮片批号:019010317958,将饮片制成规格为含生药4 g/mL浓缩液(天津中医一附院药厂制剂室)。
1.3 试剂与仪器卵白蛋白(美国Sigma-Aldrich公司),SB328437、LY294002、SB203580、PD98059、Anti-CCR3抗体(美国Abcam公司),普通RIPA裂解液、PBS缓冲液(北京索莱宝生物科技有限公司),PTX百日咳毒素(美国List Labs公司),氢氧化铝粉剂(天津天力生化有限公司),动物组织总RNA提取试剂盒[天根生化科技(北京)有限公司],0.1 mL PCR八联排管平盖(美国GENEBRICK公司),0.5 mL PCR管平盖(美国AXYGEN公司),PCR反转录试剂盒和PCR扩增试剂盒(美国GeneCopoeia公司),移液器(德国艾本德股份公司),电子天平、超净台、摇床、-80 ℃超低温冰箱(美国赛默飞世尔科技公司),高通量多样品组织研磨机(南京先欧仪器制造有限公司),荧光定量PCR仪(LightCycler 96)(天津华利源科技有限公司),通用SP检测试剂盒、Mayer苏木素染液(免疫组化)、ECL Plus超敏发光液、抗体稀释液(普通型)、小鼠CCL11 ELISA、小鼠CCL24 ELISA(南京建成生物工程研究所),Goat Anti-Rabbit IgG(H+L)Secondary Antibody、HRP Conjugate(武汉博士德生物工程有限公司),恒温培养振荡器(KHY-100)(湖南湘仪实验室仪器开发有限公司)超微量紫外可见分光光度计(美国DeNovix公司),BPX-162电热恒温培养箱(上海博迅医疗生物仪器股份有限公司),正置光学显微镜(BX43)(日本奥林巴斯株式会社)。
1.4 哮喘小鼠模型建立应用卵清蛋白吸入致敏激发法建立哮喘小鼠模型,分别于实验第0天与第14天腹腔注射致敏液(OVA)0.2 mL,从第24天开始将小鼠放于一自制密闭容器(20 cm×40 cm×50 cm)中,每日给予1次30 min的雾化吸入(2.5% OVA溶液20 mL),连续7 d,建立哮喘模型。
1.5 分组与给药将70只小鼠随机分为:空白对照组、哮喘模型组、疏风通络方低剂量组(简称中药低剂量组)、疏风通络方中剂量组(简称中药中剂量组)、疏风通络方高剂量组(简称中药高剂量组)、PTX组、SB328437组、LY294002组、SB203580组、PD98059组,每组各7只,中药组在第30天激发完毕后分别给予低剂量7.75 g/kg,中剂量15.5 g/kg,高剂量30 g/kg的疏风通络方0.2 mL灌胃,连续给药4 d,哮喘模型组给予同等剂量的生理盐水灌胃,拮抗剂组则在生理盐水灌胃基础上采用腹腔注射的方法给予相应拮抗剂0.2 mL。
1.6 组织取材与检测眼球放血处死小鼠,应用气管灌注固定法获取小鼠肺组织,将沿左肺门处斜形切取的2 mm肺叶经梯度乙醇脱水、二甲苯透明、石蜡包埋后制成石蜡切片以备免疫组化检测。以灭酶剪刀摘除右肺,置于灭酶冻存管保存于-80 ℃冰箱,留测CCL11、CCL24、CCR3基因表达及CCL11、CCL24含量。
1.7 聚合酶链式反应(RT-PCR)法检测肺组织中CCR3 mRNA、CCL11 mRNA、CCL24 mRNA含量将配制的25μL逆转录反应液短暂离心后置于37 ℃温育60 min,随后置于85 ℃孵育5 min。未纯化的逆转录产物,直接进行实时荧光PCR。引物序列见表 1,将试剂盒中的All-in-One TM qPCR Mix解冻、混匀、离心等处理后配置成qPCR预混液以用于qPCR反应,最后按3步法PCR程序开始qPCR反应。用Realtime-PCR定量分析软件自动生成扩增动力曲线和溶解曲线,以相对定量法分析数据,以2-ΔΔCt表示实验组目的基因相对于对照组的变化倍数,ΔΔCt=(Ct目的-Ct内参)处理组-(Ct目的-Ct内参)对照组。
小鼠肺组织切片常规脱腊至水,滴加稀释的一抗37 ℃孵育1 h左右,PBS液洗涤2 min×3次,并滴加Bio-羊抗小鼠/兔lgG工作液,20~37 ℃孵育30 min,PBS液洗涤2 min×3次,随后滴加链酶亲和素-POD工作液,20~37 ℃,30 min,接着应用二氨基联苯胺(DAB)溶液室温显色,镜下把反应时间控制在5~30 min之间,最后蒸馏水洗涤以终止反应,显微镜观察,判断标准是肺组织中CCR3阳性细胞胞浆呈棕黄色染色,随机选取4个高倍视野(10×40)免疫组化切片拍照,采用Image-Pro Plus 6.0图像分析系统测定采集的图像的平均光密度值。
1.9 酶联免疫吸附(ELISA)法检测肺组织中CCL11、CCL24含量切取肺组织后,称取30 mg肺组织,用匀浆器将肺组织匀浆充分、离心,仔细收集上清,分装后待检。空白孔:加显色剂A、B和终止液用于调零;标准品孔:每孔需加入稀释好的标准品50 μL;零孔:加入标准品/样品稀释液和生物素抗原工作液各50 μL;样品孔:加入样品和生物素抗原工作液各50 μL,随后进行孵育、洗涤、吸附、第2次孵育、第2次洗涤,最后将每孔先后加入显色剂A和B各50 μL,轻轻震荡混匀,放于37 ℃避光显色10 min后终止反应(此时可见蓝色立转黄色),以空白孔调零,在450 nm波长下,加终止液后10 min内依次检测各孔的吸光度(OD值),并根据浓度和OD值算出标准曲线的回归方程,用专用计算软件进行计算,使用ELISAcalc对其进行计算,拟合模型选用logistic曲线(四参数)。
1.10 统计学方法采用SPSS 24.0软件进行统计分析,实验数据采用均数±标准差(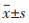
卵清蛋白致敏/激发法建立小鼠哮喘模型成功,小鼠肺组织病理切片特征符合支气管哮喘病理表现,即小鼠肺组织、肺泡结构破坏,支气管管腔变狭窄,肺组织中可见大量以嗜酸性粒细胞、淋巴细胞以及中性粒细胞为主的炎性细胞浸润,气管黏膜下可见组织水肿,皱襞增多等表现,哮喘模型病理切片见图 1。
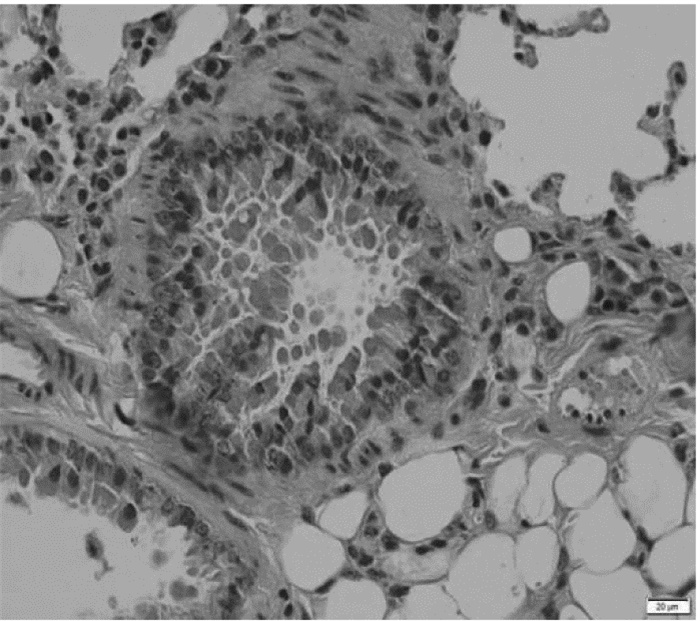
|
| 图 1 哮喘模型小鼠肺组织切片HE染色(×400) Fig. 1 HE staining of lung tissue sections of asthmatic mice(×400) |
模型组与空白对照组比较,CCR3基因表达水平明显升高,且两组间差异有统计学意义(P<0.01);各中药组和拮抗剂组分别与模型组比较,各中药组CCR3基因表达水平下降,差异有统计学意义(P<0.05),但各中药组组间比较差异无统计学意义,SB328437组CCR3基因表达水平下降明显,两组间差异具有统计学意义(P<0.01),而其他拮抗剂组CCR3基因表达水平差异无统计学意义(P>0.05)。见图 2。
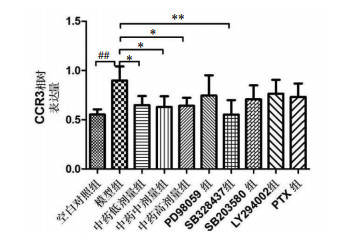
|
| 注:与模型组比较,*P<0.05,**P<0.01;与空白组比较,##P<0.01。 图 2 各组肺组织CCR3基因表达相对定量结果 Fig. 2 Relative quantitative results of CCR3 gene expression in lung tissue of each group |
模型组CCL11基因表达水平明显高于空白对照组,两组间差异具有统计学意义(P<0.01);与模型组比较,中药低剂量组CCL11基因表达明显下降,差异有统计学意义(P<0.01),中药中剂量组和中药高剂量组CCL11基因表达下降,差异有统计学意义(P<0.05),但各中药组组间比较差异无统计学意义;与模型组比较,SB328437组CCL11基因表达水平降低,两组间差异有统计学意义(P<0.05),而其他拮抗剂组CCL11基因表达水平差异无统计学意义(P>0.05)。见图 3。
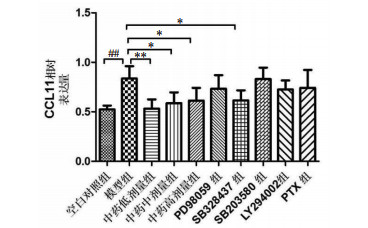
|
| 注:与模型组比较,*P<0.05,**P<0.01;与空白组比较,##P<0.01。 图 3 各组肺组织CCL11基因表达相对定量结果 Fig. 3 Relative quantitative results of CCL11 gene expression in lung tissue of each group |
模型组CCL24基因表达水平显著高于空白对照组,且两组间差异有统计学意义(P<0.05);经中药或拮抗剂干预,各中药组与拮抗剂组分别与模型组比较,CCL24基因表达水平虽均有下降趋势,但差异不具有统计学意义(P > 0.05)。见图 4。
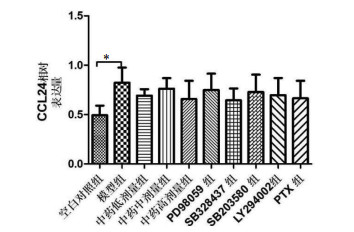
|
| 注:与空白组比较,*P<0.05。 图 4 各组肺组织CCL24基因表达相对定量结果 Fig. 4 Relative quantitative results of CCL24 gene expression in lung tissue of each group |
模型组CCR3含量明显高于空白对照组,两组间差异有统计学意义(P<0.01);经中药干预后,中药低、中、高剂量组CCR3含量不同,中药低剂量组CCR3含量明显低于模型组,差异有统计学意义(P<0.01),中药中剂量组CCR3含量有所下降,与模型组比较差异有统计学意义(P<0.05),但疏风通络方高剂量组与模型组比较差异无统计学意义(P>0.05);SB328437组与模型组比较CCR3含量下降,差异有统计学意义(P<0.05),其他拮抗剂组与模型组比较差异无统计学意义(P>0.05),具体数值见表 2。免疫组化染色,见图 5。
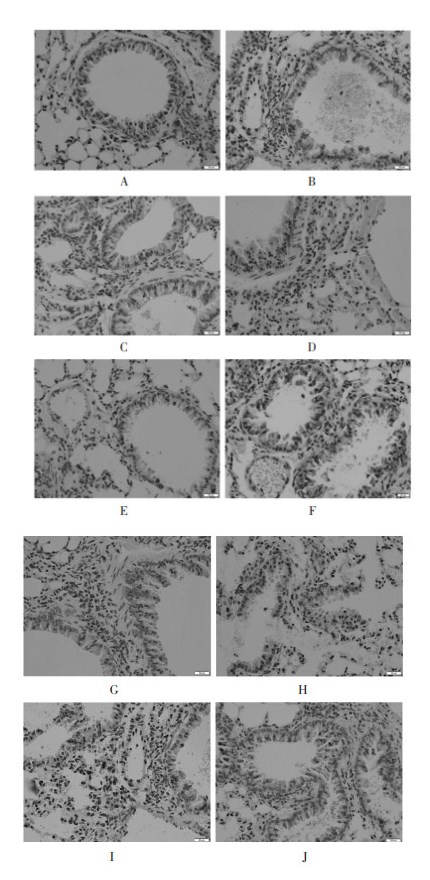
|
| 注:A. 空白对照组;B. 模型组;C. 中药低剂量组;D. 中药中剂量组;E. 中药高剂量组;F. SB328437组;G. SB203580组;H. PD98059组;I. LY294002组;J. PTX组。 图 5 各组肺组织CCR3免疫组化染色 Fig. 5 CCR3 immunohistochemical staining of lung tissue in each group |
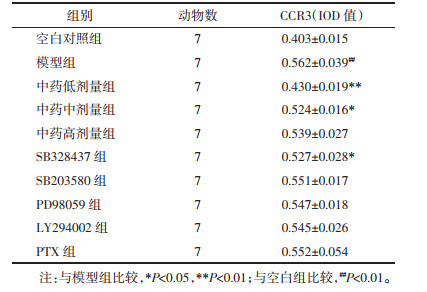
模型组与空白对照组比较,小鼠肺组织中CCL11含量明显升高,差异有统计学意义(P<0.01),CCL24含量也存在上升趋势,差异有统计学意义(P<0.05);经中药干预后,中药中剂量组CCL11与CCL24含量均有所下降,与模型组比较,差异有统计学意义(P<0.05),而其他中药组与模型组比较,差异无统计学意义(P>0.05);SB328437组CCL11含量与模型组比较明显下降,差异有统计学意义(P<0.01),CCL24含量与模型组比较也有所下降,差异有统计学意义(P<0.05),其他拮抗剂组与模型组比较,差异无统计学意义(P>0.05),具体数值见表 3。
哮喘是一种由多种气道炎性细胞、结构细胞及细胞组分参与的慢性异质性呼吸道疾患[10],其中嗜酸性粒细胞与哮喘的发病过程有着密切关系,当Eotaxin和EOS表面的CCR3结合后,可趋化并激活EOS,诱导气道炎症反应和气道高反应性的发生,从而引发喘息、气短、胸闷等症状。前期研究发现,疏风通络方治疗哮喘的机制可能是通过抑制哮喘模型Wistar大鼠肺组织EOS的跨膜迁移而发挥作用[9]。然而哮喘气道慢性炎症的病理生理改变是一个较为复杂的过程,其与多种信号通路相关,而Eotaxin/CCR3通路是参与这一过程的重要路径,因此研究疏风通络方调控哮喘小鼠该通路相关因子具有重要意义。本研究结果显示,疏风通络方具有降低哮喘模型小鼠肺组织中EOS趋化因子CCL11及其受体CCR3基因表达水平、减少哮喘模型小鼠肺组织中EOS趋化因子CCL11、CCL24及CCR3蛋白水平含量的作用,从而抑制EOS的迁移与活化,减少EOS在气道的浸润,达到控制哮喘气道炎症的疗效,进一步揭示了疏风通络方防治哮喘良好临床效果的分子机制。而Eotaxin/CCR3通路依赖嗜酸细胞趋化因子与细胞表面受体CCR3结合后激活G蛋白偶联的一系列信号转导和级联放大作用,通过PLK3通路并进一步激活其下游信号通路ERK及P38MAPK的磷酸化以促使EOS活化并脱颗粒。故在既往研究中,Eotaxin/CCR3通路各阶段拮抗剂均具有抑制嗜酸细胞活化作用,而本实验设计了PTX、SB328437、LY294002、SB203580、PD98059等拮抗剂作为疏风通络方的阳性对照药,比较了中药与相关拮抗剂对Eotaxin/CCR3通路相关因子含量与基因表达的影响。有趣的是,本实验发现疏风通络方中药组具有减少嗜酸细胞趋化因子及其受体含量和相应基因表达的作用,且与CCR3受体拮抗剂的作用类似,而Eotaxin/CCR3通路的下游阻断剂,如LY294002、SB203580、PD98059却没有表现出预期的抑制效应,具体原因还有待进一步研究。值得注意的是,本研究结果提示中药中低剂量组对CCL11、CCL24、CCR3水平有较好抑制作用,而中药高剂量组反而没有明显效果,这可能反映了中医药疗法需要在合适的剂量范围内才能发挥最优治疗作用,课题组下阶段将继续深入探索疏风通络方防治哮喘的量-效关系及药效学物质。
| [1] |
李为民, 罗汶鑫. 我国慢性呼吸系统疾病的防治现状[J]. 西部医学, 2020, 32(1): 1-4. LI W M, LUO W X. Progress in the prevention and treatment of chronic respiratory diseases[J]. Medical Journal of West China, 2020, 32(1): 1-4. DOI:10.3969/j.issn.1672-3511.2020.01.001 |
| [2] |
CHOI Y, SIM S, PARK H S. Distinct functions of eosinophils in severe asthma with type 2 phenotype: clinical implications[J]. The Korean Journal of Internal Medicine, 2020, 35(4): 823-833. DOI:10.3904/kjim.2020.022 |
| [3] |
王珏, 李竹英. 平喘颗粒对哮喘小鼠肺组织Eotaxin和CCR3表达的影响[J]. 中国中医急症, 2020, 29(11): 1955-1958. WANG J, LI Z Y. Effect of Pingchuan Granule on eotaxin and CCR3 expression in lung tissue of asthmatic mice[J]. Journal of Emergency in Traditional Chinese Medicine, 2020, 29(11): 1955-1958. DOI:10.3969/j.issn.1004-745X.2020.11.020 |
| [4] |
李小波, 张蓉映, 王斌梁, 等. 哮喘小鼠CD34+祖细胞和嗜酸性粒细胞的动态变化及其与CCR3/eotaxin表达的关系[J]. 中华全科医学, 2019, 17(8): 1261-1264, 1326. LI X B, ZHANG R Y, WANG B L, et al. Dynamic changes of CD34+ progenitor cells and eosinophils in asthmatic mice and their relationship with CCR3/eotaxin expression[J]. Chinese Journal of General Practice, 2019, 17(8): 1261-1264, 1326. |
| [5] |
葛阳涛. 苏黄止咳胶囊治疗咳嗽变异性哮喘(风咳)60例临床观察[D]. 北京: 北京中医药大学, 2015. GE Y T. Clinical observation on 60 cases of cough variant asthma(wind cough) treated with Suhuang Zhike Capsule[D]. Beijing: Beijing University of Chinese Medicine, 2015. |
| [6] |
刘文彬, 刘贵颖. 疏风通络方治疗支气管哮喘验案[J]. 河南中医, 2012, 32(5): 644. LIU W B, LIU G Y. Shufeng Tongluo Recipe in the treatment of bronchial asthma[J]. Henan Traditional Chinese Medicine, 2012, 32(5): 644. |
| [7] |
张慧琪, 刘贵颖, 尹新中, 等. 疏风通络方对哮喘大鼠不同时相外周血和肺泡灌洗液嗜酸细胞数量变化的影响[J]. 中华中医药学刊, 2013, 31(11): 2365-2368. ZHANG H Q, LIU G Y, YIN X Z, et al. Influence of Shufeng Tongluo Decoction on eosinophiis number in peripheral blood and bronchoalveolar lavage fluid of asthmatic bats at different phases[J]. Chinese Archives of Traditional Chinese Medicine, 2013, 31(11): 2365-2368. |
| [8] |
窦迎婷, 刘贵颖. 疏风通络方对哮喘大鼠外周血和肺泡灌洗液黏附分子ICAM-1和VCAM-1的影响[J]. 中国中医急症, 2013, 22(5): 693-695. DOU Y T, LIU G Y. Effects of Shufeng Tongluo Decoction on content of both VCAM-1 and ICAM-1 in peripheral blood and BALF of rats with asthma[J]. Journal of Emergency in Traditional Chinese Medicine, 2013, 22(5): 693-695. DOI:10.3969/j.issn.1004-745X.2013.05.002 |
| [9] |
刘贵颖, 张慧琪, 尹新中, 等. 疏风通络方对哮喘大鼠嗜酸细胞跨膜迁移相关因子VCAM-1/PI3K/Rac-1/NOX2/NOX4/SHP-2表达影响的研究[J]. 天津中医药, 2013, 30(3): 159-163. LIU G Y, ZHANG H Q, YIN X Z, et al. Influence of Shufeng Tongluo Prescription on expression of VCAM-1/PI3K/Rac-1/NOX2/NOX4/SHP-2 related factors in eosinophils transendothelia migration in lung of rats with asthma[J]. Tianjin Journal of Traditional Chinese Medicine, 2013, 30(3): 159-163. |
| [10] |
李建生, 王至婉. 支气管哮喘中医证候诊断标准(2016版)[J]. 中医杂志, 2016, 57(22): 1978-1980. LI J S, WANG Z W. Diagnostic criteria of TCM Syndromes of bronchial asthma(2016 Edition)[J]. Journal of Traditional Chinese Medicine, 2016, 57(22): 1978-1980. |
 2021, Vol. 38
2021, Vol. 38