文章信息
- 张玮, 李华南, 赵娜, 骆雄飞, 刘斯文, 陈英英, 包安, 王海腾, 海兴华, 王金贵
- ZHANG Wei, LI Huanan, ZHAO Na, LUO Xiongfei, LIU Siwen, CHEN Yingying, BAO An, WANG Haiteng, HAI Xinghua, WANG Jingui
- 腹部推拿对非酒精性脂肪肝病大鼠肠上皮细胞MLCK、P-MLC表达及P-MLC与F-actin共定位的影响
- Effect of abdominal tuina on the expression of MLCK, P-MLC and co localization of P-MLC and F-actin in intestinal epithelial cells in rats with non-alcoholic fatty liver disease
- 天津中医药, 2021, 38(9): 1191-1194
- Tianjin Journal of Traditional Chinese Medicine, 2021, 38(9): 1191-1194
- http://dx.doi.org/10.11656/j.issn.1672-1519.2021.09.21
-
文章历史
- 收稿日期: 2021-05-10
肠道黏膜通透性在非酒精性脂肪性肝病(NAFLD)的发病中起到关键作用,且通透性的高低与NAFLD的严重程度密切相关。目前,已有众多研究证实[1-3],以改善肠道黏膜通透性为干预靶点的治疗方法均可逆转和预防NAFLD的进一步发展。腹部推拿治疗NAFLD的临床疗效已被证实,但其机制研究尚处于探索阶段,相关研究甚少。最新研究证实,肌球蛋白轻链激酶(MLCK)、肌球蛋白轻链磷酸化(P-MLC)及多聚体的纤维状肌动蛋白(F-actin)的含量及相互作用与调控肠道黏膜通透性密切相关。因此,项目组以MLCK、P-MLC和F-actin为切入点,探索腹部推拿治疗NAFLD的作用机制。
1 材料 1.1 动物SPF级的健康成年SD大鼠30只,2~3月龄,体质量(200±20)g,雌雄不限,适应性饲养1周。实验动物由北京华阜康生物科技股份有限公司提供。实验动物合格证:SCXK(京)2014-0004。
1.2 主要试剂与设备F-actin Antibody(美国Proteintech公司),DAPI(鼎国,北京),PDAB显色试剂盒(北京中杉金桥生物技术有限公司),Western Lightning Chemiluminescence Reagent(美国PerkinElmer公司),Super RX感光胶片(日本FUJIFILM公司),LabWorksTM凝胶成像及分析系统(美国UVP公司),VE-386型转移电泳槽(北京原平皓生物技术有限公司),倒置显微镜(日本OLYMPUS公司),荧光显微镜(日本SONY公司)
2 方法 2.1 造模方法将SD大鼠进行适应性饲养,1周后参考文献造模方法[4]进行大鼠的NAFLD模型复制。利用高脂饲料,每日对SD大鼠进行灌胃处理,饲料喂养的标准为10 mL/kg。正常对照组则进行蒸馏水灌胃处理。6周后,随机选择3只SD大鼠,其中1只为正常大鼠,2只为造模大鼠,处死后取出肝脏,并进行肝组织的苏木精-伊红(HE)染色,以判断造模是否成功。
2.2 分组与治疗将剩余的18只模型大鼠和9只健康大鼠进行1周的适应性饲养。然后采用随机数字表法分为腹部推拿组、模型组,每组9只。剩余9只健康大鼠为正常对照组。腹部推拿组:手法施术方案来源于津沽脏腑推拿第四代传承人王金贵教授的经验方。且为保证推拿施术一致性,实验前会应用YF-3手法测定仪(上海中医药大学和复旦大学共同研发)采集王金贵教授手法信息,待操作者手法力度、频率波形轨迹与王金贵教授模型基本一致后,方可于实验大鼠身上操作。具体操作如下:模型大鼠取仰卧位,束缚于实验台,操作者位其左侧,将并拢的右手示指、中指指腹置于大鼠腹部中央。通过腕关节有节律的旋转,带动示指和中指依次施术于模型大鼠的腹部。手法操作的转动频率为每分钟20~30次,操作10 min,连续治疗28 d。模型组采用同样的束缚方式,但不予腹部推拿干预,10 min后结束束缚。正常对照组不予任何干预手段。
2.3 实验前动物处理经过28 d干预,3组实验大鼠开始禁食不禁水处理,持续12 h。然后在实验大鼠的腹腔注射1%戊巴比妥钠。大鼠昏迷之后,行手术取出部分回肠组织涂片于载玻片,然后利用4 ℃ 4%多聚甲醛进行固定。
2.4 肝组织HE染色将实验大鼠进行麻醉,行手术取出部分肝脏组织,放入10%的福尔马林溶液中;酒精脱水后放入二甲苯。然后将组织块置入石蜡中并包埋,切成5~8 μm薄片。脱去石蜡,经高浓度到低浓度乙醇后入蒸馏水。HE染色后光镜下观察。
2.5 免疫蛋白印迹(Western blot)法检测MLCK及P-MLC蛋白表达向1.5 mL EP管中加入500 μL RIPA裂解液重悬,进行黏膜组织的裂解;配制分离胶为10%的SDS-PAGE凝胶;配制SDS变性5%聚丙烯酰胺凝胶;取蛋白样品进行上样,进行电泳,待目的蛋白分离后停止电泳;分别与一抗、二抗结合;最后曝光、显影、定影,用LabWorks凝胶成像分析系统摄像。
2.6 免疫荧光方法检测肠黏膜P-MLC与F-actin的共定位待4%多聚甲醛固定30 min后,用预冷的1×磷酸盐缓冲液(PBS)洗3遍。然后利用4 ℃,0.5%Triton X-100通透5 min,用预冷的1×PBS浸洗3遍,每次5 min,吸水纸吸干残余PBS。在室温下,用10%驴血清封闭2 h(1×PBS稀释)。吸弃封闭液,加一抗(鼠单抗P-MLC:1%驴血清1∶100稀释;兔多抗F-actin:1%驴血清1∶50稀释),放入湿盒内,4 ℃过夜。吸弃一抗结合液,PBS浸洗3次,每次5 min。加二抗(1%血清1∶100稀释),避光,室温作用2 h。预冷的PBS浸洗3次,每次5 min。加DAPI(1∶1 000,1×PBS稀释),4 ℃避光作用5 min。PBS浸洗3次,每次3 min。用吸水纸吸干残余液体。封片剂封片,荧光显微镜下观察图像。荧光显微镜下观察P-MLC与F-actin共定位情况。
2.7 统计学方法研究数据应用SPSS 24.0软件统计分析,数据用均数±标准差( 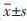
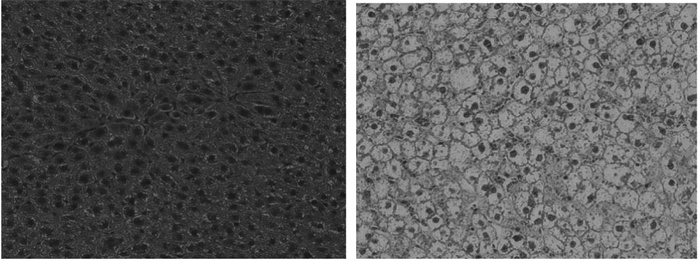
肝脏组织HE染色结果显示,模型组的肝细胞呈气球样变,结构紊乱,且包含数量较多的脂肪空泡,而正常对照组肝细胞的形态和结构正常,结果表明造模复制成功,见图 1。
|
| 图 1 两组大鼠肝脏组织HE染色观察(×400) Fig. 1 HE staining observation of liver tissue in two groups(×400) |
采用Western blot方法,用LabWorksTM凝胶成像及分析系统进行摄像分析,分析计算各组MLC及p-MLCK条带亮度的相对值。经单因素方差分析显示,3组MLCK及P-MLC表达量数据比较差异有统计学意义(P<0.01);模型组的MLCK及P-MLC表达明显增多;与模型组比较,腹部推拿组的MLCK及P-MLC表达明显降低,差异均有统计学意义(P<0.01);正常对照组的MLCK及P-MLC表达量处于模型组和腹部推拿组之间。见表 1、图 2。
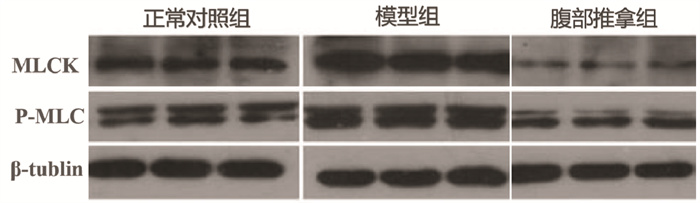
|
| 图 2 MLCK、P-MLC的表达 Fig. 2 Expression of MLCK and P-MLC |
通过转染鼠单抗P-MLC和兔多抗F-actin,进行免费荧光制片、显微拍摄。其中鼠单抗P-MLC:为红光;兔多抗F-actin:为绿光;蓝光为DAPI染细胞核。结果显示:3组肠黏膜涂片P-MLC与F-actin均存在共定位,但是腹部推拿组的P-MLC和F-actin表达量最高。见图 3。

|
| 图 3 P-MLC/F-actin/DAPI免疫荧光检测组图 Fig. 3 P-MLC/F-actin/DAPI immunofluorescence detection group |
NAFLD是全球最常见的慢性肝病,其患病率已达25.24%[5]。据国际癌症研究机构发布的最新统计显示[6],中国已成为年龄标准化发病率最高的地区之一,而NAFLD正是诱发肝癌风险的首要因素[7-8]。因此,防治NAFLD已成为降低肝癌发病率和病死率的重要医学策略。这也与中医“既病防变”的理念高度契合。随着“肠-肝轴”概念的广泛认知,NAFLD的研究聚点也逐步前移至肠道。剖释NAFLD发病的启动机制,肠道黏膜通透性的增高是整个机制中的关键环节[9]。因此,如何维护肠道黏膜通透性,重新构建平衡的肠-肝对话,已成为未来潜在的研究热点。
现阶段,对于细胞内力学信号传递途径的研究更多聚焦于MLCK信号通路。因为细胞骨架蛋白F-actin在细胞中央远比细胞外围稳固,故细胞的外围对外界机械力刺激更为敏感。MLCK恰巧定位于细胞外围较多。故本研究选择MLCK信号通路作为研究调控肠黏膜通透性的信号路通。许多研究者认为P-MLC是肠黏膜通透性增加的分子基础,其水平的高低可以调控细胞微丝骨架的结构,从而影响通透性。而P-MLC水平正是由MLCK所调控。本研究的结果也证明,通过高脂饮食诱导NAFLD大鼠模型肠道黏膜组织中的MLCK与P-MLC表达均增高。说明高脂饮食可以增强MLCK信号通路的活性,介导P-MLC表达上升,通过解聚细胞骨架蛋白F-actin破坏肠道黏膜屏障功能,使通透性增高,加剧肠道内细胞毒素对肝细胞的破坏。而通过腹部推拿28 d的干预后发现,MLCK与P-MLC表达均显著下降,证明腹部推拿可有效抑制MLCK蛋白及其介导的P-MLC蛋白表达,从而减缓肠道黏膜通透性的增加,为肝细胞逆转脂肪变性奠定基础。
既往研究证实,细胞微丝骨架蛋白F-actin、P-MLC的改变与MLCK信号通路的活性密切相关[10]。MLCK可通过调控P-MLC水平进而解聚或重塑F-actin结构,引起微丝重新分布,造成力学不稳定,使细胞群收缩,细胞间隙增大,通透性增强。故本研究还利用了免疫荧光观测了P-MLC与F-actin的共定位关系。研究结果显示3组均存在共定位关系,但是腹部推拿组的P-MLC和F-actin的表达量最高。证明通过腹部推拿干预后,可增加P-MLC和F-actin处于同一区域的概率。腹部推拿可以抑制MLCK与P-MLC表达,可以增加P-MLC和F-actin共定位的关系,这种结果也间接为腹部推拿通过机械力重塑细胞骨架蛋白奠定研究基础。
本研究通过对MLCK、P-MLC表达以及P-MLC与F-actin的共定位关系,初步验证了腹部推拿对肠道黏膜通透性的干预作用。同时,也为后续腹部推拿重塑细胞骨架蛋白的研究提供了研究支持。
| [1] |
KRAWCZYK M, MACIEJEWSKA D, RYTERSKA K, et al. Gut permeability might be improved by dietary fiber in individuals with nonalcoholic fatty liver disease(NAFLD) undergoing weight reduction[J]. Nutrients, 2018, 10(11): 1793. DOI:10.3390/nu10111793 |
| [2] |
BIOLATO M, MANCA F, MARRONE G, et al. Intestinal permeability after mediterranean diet and low-fat diet in non-alcoholic fatty liver disease[J]. World Journal of Gastroenterology, 2019, 25(4): 509-520. DOI:10.3748/wjg.v25.i4.509 |
| [3] |
SCARPELLINI E, LUPO M, IEGRI C, et al. Intestinal permeability in non-alcoholic fatty liver disease: the gut-liver axis[J]. Rev Recent Clin Trials, 2014, 9(3): 141-147. |
| [4] |
ZHAO J Y, ZHENG H Y, LIU Y, et al. Anti-inflammatory effects of total alkaloids from rubus alceifolius poir[corrected]. On non-alcoholic fatty liver disease through regulation of the NF-κB pathway[J]. International Journal of Molecular Medicine, 2013, 31(4): 931-937. DOI:10.3892/ijmm.2013.1281 |
| [5] |
LONARDO A, BYRNE C D, CALDWELL S H, et al. Global epidemiology of nonalcoholic fatty liver disease: meta-analytic assessment of prevalence, incidence, and outcomes[J]. Hepatology, 2016, 64(4): 1388-1389. DOI:10.1002/hep.28584 |
| [6] |
RAWLA P, SUNKARA T, MURALIDHARAN P, et al. Update in global trends and aetiology of hepatocellular carcinoma[J]. Contemporary Oncology, 2018, 22(3): 141-150. |
| [7] |
MANDAL A, BHATTARAI B, KAFLE P, et al. Elevated liver enzymes in patients with type 2 diabetes mellitus and non-alcoholic fatty liver disease[J]. Cureus, 2018, 10(11): e3626. |
| [8] |
DIVELLA R, MAZZOCCA A, DANIELE A, et al. Obesity, nonalcoholic fatty liver disease and adipocytokines network in promotion of cancer[J]. International Journal of Biological Sciences, 2019, 15(3): 610-616. DOI:10.7150/ijbs.29599 |
| [9] |
GRAZIANI C, TALOCCO C, DE S R, et al. Intestinal permeability in physiological and pathological conditions: major determinants and assessment modalitiesr[J]. Eur Rev Med Pharmacol Sci, 2019, 23(2): 795-810. |
| [10] |
CHEN C, TAO T, WEN C, et al. Myosin light chain kinase(MLCK) regulates cell migration in a myosin regulatory light chain phosphorylation-independent mechanism[J]. Journal of Biological Chemistry, 2014, 289(41): 28478-28488. DOI:10.1074/jbc.M114.567446 |
 2021, Vol. 38
2021, Vol. 38