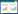文章信息
- 戢杨, 丁晴, 吴沅皞
- JI Yang, DING Qing, WU Yuanhao
- 基于网络药理学探讨独活寄生汤治疗类风湿关节炎与骨关节炎的“异病同治”机制
- Network pharmacological analysis of Duhuo Jisheng Decoction for treating different diseases with same method on rheumatoid arthritis and osteoarthritis
- 天津中医药, 2021, 38(9): 1201-1208
- Tianjin Journal of Traditional Chinese Medicine, 2021, 38(9): 1201-1208
- http://dx.doi.org/10.11656/j.issn.1672-1519.2021.09.23
-
文章历史
- 收稿日期: 2021-04-28
2. 天津中医药大学第一附属医院风湿免疫科, 天津 300193;
3. 国家中医针灸临床医学研究中心, 天津 300193;
4. 天津市中医方证转化研究重点实验室, 天津 300193
类风湿关节炎(RA)与骨关节炎(OA)均为风湿性疾病, 属中医痹证范畴, 两者发病机制虽有所不同, 但均与炎症相关, 在临床表现、辨证用药方面也具有较多的相似性[1-2]。中医认为痹证主要是由风、寒、湿、热等邪气滞留于肢体经脉、骨节、筋肉, 致使经脉痹阻、气血运行不畅, 出现关节肌肉等处疼痛、酸楚不适, 或关节屈伸不利, 甚则僵硬、畸形等症状。两者发病在内责之脏腑亏虚、营卫气血失调, 在外责之风、寒、湿、热等邪气侵袭。诚如《素问·痹论篇》所言: “痹病, 五脏亏虚为之大因。”“所为痹者, 各以其时重感于风寒湿之气也。”
痹证的治疗大法当祛邪通络, 临证时配以祛风、散寒、清热、除湿等治法, 临床常用方剂独活寄生汤出自《备急千金药方》一书, 为唐代著名医家孙思邈所创制, 全方共由15味药组成, 兼具祛风湿、除痹痛、补肝肾、养气血等功效, 由于痹证日久出现气血不足、肝肾亏虚, 故可以独活寄生汤治之, 临床再随证加减。独活寄生汤具有抗炎、抗氧化、抑制凋亡等作用, 在风湿病领域应用广泛, 可用于治疗类风湿关节炎、骨关节炎、强直性脊柱炎、骨质疏松症等疾病[3]。其治疗类风湿关节炎主要与抗炎镇痛、调节免疫、抑制滑膜炎、抑制骨破坏等相关, 治疗骨关节炎主要与调控炎性细胞因子、促进软骨细胞增殖以及抑制软骨细胞凋亡有关[4-5]。
“异病同治”是中医辨证论治的重要组成部分, 该理论源自《黄帝内经》, 确立于《伤寒杂病论》。“同治”的核心是“同证”, 即不同疾病在疾病过程中出现相同的病机, 可以选择相同的治法进行治疗[6]。RA和OA是临床常见的代表性“痹证”, 病程中均常见气血不足、肝肾亏虚等证, 基于“异病同治”的理论, 以独活寄生汤治疗均能起到明显的临床疗效。本研究利用网络药理学的方法, 从分子层面探讨独活寄生汤治疗RA和OA的“异病同治”内涵, 为进一步的实验研究提供一定的参考。
1 资料与方法 1.1 各中药化合物及药物靶点预测在中药系统药理学数据库和分析平台(TCMSP)(http://lsp.nwu.edu.cn/tcmsp.php)[7]中分别以独活寄生汤各味中药为关键词检索预测独活寄生汤的化合物, 并以OB≥0.18、DL≥30%为条件筛选活性化合物。在TCMSP数据库中查找筛选出的活性化合物所对应的药物作用靶点, 若在TCMSP中无法获取则从中药分子机制生物信息学分析工具(BATMAN-TCM)数据库(http://bionet.ncpsb.org.cn/batman-tcm/)[8]中查找, 设置筛选条件为分数截断值≥30且校正后P值<0.05。对于从TCMSP数据库中获取的命名不规范的靶点, 本研究利用环球蛋白资源数据库(UniProt)(http://www.uniprot.org/)[9-10]中的知识库查找选项进行转换, 通过输入蛋白名称并限定物种为人, 将其校正为官方名称。根据前面预测和筛选得到的结果, 剔除未找到对应靶点的化合物及重复的靶点。
1.2 疾病相关靶点预测分别以Osteoarthritis、Rheumatoid Arthritis为检索词, 从疾病基因数据库(GeneCards, version5.0,https://www.genecards.org)[11]中查询RA和OA的疾病靶点基因。
1.3 靶点蛋白质-蛋白质相互作用(PPI)网络的构建与分析应用在线工具Venny(version 2.1,http://bioinfogp.cnb.csic.es/tools/venny/index.html)[12]获取独活寄生汤成分靶点、RA疾病靶点与OA疾病靶点三者的重叠部分。将独活寄生汤分别治疗RA、OA的特有靶点以及三者的共有靶点上传至蛋白相互作用网络分析数据库(STRING, version 11.0,https://string-db.org/)中[13], 将物种限定为人, 得到共有靶点之间的PPI网络。在网络中, 靶点被表示为节点, 边表示靶点之间的相互作用, 共有靶点与特有靶点可从靶点角度来解释“异病同治”的科学内涵。应用Cytoscape(version3.7.1,http://www.cytoscape.org/)[14]软件对PPI网络进行可视化, 并分别进行网络拓扑特征分析及模块分析。网络拓扑特征分析利用Cytoscape软件中的网络分析插件进行, 根据节点度值和接近中心性这两个重要的拓扑参数来分析独活寄生汤治疗RA、OA的靶点。利用Cytoscape软件中的分子复杂检测(MCODE)插件进行模块分析, 将模块大小识别参数(k-core)设置为4, 即识别出至少包含5条边的模块。
1.4 基因本体功能富集和京都基因与基因组百科全书通路富集分析为了进一步挖掘独活寄生汤“异病同治”的作用机制, 将“1.3”部分得到的独活寄生汤分别治疗RA和OA的特有靶点基因及三者共有靶点基因输入注释、可视化和综合发现数据库(DAVID, version 6.8,https://david.ncifcrf.gov)[15-16]数据库中, 将物种限定为人, 分别进行基因本体(GO)和京都基因与基因组百科全书(KEGG)通路富集分析, 结果根据伪发现率(FDR)<0.05筛选, 并利用组学分析工具(OmicShare)平台(http://www.omicshare.com/tools)进行展示。
2 结果 2.1 独活寄生汤的活性成分及药物靶点预测独活寄生汤中各中药的成分和靶点基本信息见表 1, 经去重整理后, 本研究共收集得到202个活性化合物和560个药物作用靶点。可见不同中药既存在单个化合物与多个靶点相互作用, 也存在不同化合物同时作用于同一靶点的情况。说明中药复方的治疗作用具有多成分、多靶点、多途径的特点, 与中药复方配伍的多样性与复杂性相一致。结果可见不同中药既存在单个化合物与多个靶点相互作用, 也存在不同化合物同时作用于同一靶点的情况。
|
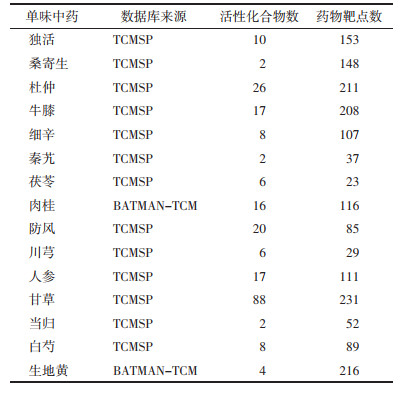
通过GeneCards数据库共获得RA疾病靶点4 329个, OA疾病靶点2 885个。运用在线工具Venny得到独活寄生汤成分靶点、RA疾病靶点与OA疾病靶点的重叠靶点基因(见图 1)。独活寄生汤成分靶点中有80个治疗RA的特有靶点, 占总成分靶点数目的14.29%;有28个治疗OA的特有靶点, 占总成分靶点数目的5%。独活寄生汤治疗RA和OA的共有靶点有194个, 占总成分靶点数的34.64%。
|
| 图 1 独活寄生汤治疗类风湿关节炎、骨关节炎靶点的韦恩图 Fig. 1 Venn diagram of the targets between Duhuo Jisheng Decoction in the treatment of rheumatoid arthritis and osteoarthritis |
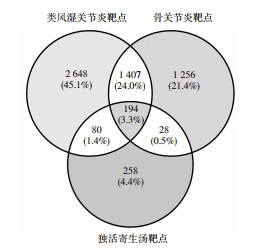
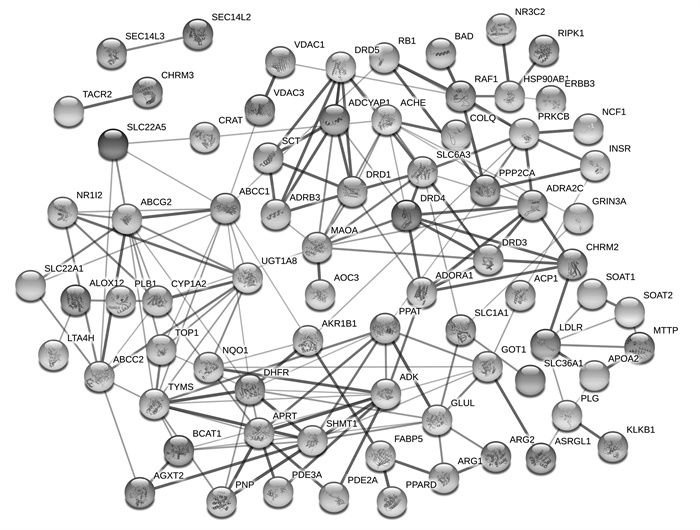
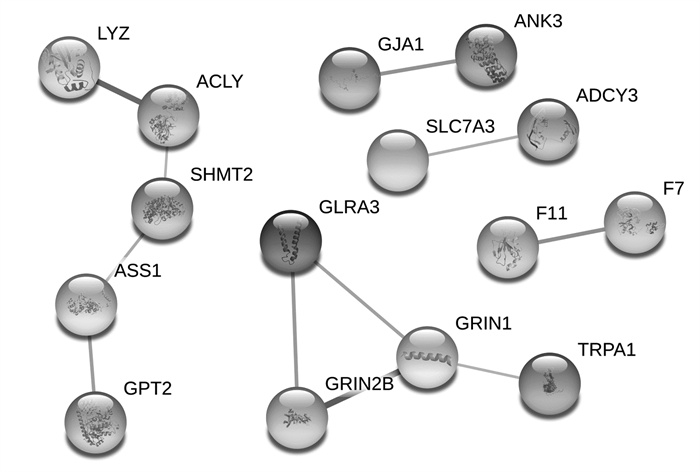
应用STRING工具构建独活寄生汤治疗RA、OA之间共有靶点的相互作用网路(见图 2), 共包含192个节点和4 758条边; 独活寄生汤治疗RA特有靶点的相互作用网路(见图 3)包含76个节点和173条边; 独活寄生汤治疗OA的特有靶点相互作用网络(见图 4)包含15个节点和11条边。

|
| 图 2 独活寄生汤治疗类风湿关节炎、骨关节炎的共有靶点相互作用网络 Fig. 2 Interaction network between common targets of Duhuo Jisheng Decoction in the treatment of rheumatoid arthritis and osteoarthritis |
|
| 图 3 独活寄生汤治疗类风湿关节炎的特有靶点相互作用网络 Fig. 3 Interaction network of unique targets of Duhuo Jisheng Decoction in the treatment of rheumatoid arthritis |
|
| 图 4 独活寄生汤治疗骨关节炎的特有靶点相互作用网络 Fig. 4 Interaction network of unique targets of Duhuo Jisheng Decoction in the treatment of osteoarthritis |
在独活寄生汤治疗RA和OA的共有靶点相互作用网络(见图 2)中, 度值排名前10位的靶点为丝氨酸/苏氨酸蛋白激酶1(AKT1)、白细胞介素(IL)-6、胰岛素(INS)、白蛋白(ALB)、肿瘤坏死因子(TNF)、肿瘤抗原P53(TP53)、血管内皮生长因子(VEGF)A、丝裂原活化蛋白激酶(MPK)3、胱天蛋白酶(CASP)3、Jun氨基末端激酶(JUN)。采用Cytoscape软件的MCODE插件进行模块分析, 结果得到分数>4的模块共4个, 各模块的参数分别为: 模块1, 得分55.826, 节点70个, 边1 926条; 模块2, 得分6.357, 节点29个, 边89条; 模块3, 得分4.4, 节点6个, 边11条; 模块4, 得分4, 节点5个, 边8条。在独活寄生汤治疗RA的特有靶点相互作用网络(见图 3)中, 度值排在前5位的靶点为胸苷酸合成酶(TYMS)、多药耐药相关蛋白1(ABCC1)、二氢叶酸还原酶(DHFR)、单胺氧化酶(MAO)A、乙酰胆碱酯酶(AChE)。在独活寄生汤治疗OA的特有靶点相互作用网络(见图 4)中, 共筛选得到4个靶点, 分别为N-甲基-D-天氡氨酸离子能谷氨酸受体1(GRIN1)、丝氨酸羟甲基转移酶2(SHMT2)、三磷酸腺柠檬酸裂解酶(ACLY)、精氨基琥珀酸合成酶1(ASS1)。
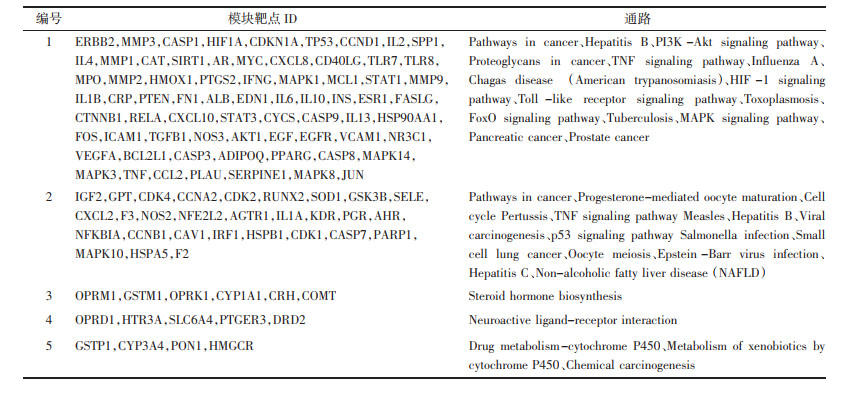
2.4 共有基因靶点的通路富集分析独活寄生汤治疗RA和OA共有基因靶点各模块分别包含70、29、6、5、4个基因靶点, 分别涉及102、24、1、1、3条通路, 各模块富集的通路信息见表 2。模块1和模块2的基因靶点不仅参与信号转导通路, 还参与肿瘤与感染性疾病相关通路; 模块3与甾类激素生物合成相关, 模块4与神经活性配体受体相互作用有关; 模块5与药物代谢通路相关, 包括药物代谢-细胞色素P450、细胞色素P450对外源性药物代谢的影响、化学致癌3条通路。不同模块的基因靶点既参与不同的通路, 又存在部分相同的通路, 如模块1和模块2的靶点均富集在细胞周期、TNF信号通路、p53信号通路、核苷酸寡聚结构域(NOD)样受体信号通路、乙型肝炎、沙门氏菌感染、EB病毒感染等通路上, 说明这些通路在独活寄生汤的“异病同治”机制中发挥比较重要的作用。
|
KEGG通路富集分析可见独活寄生汤治疗RA的特有靶点参与24条通路, 包括为新陈代谢通路(26.25%)、神经活性配体-受体相互作用(15%)、环磷酸鸟苷酸-G激酶(cGMP-PKG)信号通路(13.75%)、钙信号通路(12.5%)、环磷酸腺苷(cAMP)信号通路(11.25%)等。治疗OA的特有靶点参与6条通路, 主要为谷氨酸能突触(14.29%)、氨基酸生物合成(10.71%)等通路。上述结果提示独活寄生汤的活性成分亦可能通过作用于这些特有靶点而影响相同或不同的通路, 从而分别起到治疗RA和OA的作用。
3 讨论RA和OA同属“痹证”, 病位在肢体经脉、骨节、筋肉, 病情重者可内舍于脏腑, 两者常见病因病机类似。独活寄生汤作为治疗痹证的经典方剂, 以独活祛风除湿, 细辛、秦艽、防风、桂枝合用祛风寒湿邪、通利关节; 桑寄生、杜仲、牛膝补肝肾、强筋骨, 当归、熟地黄、白芍、川芎合用养血和血, 人参、茯苓、甘草者益气助阳、健脾除湿, 诸药合用, 共同发挥祛风除湿、通利关节、补益肝肾、调养气血的功效。可见独活寄生汤能用以治疗同为气血亏虚、肝肾不足之痹证的“异病”。
本研究先从靶点的角度分析, 在数据库中共查找到独活寄生汤活性化合物、类风湿关节炎和骨关节炎三者之间的共有靶点194个, 对其PPI网络进行拓扑分析并按节点度值排序, 筛选得到10个关键靶点, 包括AKT1、IL6、INS、ALB、TNF、TP53、VEGFA、MAPK3、CASP3、JUN。推测这些靶点即为独活寄生汤发挥“异病同治”作用的分子基础。研究表明它们主要与炎症、免疫、血管生成、细胞增殖、细胞凋亡等相关。然后对共有靶点进行模块化分析和GO及KEGG富集分析, 发现其中靶点数较多的两个模块共涉及126条通路, 重要的通路包括磷脂酰肌醇-3-羟激酶-丝氨酸/苏氨酸激酶(PI3K-Akt)信号通路、TNF信号通路、叉头转录因子(FoxO)信号通路、缺氧诱异因子(HIF)-1信号通路、Toll样受体信号通路、MAPK信号通路、p53信号通路等。这些通路均与RA和OA的发病过程相关, 且不同通路之间还存在一定的联系。
3.1 独活寄生汤祛风除湿、通利关节以治“异病”风寒湿热等诸邪入侵经脉、骨节、筋肉, 痹阻不通, 是各型痹证共有的基础病机, 可体现于滑膜细胞增生侵袭、异常骨形成等病理机制。独活寄生汤可祛风除湿、通利关节以同治诸痹, 其作用机制可能是通过调控PI3K-Akt、TNF、FoxO等相关信号通路实现。
PI3K-Akt信号通路是一种重要的细胞内信号转导通路。PI3K被活化后可进一步激活AKT, 后者再磷酸化下游多种效应分子。PI3K-Akt信号通路参与了RA的滑膜炎症、血管翳及骨侵蚀等多个病理环节, 一方面可通过刺激IL-1、IL-6、TNF-α、IL-17等炎性细胞因子的表达, 促进RA成纤维样滑膜细胞(FLS)的异常增殖[17], 另一方面可通过作用于细胞凋亡相关的叉头转录因子、cAMP应答元件结合蛋白等靶点抑制RA-FLS凋亡[18]。在OA中, PI3K-Akt信号通路在被激活后, 可通过多种方式抑制软骨细胞的凋亡, 而抑制该通路激活则会促进软骨细胞的凋亡与自噬, 进而抑制异常骨形成、减弱软骨变性[19-20]。
TNF是一种重要的炎性细胞因子, 在RA和OA中都存在过表达。TNF-α通过激活RA滑膜细胞中的核转录因子-κB(NF-κB)通路, 进一步促进滑膜细胞增殖、抑制其凋亡, 与滑膜血管翳的形成相关[21], 该通路受活化的PI3K-Akt信号通路调控, 从而引起关节局部滑膜增生、炎症[20]。
3.2 独活寄生汤补益肝肾、调养气血以治“异病”类风湿关节炎、骨关节炎等痹证日久迁延不愈, 正虚邪恋, 均可发为气血不足、肝肾亏损等证, 体现于关节软骨细胞的凋亡、细胞外基质代谢失衡等病理机制。独活寄生汤可补益肝肾、调养气血以补益肝肾气血, 强筋壮骨, 其作用机制可能是通过调控HIF-1、Toll样受体、MAPK、p53等相关信号通路实现。
缺氧诱导因子-1α(HIF)可在缺氧的条件下, 促进RA-FLS的增殖、迁移, 并抑制其凋亡, 与RA的血管形成相关[17, 22]。HIF-1α在兔OA滑膜中也存在异常表达, 牛膝总皂苷可能通过HIF-1信号通路来促进实验兔OA模型的软骨细胞增殖及软骨修复[23-24]。在RA中Toll样受体(TLR)是一类位于细胞表面的跨膜受体, 参与细胞内信号转导。TLR识别相应配体后激活下游的酶联反应。在RA中, Toll样受体信号通路通过激活NF-κB和Janus激酶-信号转导子和转录激活子(JAK-STAT)信号通路, 导致进行性的炎症, 引起滑膜增生及软骨侵蚀[25]。而在OA中, Toll样受体信号通路与软骨细胞的凋亡相关, 对细胞外基质代谢失衡也有重要作用[26]。
丝裂原活化蛋白激酶通路是与细胞的增殖、分化、凋亡等密切相关的细胞内信号转导通路。MAPK家族包括p38、MAPK、c-Jun氨基末端激酶(c-JNK)、细胞外调节蛋白激酶(ERK)等8个亚家族。Zhai等[27]用不同浓度的甘草苷处理经白细胞介素-1β诱导的RA-FLS, 发现VEGF的表达及JNK、P38的磷酸化受到抑制, 提示甘草苷可通过减轻炎症、抑制血管生成、抑制MAPK信号通路等途径来减轻RA。MAPK信号通路在OA的软骨损伤中具有重要作用, 其中JNK和p38 MAPK通路与OA的炎症反应相关, 而ERK1/2通路主要与软骨细胞的分化和增殖相关[28]。大鼠膝OA模型实验发现独活寄生汤可抑制NF-κB p65和p38 MAPK的基因表达[29]。
p53信号通路是一种与线粒体途径细胞凋亡相关的信号通路。p53基因是目前研究最广泛的肿瘤抑制基因之一, 其过度激活与动脉粥样硬化、糖尿病、恶性疟原虫和斑疹伤寒感染等疾病以及多种风湿免疫病相关, 包括类RA和OA。Zhang等[30]利用构建佐剂诱导性关节炎大鼠模型(AIA)和人FLS进行实验, 发现p53可以下调AIA和FLS中IL-6的表达、抑制AIA关节滑膜炎症。此外, p53基因抑制RA的骨重塑[31]。在OA中, 机械应力和氧化应激等各种外界刺激通过多条信号通路激活p53, 进而激活线粒体凋亡途径, 最后导致软骨细胞的凋亡[32]。
此外, 独活寄生汤还可能通过作用于其他靶点发挥治疗RA和OA的作用。独活寄生汤一方面可通过新陈代谢通路、神经活性配体-受体相互作用、cGMP-PKG信号通路、钙信号通路、cAMP信号通路等治疗RA; 另一方面可通过谷氨酸能突触、氨基酸生物合成等通路治疗OA。需要注意的是, 上述分析中剩余的一些靶点、通路相关报道较少, 尚需进一步的实验进行验证。
综上所述, 独活寄生汤可通过祛风除湿、通利关节、补益肝肾、调养气血作用于AKT1、IL6、INS、ALB、TNF等共有靶点, 参与PI3K-Akt、TNF、FoxO、HIF-1、Toll样受体、MAPK、p53等相关信号通路, 起到“同治”RA、OA等“异病”的作用。详参这些共同信号通路导致的病理机制, 可见与“异病”中的经脉痹阻、气血亏虚、肝肾不足等“同证”存在对应联系, 提示了独活寄生汤“同治”的分子机制。本研究的结果与既往研究具有一定的一致性, 提示网络药理学方法的可行性。同时也提示, 可从AKT1、IL6、INS、ALB、TNF等基因靶点入手, 研究RA与OA的共同发病机制, 以助于研发新的治疗药物, 从而更好地治疗风湿痹病患者。
| [1] |
龚雪, 汪元. 类风湿关节炎中医病因病机研究进展[J]. 风湿病与关节炎, 2020, 9(6): 62-65. GONG X, WANG Y. Research progress on etiology and pathogenesis of rheumatoid arthritis in TCM[J]. Rheumatism and Arthritis, 2020, 9(6): 62-65. DOI:10.3969/j.issn.2095-4174.2020.06.019 |
| [2] |
付志彬, 程杰. 中医治疗膝骨关节炎的研究进展[J]. 现代临床医学, 2020, 46(5): 384-386. FU Z B, CHENG J. Advances in the treatment of knee osteoarthritis in Chinese medicine[J]. Journal of Modern Clinical Medicine, 2020, 46(5): 384-386. |
| [3] |
李璘麟, 周小莉. 独活寄生汤在风湿病中的临床应用及研究进展[J]. 中国中医急症, 2019, 28(3): 549-552. LI L L, ZHOU X L. Clinical application and research progress of Duhuo Jisheng Decoction in rheumatism[J]. Journal of Emergency in Traditional Chinese Medicine, 2019, 28(3): 549-552. |
| [4] |
田镭, 钟琴, 马武开, 等. 独活寄生汤治疗膝骨关节炎的研究进展[J]. 风湿病与关节炎, 2019, 8(1): 66-68, 72. TIAN L, ZHONG Q, MA W K, et al. Progress in the treatment of knee osteoarthritis in Duhuo Jisheng Decoction[J]. Rheumatism and Arthritis, 2019, 8(1): 66-68, 72. DOI:10.3969/j.issn.2095-4174.2019.01.016 |
| [5] |
张鸿婷, 杜旭, 郭丹丹, 等. 独活寄生汤治疗类风湿关节炎药效学及作用机制的研究进展[J]. 中医药学报, 2020, 48(9): 77-80. ZHANG H T, DU X, GUO D D, et al. Research progress on pharmacodynamics and action mechanism of Duhuo Jisheng Decoction in treating rheumatoid arthritis[J]. Acta Chinese Medicine and Pharmacology, 2020, 48(9): 77-80. |
| [6] |
李秀月, 代民涛, 柴可夫. 《金匮要略》同病异治和异病同治运用析述[J]. 中华中医药杂志, 2017, 32(10): 4351-4354. LI X Y, DAI M T, CHAI K F. Analysis on the application of treating the same disease with different therapies and treating different diseases with the same therapy in Jingui Yaolue[J]. China Journal of Traditional Chinese Medicine and Pharmacy, 2017, 32(10): 4351-4354. |
| [7] |
RU J L, LI P, WANG J N, et al. TCMSP: a database of systems pharmacology for drug discovery from herbal medicines[J]. J Cheminform, 2014, 6(1): 13. DOI:10.1186/1758-2946-6-13 |
| [8] |
LIU Z, GUO F, WANG Y, et al. BATMAN-TCM: a bioinformatics analysis tool for molecular mechANism of traditional Chinese medicine[J]. Scientific Reports, 2016, 6: 21146. DOI:10.1038/srep21146 |
| [9] |
PUNDIR S, MARTIN M J, O'DONOVAN C. UniProt protein knowledgebase[J]. Methods in Molecular Biology, 2017, 1558: 41-55. |
| [10] |
PUNDIR S, MARTIN M J, O'DONOVAN C. UniProt tools[J]. Current Protocols in Bioinformatics, 2016, 53(1): 1-29. |
| [11] |
STELZER G, ROSEN N, PLASCHKES I, et al. The Genecards suite: from gene data mining to disease genome sequence analyses[J]. Curr Protoc Bioinformatics, 2016, 54: 1-30. |
| [12] |
OLIVEROS J C. (2007-2015) Venny. An interactive tool for comparing lists with Venn's diagrams[OB]. https://bioinfogp.cnb.csic.es/tools/venny/index.html.
|
| [13] |
SZKLARCZYK D, GABLE A L, LYON D, et al. STRING v11:protein-protein association networks with increased coverage, supporting functional discovery in genome-wide experimental datasets[J]. Nucleic acids research, 2019, 47(D1): D607-D613. DOI:10.1093/nar/gky1131 |
| [14] |
SHANNON P, MARKIEL A, OZIER O, et al. Cytoscape: a software environment for integrated models of biomolecular interaction networks[J]. Genome Research, 2003, 13(11): 2498-2504. DOI:10.1101/gr.1239303 |
| [15] |
HUANG D W, SHERMAN B T, LEMPICKI R A. Systematic and integrative analysis of large gene lists using DAVID bioinformatics resources[J]. Nature Protocols, 2009, 4(1): 44-57. DOI:10.1038/nprot.2008.211 |
| [16] |
HUANG D W, SHERMAN B T, LEMPICKI R A. Bioinformatics enrichment tools: paths toward the comprehensive functional analysis of large gene lists[J]. Nucleic Acids Research, 2009, 37(1): 1-13. DOI:10.1093/nar/gkn923 |
| [17] |
张行, 保国锋, 崔志明. PI3K/AKT信号通路在类风湿关节炎发病机制中的研究进展[J]. 东南大学学报(医学版), 2019, 38(2): 358-363. ZHANG X, BAO G F, CUI Z M. Advances in the study of PI3K/AKT signaling pathways in the pathogenesis of rheumatoid arthritis[J]. Journal of Southeast University (Medical Science Edition), 2019, 38(2): 358-363. DOI:10.3969/j.issn.1671-6264.2019.02.029 |
| [18] |
于静雅, 陈勇. PI3K-AKT信号通路及其在类风湿性关节炎滑膜细胞增殖和凋亡中的作用[J]. 细胞与分子免疫学杂志, 2014, 30(12): 1326-1329. YU J Y, CHEN Y. PI3K-AKT signaling pathway and its role in the proliferation and apoptosis of rheumatoid arthritis-like membrane cells[J]. Chinese Journal of Cellular and Molecular Immunology, 2014, 30(12): 1326-1329. |
| [19] |
XUE J F, SHI Z M, ZOU J, et al. Inhibition of PI3K/AKT/mTOR signaling pathway promotes autophagy of articular chondrocytes and attenuates inflammatory response in rats with osteoarthritis[J]. Biomed Pharmacother, 2017, 89: 1252-1261. DOI:10.1016/j.biopha.2017.01.130 |
| [20] |
李晓燕, 张艳, 董春萍, 等. 骨关节炎大鼠模型软骨组织中PI3K/AKT信号通路功能与细胞凋亡的相关性研究[J]. 海南医学院学报, 2017, 23(11): 1452-1455. LI X Y, ZHANG Y, DONG C P, et al. Relationship between PI3K/AKT signaling pathway and apoptosis in cartilage tissue of rats with osteoarthritis[J]. Journal of Hainan Medical University, 2017, 23(11): 1452-1455. |
| [21] |
石慧, 王丹彤, 乌日嘎, 等. TNF-α介导的NF-κB信号通路在类风湿性关节炎血管形成中的作用[J]. 医学综述, 2012, 18(15): 2397-2400. SHI H, WANG D T, WU R G, et al. Role of tumor necrosis factor-α mediated nuclear factor kappa b signaling pathway in antiogenesis in rheumatoid arthritis[J]. Medical Recapitulate, 2012, 18(15): 2397-2400. DOI:10.3969/j.issn.1006-2084.2012.15.019 |
| [22] |
于若寒, 赵金霞, 刘湘源. 低氧诱导因子在类风湿关节炎发病机制中的作用[J]. 北京大学学报(医学版), 2016, 48(6): 1095-1099. YU R H, ZHAO J X, LIU X Y. Role of hypoxia-inducible factor in the pathogenesis of rheumatoid arthritis[J]. Journal of Peking University (Health Sciences), 2016, 48(6): 1095-1099. DOI:10.3969/j.issn.1671-167X.2016.06.031 |
| [23] |
帅明. 白介素-1β、HIF-1α和VEGF在兔骨性关节炎模型的滑膜中的表达[D]. 广州: 南方医科大学, 2013. SHUAI M. Expression of interleukin-1 beta, HIF-1 alpha, and VEGF in the sliding membrane of rabbit osteoarthritis models[D]. Guangzhou: Southern Medical University, 2013. |
| [24] |
马笃军, 彭力平, 余阗, 等. 牛膝总皂苷对骨关节炎模型兔软骨修复及低氧诱导因子1信号通路的影响[J]. 中国组织工程研究, 2019, 23(27): 4332-4337. MA D J, PENG L P, YU T, et al. Influence of achyranthes bidentata saponins on the repair of cartilage and hypoxia-inducible factor 1 signaling pathway in a rabbit model of osteoarthritis[J]. Chinese Journal of Tissue Engineering Research, 2019, 23(27): 4332-4337. DOI:10.3969/j.issn.2095-4344.1381 |
| [25] |
谢小倩, 王亚乐, 罗沙沙, 等. 类风湿性关节炎发病机制研究进展[J]. 世界最新医学信息文摘(连续型电子期刊), 2019, 19(71): 109-111. XIE X Q, WANG Y L, LUO S S, et al. Pathogenesis of rheumatoid arthritis[J]. World Latest Medicine Information, 2019, 19(71): 109-111. |
| [26] |
陈金伟, 吕杰, 俞银贤, 等. 膝骨关节炎中天然免疫和TLR/NF-κB信号通路的研究进展[J]. 中华临床医师杂志(电子版), 2013, 7(24): 11602-11606. CHEN J W, LYU J, YU Y X, et al. The research on natural immunity and toll-like receptor/NF-κB signaling pathways in the knee osteoarthritis[J]. Chinese Journal of Clinicians (Electronic Edition), 2013, 7(24): 11602-11606. DOI:10.3877/cma.j.issn.1674-0785.2013.24.119 |
| [27] |
ZHAI K F, DUAN H, CUI C Y, et al. Liquiritin from glycyrrhiza uralensis attenuating rheumatoid arthritis via reducing inflammation, suppressing angiogenesis, and inhibiting MAPK signaling pathway[J]. Journal of Agricultural and Food Chemistry, 2019, 67(10): 2856-2864. DOI:10.1021/acs.jafc.9b00185 |
| [28] |
高世超, 殷海波, 刘宏潇, 等. MAPK信号通路在骨关节炎发病机制中的研究进展[J]. 中国骨伤, 2014, 27(5): 441-444. GAO S C, YIN H B, LIU H X, et al. Research progress on MAPK signal pathway in the pathogenesis of osteoarthritis[J]. China Journal of Orthopaedics and Traumatology, 2014, 27(5): 441-444. DOI:10.3969/j.issn.1003-0034.2014.05.022 |
| [29] |
吴广文, 刘淑如, 陈俊, 等. 独活寄生汤治疗膝骨关节炎的作用机制[J]. 中国组织工程研究, 2019, 23(19): 2965-2971. WU G W, LIU S R, CHEN J, et al. Mechanism of Duhuo Jisheng Decoction for treating knee osteoarthritis[J]. Chinese Journal of Tissue Engineering Research, 2019, 23(19): 2965-2971. DOI:10.3969/j.issn.2095-4344.1241 |
| [30] |
ZHANG T, LI H H, JUAN S, et al. p53 predominantly regulates IL-6 production and suppresses synovial inflammation in fibroblast-like synoviocytes and adjuvant-induced arthritis[J]. Arthritis research & therapy, 2016, 18(1): 271. |
| [31] |
庞琳娜, 徐连那, 董红宇. P53基因在类风湿关节炎骨代谢中的作用[J]. 中国骨质疏松杂志, 2014, 20(3): 327-330. PANG L N, XU L N, DONG H Y. Function of P53 gene in the bone metabolism in rheumatoid arthritis[J]. Chinese Journal of Osteoporosis, 2014, 20(3): 327-330. DOI:10.3969/j.issn.1006-7108.2014.03.025 |
| [32] |
周绪昌, 邹军, 吴伟. p53调控骨关节炎软骨细胞凋亡[J]. 中国生物化学与分子生物学报, 2019, 35(3): 280-285. ZHOU X C, ZOU J, WU W. p53 regulates chondrocyte apoptosis in osteoarthritis[J]. Chinese Journal of Biochemistry and Molecular Biology, 2019, 35(3): 280-285. |
2. Department of Rheumatology, First Teaching Hospital of Tianjin University of Traditional Chinese Medicine, Tianjin 300193, China;
3. National Clinical Research Center for Chinese Medicine Acupuncture and Moxibustion, Tianjin 300193, China;
4. Tianjin Key Laboratory of Translational Research of TCM Prescription and Syndrome, Tianjin 300193, China
 2021, Vol. 38
2021, Vol. 38