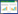文章信息
- 韦秋, 侯佳华, 覃小燕, 杨云, 安然, 毛浩萍
- WEI Qiu, HOU Jiahua, QIN Xiaoyan, YANG Yun, AN Ran, MAO Haoping
- 女贞子多糖抗去势小鼠骨质疏松作用研究
- Study on the anti-osteoporosis effect of ligustrum lucidum polysaccharide in ovariectomized mice
- 天津中医药, 2022, 39(1): 104-109
- Tianjin Journal of Traditional Chinese Medicine, 2022, 39(1): 104-109
- http://dx.doi.org/10.11656/j.issn.1672-1519.2022.01.24
-
文章历史
- 收稿日期: 2021-09-26
绝经期骨质疏松是一种以骨量减少和骨微观结构变化导致骨密度降低及骨脆性增加的代谢性骨病[1],已成为世界上常见的老年疾病之一。破骨细胞为唯一行使骨吸收功能的细胞,在维持骨代谢平衡中发挥重要作用[2]。目前国内外抗骨质疏松的药物以抑制破骨细胞为主[3-4]。女贞子常用于骨质疏松症的治疗[5],药理研究发现女贞子中的女贞苷、特女贞苷、女贞苷Gl3、油女贞苷、红景天苷、齐墩果酸和熊果酸均具有抗骨质疏松作用[6-7]。但尚未见女贞子多糖对骨质疏松的影响,本研究旨在研究女贞子多糖对去卵巢所致骨质疏松的影响,为女贞子多糖用于骨质疏松症的治疗提供实验依据。
1 材料 1.1 实验动物SPF级8周龄雌性C57BL/6小鼠40只,购于北京斯贝福实验动物技术有限公司,动物合格证号:SCXK(京)2016-0002,动物饲养于中国中医科学院放射医学研究所,饲养温度为20~25 ℃,湿度为40%~70%,自由进食和饮水。
1.2 药物女贞子药材1 kg,80%乙醇加热回流提取两次(料液比),每次2 h,药渣挥干乙醇,水提取(90 ℃,2 h,1∶10),提取两次,提取液减压浓缩,乙醇醇沉,调节乙醇终浓度为80%,4 ℃静置过夜,得沉淀即为女贞子多糖,提取率约为6.4%。结合雌激素片(红利来),新疆新姿源生物制药有限责任公司生产。
1.3 试剂和仪器无机磷(P)、钙(Ca)全自动生化仪试剂盒,深圳迈瑞生物医疗股份有限公司生产;雌二醇酶联免疫吸附测定(ELISA)试剂盒,天津安诺瑞康生物技术有限公司;三溴乙醇,Sigma公司;α-MEM培基,Gibico公司;胎牛血清,BioInd公司;抗生素(青霉素、链霉素),BioInd公司;Ficoll-Paque PREMIUM sterile solution,GE Healthcare公司;巨噬细胞集落刺激因子(MCSF),R&D systems公司;核因子κB受体活化因子配体(RANKL),R&D systems公司;CCK-8试剂盒,日本同仁化学研究所;抗酒石酸酸性磷酸酶(TRAP)试剂盒,碧云天生物技术有限公司;万分之一天平(PTX-FA110S),福州华志科学仪器有限公司生产;全自动生化仪(BS240),深圳迈瑞生物医疗股份有限公司生产;双能射线骨密度仪(UltraFous DXA),FaxitronBioptics;微计算机断层扫描技术(micro CT,VivaCT40),SCANCO Medical AG公司;多功能读板仪(Spark),TECAN公司等。
2 方法 2.1 去势骨质疏松小鼠模型制备适应性喂养1周后,将小鼠按照随机数字表法随机分为两组其中假手术组8只,造模组32只。腹腔注射1.5%三溴乙醇,每只0.18 mL,造模组进行双侧卵巢摘除术,假手术组摘除双侧卵巢周围脂肪组织,术后连续腹腔注射2万单位青霉素,连续注射3 d。
2.2 分组与给药造模15 d后眼眶取血约100 μL,假手术组(Sham)和造模组各取8只。随后将32只卵巢摘除小鼠随机分为模型组(OVX),雌激素组(Estrogen,0.039 mg/kg)、女贞子多糖3 g/kg组(FLLP,3 g/kg)和女贞子多糖6 g/kg组(FLLP,6 g/kg)。按0.1 mL/10 g灌胃给药,每日1次,连续给药8周,其中假手术组和模型组给对应体积的0.2%羧甲基纤维素钠溶液。每周记录1次小鼠体质量。
2.3 动物取材 2.3.1 股骨及脏器分离最后1次给药结束后,腹腔注射1.5%三溴乙醇(0.1 mL/10 g),在冰上取出小鼠肝、脾、肾、子宫并称质量,计算脏器指数(以脏器质量/体质量表示);取小鼠后肢双侧股骨并去除肌肉组织,在4%多聚甲醛中固定。用双能射线骨密度仪扫描分析股骨骨密度,用microCT扫描分析股骨骨微结构。
2.3.2 血浆样本摘眼球取血,置于提前用肝素钠处理的1.5 mL小型离心管中,静置30 min,1 300×g离心15 min,取血浆分装于200 μL小型离心管中保存。用BS240全自动生化分析仪检测血浆中Ca、P和碱性磷酸酶(ALP)水平。
2.4 骨髓来源单个核细胞分离与破骨细胞诱导分化 2.4.1 骨髓来源单个核细胞分离与纯化将4周龄C57BL/6J雌鼠脱颈处死并在75%乙醇浸泡5 min后,在生物安全柜中分离双侧后肢股骨和胫骨,完全去尽肌肉组织与结缔组织,用磷酸盐缓冲溶液(PBS)吹出骨髓,用Ficoll-Paque PREMIUM sterile solution进行密度梯度离心后使用红细胞裂解液裂解红细胞。250×g离心15 min获得单个核细胞。将细胞用含10%胎牛血清(FBS)的α-MEM培养基接种于T25培养瓶中。24 h后,取未贴壁的细胞即可获得纯度较高的骨髓来源单个核细胞。
2.4.2 女贞子多糖对破骨前体细胞活性的影响将骨髓来源单个核细胞(3×104个/孔)接种到96孔板中,用含25 μg/L MCSF和10% FBS的α-MEN完全培养基培养3 d。随后继续用含25 μg/L MCSF的完全培养基培养,同时给予不同浓度的女贞子多糖(1×10-3、1×10-4、1×10-5 mg/mL)干预培养5 d,第3天时更换培养液。培养结束后吸弃培养基,加入100 μL用α-MEN基培稀释的CCK8溶液,37 ℃避光孵育2 h,在450 nm处检测吸光度,观察女贞子多糖对破骨前体细胞活性的影响。
2.4.3 女贞子多糖对破骨细胞分化的影响将骨髓来源单个核细胞(3×104个/孔)接种到96孔板中,用含25 μg/L MCSF和10% FBS的α-MEN完全培养基培养3 d。随后用含25 μg/L MCSF和50 μg/L RANKL的培养液诱导破骨细胞分化。不同浓度的女贞子多糖(1×10-3、1×10-4、1×10-5 mg/mL)干预培养5 d,第3天时更换培养液。诱导培养结束后检测培养上清中TRAP的含量,观察女贞子多糖对破骨细胞分化的影响。
2.5 统计学方法使用SPSS 24.0软件进行数据分析,计量资料以均数±标准差(x±s)表示,组间比较采用单因素方差分析,P < 0.05为差异有统计学意义。
3 结果 3.1 女贞子多糖对体质量、脏器系数的影响图 1A所示,造模15 d后血浆中雌二醇的含量显著降低(P < 0.05),提示模型成功建立。给药8周后,与假手术相比,模型组体质量、脾脏指数、肾脏指数、子宫指数均有统计学差异(P < 0.05,表 1和图 1C),肝指数未见统计学差异(P>0.05,表 1)。与模型组相比,雌激素组和女贞子多糖3 g/kg组肾系数显著升高(P < 0.05,表 1);雌激素组子宫系数显著升高(P < 0.05,表 1),但女贞子多糖3 g/kg和6 g/kg组多子宫系数均未见统计学差异(P>0.05,表 1);女贞子多糖不同剂量组体质量和肝系数均未见统计学差异(P>0.05,表 1、图 1B和图 1C)。
|
| 注:Sham:假手术组,OVX:模型组,Estrogen:雌激素组,FLLP:女贞子多糖;与Sham相比,#P < 0.05。 图 1 女贞子多糖对去势小鼠体质量的影响(x±s) Fig. 1 The effect of FLLP on the body weight of ovariectomized mice(x±s) |
|
双能射线结果显示,与假手术组比,给药8周后模型组小鼠股骨骨密度显著降低(P < 0.05,图 2A);与模型组比,给雌激素和不同剂量女贞子多糖8周后小鼠股骨骨密度显著升高,具有统计学意义(P < 0.05,图 2A)。microCT结果显示,与假手术组比,给药8周后模型组小鼠股骨干骺端骨小梁数目(Tb.N)和骨体积分数(BV/TV)显著降低(P < 0.05,图 2B和图 2C),而骨小梁分离度(Tb.Sp)显著升高(P < 0.05,图 2D);与模型组相比,3 g/kg和6 g/kg女贞子多糖组Tb.N显著升高(P < 0.05,图 2B),3 g/kg女贞子多糖和雌激素组BV/TV显著升高(P < 0.05,图 2C),3 g/kg和6 g/kg女贞子多糖组Tb.Sp显著降低(P < 0.05,图 2D)。结果显示3 g/kg和6 g/kg女贞子多糖能明显改善去势所致的骨流失和骨微结构破坏。
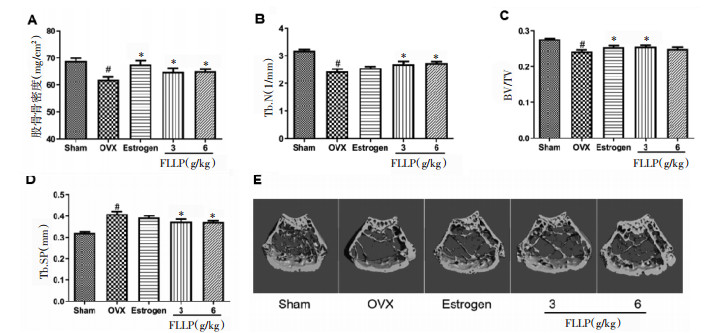
|
| 注:Sham:假手术组,OVX:模型组,Estrogen:雌激素组,FLLP:女贞子多糖;与Sham相比,#P < 0.05;与OVX相比,*P < 0.05。 图 2 女贞子多糖给药8周对去势小鼠股骨骨密度和骨微结构的影响(x±s) Fig. 2 Effect of FLLP administration for 8 weeks on bone mineral density and bone microstructure of ovariectomized mice(x±s) |
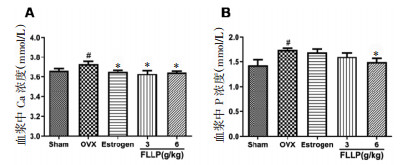
与假手术组相比,模型组血浆中Ca、P均显著升高(P < 0.05,图 3A-B)。与模型组相比,雌激素和不同剂量女贞子多糖均能显著降低小鼠血浆中Ca水平(P < 0.05,图 3A);6 g/kg女贞子多糖能显著降低小鼠血浆中P的含量(P < 0.05,图 3B)。
|
| 注:Sham:假手术组,OVX:模型组,Estrogen:雌激素组,FLLP:女贞子多糖;与Sham相比,#P < 0.05;与OVX相比,*P < 0.05。 图 3 女贞子多糖给药8周对去势小鼠血浆中Ca、P水平的影响(x±s) Fig. 3 The effect of FLLP administration for 8 weeks on the plasma Ca and P levels in ovariectomized mice(x±s) |
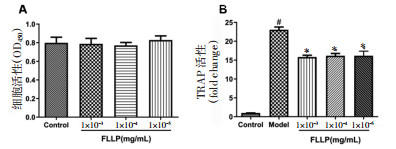
CCK-8结果显示,1×10-3、1×10-4、1×10-5 mg/mL女贞子多糖对破骨前体细胞活性无显著影响(P>0.05,图 4A)。TRAP结果显示,与对照组相比,模型组的培养上清中TRAP酶活性显著升高(P < 0.05,图 4B)。与模型组相比,1×10-3、1×10-4、1×10-5 mg/mL女贞子多糖组的培养上清中TRAP酶活性显著降低(P < 0.05,图 4B)。提示1×10-3、1×10-4、1×10-5 mg/mL女贞子多糖显著抑制骨髓来源的单个核细胞向破骨细胞分化。
|
| 注:Control:正常组,Model:模型组,FLLP:女贞子多糖;与Control相比,#P < 0.05;与Model相比,*P < 0.05。 图 4 女贞子多糖对骨髓来源的单个核细胞向破骨细胞分化的影响(x±s) Fig. 4 The effect of FLLP on the differentiation of bone marrow-derived mononuclear cells into osteoclasts(x±s) |
随着老龄化的加剧,骨质疏松症的患病率逐渐升高。有研究发现骨密度下降分为40~59岁、60~69岁及70岁以上3个年龄段,其中前两个阶段的下降幅度最明显[8]。女性骨质疏松患病率明显高于男性,由于绝经后体内雌激素水平显著下降,对破骨细胞的抑制作用减弱,导致骨密度降低。不同年龄阶段绝经后妇女的骨质疏松症患病率高达21.2%~70.5%[9]。骨质疏松性骨折是其最严重的并发症之一,具有较高的致畸和致残率,严重影响患者生活质量[10-12]。骨质疏松症的防治已成为全球关注和研究的热点之一。中医认为骨质疏松症属于“骨痹”“骨痿”和“骨枯”的范畴,病变在骨,病位在肾,与肝脾胃紧密相关,以补肾填精、健脾和胃和血化瘀为治则[13]。
女贞子具有滋阴补肾的作用,其含有三萜类、黄酮类、苯乙醇苷类、多糖类、挥发油等成分[14-17]。女贞子在临床上常用于骨质疏松症的治疗,现代药理研究表明女贞子及其成分女贞苷、特女贞苷、齐墩果酸和熊果酸等可通过激活Wnt/β-catenin/LRP6通路,促进骨髓间充质干细胞向成骨细胞分化;抑制NFATC1/RANKL信号通路抑制破骨细胞分化;促进小肠及十二指肠中钙重吸收以及升高骨组织中Ca和P的含量,调控骨代谢等多种途径发挥抗骨质疏松作用[7, 18-21]。但是女贞子多糖对骨质疏松的作用未见相关报道。战兴晓等[22]研究发现女贞子多糖的重均相对分子质量为10 721,数均相对分子质量为10 673,其由葡萄糖、鼠李糖、阿拉伯糖3种单糖组成,其物质的量比9.14∶8.10∶5.18。本研究采用经典的双侧卵巢摘除术复制骨质疏松小鼠模型,研究女贞子多糖对骨质疏松的作用。研究发现与假手术组相比,模型组小鼠子宫明显萎缩,血浆中Ca、P水平显著升高,股骨干骺端BMD、Tb.N及BV/TV显著降低,Tb.Sp显著升高,呈现骨质疏松症中典型的骨丢失的特点。而给予女贞子多糖8周后能明显改善去卵巢所致的骨密度降低和骨微结构,提示女贞子多糖具有潜在的抗骨质疏松作用。
破骨细胞是体内唯一行使骨吸收功能的细胞,抑制破骨细胞分化是目前临床抗骨质疏松治疗的主要手段之一。本研究使用MCSF和RANKL诱导骨髓来源单个核细胞向破骨细胞分化,同时给予女贞子多糖,观察女贞子多糖对破骨细胞分化的影响。目前研究中药多糖对破骨细胞分化的影响给药剂量从1×10-4 mg/mL到1×10-1 mg/mL不等[23-24]。本研究女贞子多糖相关细胞实验给药浓度是综合参考已发表多糖相关细胞实验的基础上,进行CCK-8细胞活力检测以及破骨细胞分化相关预实验后最终确定的女贞子多糖给药剂量。首先,CCK-8实验结果显示1×10-3、1×10-4、1×10-5 mg/mL女贞子多糖对破骨前体细胞活性无显著影响的(P > 0.05),然后在MCSF和RANKL诱导破骨前体细胞向破骨细胞分化的同时给予上述剂量的女贞子多糖,5 d后检测培养上清中TRAP活性,发现给予女贞子多糖处理后TRAP活性明显降低,说明1×10-3、1×10-4、1×10-5 mg/mL女贞子多糖具有抑制骨髓来源的单个核细胞向破骨细胞分化的能力,而非抑制破骨前体细胞活力。
骨代谢平衡与体内钙磷代谢关系密切[2, 25-26],因此调节钙磷代谢对维持骨代谢平衡具有重要意义。体内实验发现女贞子多糖可以降低血浆Ca和P水平,体外实验发现女贞子多糖能抑制MCSF和RANKL诱导的骨髓来源单个核细胞向破骨细胞分化,降低TRAP酶活性,说明女贞子多糖可能通过调节钙磷代谢和抑制破骨细胞分化发挥抗骨质疏松作用。但女贞子多糖是如何影响钙磷代谢尚不明确,是否影响肠钙磷吸收、促进骨组织中钙沉积或降低尿钙排泄,需要进一步实验研究。综上所述,研究证实女贞子多糖能有效抑制去卵巢所致的骨密度降低,其可能与调节骨代谢平衡和钙磷代谢有关。本研究为女贞子多糖应用于绝经后骨质疏松症治疗提供理论依据。
| [1] |
马远征, 王以朋, 刘强, 等. 中国老年骨质疏松症诊疗指南(2018)[J]. 中国实用内科杂志, 2019, 39(1): 38-61. MA Y Z, WANG Y P, LIU Q, et al. 2018 China guideline for diagnosis and treatment of senile osteoporosis[J]. Chinese Journal of Practical Internal Medicine, 2019, 39(1): 38-61. |
| [2] |
王瑞, 杨谛. 成骨细胞调节破骨细胞功能的机制及途径研究进展[J]. 山东医药, 2020, 60(36): 112-115. WANG R, YANG D. Research Progress on mechanism and pathway of osteoblast regulating osteoclast function[J]. Shandong Medical Journal, 2020, 60(36): 112-115. DOI:10.3969/j.issn.1002-266X.2020.36.030 |
| [3] |
MORIZIO P, BURKHART J I, OZAWA S. Denosumab: a unique perspective on adherence and cost-effectiveness compared with oral bisphosphonates in osteoporosis patients[J]. The Annals of Pharmacotherapy, 2018, 52(10): 1031-1041. DOI:10.1177/1060028018768808 |
| [4] |
张正良. 唑来膦酸钠治疗老年骨质疏松症的临床观察[J]. 浙江创伤外科, 2017, 22(2): 233-234. ZHANG Z L. Clinical observation of zoledronic acid sodium in the treatment of senile osteoporosis[J]. Zhejiang Journal of Traumatic Surgery, 2017, 22(2): 233-234. DOI:10.3969/j.issn.1009-7147.2017.02.012 |
| [5] |
李晓曦, 刘仁慧. 淫羊藿、女贞子及其相关方剂治疗骨质疏松症的研究进展[J]. 医学研究杂志, 2019, 48(4): 148-152. LI X X, LIU R H. Research progress of epimedium, ligustrum lucidum and related prescriptions in the treatment of osteoporosis[J]. Journal of Medical Research, 2019, 48(4): 148-152. |
| [6] |
王涛, 刘佳维, 赵雪莹. 女贞子中化学成分、药理作用的研究进展[J]. 黑龙江中医药, 2019, 48(6): 352-354. WANG T, LIU J W, ZHAO X Y. Research progress on chemical constituents and pharmacological effects of fructus ligustri lucidi[J]. Heilongjiang Journal of Traditional Chinese Medicine, 2019, 48(6): 352-354. |
| [7] |
陈楠, 李晓莉, 张岩. 女贞子及其活性成分抗骨质疏松作用及途径研究进展[J]. 中国药理学通报, 2018, 34(8): 1057-1060. CHEN N, LI X L, ZHANG Y. Research progress on osteoprotective effects of fructus ligustri lucidi and its active components and action pathways involved[J]. Chinese Pharmacological Bulletin, 2018, 34(8): 1057-1060. DOI:10.3969/j.issn.1001-1978.2018.08.006 |
| [8] |
林杭, 郝毅, 赵正旭, 等. 不同年龄男性骨质疏松症患者骨密度及骨代谢指标的变化研究[J]. 中国卫生检验杂志, 2018, 28(1): 74-75, 78. LIN H, HAO Y, ZHAO Z X, et al. Study on changes of bone mineral density and bone metabolism in male patients with osteoporosis at different ages[J]. Chinese Journal of Health Laboratory Technology, 2018, 28(1): 74-75, 78. |
| [9] |
高雪莲, 高莉敏. 绝经后妇女骨质疏松患病率现状及影响因素分析[J]. 现代医学, 2015, 43(7): 870-873. GAO X L, GAO L M. Prevalence and influence factors of osteoporosis among postmenopausal women[J]. Modern Medical Journal, 2015, 43(7): 870-873. |
| [10] |
COSMAN F, BEUR S J, LEBOFF M S, et al. Clinician's guide to prevention and treatment of osteoporosis[J]. Osteoporosis International, 2014, 25(10): 2359-2381. DOI:10.1007/s00198-014-2794-2 |
| [11] |
胡洁玫, 刘晨. 骨质疏松症流行病学概况及相关危险因素[J]. 世界最新医学信息文摘, 2019, 19(42): 55-57. HU J M, LIU C. Epidemiological profile of osteoporosis and related risk factor[J]. World Latest Medicine Information, 2019, 19(42): 55-57. |
| [12] |
季敏. 上海某街道老年女性骨质疏松症的相关因素分析[J]. 上海医药, 2018, 39(24): 50-52. JI M. Analysis of related factors of osteoporosis in elderly women in a community in Shanghai[J]. Shanghai Medical & Pharmaceutical Journal, 2018, 39(24): 50-52. DOI:10.3969/j.issn.1006-1533.2018.24.019 |
| [13] |
陈赛楠, 吴华嵩, 程佑民, 等. 续苓健骨方对去卵巢骨质疏松模型大鼠血液钙磷代谢的影响[J]. 中国骨质疏松杂志, 2019, 25(4): 528-532. CHEN S N, WU H S, CHENG Y M, et al. The effect of Xuling Jiangu Prescription on blood calcium and phosphorus metabolism in ovariectomized osteoporosis model rats[J]. Chinese Journal of Osteoporosis, 2019, 25(4): 528-532. DOI:10.3969/j.issn.1006-7108.2019.04.021 |
| [14] |
李德成, 刘庆燕. 女贞子化学成分和药理作用的研究进展[J]. 当代医药论丛, 2019, 17(14): 33-34. LI D C, LIU Q Y. Research progress on chemical constituents and pharmacological effects of fructus ligustri lucidi[J]. Contemporary Medical Symposium, 2019, 17(14): 33-34. DOI:10.3969/j.issn.2095-7629.2019.14.020 |
| [15] |
高赛, 周欣, 陈华国. 女贞子化学成分及质量控制研究进展[J]. 中国中医药信息杂志, 2018, 25(12): 133-136. GAO S, ZHOU X, CHEN H G. Research progress in chemical components and quality control of ligustri lucidi fructus[J]. Chinese Journal of Information on Traditional Chinese Medicine, 2018, 25(12): 133-136. DOI:10.3969/j.issn.1005-5304.2018.12.034 |
| [16] |
秦艳芳. 女贞子环烯醚萜类成分及其药理作用研究进展[J]. 家庭医药.就医选药, 2018(10): 83. QIN Y F. Research Progress on iridoids from fructus ligustrilucidi and their pharmacological effects[J]. Home Medicine, 2018(10): 83. |
| [17] |
刘先芳, 梁敬钰, 孙建博, 等. 女贞子化学成分和药理活性研究进展[J]. 海峡药学, 2018, 30(1): 1-8. LIU X F, LIANG J Y, SUN J B, et al. Research progress of the fructus ligustri lucidi on the chemical compounds and pharmacological activity[J]. Strait Pharmaceutical Journal, 2018, 30(1): 1-8. DOI:10.3969/j.issn.1006-3765.2018.01.001 |
| [18] |
贾强强, 陈贝贝, 朱如愿, 等. 女贞子对去卵巢大鼠抗骨质疏松作用及其对GH/IGF-1信号通路的影响[J]. 中草药, 2019, 50(16): 3852-3858. JIA Q Q, CHEN B B, ZHU R Y, et al. Antiosteoporosis effect of ligustrum lucidum on ovariectomized rats and its effect on GH/IGF-1 signaling pathway[J]. Chinese Traditional and Herbal Drugs, 2019, 50(16): 3852-3858. DOI:10.7501/j.issn.0253-2670.2019.16.017 |
| [19] |
李琴. 女贞子及其成分对MC3T3-E1细胞增殖和OPG表达影响及其机制研究[D]. 北京: 中国农业大学, 2015. LI Q. Effect and mechanism research of fructus ligustri lucidiand its constituents on MC3T3-E1 proliferation and OPG expression[D]. Beijing: China Agricultural University, 2015. |
| [20] |
张明发, 沈雅琴. 女贞子及其活性成分抗骨质疏松症的研究进展[J]. 药物评价研究, 2014, 37(6): 566-571. ZHANG M F, SHEN Y Q. Research progress in anti-osteoporosis of ligustrum lucidum and its active components[J]. Drug Evaluation Research, 2014, 37(6): 566-571. |
| [21] |
杨军, 张小莉, 刘仕杰, 等. 齐墩果酸对去卵巢骨质疏松症雌鼠的疗效及机理研究[J]. 时珍国医国药, 2013, 24(7): 1564-1565. YANG J, ZHANG X L, LIU S J, et al. Study on the efficacy and mechanism of oleanolic acid in ovariectomized female rats with osteoporosis[J]. Lishizhen Medicine and Materia Medica Research, 2013, 24(7): 1564-1565. DOI:10.3969/j.issn.1008-0805.2013.07.009 |
| [22] |
战兴晓, 刘希光, 刘祥龙, 等. 女贞子多糖相对分子质量与组成分析[J]. 中草药, 2019, 50(18): 4288-4292. ZHAN X X, LIU X G, LIU X L, et al. Molecular weight and composition determination of polysaccharide from ligustrum lucidum[J]. Chinese Traditional and Herbal Drugs, 2019, 50(18): 4288-4292. DOI:10.7501/j.issn.0253-2670.2019.18.006 |
| [23] |
HWANG Y H, JANG S A, LEE A, et al. Polysaccharides isolated from Lotus leaves (LLEP) exert anti-osteoporotic effects by inhibiting osteoclastogenesis[J]. International Journal of Biological Macromolecules, 2020, 161: 449-456. DOI:10.1016/j.ijbiomac.2020.06.059 |
| [24] |
HWANG Y H, HA H, KIM R, et al. Protective effects of a polysaccharide BLE0 isolated from barley leaf on bone loss in ovariectomized mice[J]. International Journal of Biological Macromolecules, 2019, 123: 314-321. DOI:10.1016/j.ijbiomac.2018.11.075 |
| [25] |
WEAVER C M, ALEXANDER D D, BOUSHEY C J, et al. Calcium plus vitamin D supplementation and risk of fractures: an updated meta-analysis from the national osteoporosis foundation[J]. Osteoporosis International, 2016, 27(1): 367-376. DOI:10.1007/s00198-015-3386-5 |
| [26] |
PASCHALIS E P, GAMSJAEGER S, HASSLER N, et al. Vitamin D and calcium supplementation for three years in postmenopausal osteoporosis significantly alters bone mineral and organic matrix quality[J]. Bone, 2017, 95: 41-46. DOI:10.1016/j.bone.2016.11.002 |
 2022, Vol. 39
2022, Vol. 39