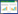文章信息
- 高静, 王彦红, 许邦礼
- GAO Jing, WANG Yanhong, XU Bangli
- 知母总皂苷对雌性性早熟SD大鼠性激素水平的影响及对HPGA轴的作用研究
- Effects of anemarrhena total saponins on sex hormone levels in female SD rats with precocious puberty and its effects on HPGA axis
- 天津中医药, 2022, 39(1): 110-115
- Tianjin Journal of Traditional Chinese Medicine, 2022, 39(1): 110-115
- http://dx.doi.org/10.11656/j.issn.1672-1519.2022.01.25
-
文章历史
- 收稿日期: 2021-09-29
2. 河南省儿童医院/河南省儿童医院新生儿科, 郑州 450000
性早熟为儿童常见的一种青春期发育异常疾病,以女孩特发性性早熟最多见,且其对儿童身心健康带来的不良影响以及逐年增加的发病趋势,均日益受人们关注。据报道[1],性早熟患儿下丘脑-垂体-性腺轴(HPGA)功能启动过早,导致其骨龄超前发育,影响其生长潜力与最终身高,加上第二性征与月经初潮提前出现,容易出现社交退缩、抑郁等心理行为异常。Eugster等[2]报道促性腺激素释放激素(GnRH)的长效类似物已成为全球治疗中枢性性早熟的常用药,但长期随访以及比较数据均有限,在临床使用中存在不确定性。中医学认为,性早熟患儿往往形体偏胖,食欲旺盛,有面赤口渴、怕热、便秘、急躁易怒等症状,呈痰火互结征象。刘志伟等[3]通过挖掘中药治疗性早熟的组方用药特点及规律发现知母为应用频次最高的药物。目前,关于儿童性早熟中医药研究集中于中药方剂上,其中知母有清热泻火、滋阴润燥之功效,主治热病烦渴、肠燥便秘,为该病治疗常用药材。知母总皂苷为知母主要成分,近年来被发现有降压、平衡血糖、抗炎、抗性抑郁等功效,但用于性早熟治疗中的作用方面报道鲜见[4]。本研究拟通过动物实验探讨知母总皂苷治疗雌性性早熟大鼠的作用及其机制,为中医药研发提供实验依据。
1 材料与方法 1.1 材料 1.1.1 实验动物SPF级雌性SD大鼠,50只,5日龄,体质量8~10 g,购自北京斯贝福生物技术有限公司,生产许可证号SCXK(京)2019-0010,共同饲养在自然光照环境中,自由摄食饮水,21日龄离乳。本实验中动物处置方法符合一般动物实验伦理学标准。
1.1.2 药物、主要试剂和仪器知母总皂苷[辽宁生物医药科技有限公司,黄色粉末,UV法测纯度>80%,主要成分:知母皂苷原B-II(58%),知母皂苷原E1(4%),知母皂苷原B(1%)等],达那唑胶囊(江苏联环药业股份有限公司,批准文号H20023116),曲普瑞林(Ferring GmbH,批准文号H20090256)。卵泡生成激素(FSH)、黄体生成激素(LH)、雌二醇(E2)促性腺激素释放激素(ELISA)试剂盒(上海双赢生物科技有限公司),兔抗大鼠肿瘤转移抑制基因亲吻素-1(KiSS-1)、G蛋白偶联受体54(GPR54)、GnRH及其受体(GnRHR)、β-actin一抗(ABcam),辣根过氧化物酶标记的山羊抗兔IgG二抗(上海碧云天生物技术有限公司)。PowerPac型号电泳仪(美国Bio-Rad公司)。
1.2 方法 1.2.1 造模、分组和干预取40只大鼠建立性早熟模型[5]:在大鼠出生后5 d一次性皮下注射300 μg达那唑(取300 μg胶囊溶于体积比为1∶1的乙二醇/乙醇25 μL中制成混合液)诱导性成熟。剩余10只设为正常组,皮下注射等体积生理盐水。造模大鼠随机分为模型组、知母总皂苷低剂量组(知低组)、知母总皂苷高剂量组(知高组)、阳性对照组,每组各10只,造模15日龄起开始给药:知低组、知高组分别灌胃100、200 mg/kg知母总皂苷(以生理盐水将知母总皂苷粉末配制为相应浓度)[6],模型组、正常组灌胃等体积生理盐水,阳性对照组皮下注射曲普瑞林100 μg/kg[7],平均每日1次,连续干预16 d,记录各组大鼠阴门开启时间与首个动情间期时间。
1.2.2 标本采集大鼠20日龄起,每日上午9点准时观察阴门开启情况,并在模型组大鼠阴门开启时间作为处死时间点(约21~23日龄),同时一并处死其余4组大鼠,留取外周血、子宫、卵巢、下丘脑,下丘脑液氮冷冻保存。称取子宫、卵巢湿质量,计算子宫、卵巢指数。子宫指数=子宫质量(mg)/大鼠体质量(g),卵巢指数=两侧卵巢总质量(mg)/大鼠体质量(g)。
1.2.3 苏木精-伊红(HE)染色观察大鼠卵巢形态学变化取大鼠卵巢置于10%多聚甲醛中固定,经脱水、透明、浸蜡、包埋等常规操作后,制备4 μm后的组织病理切片,进行HE染色后光镜下观察大鼠卵巢形态学,并计算各组大鼠卵巢黄体数量。
1.2.4 ELISA检测大鼠血清性激素水平取大鼠外周血,3 000 r/min离心10 min,离心半径8 cm,取上清液,-20 ℃保存。参考FSH、LH、E2 ELISA试剂盒说明书进行操作,用酶标仪在450 nm波长处检测吸光度值,检测血清FSH、LH、E2水平。
1.2.5 qPCR检测KISS-1、GPR54、GnRH、GnRHR mRNA表达取一半下丘脑组织,Trizol法提取总RNA,测定RAN浓度、纯度,以总RNA为模板逆转录合成cDNA第一链,反应体系20 μL,依次加入5×Prime Script Buffer缓冲液2 μL,Prime Script RT Enzyme Mix 0.5 μL,Oligo Dt Primer 0.5 μL,Random 6 mers 0.5 μL,RNA样品原液200 ng,最后用RNzse Free dH2O补足至20 μL。将上述PCR反应液加入PCR反应管内,混匀后放入扩增仪,引物序列为Kiss-1:上游5′-GCGTGCTGCTTCTCCTCTGTGT-3′,下游5′-CTGTTGGCCTGTGGGTTCA-3′;GPR54:上游5′-GCGGCCCACAGATGTCACTTT-3′,下游5′-AGGTGGGCAGCGGATAGAG-3′;GnRH:上游5′-GGAGCTCTGGAACGTCTGATT-3′,下游5′-CAGC-GTCAATGTCACACTCG-3′;GnRHR:上游5′-CAGGACCCACGCAAACTACA-3′,下游5′-GGGA-GTCCAGCAGATGACAA-3′;β-actin:上游5′-TGA-CAGGATGCAGAAGGAGA-3′,下游5′-TAGAGCC-ACCAATCCACACA-3′。PCR反应条件:预变性95 ℃30 s,PCR反应95 ℃ 5 s,60 ℃ 30 s,94 ℃变性6 min,55 ℃退火,72 ℃延伸,共55个循环。反应结束后,用2-△△Ct公式计算目的基因。
1.2.6 Western blot检测KISS-1、GPR54、GnRH、GnRHR蛋白表达取另一半下丘脑,RIPA裂解,离心取上清,离心机半径8 cm,BCA检测蛋白浓度,加上样缓冲液,沸水浴5 min变性,进行SDS-PAGE电泳,电转PVDF膜,5%脱脂奶粉封闭2 h。加兔抗大鼠KISS-1、GPR54、GnRH、GnRHR、β-actin一抗(稀释1∶1 000),4 ℃过夜孵育,次日加辣根过氧化物酶标记的山羊抗兔IgG二抗(稀释1∶2 000)室温孵育2 h,ECL发光显色,用Gel-pro Application软件分析目的条带灰度值。
1.3 统计学方法采用SPSS 26.0统计软件分析实验数据以均数±标准差(x±s)表示,多组比较进行单因素方差分析,两两比较进行LSD-t检验,以P < 0.05为差异有统计学意义。
2 结果 2.1 大鼠阴门开启时间与首个动情间期时间与正常组比较,模型组大鼠阴门开启时间与首个动情间期时间较短(P<0.05);与模型组比较,知低组、知高组、阳性对照组大鼠阴门开启时间与首个动情间期时间较长(P<0.05);与知低组比较,知高组、阳性对照组大鼠阴门开启时间与首个动情间期时间较长(P<0.05);与知高组比较,阳性对照组大鼠阴门开启时间与首个动情间期时间较长(P<0.05)。见表 1。
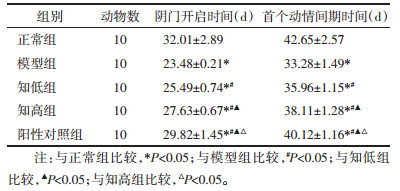
|
与正常组比较,模型组大鼠子宫、卵巢指数较高(P<0.05);与模型组比较,知低组、知高组、阳性对照组大鼠子宫、卵巢指数较低(P<0.05);与知低组比较,知高组、阳性对照组大鼠子宫、卵巢指数较低(P<0.05);与知高组比较,阳性对照组大鼠子宫、卵巢指数较低(P<0.05)。见表 2。
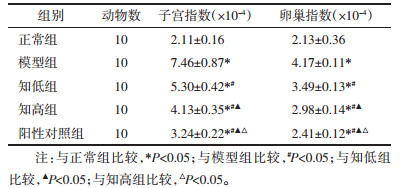
正常组大鼠卵巢形态正常。与正常组比较,模型组大鼠卵巢明显增大。与模型组比较,知低组、知高组、阳性对照组卵巢形态改善,见图 1。在黄体数量上,模型组、知低组、知高组、阳性对照组、正常组逐渐减少(P<0.05)。见表 3。
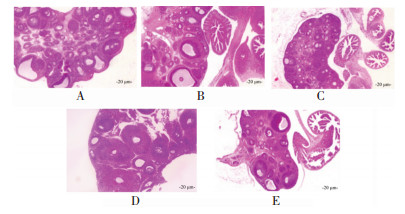
|
| 注:A.正常组;B.模型组;C.知低组;D.知高组;E.阳性对照组。 图 1 大鼠卵巢形态病理学图(HE染色,×100) Fig. 1 Morphological and pathological map of the ovary of rats (HE staining, ×100) |
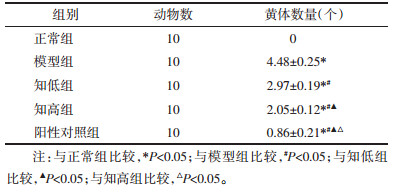
与正常组比较,模型组大鼠血清FSH、LH、E2水平升高(P<0.05);与模型组比较,知低组、知高组、阳性对照组血清FSH、LH、E2水平降低(P<0.05);与知低组比较,知高组、阳性对照组血清FSH、LH、E2水平降低(P<0.05);与知高组比较,阳性对照组血清FSH、LH、E2水平降低(P<0.05)。见表 4。
与正常组比较,模型组大鼠下丘脑KISS-1、GPR54、GnRH、GnRHR mRNA表达上调(P<0.05);与模型组比较,知低组、知高组KISS-1、GPR54、GnRH、GnRHR mRNA表达下调(P<0.05);与知低组比较,知高组KISS-1、GPR54、GnRH、GnRHR mRNA表达下调(P<0.05)。见表 5。
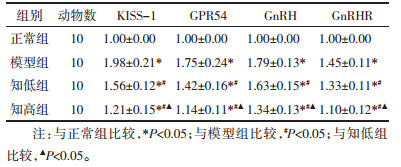
|
与正常组比较,模型组大鼠下丘脑KISS-1、GPR54、GnRH、GnRHR蛋白表达上调(P<0.05);与模型组比较,知低组、知高组KISS-1、GPR54、GnRH、GnRHR蛋白表达下调(P<0.05);与知低组比较,知高组KISS-1、GPR54、GnRH、GnRHR蛋白表达下调(P<0.05)。见表 6和图 2。
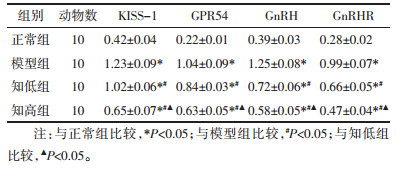
|
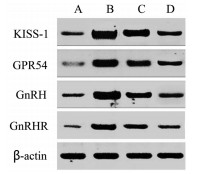
|
| 注:A.正常组;B.模型组;C.知低组;D.知高组。 图 2 大鼠下丘脑KISS-1、GPR54、GnRH、GnRHR蛋白电泳图 Fig. 2 KISS-1, GPR54, GnRH, GnRHR protein electrophoresis diagram in hypothalamus of rats |
性早熟为儿童生长发育期间因HPGA轴功能提前启动、功能亢进而发生的发育障碍性疾病。中医学者对性早熟进行了大量研究,认为其病机为相火偏旺、阴阳失调,病位在冲任,源在肝肾,是因肾阴不足,无法制阳,致阴虚火旺,相火妄动,则天葵早至,生长发育加速[8]。中医学中肾之推动作用类似现代医学中HPGA刺激生长发育的机制。知母味苦甘,性寒,归肺、胃、肾三经,为清热泻火、滋阴润燥之要药,可泻肝火而滋肾,宜用于性早熟治疗中。知母总皂苷为知母主要药效成分,故以其为实验用药,分析其对性早熟大鼠模型的作用及可能机制,为性早熟相关中药研发提供借鉴。
阴门开启是雌性性发育启动的外在标志,也是判断青春期启动的标准[9]。结果显示:知低组、知高组大鼠阴门开启时间与首个动情间期时间长于模型组,提示知母总皂苷可延缓大鼠性发育进程。性早熟主要病理表现为内生殖器官增大,第二性征提前出现,故子宫、卵巢指数可反应大鼠性早熟程度:知低组、知高组大鼠子宫、卵巢指数低于模型组,提示知母总皂苷可缓解大鼠性器官发育过度;结合大鼠卵巢HE染色结果可知,知母总皂苷不仅能改善大鼠卵巢形态,还可减少黄体生成数量,进一步提示其可控制性早熟发展程度。FSH、LH由垂体前叶合成,对青春期发育、性腺、生殖能力有重要影响,分泌过早可导致性腺过早激活[10]。E2由卵巢分泌,其受体分布于乳房、卵巢等部位,对性器官成熟有促进作用[11]。下丘脑分泌GnRH,从而刺激垂体前叶释放FSH、LH,并作用于性腺(卵巢),分泌雌激素E2,形成HPGA轴[12]。子宫、卵巢均为促性腺激素的器官,FSH、LH分泌增加,结合性腺受体,可增加雌性子宫、卵巢体积。结果显示:知低组、知高组大鼠血清FSH、LH、E2水平低于模型组,提示知母总皂苷可降低FSH、LH水平,从而减少E2分泌,进而改善子宫、卵巢病理。Hu等[13]报道促性腺激素释放激素类似物如曲普瑞林等可通过抑制FSH、LH,抑制第二性行为发展。本研究结果提示知母总皂苷在调节性早熟大鼠性激素水平方面的效果仅次于促性腺激素释放激素类似物,而与Hu等研究结果不同之处在于本研究证实高剂量知母总皂苷治疗性早熟的效果更佳。
迄今关于性早熟的确切病因、分子机制尚未阐明。Xu等[14]报道KISS-1/GPR54基因与生殖系统发育密切相关,故KISS-1/GPR54基因为性早熟研究的最佳候选基因,对HPGA轴启动十分重要。KISS-1是由54个氨基酸残基构成的多肽,其编码产物转移抑制素与其受体结合种植于胎盘,在调控胎盘发育和HPGA轴上发挥着重要作用[15]。GPR54是一个膜结合蛋白受体家族,转移抑制素为其天然配体,主要存在于下丘脑、中脑等中枢神经系统,若其功能突变或缺失可导致性腺发育不全、机能减退[16]。性早熟大鼠血清性激素浓度与GnRH密切相关,而GnRH、GnRHR的合成与释放受KISS-1/GPR54基因影响,罗小娟等[17]证明雌性大鼠性早熟发生机制中涉及中枢性关键基因KISS-1/GPR54 mRNA提前表达,激活了下丘脑神经元细胞合成GnRH,从而启动HPGA轴,导致性发育提前。结果提示:模型组、知低组、知高组、正常组,大鼠KISS-1、GPR54、GnRH、GnRHR mRNA与蛋白均逐渐下调,提示知母总皂苷可能通过抑制KISS-1、GPR54、GnRH、GnRHR蛋白表达,抑制HPGA轴发挥性早熟治疗作用。
综上所述,知母总皂苷可降低性早熟大鼠性激素水平,可能对HPGA轴有抑制作用。
| [1] |
AGUIRRE R S, EUGSTER E A. Central precocious puberty: from genetics to treatment[J]. Best Practice & Research Clinical Endocrinology & Metabolism, 2018, 32(4): 343-354. |
| [2] |
EUGSTER E A. Treatment of central precocious puberty[J]. Journal of the Endocrine Society, 2019, 3(5): 965-972. DOI:10.1210/js.2019-00036 |
| [3] |
刘志伟, 刘璐佳, 景伟超, 等. 基于数据挖掘中药治疗性早熟的用药规律研究[J]. 中国医药导报, 2019, 16(10): 120-123, 136. LIU Z W, LIU L J, JING W C, et al. Analysis on medication rule of Chinese medicine in treating precocious puberty based on data mining technology[J]. China Medical Herald, 2019, 16(10): 120-123, 136. |
| [4] |
潘婷, 陈欢, 刘攀旺, 等. 知母总皂苷对佐剂型关节炎模型大鼠琥珀酸/GPR91/IL-1β通路的影响[J]. 中国中医基础医学杂志, 2019, 25(5): 610-613. PAN T, CHEN H, LIU P W, et al. Effects of total saponins of anemarrhena asphodeloides on succinic acid/GPR91/IL-1 beta pathway in adjuvant arthritis model rats[J]. Chinese Journal of Basic Medicine in Traditional Chinese Medicine, 2019, 25(5): 610-613. |
| [5] |
PARK S C, TRINH T A, LEE W Y, et al. Effects of estrogen inhibition formula herbal mixture for danazol-induced precocious puberty in female rats: an experimental study with network pharmacology[J]. Integrative Medicine Research, 2021, 10(3): 100708. DOI:10.1016/j.imr.2020.100708 |
| [6] |
刘卓, 金英, 隋海娟. 知母总皂苷对老年大鼠海马突触相关蛋白表达的影响[J]. 中国药理学通报, 2012, 28(3): 441-442. LIU Z, JIN Y, SUI H J. Effects of saponins from anemarrhena asphodeloides bge on expression of synapse associated proteins in hippocampus in aged rats[J]. Chinese Pharmacological Bulletin, 2012, 28(3): 441-442. DOI:10.3969/j.issn.1001-1978.2012.03.033 |
| [7] |
段娟, 刘莱莱. 滋阴泻火方对性早熟大鼠下丘脑GnRH mRNA和Leptin mRNA表达的影响[J]. 四川中医, 2015, 33(7): 38-41. DUAN J, LIU L L. The effect of Ziyin Xiehuo Recipe on GnRH mRNA and Leptin mRNA expression in hypothalamus of precocious puberty rats[J]. Journal of Sichuan of Traditional Chinese Medicine, 2015, 33(7): 38-41. |
| [8] |
任娟, 叶进. 叶进基于脾肾互赞理论辨治性早熟经验[J]. 山东中医杂志, 2019, 38(10): 970-973. REN J, YE J. Experience of YE Jin on treating precocious puberty according to the theory of spleen and kidney assisting each other[J]. Shandong Journal of Traditional Chinese Medicine, 2019, 38(10): 970-973. |
| [9] |
ZHOU S S, LI P. Effects of NELL2 on the regulation of GnRH expression and puberty in female rats[J]. Genetics and Molecular Research: GMR, 2014, 13(3): 6672-6682. DOI:10.4238/2014.August.28.12 |
| [10] |
TAO Y H, SI C Y, LI H Y, et al. Effect of gonadotropin-releasing hormone analog on ovarian reserve in children with central precocious puberty[J]. Annals of Palliative Medicine, 2020, 9(1): 53-62. DOI:10.21037/apm.2020.01.04 |
| [11] |
QIAN F, SHI N, ZHOU H. Estrogen can promote the expression of genes related to precocious puberty in GT1-7 mouse hypothalamic GnRH neuronal cell line via activating G protein-coupled estrogen receptor[J]. General Physiology and Biophysics, 2020, 39(1): 27-36. DOI:10.4149/gpb_2019049 |
| [12] |
JU M D, YANG L, ZHU J, et al. MiR-664-2 impacts pubertal development in a precocious-puberty rat model through targeting the NMDA receptor-1[J]. Biology of Reproduction, 2019, 100(6): 1536-1548. DOI:10.1093/biolre/ioz044 |
| [13] |
HU K L, SUN W Y, LI Y, et al. Study on the mechanism of sarsasapogenin in treating precocious puberty by regulating the HPG axis[J]. Evidence-Based Complementary and Alternative Medicine: ECAM, 2020, 2020: 1978043. |
| [14] |
XU L X, XUE H L, LI S N, et al. Seasonal differential expression of KiSS-1/GPR54 in the striped hamsters (Cricetulus barabensis) among different tissues[J]. Integrative Zoology, 2017, 12(3): 260-268. DOI:10.1111/1749-4877.12223 |
| [15] |
KANASAKI H, TUMURBAATAR T, TUMURGAN Z, et al. Effect of relaxin-3 on Kiss-1, gonadotropin-releasing hormone, and gonadotropin subunit gene expression[J]. Reproductive Medicine and Biology, 2019, 18(4): 397-404. DOI:10.1002/rmb2.12298 |
| [16] |
LEI Z L, BAI X, MA J X, et al. Kisspeptin 13 inhibits bleomycin induced pulmonary fibrosis through GPR54 in mice[J]. Molecular Medicine Reports, 2019, 20(2): 1049-1056. |
| [17] |
罗小娟, 曹科, 金晨, 等. 双酚A诱导青春前期雌性大鼠中枢性性早熟模型的建立[J]. 中国卫生检验杂志, 2019, 29(3): 264-268. LUO X J, CAO K, JIN C, et al. Establishment of central precocious puberty model in prepuberty female rats induced by bisphenol A[J]. Chinese Journal of Health Laboratory Technology, 2019, 29(3): 264-268. |
2. Department of Neonatology, Zhengzhou Children's Hospital/Henan Children's Hospital, Zhengzhou 450000, China
 2022, Vol. 39
2022, Vol. 39