文章信息
- 蔡秋晗, 胡思源, 钟成梁, 郭圣璇
- CAI Qiuhan, HU Siyuan, ZHONG Chengliang, GUO Shengxuan
- 估计目标结构性框架及其在中药临床研究中的应用
- Framework of estimands and its application in clinical trials of traditional Chinese medicine
- 天津中医药, 2022, 39(10): 1289-1294
- Tianjin Journal of Traditional Chinese Medicine, 2022, 39(10): 1289-1294
- http://dx.doi.org/10.11656/j.issn.1672-1519.2022.10.12
-
文章历史
- 收稿日期: 2022-06-16
2019年11月,国际人用药品注册技术协调会(ICH)发布了E9(R1):《临床试验中的估计目标与敏感性分析》[1],引入估计目标(Estimands)的概念,并构建了基于估计目标的临床试验计划、设计、实施、分析和解释的结构化框架。2021年1月,国家药品监督管理局发布了《关于适用 < E9(R1):临床试验中的估计目标与敏感性分析 > 国际人用药品注册技术协调会指导原则的公告》[2],提出12个月后启动的药物临床研究适用E9(R1)的要求。2021年10月,ICH发布了E8(R1)《临床研究的一般考虑》[3],进一步强调了规范设立估计目标、识别和处理伴发事件的重要性。为适应这些新变化,国家药品审评中心于2021年12月修订了《药物临床试验数据管理与统计分析计划指导原则》[4]。
自E9(R1)发布以来,已有TransCelerate、美国食品药品监督管理局/美国国立卫生研究院(NIH/FDA)、ICH[5-7]等跨行业学术组织/机构着手融入估计目标理念的临床试验方案模板的制定工作。其中,TransCelerate于2021年率先共享了最新版本的方案模板及配套文件。为在中药新药临床试验设计、实施和分析中更好地应用估计目标及其结构性框架,文章从估计目标及其结构性框架、中药临床试验常见的伴发事件及处理策略、敏感性分析和补充分析、引入估计目标的临床试验方案设计等方面,对估计目标和敏感性分析及其在中药临床试验设计中的应用进行了探讨。
2 估计目标及其结构性框架 2.1 估计目标估计目标是对治疗效应的精准描述,反映了既定试验目的提出的临床问题,在群体层面汇总同一批患者在不同治疗条件下比较的结果[8]。既往,笔者常在试验方案中的“试验目的”项下,列出主、次要目的及其观察指标,意即构成这个试验方案的基本框架。但方案中对于各主、次要指标的描述,还不是十分精确、系统,给新药监管决策带来了一定的不确定性,也妨碍了研究数据的二次应用。因此,在1项临床试验中设立针对试验目的和临床问题的估计目标,精准描述干预措施的治疗效应,非常必要。
为精准描述治疗效应,E9(R1)提出了估计目标的五大属性,即治疗(处理)、人群、变量(或终点)、其他伴发事件(ICEs)和群体层面汇总。1)治疗,可以是单独的干预措施、同时进行的干预措施组合(如加载治疗)或一个复杂干预序列的整体方案。2)人群,即临床问题所针对的患者人群,可以是整个试验人群、按某种基线特征定义的亚组或基于ICEs定义的“主层”。3)变量,为解决临床问题从每位患者中获得的变量,可以包括或不包括ICEs。4)其他ICEs,指通过治疗、人群和变量的精确说明即可得到解决的事件以外的一些事件,需要选择合适的处理策略(如疗法策略)予以解决。5)群体层面汇总,即规定群体层面的汇总统计量,如率差、均数差、风险比、危险比、比值比等,为不同治疗之间的比较提供基础。
2.2 基于估计目标的结构性框架为协调临床试验的目的与实施的一致性,促进申办方和监管机构关于试验目的、试验设计、数据收集、分析、结果解读的思考和交流,E9(R1)提出了一个基于估计目标的结构化框架。这个结构化框架,包括试验目的、估计目标、主估计方法和主估计值以及一种或多种敏感性分析、补充分析几部分:1)试验目的,应针对感兴趣的临床问题,定义并明确治疗效应。2)估计目标,应合理定义,以指导试验的实施、分析和结果解读。3)主估计方法和主估计值,应依据估计目标,考虑不同数据类型,选择合适主估计方法,如卡方检验、Logistic回归模型、协方差/秩协方差、重复测量混合效应模型(MMRM)、对数秩检验(Log-rank)、Cox比例风险回归分析等,计算主估计值。4)敏感性分析,因主估计方法往往基于某些统计假设,建议进行一种或多种敏感性分析来评估偏离假设时主估计方法的稳健性。5)补充分析,即主估计方法和敏感性分析之外的分析,可以提供对治疗效应更全面的了解,但在解释研究结果方面的作用通常较小。通过上述结构化框架,可以在一定程度上“程式化”整个思考和交流的过程。
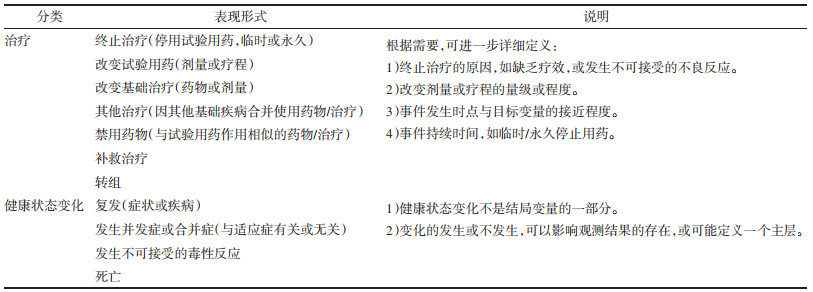
3 中药临床试验常见的ICEs及处理策略 3.1 ICEs及处理策略ICEs指治疗开始后发生的事件,可影响与临床问题相关的观测结果的解释或存在[8]。影响结果解释的ICEs,包括终止治疗、使用额外/其他治疗(如基础治疗、补救药物和禁用药物);影响结果存在的ICEs,主要包括终末事件(如死亡、截肢),且这些事件不是变量的一部分。在构建估计目标时需要考虑ICEs。与缺失数据不同,ICEs不应被认为是临床试验中需要避免的缺陷,退出研究及其他缺失数据的原因(如生存结局试验中的数据管理性删失)本身都不属于ICEs。常见ICEs的分类和表现形式,见表 1。
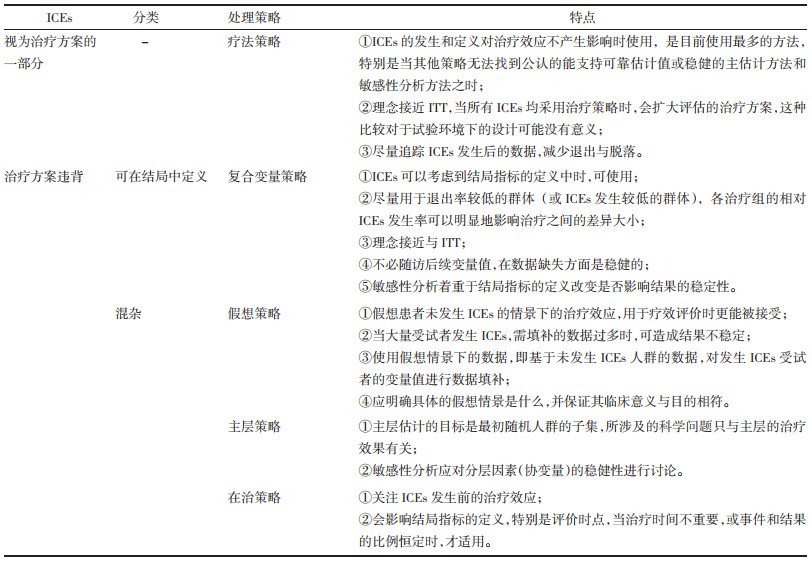
ICEs是治疗过程中自然发生的事件,无法通过随机避免,应在研究设计早期阶段考虑并明确其处理策略。E9(R1)中推荐了5种ICEs的处理策略,包括疗法策略、假想策略、复合变量策略、在治策略、主层策略[8]。不同的处理策略在解释临床问题、适用场景、数据处理方式等方面均有不同。例如,ICEs被视为治疗方案的一部分(如改变基础治疗、使用补救药物或禁用药物),疗法策略是最容易被接受的方法。ICEs为治疗方案违背,若可以定义到结局指标之中(如因缺乏疗效的终止治疗),则倾向于采用复合变量策略;若为其他混杂,可结合估计目标的其他因素,选择假想策略(如ICEs为因不可接受毒性反应的终止治疗)、主层策略(如ICEs为预防重症研究中的接种疫苗后的仍然感染)、在治策略(如ICEs为缓解症状研究中因死亡所致的终止对症治疗)等[9]。基于ITT原则,使用基于疗法策略的估计目标来描述获益效应以支持监管决策,可能更被普遍接受。ICEs各处理策略及特点[8-11],见表 2。
因缺少公认有效、同类可比的“阳性药”,多数中药临床试验采用安慰剂/低剂量对照设计,或标准治疗基础上的加载试验设计。在此类研究中,发生“因缺乏疗效的终止治疗”“改变基础治疗”“使用禁用药物”等情况,在所难免,因其可能影响研究结果的解释,应考虑判定为ICEs。例如,在“中药联合阿奇霉素治疗支原体肺炎研究”中,因不能忍受阿奇霉素的不良反应,改变基础治疗药物-阿奇霉素为其他抗支原体药物(如红霉素、喹诺酮类);在“中药治疗急性缺血性脑梗死临床研究”中,违禁使用脑细胞保护剂(如依达拉奉注射液)等。
根据中药不同的主治病证/目标适应症,可能出现“复发(症状或疾病)”“并发症或合并症”“死亡”等健康状态变化,以及需要使用“补救药物”等情况,均可判定为ICEs。例如,“中药缩短儿童流感病程研究”中发生并发症、使用解热镇痛药补救治疗,都是必然要发生的事件;“中药改善晚期肿瘤患者生存质量研究”中的死亡事件,可影响生存质量结果的解释等。此外,中药一般作用和缓,安全性较好,因不可接受的不良反应导致的终止治疗,比较少见。
4 关于敏感性分析和补充分析敏感性分析是基于估计目标的结构性框架的重要组成部分,指针对假设的偏离和数据的局限性,探索主估计方法统计推断的稳健性的一系列分析。其针对同一个估计目标下的主估计方法进行,可以有一项或多项,目的在于考察主估计方法中统计模型假设的稳健性和对缺失数据处理假设的稳健性。例如,以卡方检验为估计目标的主估计方法,如果2×2列联表的理论频数过小时,采用Fisher精确检验的敏感性分析;针对连续型变量或二分类变量数据缺失进行的临界点分析[12],或针对多种缺失机制共存的定量纵向缺失数据的基于对照的模式混合模型(PMM)[主要包括参照跳转(J2R)、参照替代(CR)、参照增量替代(CIR)]进行的敏感性分析[13-14]。无论何种缺失,在选择敏感性分析时,建议一次考虑一个假设,避免同时改变多个方面的假设而使得难以确定到底哪些假设导致了结果的差异。
补充分析泛指针对同一个估计目标,除主估计方法和敏感性分析之外的其他分析。例如,对ICEs采用不同的处理策略进行的分析等。补充分析在结果评估中优先级最低,通常不被优先考量。
5 引入估计目标的临床试验方案设计估计目标在临床试验方案中的呈现,主要体现在研究目的与观察指标、统计分析两部分。前者强调估计目标与研究目的/临床问题的一致性,为总体设计和试验实施提供指导;后者突出对统计学考虑、结果解释的预先约定,为统计分析计划和实施提供明确思路。
5.1 研究目的与观察指标建议将标题完善为“研究目的、观察指标与估计目标”。应分别描述主要、次要和探索性估计目标,所呈现的内容均包括估计目标拟解决的主要临床问题和估计目标的属性两部分。拟解决的临床问题,可以单列标题表达,或以引言的形式呈现。一般通过PICO原则提出,包括人群(P)、干预措施(I)、对照(C)、结局指标(O),以便更好地与估计目标属性相呼应。
应按照主、次和探索性估计目标,分别表达其5种属性。1)人群,一般指受试人群,应与方案的入选标准一致,可简要描述为具有某种疾病或健康状态的人群。2)治疗,应与方案的治疗部分相呼应,可精炼为干预措施与疗程。3)变量,应至少包括结局变量、定义和评价时点。4)ICEs,内容至少包括ICEs类型、处理策略和处理策略的考虑3部分,相同ICEs在不同估计目标下可能有不同的处理策略则需分别描述,可以通过列表同时对多个估计目标的ICEs和处理策略进行汇总。5)群体层面汇总,需根据结局变量的数据属性予以定义。
5.2 统计分析一项临床试验,需要起草一份单独的统计分析计划(SAP),以对统计分析内容和方法的细节做进一步描述。在本章节中,应概述其主要内容,一般包括统计假设、分析集、统计分析和期中分析4部分。其中,统计分析是核心内容,又分为一般考虑、主要估计目标分析、次要估计目标分析、三级/探索性/其他估计目标分析、安全性分析、其他分析等。
5.2.1 统计假设应至少明确主要目的的统计假设,次要目的的统计假设可在SAP中体现。应针对研究目的,给出与估计目标相关的待检验的零假设和备择假设。对于确证性研究,若存在多重性检验问题,如多个终点、多组间的比较、亚组分析、期中分析等,需事先约定相应的调整方法与策略,例如采用Bonferron法、O’BrienFleming法等调整检验水准,控制总的I类错误[15]。
5.2.2 分析集一般分为全分析数据集(FAS)和安全性数据集(SS)。FAS可定义为“所有随机入组的受试者”,也可稍加限制,定义为“正确随机的受试者”“符合纳排标准的所有随机受试者”或“至少服用1次研究药物的随机受试者”等。SS一般定义为“接受研究干预的所有受试者”。目前常用的符合方案数据集(PPS),因其结果可能会产生严重偏倚,E9(R1)不推荐采用,但在过渡阶段,可以作为补充分析之一。此外,还可能需要对数据时点做出规定,即明确该估计目标下的分析应包括哪些时点的数据。
5.2.3 统计分析1)一般考虑,包括检验水准、不同数据类型的统计描述方法,以及所用软件及版本等。2)主要估计目标分析,包括终点的定义、主要估计方法、敏感性分析和补充分析。其中,应明确主要估计方法采用的统计方法/模型,针对假设的偏离和数据的局限性,设计一种或多种敏感性分析,并考虑必要的补充分析。3)次要和探索性估计目标分析,其内容与主要估计目标分析相同,但可适当简化,如敏感性分析和补充分析。4)安全性分析,包括暴露的程度、不良事件,以及额外的安全性评估。5)其他分析,主要包括其他变量和/或参数的分析、亚组分析等。
5.3 对于其他章节的影响 5.3.1 样本量引入估计目标的样本量估算,仍按常规方法执行。是否需要额外增加样本量,一般应考虑ICEs处理策略和分析集定义两方面因素的影响。当所有受试者均能为分析提供信息,且在目标效应量和预期方差中已考虑了相应的策略来反映,则通常不需要,但若存在一定比例的未进入分析集的受试者,则需考虑相应增加。
5.3.2 退出试验标准与终止治疗在意向性分析(ITT)原则下,提前终止治疗受试者的后续试验数据仍可能具有分析价值,需针对主要估计目标,明确是否继续收集这些数据。应详细记录退出研究的原因,如缺乏疗效、不良事件、异地搬迁、撤回知情同意等,因为退出研究本身并非ICEs,但导致退出研究的原因可能是ICEs,并能进一步判断数据缺失类型[完全随机缺失(MCAR)、随机缺失(MAR)、非随机缺失(MNAR)]。
5.3.3 治疗方案也称“研究干预”,包括用药方案、基础治疗、合并用药/治疗的规定(补救药物/治疗、允许或禁用药物/治疗)等。为明确判断ICEs,对于用药方案,除明确用法用量和疗程外,对于可能发生的、允许的方案调整也应予以说明;对于基础治疗、合并用药/治疗,均应尽可能明确方案允许使用的药物品种和用药时点,并规定详细记录使用原因、药物种类、剂量和疗程等信息。
5.3.4 有效性评价因终点指标的定义可能受ICEs及其处理策略影响,在复合变量策略下,应详细描述指标定义的内容,保持与估计目标的一致性。必要时,也可围绕ICEs定义额外的结局指标,如合并用药率、ICEs时间分布、某主层患者比例等。
5.3.5 方案的执行文件为详细记录ICEs,必要时,应在病历/病例报告表中,细化终止治疗(临时或永久停用试验用药)及改变试验用药(剂量或疗程)、基础治疗(药物或剂量)内容,设计专门的表格记录。
6 小结自ICH E9(R1)适用以来,国内外学者已从多个角度对估计目标的理论和应用展开了讨论[16-21]。目前,中药临床研究对估计目标的实践尚处于探索阶段,仅有几项新启动的新药确证性随机对照试验在尝试应用,但在对框架的理解和设计实施方面仍存在诸多不足。文章围绕ICEs这一关键属性,重点探讨了基于估计目标的结构性框架及其在中药临床试验设计中的应用,具体呈现在“研究目的、观察指标与估计目标”“统计分析”及其他章节之中,以供同道在中药临床研究设计时参考和借鉴。需要指出,无论确证性或探索性试验,均可以引入估计目标,但新药确证性试验是目前监管要求的应用情景。此外,不限于随机对照试验,估计目标对于观察性研究、单臂试验、二次分析等其他类型研究,也具有非常重要的指导价值。
| [1] |
The International Council for Harmonisation of Technical Requirements for Pharmaceuticals for Human Use (ICH). E9(R1): addendum on estimands and sensitivity analysis in clinical traials[EB/OL]. (2019-09-20)[2022-05-31]. https://database.ich.org/sites/default/files/E9-R1_Step4_Guideline_2019_1203.pdf
|
| [2] |
国家药品监督管理局. 《国家药监局关于适用 < E9(R1): 临床试验中的估计目标与敏感性分析 > 国际人用药品注册技术协调会指导原则的公告》[EB/OL]. (2021-01-21)[2022-05-31]. https://www.nmpa.gov.cn/yaopin/ypggtg/20210125153350133.html. National Medical Products Administration. An announcement about application of E9(R1): addendum on estimands and sensitivity analysis in clinical trials[EB/OL]. (2021-01-21)[2022-05-31]. https://www.nmpa.gov.cn/yaopin/ypggtg/20210125153350133.html. |
| [3] |
The International Council for Harmonisation of Technical Requirements for Pharmaceuticals for Human Use (ICH). E8(R1): general considerations for clinical studies[EB/OL]. (2021-10-06)[2022-05-31]. https://database.ich.org/sites/default/files/E8-R1_Guideline_Step4_2022_0204%20%281%29.pdf
|
| [4] |
国家药品监督管理局药品审评中心. 国家药监局药审中心关于发布《药物临床试验数据管理与统计分析计划指导原则》的通告(2021年第63号)[EB/OL]. (2021-12-27)[2022-05-31]. https://www.cde.org.cn/main/news/viewInfoCommon/825fc74efe0a1c699eb8a1f02118e88e. Center for Drug evaluation. An announcement about publish the guidelines for drug clinical trial data management and Statistical analysis planning (63 of 2021)[EB/OL]. (2021-12-27)[2022-05-31]. https://www.cde.org.cn/main/news/viewInfoCommon/825fc74efe0a1c699eb8a1f02118e88e. |
| [5] |
Trans Celerate. Clinical template suite (CTS); template, resources, and use guidance[EB/OL]. (2021-10-17)[2022-05-31]. https://www.transceleratebiopharmainc.com/assets/clinical-content-reuse-solutions/.
|
| [6] |
NIH/FDA. Clinical trial e-protocol tool and template documents[EB/OL]. [2022-05-31]. https://osp.od.nih.gov/clinical-research/clinical-trials/#143bd4423a302fec2
|
| [7] |
The International Council for Harmonisation of Technical Requirements for Pharmaceuticals for Human Use (ICH). M11: clinical electronic structured harmonised protocol(CeSHarP)[EB/OL]. (2022-02-24)[2022-05-31]. https://database.ich.org/sites/default/files/M11_EWG_WorkPlan_2022_0224.pdf
|
| [8] |
国家药品监督管理局药品审评中心. E9(R1): 临床试验中的估计目标与敏感性分析(E9指导原则增补文件)[EB/OL]. (2019-11-20)[2022-05-31]. https://www.cde.org.cn/ichWeb/guideIch/toGuideIch/3/0. Center for Drug Evaluation. E9(R1): stimands and sensitivity analysis in clinical trials (addendum on E)[EB/OL]. (2019-11-20)[2022-05-31]. https://www.cde.org.cn/ichWeb/guideIch/toGuideIch/3/0. |
| [9] |
MALLINCKRODT C H, BELL J, LIU G, et al. Aligning estimators with estimands in clinical trials: Putting the ICH E9(R1) guidelines into practice[J]. Therapeutic Innovation & Regulatory Science, 2020, 54(2): 353-364. |
| [10] |
DIA中国统计社区. 蓝皮书: ICH E9(R1)估计目标及敏感性分析(第1版)[EB/OL]. (2021-10-22)[2022-05-31]. https://www.wdfxw.net/doc100379846.htm. DIA China Statistics Community. The blue book: ICH E9 (R1) stimands and sensitivity analysis (first edition)[EB/OL]. (2021-10-22)[2022-05-31]. https://www.wdfxw.net/doc100379846.htm. |
| [11] |
The International Council for Harmonisation of Technical Requirements for Pharmaceuticals for Human Use (ICH). E9(R1) estimands and sensitivity analysis in clinical trials trianning materials[EB/OL]. (2021-12-10)[2021-05-31]. https://database.ich.org/sites/default/files/E9%28R1%29%20Training%20Material%20-%20PDF_0.pdf
|
| [12] |
张盛婕, 王杨, 李卫. 临界点分析法在处理临床研究缺失数据中的应用[J]. 中华流行病学杂志, 2017, 38(5): 674-678. ZHANG S J, WANG Y, LI W. Application of tipping-point analysis to address missing data in clinical studies[J]. Chinese Journal of Epidemiology, 2017, 38(5): 674-678. DOI:10.3760/cma.j.issn.0254-6450.2017.05.024 |
| [13] |
陈丽嫦, 衡明莉, 王骏, 等. 多种缺失机制共存的定量纵向缺失数据处理方法的模拟比较研究[J]. 现代预防医学, 2020, 47(20): 3684-3687, 3697. CHEN L C, HENG M L, WANG J, et al. Missing data handing methods of quantitative longitudinal data under mixed missing mechanisms scenarios: a simulation study[J]. Modern Preventive Medicine, 2020, 47(20): 3684-3687, 3697. |
| [14] |
国家药品监督管理局药品审评中心. 验证性临床试验中有关缺失数据的指导原则[EB/OL]. (2010-07-03)[2010-07-03]. https://www.cde.org.cn/zdyz/guideGwView/c71e6c0d4339b11102eb62912c40bc19. Center for Drug Evaluation. Guideline on Missing Data in Confirmatory Clinical Trials[EB/OL]. (2010-07-03)[2010-07-03]. https://www.cde.org.cn/zdyz/guideGwView/c71e6c0d4339b11102eb62912c40bc19. |
| [15] |
国家药品监督管理局药品审评中心. 药物临床试验多重性问题指导原则(试行)[EB/OL]. (2020-12-31)[2020-12-31]. https://www.cde.org.cn/main/news/viewInfoCommon/a1fd04ab94ffa83aadee4bd1c0327a7f. Center for Drug Evaluation. Guidelines for multiplicity in drug clinical trials[EB/OL]. (2020-12-21)[2020-12-31]. https://www.cde.org.cn/main/news/viewInfoCommon/a1fd04ab94ffa83aadee4bd1c0327a7f. |
| [16] |
QU Y M, SHURZINSKE L, SETHURAMAN S. Defining estimands using a mix of strategies to handle intercurrent events in clinical trials[J]. Pharmaceutical Statistics, 2021, 20(2): 314-323. |
| [17] |
FANG Y X, JIN M. Sample size calculation when planning clinical trials with intercurrent events[J]. Therapeutic Innovation & Regulatory Science, 2021, 55(4): 779-785. |
| [18] |
KANG M, KENDALL M A, RIBAUDO H, et al. Incorporating estimands into clinical trial statistical analysis plans[J]. Clinical Trials (London, England), 2022, 19(3): 285-291. |
| [19] |
POHL M, BAUMANN L, BEHNISCH R, et al. Estimands-A basic element for clinical trials[J]. Deutsches Arzteblatt International, 2021, 118(51/52): 883-888. |
| [20] |
FIERO M H, PE M, WEINSTOCK C, et al. Demystifying the estimand framework: A case study using patient-reported outcomes in oncology[J]. The Lancet Oncology, 2020, 21(10): e488-e494. |
| [21] |
李新旭, 周军, 唐智敏, 等. 从审评角度谈适用ICH E9(R1)的初步考虑[J]. 中国食品药品监管, 2022, 25(5): 40-47. LI X X, ZHOU J, TANG Z M, et al. Preliminary considerations on implementation of ICH E9(R1) from a review's perspective[J]. China Food & Drug Administration Magazine, 2022, 25(5): 40-47. |
 2022, Vol. 39
2022, Vol. 39