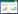文章信息
- 许虹, 李琳, 潘桂湘, 李玉红
- XU Hong, LI Lin, PAN Guixiang, LI Yuhong
- 葛根素激活AMPK/Akt/GSK-3β信号通路减轻高糖诱导的H9c2心肌细胞肥大作用研究
- Study on the effect of puerarin on alleviating high glucose-induced hypertrophy of H9c2 cells via activating AMPK/Akt/GSK-3β signaling pathway
- 天津中医药, 2022, 39(10): 1329-1334
- Tianjin Journal of Traditional Chinese Medicine, 2022, 39(10): 1329-1334
- http://dx.doi.org/10.11656/j.issn.1672-1519.2022.10.18
-
文章历史
- 收稿日期: 2022-07-15
2. 组分中药国家重点实验室, 天津 301617;
3. 天津市中药药理学重点实验室, 天津 301617;
4. 天津中医药大学第二附属医院, 天津 300250
糖尿病心肌病(DCM)是一种独立于高血压、冠心病、瓣膜病及先天性心脏病的心脏疾病, 与糖尿病患者心力衰竭的高发病率和高病死率密切相关[1]。临床上DCM早期以左心室肥厚和舒张功能受损为主要特征[2]。在糖尿病患者中, 大量的代谢改变参与了心肌功能障碍的病理过程。心肌细胞能量代谢紊乱是DCM发展的机制之一, 葡萄糖和脂肪酸代谢失衡通过多条信号通路促进心肌细胞肥大[3]。持续的失代偿性的心肌肥大不断加重心脏负担, 成为糖尿病心肌病患者晚期发展为心力衰竭的原因之一[4]。尽管DCM的发病机制和临床特点在过去的几十年中得到了广泛的研究, 但有效的预防和治疗方法仍有待进一步探索。
葛根素(Puerarin)是从豆科植物野葛的干燥根中提取的异黄酮类化合物[5], 是中药葛根的主要活性成分。葛根素注射剂已被列入中国药典作为血管扩张剂使用。现代药理学研究表明, 葛根素具有抑制晚期糖基化终产物形成、抑制炎症、降低氧化应激、降低血糖、改善胰岛素抵抗、保护胰岛等药理作用[6]。除了对糖尿病的治疗作用外, 葛根素及其制剂在改善DCM中的作用也得到了关注。Yin等[7]研究发现, 在链脲霉素诱导的糖尿病大鼠和高糖损伤的H9c2心肌细胞中, 葛根素通过抑制炎症相关因子的产生发挥心脏保护作用。此外, 黄芪注射液与葛根素注射液联合应用可保护2型糖尿病小鼠心肌细胞超微结构, 抑制内质网应激, 减少心肌细胞凋亡[8-9]。这些研究结果提示葛根素对糖尿病心肌病可能有较好的治疗潜力, 但葛根素对高糖诱导的心肌细胞肥大是否具有干预作用尚无报道。因此, 本研究通过高糖损伤H9c2大鼠心肌细胞体外建立高糖损伤心肌细胞模型, 从心肌肥大角度初步探讨葛根素对H9c2大鼠心肌细胞的保护作用及潜在的作用机制。
1 材料与方法 1.1 细胞与主要试剂大鼠H9c2心肌细胞购自美国ATCC; 葛根素购自上海源叶生物科技有限公司(纯度≥98%, 批号B20446); 低糖DMEM购自以色列Biological Industries公司; 胎牛血清与胰蛋白酶购自美国Gibco公司; BCA蛋白浓度测定试剂盒购自北京索莱宝科技有限公司; D-葡萄糖、甘露醇购自美国Sigma公司; AMP活化蛋白激酶α(AMPKα)抗体、磷酸化AMPKα(p-AMPKα)抗体、丝氨酸/苏氨酸激酶(Akt)抗体、磷酸化Akt(p-Akt)抗体、糖原合成激酶3β(GSK-3β)抗体、磷酸化GSK-3β(p-GSK-3β)抗体、Sigma-1受体(Sig-1R)抗体以及山羊抗兔免疫球蛋白G二抗购自美国Cell Signaling Technology公司; β-肌球蛋白重链(β-MHC)抗体购自英国Abcam公司; 1, 4, 5-三磷酸2型受体(IP3R2)抗体、β-肌动蛋白(β-actin)抗体购自美国Santa Cruz Biotechnology公司; 罗丹明标记的鬼笔环肽购自美国Cytoskeleton公司。
1.2 仪器HF240型二氧化碳培养箱(中国力康生物医疗科技控股有限公司); Infinite F50型酶标仪(瑞士Tecan公司); Powerpac型电泳仪(美国BIO-RAD公司); INCell 2000型高内涵细胞分析仪、Amersham Imager 600型超灵敏多功能成像仪(美国General Electric公司)。
1.3 方法 1.3.1 H9c2心肌细胞培养使用添加10%胎牛血清的低糖DMEM培养基, 在37 ℃、5% CO2的细胞培养箱中对H9c2心肌细胞进行常规培养, 当培养瓶中的细胞融合至70%~80%时, 用含0.25%乙二胺四乙酸(EDTA)胰酶消化细胞, 按1: 2的比例传代, 根据细胞的生长情况, 每2~3 d进行传代, 取对数生长期生长良好的细胞用于实验。
1.3.2 给药与分组DCM细胞模型的建立: 将H9c2心肌细胞以3×104个/mL接种于6孔板中, 每孔3 mL, 随机分为正常对照(NG)组、低糖模型(LG)组、高糖模型(HG)组、低甘露醇(LM)组、高甘露醇(HM)组。NG、LG、HG组分别采用5.6、33、44 mmol/L葡萄糖处理, LM组采用5.6 mmol/L葡萄糖+27.4 mmol/L甘露醇处理, HM组采用5.6 mmol/L葡萄糖+38.4 mmol/L甘露醇处理, 均处理48 h。
葛根素心肌细胞保护作用: 根据相关蛋白表达情况, 选择葡萄糖浓度为44 mmol/L为高糖损伤模型浓度进行后续实验, 分为NG组、HG组、HM组、低剂量给药(HG+PUE-Ⅰ)组、高剂量给药(HG+PUE-Ⅱ)组。NG、HG组分别采用5.6、44 mmol/L葡萄糖处理, HM组采用5.6 mmol/L葡萄糖+38.4 mmol/L甘露醇处理, HG+PUE-Ⅰ、HG+PUE-Ⅱ组分别采用44 mmol/L葡萄糖+5、20 μmol/L葛根素干预, 均干预48 h。
1.3.3 细胞表面积染色将H9c2心肌细胞接种于96孔板中, 用4%多聚甲醛室温固定细胞30 min, 然后用0.1% TritonX-100孵育5 min, 用罗丹明标记的鬼笔环染色20 min, 磷酸盐缓冲液(PBS)缓慢冲洗细胞3次, 4', 6-二脒基-2-苯基吲哚(DAPI)孵育细胞10 min, PBS缓慢冲洗细胞3次, 使用高内涵细胞分析仪采集图像, 参考文献[10]方法计算细胞的表面积, 每孔选择4个观察视野, 随机选取60个心肌细胞, 使用Image J软件进行定量分析。
1.3.4 蛋白免疫印迹法(Western Blot)检测蛋白的表达收集6孔板中的H9c2细胞, 加入细胞裂解液静置20 min, 离心后取上清, 使用BCA蛋白定量试剂盒进行蛋白定量。所得样品进行SDS凝胶电泳, 转膜, 脱脂奶粉封闭, 加入对应一抗抗体4 ℃孵育过夜, TBST洗涤后, 加入相应种属二抗抗体室温孵育1.5 h。再用TBST洗涤, ECL试剂浸润后, 使用超灵敏多功能成像仪成像。Image J、Gelpro32软件对蛋白条带进行分析计算蛋白的相对表达水平。
1.4 统计学方法采用SPSS 26. 0软件进行统计分析, 数据用均数±标准差(x±s)表示, 多组间比较采用单因素方差分析法, 组间两两比较采用LSD法。以P < 0.05为差异有统计学意义。
2 结果 2.1 不同浓度葡萄糖对H9c2心肌细胞表面积的影响分别采用33 mmol/L和44 mmol/L葡萄糖处理H9c2心肌细胞48 h, 模拟机体高糖环境对心肌细胞的损伤。细胞表面积增加是细胞肥大的特征之一[11], 故采用罗丹明标记的鬼笔环肽对细胞骨架进行染色并对H9c2心肌细胞表面积进行分析。由图 1可见, 与NG组相比, 44 mmol/L葡萄糖处理后心肌细胞表面积增加, 差异具有统计学意义(P < 0.01), 而33 mmol/L葡萄糖不影响心肌细胞表面积。此外, 为了排除高糖引起的渗透压增高对心肌细胞的影响, 实验设置了33、44 mmol/L的甘露醇等渗对照组, 结果显示, 渗透压增高不影响心肌细胞表面积。
|
| 注: 与NG组比较, **P < 0.01。 图 1 葡萄糖对H9c2细胞表面积的影响(x±s, n=3) Fig. 1 Effect of glucose on surface area of H9c2 cell(x±s, n=3) |
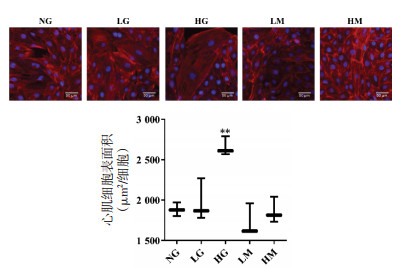
β-MHC是细胞肥大的生物标志物之一[11]。Western Blot法检测β-MHC蛋白水平, 如图 2所示, 与NG组相比, 44 mmol/L葡萄糖处理后心肌细胞β-MHC蛋白相对表达量升高, 差异具有统计学意义(P < 0.01), 而33 mmol/L葡萄糖不影响心肌细胞β-MHC蛋白相对表达量, 且渗透压增高不影响心肌细胞β-MHC蛋白水平。因此选择44 mmol/L葡萄糖损伤心肌细胞48 h为后续葛根素药效研究的细胞模型。
|
| 注: 与NG组比较, **P < 0.01。 图 2 葡萄糖对H9c2细胞β-MHC蛋白表达的影响(x±s, n=3) Fig. 2 Effect of glucose on β-MHC expression in H9c2 cells (x±s, n=3) |
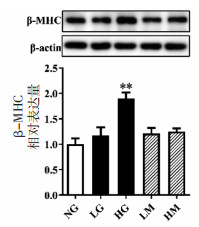
AMPK是细胞内重要的能量传感器和能量稳态调节器, 可激活Akt调节细胞内的能量平衡, 从而抑制心肌肥厚的发展[12-14]。如图 3A-B所示, 与NG组相比, 33、44 mmol/L的甘露醇等渗对照组AMPKα与Akt磷酸化水平无明显差异; 与NG组相比, 33 mmol/L葡萄糖不影响AMPKα磷酸化水平, 44 mmol/L葡萄糖使AMPKα磷酸化水平降低, 差异具有统计学意义(P < 0.01); 与NG组相比, 33 mmol/L或44 mmol/L葡萄糖均可使Akt磷酸化水平降低, 差异具有统计学意义(P < 0.05)。上述结果表明, 44 mmol/L葡萄糖可抑制H9c2心肌细胞AMPK和Akt磷酸化。
|
| 注: 与NG组比较, *P < 0.05, **P < 0.01。 图 3 葡萄糖对H9c2细胞中AMPK、p-AMPK、Akt、p-Akt蛋白表达的影响(x±s, n=3) Fig. 3 Effect of glucose on AMPK, p-AMPK, Akt, p-Akt expression in H9c2 cells(x±s, n=3) |
为了探索葛根素能否调节高糖诱导的心肌肥大, 使用不同浓度的葛根素(5、20 μmmol/L)干预H9c2心肌细胞48 h。由图 4A可见, 与NG组相比, HM组心肌细胞表面积增加, 差异具有统计学意义(P < 0.01); 与HM组相比, HG+PUE-Ⅰ组心肌细胞表面积有所降低, 但无统计学差异(P > 0.05); 而HG+PUE-Ⅱ组能够降低心肌细胞表面积, 差异具有统计学意义(P < 0.01)。此外, Western Blot法检测β-MHC蛋白水平, 如图 4B所示, HM组心肌细胞β-MHC蛋白水平高于NG组, 差异具有统计学意义(P < 0.01), 与HM组相比, HG+PUE-Ⅰ组心肌细胞β-MHC蛋白相对表达量有所降低, 但无统计学差异(P > 0.05); 而HG+PUE-Ⅱ组心肌细胞β-MHC蛋白相对表达量降低, 差异具有统计学意义(P < 0.05)。
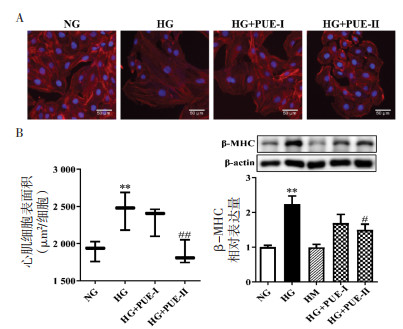
|
| 注: A.H9c2细胞表面积; B. β-MHC蛋白表达; 与NG组比较, **P < 0.01; 与HG组比较, #P < 0.05, ##P < 0.01。 图 4 葛根素对高糖诱导H9c2心肌细胞肥大的影响(x±s, n=3) Fig. 4 Effect of puerarin on hypertrophy of H9c2 cardiomyocytes induced by high glucose(x±s, n=3) |
为了进一步研究葛根素如何减轻高糖诱导的H9c2心肌细胞肥大, 检测了与心肌肥大相关的AMPK、Akt、GSK-3β蛋白磷酸化水平以及IP3R2和Sig-1R蛋白水平。如图 5A-C所示, 与NG组相比, HG组心肌细胞AMPKα和Akt磷酸化水平降低, 差异具有统计学意义(P < 0.01)。与HG组相比, HG+PUE-Ⅰ组心肌细胞AMPKα和GSK-3β磷酸化水平升高, 差异具有统计学意义(P < 0.05, P < 0.01)、Akt磷酸化水平无统计学差异(P < 0.05); 而HG+PUE-Ⅱ组AMPKα、p-Akt和GSK-3β磷酸化水平均升高, 差异具有统计学意义(P < 0.01)。此外, 由图 5D、E可见, 与HG组相比, HG组IP3R2和Sig-1R蛋白相对表达量升高, 差异具有统计学意义(P < 0.05); 而葛根素对IP3R2、Sig-1R蛋白相对表达量没有明显影响。以上结果说明, 葛根素可通过激活心肌细胞AMPK和Akt、抑制GSK-3β的活性, 抑制心肌细胞肥大。
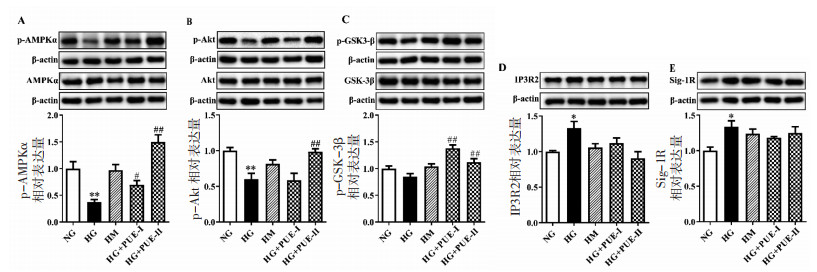
|
| 注: A.AMPK和p-AMPK蛋白表达; B.Akt和p-Akt蛋白表达; C.GSK-3β和p-GSK-3β蛋白表达; D.IP3R2蛋白表达; E.Sig-1R蛋白表达; 与NG组比较, *P < 0.05, **P < 0.01; 与HG组比较, #P < 0.05, ##P < 0.01。 图 5 葛根素对高糖损伤的H9c2细胞AMPK、p-AMPK、Akt、p-Akt、GSK-3β、p-GSK3β、IP3R2、Sig-1R蛋白表达的影响(x±s, n=3) Fig. 5 Effect of puerarin on AMPK, p-AMPK, Akt, p-Akt, GSK-3β, p-GSK-3β, IP3R2, Sig-1R expression in HG-injured H9c2 cells(x±s, n=3) |
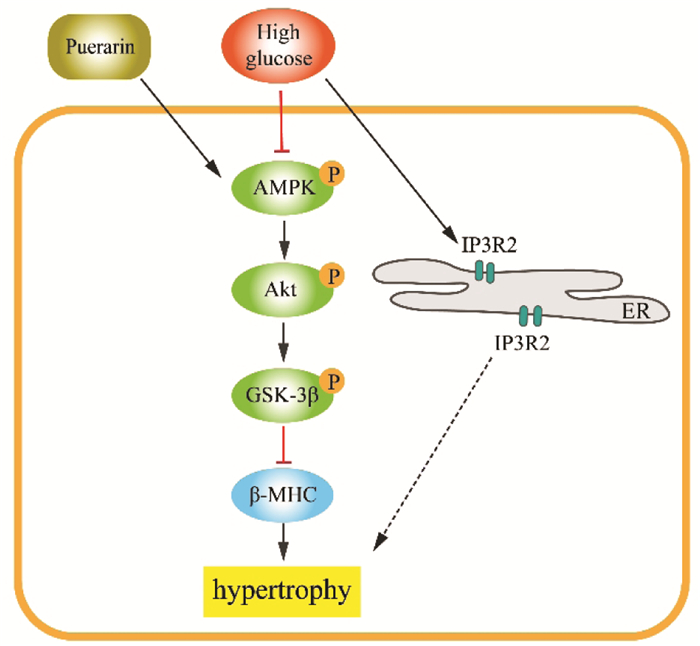
|
| 图 6 葛根素通过激活AMPK/Akt/GSK-3β信号通路抑制高糖诱导的H9c2细胞肥大 Fig. 6 Puerarin inhibits hypertrophy of H9c2 cells induced by high glucose through activating AMPK/Akt/GSK-3β signaling pathway |
高血糖诱发的能量代谢紊乱引起心脏结构和功能损伤, 导致心肌肥厚和心律失常, 是糖尿病性心肌病发生的独立危险因素。本研究在不同浓度的高糖刺激下观察心肌细胞肥大情况, 通过检测细胞表面积和肥大关键蛋白β-MHC的水平, 建立了高糖诱导的心肌细胞肥大模型。在此基础上, 发现葛根素能显著下调β-MHC蛋白水平, 抑制高糖诱导的心肌细胞肥大。
AMPK是调节糖尿病心脏代谢的关键蛋白。在糖尿病心肌病的发展过程中, AMPK对心脏代谢异常起到调节葡萄糖利用、改善线粒体钙离子(Ca2+)转运、减轻线粒体功能障碍、抑制心肌肥厚和纤维化等有益作用[15]。AMPK通过影响Akt活化调节心肌肥厚和心肌收缩功能。Akt能够介导下游靶蛋白GSK-3β磷酸化, 抑制GSK-3β的活性[16-17]。已有文献报道, 小檗碱可通过激活AMPK和Akt、抑制GSK-3β活化, 减轻棕榈酸酯诱导的H9c2心肌细胞肥大; 一旦采用AMPK抑制剂阻断AMPK后, Akt/GSK-3β信号通路蛋白磷酸化程度也受到抑制, 并减弱小檗碱的抗心肌肥大作用[13]。此外, Al-Damry等[14]研究发现抗糖尿病药物西格列汀可提高糖尿病大鼠心脏中AMPK和Akt磷酸化水平, 使GSK-3β失活, 从而缓解糖尿病时高糖诱导的心肌细胞凋亡和肥厚。因此, AMPK/Akt/GSK-3β信号通路是缓解糖尿病性心肌病过程中出现的心肌肥大的重要调控机制。本研究发现, 高糖抑制心肌细胞AMPK和Akt的蛋白磷酸化, 而葛根素能够促进AMPK和Akt的磷酸化修饰, 并增加GSK-3β蛋白的磷酸化水平, 提示葛根素可能通过激活AMPK/Akt/GSK-3β信号通路发挥抗心肌肥大作用。
研究显示, 心脏Ca2+信号的变化是诱发心肌肥厚的因素之一[18]。IP3R2是位于内质网的Ca2+释放通道, 介导细胞质Ca2+浓度的上升。有研究发现高表达IP3R2的转基因小鼠表现出心肌肥厚, 而低表达IP3R2的转基因小鼠, 经主动脉缩窄刺激2周后心肌肥厚的程度并没有增加[19]。此外, 位于线粒体内质网相关膜结构上的Sig-1R同样参与调节细胞内钙稳态。研究发现, 压力过载及血管紧张素II诱导的心肌肥厚模型中Sig-1R水平显著降低, 而Sig-1R激动剂不仅恢复了Sig-1R的mRNA和蛋白的表达, 而且减轻了心肌肥厚[20-21]。因此, 研究对IP3R2和Sig-1R蛋白水平进行了检测。笔者发现高糖刺激的肥大的心肌细胞内IP3R2和Sig-1R蛋白水平均升高, 而但葛根素对它们没有显著影响。说明葛根素对肥大心肌的抑制作用与调节IP3R2和Sig-1R蛋白无关。
综上所述, 葛根素可能通过激活AMPK/Akt/GSK-3β信号通路减轻高糖诱导的心肌细胞肥大, 并可能在糖尿病心肌病中发挥治疗作用。
| [1] |
PAOLILLO S, MARSICO F, PRASTARO M, et al. Diabetic cardiomyopathy: definition, diagnosis, and therapeutic implications[J]. Heart Failure Clinics, 2019, 15(3): 341-347. DOI:10.1016/j.hfc.2019.02.003 |
| [2] |
LEE M M Y, MCMURRAY J J V, LORENZO-ALMORÓS A, et al. Diabetic cardiomyopathy[J]. Heart, 2019, 105(4): 337-345. DOI:10.1136/heartjnl-2016-310342 |
| [3] |
STRATMANN B, GAWLOWSKI T, TSCHOEPE D. Diabetic cardiomyopathy: to take a long story serious[J]. Herz, 2010, 35(3): 161-168. DOI:10.1007/s00059-010-3336-0 |
| [4] |
EVANGELISTA I, NUTI R, PICCHIONI T, et al. Molecular dysfunction and phenotypic derangement in diabetic cardiomyopathy[J]. International Journal of Molecular Sciences, 2019, 20(13): E3264. DOI:10.3390/ijms20133264 |
| [5] |
国家药典委员会. 中华人民共和国药典[S]. 二部. 北京: 中国医药科技出版社, 2020: 1510. Chinese Pharmacopoeia Commission. Pharmacopoeia of the People's Republic of China[S]. volumeⅡ. Beijing: China medicine science and technology press, 2020: 1510. |
| [6] |
CHEN X P, YU J, SHI J S. Management of diabetes mellitus with puerarin, a natural isoflavone from Pueraria Lobata[J]. The American Journal of Chinese Medicine, 2018, 46(8): 1771-1789. DOI:10.1142/S0192415X18500891 |
| [7] |
YIN M S, ZHANG Y C, XU S H, et al. Puerarin prevents diabetic cardiomyopathy in vivo and in vitro by inhibition of inflammation[J]. Journal of Asian Natural Products Research, 2019, 21(5): 476-493. DOI:10.1080/10286020.2017.1405941 |
| [8] |
王庆霞, 陈会刚, 孙晶, 等. 黄芪注射液联合葛根素注射液对2型糖尿病小鼠心肌的保护作用及其机制[J]. 中国病理生理杂志, 2019, 35(6): 1010-1015. WANG Q X, CHEN H G, SUN J, et al. Protective effect of Huangqi Injection combined with puerarin injection on myocardium of type 2 diabetes mice[J]. Chinese Journal of Pathophysiology, 2019, 35(6): 1010-1015. DOI:10.3969/j.issn.1000-4718.2019.06.008 |
| [9] |
车宇娥, 高誉珊, 王岩飞, 等. 黄芪葛根联用对KKAy小鼠心脏组织GRP78、CHOP和PUMA表达的影响[J]. 北京中医药大学学报, 2021, 44(2): 128-133. CHE Y E, GAO Y S, WANG Y F, et al. Effects of astragalus and puerarin on the expression of GRP78, CHOP and PUMA in heart tissues of KKAy mice[J]. Journal of Beijing University of Traditional Chinese Medicine, 2021, 44(2): 128-133. DOI:10.3969/j.issn.1006-2157.2021.02.007 |
| [10] |
CHU C H, TZANG B S, CHEN L M, et al. IGF-Ⅱ/mannose-6-phosphate receptor signaling induced cell hypertrophy and atrial natriuretic peptide/BNP expression via Galphaq interaction and protein kinase C-alpha/CaMKⅡ activation in H9c2 cardiomyoblast cells[J]. The Journal of Endocrinology, 2008, 197(2): 381-390. DOI:10.1677/JOE-07-0619 |
| [11] |
COBOS A R, SEGADE L A, FUENTES I. Muscle fibre types in the suprahyoid muscles of the rat[J]. Journal of Anatomy, 2001, 198(Pt 3): 283-294. |
| [12] |
SUN Y K, ZHOU S S, GUO H, et al. Protective effects of sulforaphane on type 2 diabetes-induced cardiomyopathy via AMPK-mediated activation of lipid metabolic pathways and NRF2 function[J]. Metabolism: Clinical and Experimental, 2020, 102: 154002. DOI:10.1016/j.metabol.2019.154002 |
| [13] |
CHANG W G, ZHANG M, MENG Z J, et al. Berberine treatment prevents cardiac dysfunction and remodeling through activation of 5'-adenosine monophosphate-activated protein kinase in type 2 diabetic rats and in palmitate-induced hypertrophic H9c2 cells[J]. European Journal of Pharmacology, 2015, 769: 55-63. DOI:10.1016/j.ejphar.2015.10.043 |
| [14] |
AL-DAMRY N T, ATTIA H A, AL-RASHEED N M, et al. Sitagliptin attenuates myocardial apoptosis via activating LKB-1/AMPK/Akt pathway and suppressing the activity of GSK-3β and p38α/MAPK in a rat model of diabetic cardiomyopathy[J]. Biomedecine & Pharmacotherapie, 2018, 107: 347-358. |
| [15] |
HAYE A, ANSARI M A, RAHMAN S O, et al. Role of AMP-activated protein kinase on cardio-metabolic abnormalities in the development of diabetic cardiomyopathy: a molecular landscape[J]. European Journal of Pharmacology, 2020, 888: 173376. DOI:10.1016/j.ejphar.2020.173376 |
| [16] |
LI M C, HIRSCH E. Akt activation by PHLPP1 ablation prevents pathological hypertrophy by promoting angiogenesis[J]. Cardiovascular Research, 2015, 105(2): 129-130. DOI:10.1093/cvr/cvu261 |
| [17] |
HEINEKE J, MOLKENTIN J D. Regulation of cardiac hypertrophy by intracellular signalling pathways[J]. Nature Reviews Molecular Cell Biology, 2006, 7(8): 589-600. DOI:10.1038/nrm1983 |
| [18] |
BERRIDGE M J, BOOTMAN M D, RODERICK H L. Calcium signalling: dynamics, homeostasis and remodelling[J]. Nature Reviews Molecular Cell Biology, 2003, 4(7): 517-529. DOI:10.1038/nrm1155 |
| [19] |
NAKAYAMA H, BODI I, MAILLET M, et al. The IP3 receptor regulates cardiac hypertrophy in response to select stimuli[J]. Circulation Research, 2010, 107(5): 659-666. DOI:10.1161/CIRCRESAHA.110.220038 |
| [20] |
BHUIYAN M S, TAGASHIRA H, SHIODA N, et al. Targeting Sigma-1 receptor with fluvoxamine ameliorates pressure-overload-induced hypertrophy and dysfunctions[J]. Expert Opinion on Therapeutic Targets, 2010, 14(10): 1009-1022. DOI:10.1517/14728222.2010.509348 |
| [21] |
TAGASHIRA H, BHUIYAN M S, SHIODA N, et al. Fluvoxamine rescues mitochondrial Ca2+ transport and ATP production through σ(1)-receptor in hypertrophic cardiomyocytes[J]. Life Sciences, 2014, 95(2): 89-100. DOI:10.1016/j.lfs.2013.12.019 |
2. State Key Laboratory of Component-based Chinese Medicine, Tianjin 301617, China;
3. Tianjin Key Laboratory of Chinese Medicine Pharmacology, Tianjin 301617, China;
4. Second Teaching Hospital of Tianjin University of Traditional Chinese Medicine, Tianjin 300250, China
 2022, Vol. 39
2022, Vol. 39