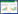文章信息
- 黄山, 刘纳文, 郝阳
- HUANG Shan, LIU Nawen, HAO Yang
- 经方麻黄附子细辛汤合防己黄芪汤减轻膜性肾病小鼠氧化应激损伤的机制研究
- Mechanism study of Mahuang Fuzi Xixin Decoction combined with Fangji Huangqi Decoction on reducing oxidative stress injury in mouse with membranous nephropathy
- 天津中医药, 2022, 39(11): 1439-1444
- Tianjin Journal of Traditional Chinese Medicine, 2022, 39(11): 1439-1444
- http://dx.doi.org/10.11656/j.issn.1672-1519.2022.11.15
-
文章历史
- 收稿日期: 2022-09-08
膜性肾病(MN)又名膜性肾小球肾炎,其特征表现以高脂血症、大量蛋白尿、水肿、低蛋白血症等为主,以肾小球基底膜上皮细胞下弥漫的免疫复合物沉积伴基底膜弥漫增厚为病理特点[1],是一类特殊的原发性肾小球病变病理类型,是成人特发性肾病综合征最常见病因[2]。近年来越来越多的证据表明,MN发病机制与氧化应激有着直接关系,而且该因素的占比较高[3-4]。对于MN西医多使用激素以及免疫抑制剂(如环磷酰胺等)加以防治,但往往会产生皮质功能亢进、引起或加剧感染、骨髓控制、胃肠道症状、泌尿道症状等较多的不良反应,且部分病人不能耐受,单纯西医治疗具有一定局限性。
MN在中医中并没有切确的病名,根据病症表现的特点可将之归属于中医的“水肿” “尿浊”“膏淋”“虚劳”等疾病范畴。通过门诊诊治大量MN患者,总结本病的中医辨证特点,笔者认为少阴枢机不利为本病病机之关键,因而提出从少阴枢机论治膜性肾病的学术观点,临床上常选用麻黄附子细辛汤合防己黄芪汤加减进行治疗并取得了较好的疗效。本研究观察麻黄附子细辛汤联合防己黄芪汤通过减轻肾脏氧化应激反应及炎症反应并参与调控核转录因子-κB(NF-κB)信号通路发挥治疗作用,以期为中医药治疗MN的临床应用提供依据。
1 实验材料 1.1 实验动物清洁级雄性Balb/c小鼠60只,6~8周龄,平均体质量20~25 g,购于斯贝福(北京)生物技术科技公司。
1.2 药品与化学试剂中药(防己10 g,黄芪20 g,白术10 g,麻黄10 g,制附子10 g,细辛3 g,炙甘草3 g),以上药品均由江阴天江药业有限公司生产供应,由天津市第一中心医院中医科统一制备。TBD氨基载玻片FISH0010,天津市智恩博莱生物科技有限公司生产;阳离子化牛血清白蛋白(C-BSA)(Chondrex公司)、氟氏不完全佐剂,购于天津市南开区艾博抗生物试剂销售中心;三酰甘油(TG)检测盒、高密度脂蛋白胆固醇(HDL-C)检测盒、总胆固醇(T-CHO)检测盒、低密度脂蛋白胆固醇(LDL-C)检测盒,南京建成生物工程研究所生产;超氧化物歧化酶(SOD)酶联免疫分析试剂盒,丙二醛(MDA)酶联免疫分析试剂盒、白细胞介素-6(IL-6)酶联免疫分析试剂盒、单核细胞趋化蛋白-1(MCP-1)酶联免疫分析试剂盒,上海泛柯实业有限公司生产;即用型SABC-POD(兔IgG)试剂盒,武汉博士德生物工程有限公司生产;DAB显色试剂盒ZLI-9032 3 mL(20×),中杉金桥;兔多抗NF-κB,北京博奥森生物科技公司生产。
1.3 主要仪器TJP-01型排毒柜,天津市超纯净化设备厂工程部生产;电热干燥箱DG-204,天津天宇技术实业有限公司;石蜡切片机(RM2235),德国Leica集团;光学显微镜(BA410),Moticam Pro集团;LX-200迷你离心机,海门市其林贝尔仪器制造有限公司。
2 实验方法 2.1 分组60只Balb/c小鼠,按体质量分层随机分为正常组、模型组、中药低剂量组、中药中剂量组、中药高剂量组,各12只。
2.2 造模与干预适应性喂养1周后,用C-BSA制成膜性肾病小鼠模:C-BSA 1 mg,加入0.5 mL磷酸缓冲盐溶液(PBS)中,在同量的氟氏不完全佐剂中混匀配制为悬浊液,在小鼠的腹股沟处、双侧腋下多点皮下注射,每只注射0.3 mL,每日1次;正常组等容积的生理盐水与弗氏不完全佐剂,按上述比例乳化后进行腹股沟处、双侧腋下多点皮下注射。1周后每只小鼠尾静脉内注射C-BSA 20 mg/kg,隔日1次,4周后验证模型复制成功[5]。于造模完成后开始灌胃治疗,向中药低剂量组、中剂量组、高剂量组依次灌服标准中药溶液(1、2、4 g生药/mL),正常组和模型组灌服等量的生理盐水,共6周。(60 kg成人的中药治疗用量大约为每日65 g生药,按体表面积,小鼠单位体质量的等效用量大约为成人用量的9.1倍,从而确定了每天对每只小鼠的灌胃剂量,每周测小鼠体质量进行药量调节。成人用量1.08 g生药/kg,小鼠的等效用量为9.83 g生药/kg,20 g小鼠按中药浓度1 g生药/mL,每日需灌药约0.2 mL)。
2.3 标本采集和处置方法灌胃治疗6周后,摘眼球取血法,室温度下保存30 min后,以7 000 r/min离心15 min,离心半径4 cm。采集上层的血清,于-80 ℃以下保存。取血后动物取出肾脏组织,将肾脏沿冠状面切成大致相等的两半,用生理盐水多次冲洗肾脏以洗去肾脏组织的血液,用滤纸片吸干水分,再将一半肾脏置于液氮瓶中封存,用于检测SOD、MDA、IL-6、MCP-1含量;另一半放于中性福尔马林中固定,用以制作病理切片。
2.4 指标检测 2.4.1 血脂及肾功能的测定全自动生化分析仪测定各组小鼠血清白蛋白(ALB)、三酰甘油(TG)、总胆固醇(TC)、血肌酐(SCr)、尿素氮(BUN)的水平。
2.4.2 肾脏病理取固定好的肾组织,用石蜡包埋法,厚度为5 μm,将其进行肾组织苏木精-伊红(HE)染色和过碘酸雪夫(PAS)染色,中性树胶封闭,光镜下观察照相。
2.4.3 酶联免疫吸附法(ELISA)检测肾脏组织SOD、MDA、IL-6、MCP-1含量表达按ELISA试剂盒说明书操作。
2.4.4 免疫组化法观察NF-κB蛋白的表达具体按SABC免疫组化染色试剂盒使用说明完成。
2.5 统计学方法数据处理使用IBM SPSS statistics 22软件完成计量资料数据均以均数±标准差(x±s)表示,多组间的比较使用单因素方差分析(one way-ANOVA),组间两两比较使用SNK-q检验。P < 0.05代表差异具有统计学意义。免疫组化结果采用Image-Pro Plus 6.0软件系统完成数据分析,使用积分光密度值分析法。
3 实验结果 3.1 中医经方麻黄附子细辛汤合防己黄芪汤对膜性肾病小鼠TG、TC、ALB、SCr、BUN水平的影响与正常组相比,模型组小鼠血清中TG、TC、SCr、BUN水平上升(P < 0.01),ALB水平下降(P < 0.01),差异具有统计学意义;与模型组比较,中药低中高各剂量浓度组TG、TC水平各有不同程度的下降,差异具有统计学意义(P < 0.05或P < 0.01),ALB水平提高,差异具有统计学意义(P < 0.01),血清SCr、BUN水平差异无统计意义(P > 0.05)。见表 1。
|
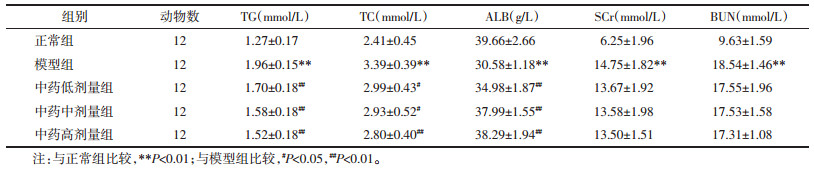
正常组小鼠肾脏组织被膜结构比较完好,没有发现炎性渗出或者结缔组织增生,其髓质与皮质的界线也较清晰,皮质区肾小球内未见毛细血管基底膜以及基质增生;肾小管结构基本完整,上皮细胞没有出现变性坏死,没有发现间质内炎症细胞浸润现象且无充血。与正常组比较,模型组小鼠的肾组织皮质肾小球结构模糊不清,基底膜增厚,由单层变为多层,细胞胞核肿胀,周围肾小管肿胀,部分变性坏死。与模型组相比较,中药的低、中、高剂量浓度组小鼠肾脏组织被膜较为完整,皮质与髓质之间分界也较为清晰,皮质肾小球结构模糊,但基底膜增厚程度有改善,部分肾小管变性。见图 1。
|
| 图 1 各组小鼠肾组织病理改变HE染色(×400) Fig. 1 HE staining of renal histological changes of mice in each group(×400) |
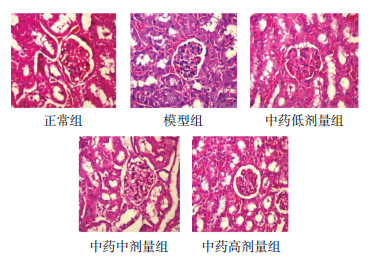
正常组小鼠肾组织未见明显纤维胶原物质生成,肾小球细胞也未见纤维化样变。但与正常组相比较,模型组的小鼠肾小球构造紊乱,体积增大明显,球囊毛细血管基底膜增厚,肾小球上皮下出现嗜复红蛋白和胶原纤维的沉积,肾小管上皮细胞数量明显减少,可见胶原纤维的沉积,部分出现空泡样变性;与模型组相比较,中药低、中、高剂量组小鼠的肾小球和肾小管结构都有了不同程度的改善。见图 2。
|
| 图 2 各组小鼠肾组织病理改变PAS染色(×400) Fig. 2 PAS staining of renal histological changes of mice in each group(×400) |
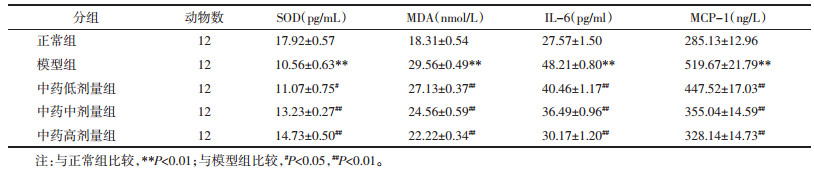
与对照组比较,模型组的小鼠肾脏组织SOD下降(P < 0.01),MDA、IL-6、MCP-1数值升高(P < 0.01);与模型组比较,中药各剂量组肾组织SOD含量均有不同程度的增加(P < 0.05或P < 0.01),差异具有统计学意义,MDA、IL-6、MCP-1含量均下降(P < 0.01),差异具有统计学意义。见表 2。
|
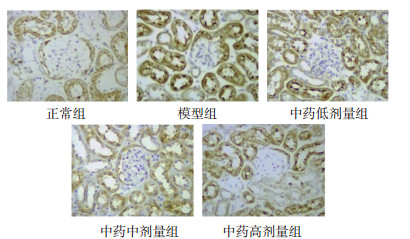
光镜下观察组织切片免疫组化染色结果,NF-κB蛋白阳性表达主要位于小鼠肾小管及肾小球球囊,呈现出圆圈状或团状的棕褐色着染,且分布范围广泛。正常组肾小管和肾小球球囊呈现的棕褐色着染比较少,与正常组相比,模型组NF-κB蛋白阳性表达明显增加,棕褐色着染变深,范围更大;与模型组比较,中药低、中、高剂量组棕褐色着染依次变浅,范围依次递减。见图 3。
|
| 图 3 经方麻黄附子细辛汤合防己黄芪汤对MN小鼠肾组织NF-κB蛋白表达的影响(×400) Fig. 3 Effect of Mahuang Fuzi Xixin Decoction combined with Fangji Huangqi Decoction on NF-κB protein expressions in kidney of MN mice(×400) |
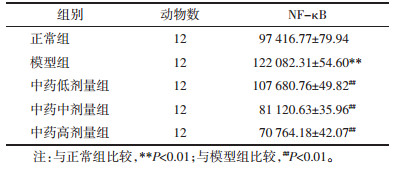
各组中阳性表达的积分光密度值(IOD)统计学分析显示:与正常组比较,模型组小鼠肾组织NF-κB蛋白表达升高(P<0.01),差异具有统计学意义;与模型组比较,中药低、中、高剂量组小鼠肾组织NF-κB蛋白表达均有不同程度的下降(P < 0.05或P < 0.01),差异具有统计学意义。见表 3。
|
麻黄附子细辛汤出自《伤寒论·辨少阴病脉证并治》,“少阴病,始得之,反发热,脉沉者,麻黄附子细辛汤主之”,有助阳解表之功。防己黄芪汤出自《金匮要略·痉湿暍病脉证并治》,“风湿,脉浮身重,汗出恶风者,防己黄芪汤主之”,有益气祛风,健脾利水之效。麻黄附子细辛汤温少阴而解表,益火之源壮少阴枢机使阴阳调和,并以汗法开鬼门以消水肿;防己黄芪汤健脾利水,益气祛风。两方联合治疗以少阴枢机不利为病机的膜性肾病,既能扶正固本,温阳补脾肾益气,又能对症去标,祛风除湿利水,标本兼顾,在临证中取得了良好的疗效。
MN的发病机制与氧化应激有着重要关系[4-5]。首先,氧化应激能够直接损害肾脏从而诱导膜性肾病的发生:氧化应激通常伴随着活性氧(ROS)生成的增多和抗氧化分子的生成下降,而ROS则能使脂质、蛋白质和核酸等重要细胞分子过氧化,从而使细胞的结构、功能出现损伤,对肾脏功能有直接破坏作用,从而参与MN的病理形成过程。其次,氧化应激还可以激活相应的信号通路(如NF-κB信号通路)介导免疫炎症反应促进膜性肾病的发生发展。NF-κB是导致相应炎症因子基因表达的主要起始因子,调控了一系列趋化因子和黏附分子物质的表达,如IL-6、MCP-1等,这些因子参与免疫和炎症细胞的趋化、浸润、增殖、分化过程,同时也能够反过来刺激NF-κB的活化,而这种正反馈效应使得炎症反应信号进一步释放,促进炎性反应,进而加重了肾脏组织损害[6-7]。本研究从中医经方麻黄附子细辛汤联合防己黄芪汤可能通过减轻肾脏氧化应激反应及炎症反应并参与NF-κB信号通路发挥对MN的治疗作用这一假说出发,通过观察肾脏组织中氧化应激反应相关蛋白SOD、MDA和炎症反应相关蛋白IL-6、MCP-1含量,及肾组织NF-κB蛋白表达的影响,以证实假说的真实性。
本研究结果发现经方麻黄附子细辛汤联合防己黄芪汤可有效降低MN小鼠血清TG、TC水平,能够使血浆白蛋白水平提高,但不会改变肾功能相关指标如SCr、BUN的数值,从而得出结论:中医经方麻黄附子细辛汤联合防己黄芪汤具有改善脂代谢紊乱和低蛋白血症的作用,但对肾功能无明显改善作用,这与以往学者研究麻黄附子细辛汤或防己黄芪汤单方作用的研究结果相似[8-10]。经过逐层剖析两方合用治疗MN的作用途径可以看到:首先,两方合用能有效改善脂质代谢紊乱,使得血浆白蛋白水平变高,从而减少高脂血症、低蛋白血症发生,减轻水肿症状;其次能有效改善膜性肾病肾脏病理形态,从而减轻病变程度,延缓病程进展;再次,两经方合用可以使MN小鼠的氧化应激反应和炎症反应减低,并抑制NF-κB通路,从中医宏观思维与西医微观思维相互联系的角度看,可以猜测这很可能是二联方缓解MN病理的最可能内在分子作用机制,而氧化应激反应、炎症反应以及NF-κB通路的激活等病理机制,是中医病机里“水湿、湿热、浊毒”等潜在的微观病理表现,由它所产生的抑制NF-κB通路、降低氧化应激反应和炎症反应是扶正固本、祛风除湿利水、化浊毒的内在分子层面的表现。
同时笔者也认识到本课题研究中存在的不足之处,如经方麻黄附子细辛汤联合防己黄芪汤对MN的作用机制只是初步的研究,其到底是如何发挥抑制氧化应激反应和炎症反应作用的,其具体机制有待进一步研究探讨。同时,在抑制氧化应激反应和炎症反应之间有没有潜在的内在分子联系,需要进一步证实。中医药防治MN具有广阔的研究前景和应用价值,相信在未来会看到更多的突破性进展和成果。
| [1] |
韩莉, 邓跃毅. 中医治疗膜性肾病的临床及实验研究进展[J]. 山东中医药大学学报, 2010, 34(3): 278-280. HAN L, DENG Y Y. Progress of clinical and experimental study on membranous nephropathy treated with traditional Chinese medicine[J]. Journal of Shandong University of Traditional Chinese Medicine, 2010, 34(3): 278-280. |
| [2] |
COUSER W G. Primary membranous nephropathy[J]. Clinical Journal of the American Society of Nephrology, 2017, 12(6): 983-997. DOI:10.2215/CJN.11761116 |
| [3] |
WU C C, HUANG Y S, CHEN J S, et al. Resveratrol ameliorates renal damage, increases expression of heme oxygenase-1, and has anti-complement, anti-oxidative, and anti-apoptotic effects in a murine model of membranous nephropathy[J]. PLoS One, 2015, 10(5): e0125726. DOI:10.1371/journal.pone.0125726 |
| [4] |
彭素英. 内质网应激与氧化应激在膜性肾病中的作用及机制[D]. 泸州: 西南医科大学, 2015. PENG S Y. Endoplasmic reticulum stress and oxidative stress effect and mechanism in membranous nephropathy[D]. Luzhou: Southwest Medical University, 2015. |
| [5] |
王慧, 王净, 李静, 等. 膜性肾病小鼠模型的建立与鉴定[J]. 细胞与分子免疫学杂志, 2013, 29(2): 197-199. WANG H, WANG J, LI J, et al. Establish and identification of mouse model of membranous nephropathy[J]. Chinese Journal of Cellular and Molecular Immunology, 2013, 29(2): 197-199. |
| [6] |
BRASIER A R. The NF-kappaB regulatory network[J]. Cardiovascular Toxicology, 2006, 6(2): 111-130. DOI:10.1385/CT:6:2:111 |
| [7] |
TOMITA N, MORISHITA R, LAN H Y, et al. In vivo administration of a nuclear transcription factor-kappaB decoy suppresses experimental crescentic glomerulonephritis[J]. Journal of the American Society of Nephrology, 2000, 11(7): 1244-1252. DOI:10.1681/ASN.V1171244 |
| [8] |
苏哲苓, 卢嫣, 韩世盛, 等. 麻黄附子细辛汤对局灶性节段性肾小球硬化症模型大鼠血尿生化及肾脏病理的影响[J]. 江苏中医药, 2020, 52(12): 81-84. SU Z L, LU Y, HAN S S, et al. Effects of Mahuang Fuzi Xixin Decoction on hematuria biochemistry and renal pathology in rats with focal segmental sclerotic nephropathy[J]. Jiangsu Journal of Traditional Chinese Medicine, 2020, 52(12): 81-84. |
| [9] |
汪小莉, 刘晓, 夏春燕, 等. 防己黄芪汤药理作用及各单味药化学成分研究进展[J]. 中草药, 2016, 47(19): 3527-3534. WANG X L, LIU X, XIA C Y, et al. Research progress in chemical constituents in single herbs of Fangji Huangqi Decoction and its pharmacological activities[J]. Chinese Traditional and Herbal Drugs, 2016, 47(19): 3527-3534. DOI:10.7501/j.issn.0253-2670.2016.19.028 |
| [10] |
聂静涛. 防己黄芪汤对原发性肾病综合征水肿期患者的疗效及对24h尿蛋白、血清白蛋白、血脂的影响[J]. 实用临床医药杂志, 2017, 21(1): 48-51. NIE J T. Efficacy of Fangji Huangqi Decoction in treatment of patients with primary nephrotic syndrome in edema period and its influence on 24h urinary protein, serum albumin and blood lipid[J]. Journal of Clinical Medicine in Practice, 2017, 21(1): 48-51. |
 2022, Vol. 39
2022, Vol. 39