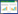文章信息
- 马亚宣, 吴垚锌, 邵瑞, 苗琳
- MA Yaxuan, WU Yaoxin, SHAO Rui, MIAO Lin
- 豆甾醇通过抑制钙离子内流抑制大鼠前列腺间质细胞收缩
- Stigmasterol inhibits the contraction of rat prostatic stromal cells by inhibiting calcium influx
- 天津中医药, 2022, 39(11): 1445-1451
- Tianjin Journal of Traditional Chinese Medicine, 2022, 39(11): 1445-1451
- http://dx.doi.org/10.11656/j.issn.1672-1519.2022.11.16
-
文章历史
- 收稿日期: 2022-08-03
2. 天津中医药大学中医药研究院, 天津 301617;
3. 方剂学教育部重点实验室, 天津 301617
良性前列腺增生(BPH)是老年男性常见的泌尿系统疾病。临床上BPH患者表现为尿频、尿急、尿不尽等下尿路症状[1](LUTS),严重影响老年男性的生活质量。前列腺腺体由上皮与间质两部分组成,其中间质又包括平滑肌细胞和成纤维细胞两种主要的细胞类型[2]。在BPH发生发展的过程中,前列腺体积增大,间质中的平滑肌细胞所占比例亦会增加[2],并且伴随有平滑肌细胞的过度收缩现象[3]。VK Lin等[4]指出,具有收缩活性并能够增殖的平滑肌细胞存在于增生进程的早期,在增生晚期大多数平滑肌细胞不再具有增殖活性。这些病理改变最终导致尿道梗阻和膀胱功能的代偿性改变[5],引起LUTS。临床上,多采用α受体阻滞剂联合抗雄、抗雌药物组合[6],一方面抑制前列腺体积增大,另一方面调节平滑肌细胞的过度收缩。
平滑肌细胞多呈梭型,其肌浆中含有的肌动蛋白(Actin)和肌球蛋白(Myosin)是平滑肌收缩系统的重要组成部分。当平滑肌细胞收缩时,相邻的Myosin以相反方向沿着Actin运动,通过相互作用而引起细胞收缩[7]。前列腺平滑肌的收缩主要是由细胞膜上的G蛋白偶联受体α-肾上腺素受体(α-Adrenoceptor)介导,激活的α-Adrenoceptor可以分别通过钙离子(Ca2+)、蛋白激酶C(PKC)和Rho激酶介导的3条信号通路诱导前列腺平滑肌收缩[8]。其中,Ca2+信号通路在调控前列腺平滑肌收缩中发挥了重要的作用。细胞内Ca2+水平的升高可以增强前列腺平滑肌细胞的兴奋性和收缩力[9]。目前已知,细胞内Ca2+的释放和细胞外Ca2+的内流均可使Ca2+浓度增加,前者主要是通过细胞内的肌浆网释放Ca2+参与肌肉收缩;后者则主要通过细胞膜上的Ca2+通道使Ca2+流入细胞内[10]。因此,调节前列腺平滑肌细胞内Ca2+内流抑制前列腺平滑肌的过度收缩在BPH的治疗中具有重要意义。
豆甾醇又称豆固醇,是一种植物甾醇,其广泛存在于各类植物中,在植物油中含量最高,其次是大豆、谷物和坚果。现代药理学研究发现,豆甾醇具有抗炎[11]、抗氧化[12]、抗癌[13]、降低胆固醇[14]等多种药理学作用,是一类极具研发价值的药用植物甾醇。结构式见图 1。近年来,有临床研究证实,植物甾醇有抑制前列腺肥大和改善膀胱收缩的效果,对尿频、夜间尿频、膀胱受迫、排尿障碍症状有明显的改善效果[15]。但是,豆甾醇对前列腺增生和前列腺平滑肌收缩的影响尚未见报道。本文研究豆甾醇对大鼠原代前列腺间质细胞收缩功能的影响,并进一步研究该作用是否与钙离子信号通路有关,旨在阐明豆甾醇调控前列腺平滑肌舒缩作用的分子机制,为豆甾醇作为治疗前列腺增生的候选药物提供实验依据。
|
| 图 1 豆甾醇的结构式 Fig. 1 Structure of stigmasterol |
Wistar大鼠,雄性,体质量180~200 g,购于北京维通利华实验动物有限公司。许可证号:SCXK(京)2019-0010。
1.2 药物豆甾醇(批号:83-48-7)购自成都埃法生物科技有限公司。
1.3 主要仪器与试剂细胞CO2培养箱购自美国Thermo scientific公司;离心机购自德国Eppendorf公司;超净工作台购自中国海尔股份有限公司;酶标仪购自北京海天友诚科技有限公司;实时定量PCR仪购自美国Bio-Rad公司;Nikon倒置显微镜购自北京恒三江仪器销售有限公司;台式震荡培养箱购自伊孚森(中国)生物技术有限公司;流式细胞仪FACS Calibur购自美国BD biosciences公司;荧光共聚焦显微镜购自美国BioTek公司。
胎牛血清(FBS,货号:F95551243)购自美国Invigentech公司;青链霉素混合液(PS,货号:2033117)、0.25%的胰蛋白酶(货号:2133226)和DMEM培养液(货号:2050238)购自以色列BI公司;鬼笔环肽(货号:YP0059)购自苏州宇恒生物科技有限公司;CCK-8检测试剂盒(货号:C6005)、乳酸脱氢酶(LDH)试剂盒(货号:CK12)购自日本Dojindo Lab公司;鼠尾胶原蛋白溶液(货号:354236)购自美国Corning公司;RNA提取试剂盒(货号:19211ES60)购自天津翌圣生物科技有限公司;反转录试剂盒(货号:AT341-02)购自北京全式金生物科技有限公司;实时荧光定量核酸扩增系统(qPCR)试剂盒(货号:A6001)购自美国Promega公司;转化生长因子-β(TGF-β1)(货号:96-100-21-10)购自派普泰克生物科技(苏州)有限公司;α-平滑肌肌动蛋白(α-SMA)抗体(货号:BM0002)购自博士德生物;GAPDH抗体(货号:60004-1-Ig)购自武汉三鹰生物技术有限公司;极敏型ECL发光液(货号:KF003)购自英国Affinity公司;氯化乙酰胆碱(货号:A6625)购自美国Sigma公司;钙荧光探针(货号:F8840)购自北京Solarbio科技有限公司。
2 实验方法 2.1 大鼠离体前列腺间质细胞的制备与培养Wistar大鼠安乐死后,仰位固定,用眼科剪和眼科镊逐层打开大鼠腹腔,分离并取出大鼠前列腺组织,放入预冷的含青链霉素的1×D-Hank’s溶液中;在超净台上,用无菌眼科剪和眼科镊剥离前列腺周围脂肪和结缔组织,清洗3次后用手术剪剪碎前列腺组织;加入5 mL的1×D-Hank’s溶液,1 000 r/min常温离心3 min(离心半径8.6 cm,下同);沉淀加入2 mL 0.25%的胰蛋白酶,于37 ℃摇床中消化60 min;再加入4 mL含15% FBS和1%PS的DMEM培养液终止消化,用70 μm的筛网过滤混悬液3次,1 000 r/min常温离心8 min;弃上清,沉淀用4 mL含15% FBS和1%PS的DMEM培养液重悬,加入铺有鼠尾胶原(25 μg/mL)的25 cm2培养瓶中,置5% CO2培养箱中37 ℃培养72 h。待细胞生长至80%融合时,传代1次。
2.2 大鼠原代前列腺间质细胞表型的鉴定大鼠原代前列腺间质细胞生长至2~3代时,以每孔1×105个细胞铺至24孔板,37 ℃培养箱中培养24 h后,弃去孔内培养液,磷酸缓冲盐溶液(PBS)洗3次,4%多聚甲醛冰上固定细胞15 min,弃去多聚甲醛,PBS洗3次,室温下用0.5% Triton X-100透化10 min,PBS洗3次后,用鬼笔环肽染液室温孵育20 min。PBS洗3次,加入4’,6-二脒基-2-苯基吲哚(DAPI)溶液室温孵育20 min,荧光显微镜观察染色情况。
2.3 细胞增殖和细胞毒性检测取对数生长期的大鼠原代前列腺间质细胞,以8×103/孔的密度接种于96孔板中,培养24 h使细胞完全贴壁。弃掉培养液,加入不同浓度的豆甾醇(0.1、0.5、1、5、10 μmol/L),继续培养24 h。检测细胞增殖时,按照CCK-8试剂盒说明书加入CCK-8溶液10 μL/孔,孵育1 h后,用酶标仪在450 nm波长处测定各孔吸光度值。检测细胞毒性时,按照LDH试剂盒说明书每孔加100 μL LDH工作液,避光孵育15 min,用酶标仪在490 nm波长处测定各孔吸光度值,确定豆甾醇的最大无毒作用剂量。
2.4 胶原凝胶收缩实验取对数生长期的大鼠原代前列腺间质细胞,1×D-Hank’s洗两遍,用0.25%的胰蛋白酶消化后,用含鼠尾胶原的不含/或含血清的DMEM培养液重悬细胞,制备细胞终浓度为6×104个/mL、鼠尾胶原浓度为1 mg/mL的细胞-胶原混合物,24孔板中每孔加500 μL,室温下放置20 min。待胶原凝固后,分别加入DMEM、含15% FBS的DMEM或用含15% FBS的DMEM配制的豆甾醇(终浓度为0.1、1、10 μmol/L)。轻轻分离凝胶与孔板,确保凝胶能够在孔板内自由移动,在加药0 h及24 h时观察与拍照。
2.5 RT-PCR检测取3~5代的大鼠原代前列腺间质细胞,以3×105/孔的密度接种于6孔板中,培养24 h使细胞完全贴壁,加入1 μmol/L豆甾醇继续孵育24 h后,按照RNA提取试剂盒说明书,提取细胞RNA;用反转录试剂盒将RNA反转录为cDNA模板;使用SYBR-Green扩增cDNA,通过2-ΔΔCt法计算目的基因α-SMA和Collagen I mRNA水平的表达情况,GAPDH为内参基因,具体引物序列如下。α-SMA:5’-GGACGTACAACTGGTATTGTGC-3’,5’-TCGGCAGTAGTCACTAAGGA-3’;Collagen I:5’-GCTCCTCTTAGGGGCCACT-3’,5’-ATTGGGGACCCTTAGGCCAT-3’,GAPDH:5’-ATGATTCTACCCACGGCAAG-3’,5’-CTGGAAGATGGTGATGGGTT-3’。
2.6 蛋白免疫印迹法(Western Blot)检测将3~5代的大鼠原代前列腺间质细胞以每孔3×105接种至6孔板,贴壁后分别加入10 ng/mL TGF-β1或TGF-β1+ 1 μmol/L豆甾醇,处理48 h后弃去上清,用PBS溶液洗2次,用0.25%的胰蛋白酶消化收集细胞,加入含有PMSF及蛋白酶抑制剂的预冷的RIPA裂解液,裂解细胞,冰上静置30 min,13 000 r/min、4 ℃离心20 min,吸取蛋白上清液用BCA法测定浓度。用Western Blot法检测细胞中α-SMA蛋白的表达。将15 μg/孔的蛋白上样到10%的聚丙烯酰胺凝胶电泳(SDS-PAGE),电泳后转至0.22 μm的PVDF膜,用5%脱脂奶粉室温封闭1.5 h,加入α-SMA抗体(1∶1 000稀释),4 ℃过夜,用TBST洗一抗30 min后,加入TBST稀释的二抗(1∶5 000稀释)孵育1 h,洗膜后用化学发光试剂盒检测化学发光。
2.7 钙离子浓度的检测大鼠原代前列腺间质细胞生长至3~5代时,以每孔6×105个细胞铺于6孔板,37 ℃培养24 h,弃去培养液,用HBSS溶液洗3次,加入1.5 μmol/L Fluo-3,AM工作液,37 ℃孵育20 min后,加入2.5 mL含有1% FBS的HBSS溶液,37 ℃孵育40 min,弃去细胞上清液,HEPES溶液洗3次,用0.25%的胰蛋白酶消化,用HEPES溶液重悬细胞并计数,用3×105个/mL的浓度上流式细胞仪检测。流式细胞仪参数设置见表 1。
使用Graphpad Prism 8.0.1软件分析,实验数据用均数±标准差(x±s)表示,多组间比较采用单因素方差分析,组间两两比较采用SNK法,P < 0.05为差异具有统计学意义。
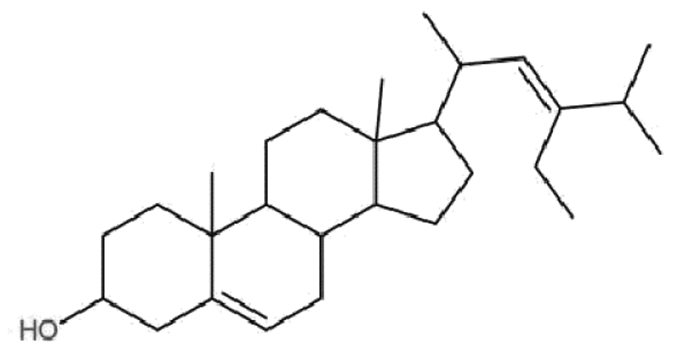
3 结果 3.1 大鼠原代前列腺间质细胞的培养与鉴定鬼笔环肽可以特异性与平滑肌细胞的标记蛋白F-肌动蛋白(F-actin)结合,因此用鬼笔环肽染色法可以鉴定平滑肌类型细胞。培养的大鼠原代前列腺间质细胞经鬼笔环肽染色后可见F-actin高表达(绿色荧光);Image J统计F-actin阳性染色细胞比例约为79.29%,提示经原代培养的大鼠前列腺间质细胞多为平滑肌细胞。见图 2。
|
| 图 2 大鼠原代前列腺间质细胞的鉴定 Fig. 2 Identification of smooth muscle cells in rat primary prostatic stromal cells |
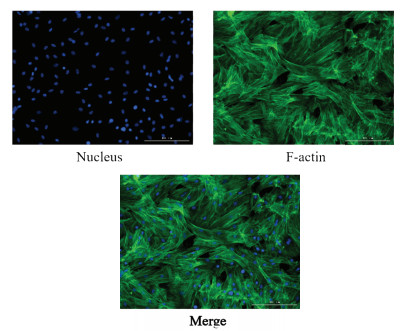
不同浓度的豆甾醇处理前列腺间质细胞后,用CCK8法检测药物对细胞活力的影响,结果显示各给药组OD450数值与对照组相比无显著性差异(见图 3A);进一步检测不同浓度的豆甾醇对前列腺间质细胞分泌LDH的影响,结果显示各给药组OD490数值与对照组相比亦无明显增加,反而在0.1、0.5和1 μmol/L浓度时可以抑制LDH的生成(见图 3B),提示浓度低于10 μmol/L时,豆甾醇对前列腺间质细胞的活力无明显抑制作用,且无毒性。
|
| 注:与对照组比较,*P<0.05,**P<0.01。 图 3 豆甾醇对大鼠前列腺间质细胞活力和毒性的影响(x±s,n=6) Fig. 3 Effects of stigmasterol on cell viability and toxicity in rat primary prostatic stromal cell(x±s, n=6) |
胶原凝胶收缩实验结果显示,含15%胎牛血清的培养液可以诱导前列腺间质细胞的收缩,而加入豆甾醇处理24 h后收缩作用被明显抑制。并且豆甾醇在浓度10 μmol/L时抑制作用最为明显,抑制率为77.1%(P < 0.05)。
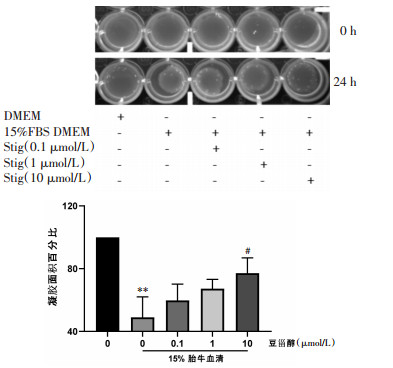
|
| 注:既不含胎牛血清也不含豆甾醇为对照组,含胎牛血清不含豆甾醇为模型组。与对照组比较,**P<0.01;与模型组比较,#P<0.05。 图 4 豆甾醇对胶原凝胶中大鼠前列腺间质细胞收缩能力的影响(x±s,n=3) Fig. 4 Effect of stigmasterol on the contractility of rat prostatic stromal cells in collagen gel(x±s, n=3) |
与对照组相比,1 μmol/L的豆甾醇可以显著抑制大鼠前列腺间质细胞收缩功能相关的α-SMA和Collagen I mRNA水平的表达。见图 5。
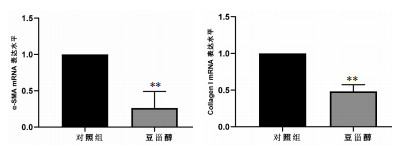
|
| 注:与对照组比较,**P<0.01。 图 5 豆甾醇对大鼠前列腺间质细胞中α-SMA和CollagenⅠmRNA表达的影响(x±s,n=3) Fig. 5 Effect of stigmasterol on α-SMA and CollagenⅠmRNA expressionin rat prostatic stromal cells(x±s, n=3) |
10 ng/mL的TGF-β1可以明显促进大鼠前列腺间质细胞中α-SMA蛋白的表达;1 μmol/L的豆甾醇可以抑制TGF-β1诱导的前列腺间质细胞α-SMA蛋白表达的升高。见图 6。

|
| 图 6 豆甾醇对TGF-β1刺激的大鼠前列腺间质细胞α-SMA表达的影响 Fig. 6 Effect of stigmasterol on TGF-β1 stimulated α-SMA expression in rat prostatic stromal cells |
用流式细胞技术检测大鼠前列腺间质细胞内钙离子浓度变化,经ACh刺激后大鼠前列腺间质细胞内钙离子浓度明显升高;豆甾醇可有效抑制ACh诱导的细胞内钙离子浓度的升高。作为对照,单独给药豆甾醇不会引起前列腺间质细胞内钙离子浓度变化。见图 7。
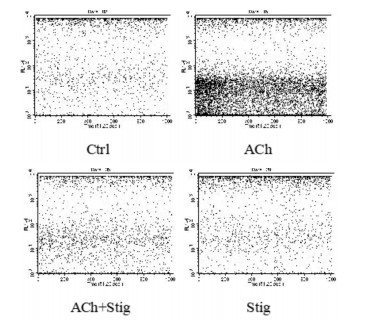
|
| 图 7 豆甾醇对大鼠前列腺间质细胞Ca2+浓度的影响 Fig. 7 Effect of stigmasterol on intracellular Ca2+ concentration in rat prostatic stromal cells |
前列腺间质细胞中平滑肌过度收缩是造成BPH相关LUTS的主要原因之一。本实验观察了豆甾醇对大鼠前列腺间质细胞收缩作用的影响,发现豆甾醇可明显抑制血清诱导的胶原凝胶中前列腺间质细胞的收缩;基因表达方面,豆甾醇可以抑制本底水平以及TGF-β1诱导的收缩相关基因的α-SMA和CollagenⅠ的表达;进一步检测钙离子浓度证实豆甾醇可以抑制ACh刺激的细胞内钙离子浓度的增加。
钙离子信号通路与细胞收缩调控关系密切。有报道指出,前列腺中平滑肌可以通过α-Adrenoceptor打开细胞膜上的电压依赖性钙通道,使Ca2+内流增加[16];与钙调蛋白结合[17]后作用于肌球蛋白轻链激酶(MLCK),催化肌球蛋白轻链(MLC)磷酸化,引起前列腺平滑肌的收缩[8]。本研究发现,豆甾醇抑制前列腺间质细胞收缩以及抑制ACh诱导的大鼠前列腺间质细胞钙离子内流。值得注意的是,PKC和Rho激酶通路亦可以促进MLC磷酸化而产生收缩效应[18]。然而豆甾醇是否可以通过其他非钙离子依赖的信号通路调节前列腺间质细胞的收缩尚不清楚。
植物甾醇尚无毒副作用的报道,常作为一种食品添加剂和保健食品原料进行开发、利用[19]。在欧洲传统疗法中常作为天然保健药用于治疗前列腺肥大症[15]。以β-谷固醇、豆固醇、菜子固醇等为主要成分的植物甾醇广泛存在于各种植物油、植物种子、花粉中[20]。研究显示,植物甾醇可以通过抑制促炎因子的表达以及p38 MAPK信号通路的激活抑制大鼠慢性非细菌性前列腺炎[21]。也有临床研究证实,β-谷甾醇具有抑制前列腺肥大、改善膀胱收缩的功效[15],但其作用机制尚未明确。目前,关于豆甾醇在前列腺疾病中的作用尚不清楚。已有的报道发现豆甾醇具有抗氧化、抗炎、抗癌的活性[12]。
Li等[22]发现,豆甾醇可以通过抑制氧化应激相关标志物活性氧的产生,增加超氧化物歧化酶和过氧化氢酶的活性发挥抗氧化作用;同时,Liang等[23]发现豆甾醇还可以通过减少氧化应激和炎症对脑缺血/再灌注损伤大鼠发挥保护作用。Ahmad等[24]发现,豆甾醇可以通过抑制促炎细胞因子人肿瘤坏死因子α、白介素-6、白介素-1β、诱导型一氧化氮合成酶和环氧合酶-2的表达,同时上调抗炎细胞因子白介素-10的表达发挥抗炎作用。此外,Zhao等[25]发现豆甾醇可以通过阻断蛋白激酶B(Akt)/哺乳动物雷帕霉素靶蛋白(mTOR)信号通路诱导细胞凋亡和自噬发挥抗癌作用。在豆甾醇调节钙离子通路方面,有报道指出[26]豆甾醇可以刺激菜豆根对钙离子的吸收并诱导钙调素的合成。李庆勇等[27]研究发现豆甾醇可以通过上调人肝癌细胞SMMC-7721内的钙离子浓度,阻滞细胞周期的不同阶段而诱导细胞发生凋亡。在豆甾醇对细胞收缩的影响方面,有报道指出,豆甾醇对血管紧张素Ⅱ诱导的大鼠胸大动脉平滑肌细胞A7r5有显著的抑制作用[22]。本研究首次发现豆甾醇可以抑制前列腺间质细胞的收缩,降低收缩相关蛋白α-SMA和CollagenⅠ的表达,并且可以抑制ACh诱导的前列腺间质细胞钙离子浓度的升高。这些结果表明,豆甾醇可以作用于前列腺间质细胞,抑制前列腺间质的过度收缩,其机制与抑制钙离子内流有关,提示豆甾醇可能通过调节前列腺间质细胞收缩状态而抑制BPH,是临床治疗BPH的潜在候选药物。
| [1] |
VENTURA S, OLIVER V, WHITE C, et al. Novel drug targets for the pharmacotherapy of benign prostatic hyperplasia (BPH)[J]. British Journal of Pharmacology, 2011, 163(5): 891-907. DOI:10.1111/j.1476-5381.2011.01332.x |
| [2] |
SHAPIRO E, HARTANTO V, LEPOR H. Quantifying the smooth muscle content of the prostate using double-immunoenzymatic staining and color assisted image analysis[J]. The Journal of Urology, 1992, 147(4): 1167-1170. DOI:10.1016/S0022-5347(17)37508-0 |
| [3] |
LEE S N, CHAKRABARTY B, WITTMER B, et al. Age related differences in responsiveness to sildenafil and tamsulosin are due to myogenic smooth muscle tone in the human prostate[J]. Scientific Reports, 2017, 7: 10150. DOI:10.1038/s41598-017-07861-x |
| [4] |
LIN V K, WANG D, LEE I L, et al. Myosin heavy chain gene expression in normal and hyperplastic human prostate tissue[J]. The Prostate, 2000, 44(3): 193-203. DOI:10.1002/1097-0045(20000801)44:3<193::AID-PROS3>3.0.CO;2-A |
| [5] |
CHAKRABARTY B, LEE S, EXINTARIS B. Generation and regulation of spontaneous contractions in theprostate[J]. Smooth Muscle Spontaneous Activity, 2019, 195-215. |
| [6] |
ROEHRBORN C G, BARKIN J, TUBARO A, et al. Influence of baseline variables on changes in international prostate symptom score after combined therapy with dutasteride plus tamsulosin or either monotherapy in patients with benign prostatic hyperplasia and lower urinary tract symptoms: 4-year results of the CombAT study[J]. BJU International, 2014, 113(4): 623-635. DOI:10.1111/bju.12500 |
| [7] |
范佳玉, 徐丽萌, 刘阳, 等. 细胞力学调控中肌动蛋白与肌球蛋白Ⅱ的作用[J]. 中国组织工程研究, 2022, 26(25): 4004-4009. FAN J Y, XU L M, LIU Y, et al. Roles of F-actin and myosin Ⅱ in the regulation of cell mechanics[J]. Chinese Journal of Tissue Engineering Research, 2022, 26(25): 4004-4009. DOI:10.12307/2022.406 |
| [8] |
HENNENBERG M, STIEF C G, GRATZKE C. Prostatic α1-adrenoceptors: New concepts of function, regulation, and intracellular signaling[J]. Neurourology and Urodynamics, 2014, 33(7): 1074-1085. DOI:10.1002/nau.22467 |
| [9] |
李卓, 柳建军. 钙离子途径介导的良性前列腺增生机制的研究进展[J]. 药学研究, 2013, 32(3): 168-171. LI Z, LIU J J. Research progress on the calcium pathway mediated mechanisms of benign prostatic hyperplasia[J]. Journal of Pharmaceutical Research, 2013, 32(3): 168-171. |
| [10] |
范雪新, 杨磊, 项斌, 等. 钙离子通道蛋白的研究进展[J]. 生物化学与生物物理进展, 2016, 43(12): 1129-1138. FAN X X, YANG L, XIANG B, et al. Recent research progress of Ca2+ permeable channels[J]. Progress in Biochemistry and Biophysics, 2016, 43(12): 1129-1138. DOI:10.16476/j.pibb.2016.0365 |
| [11] |
GABAY O, SANCHEZ C, SALVAT C, et al. Stigmasterol: a phytosterol with potential anti-osteoarthritic properties[J]. Osteoarthritis and Cartilage, 2010, 18(1): 106-116. DOI:10.1016/j.joca.2009.08.019 |
| [12] |
PANDA S, JAFRI M, KAR A, et al. Thyroid inhibitory, antiperoxidative and hypoglycemic effects of stigmasterol isolated from Butea monosperma[J]. Fitoterapia, 2009, 80(2): 123-126. DOI:10.1016/j.fitote.2008.12.002 |
| [13] |
KIM Y S, LI X F, KANG K H, et al. Stigmasterol isolated from marine microalgae Navicula incerta induces apoptosis in human hepatoma HepG2 cells[J]. BMB Reports, 2014, 47(8): 433-438. DOI:10.5483/BMBRep.2014.47.8.153 |
| [14] |
BATTA A K, XU G R, HONDA A, et al. Stigmasterol reduces plasma cholesterol levels and inhibits hepatic synthesis and intestinal absorption in the rat[J]. Metabolism, 2006, 55(3): 292-299. DOI:10.1016/j.metabol.2005.08.024 |
| [15] |
何雄伟. 植物甾醇治疗前列腺疾病应用进展[J]. 中国医药导报, 2010, 7(10): 17-18. HE X W. Application progress of phytosterol in the treatment of prostate diseases[J]. China Medical Herald, 2010, 7(10): 17-18. |
| [16] |
李新, 宋波, 李益人, 等. 钙通道在大鼠逼尿肌不稳定膀胱中的表达及变化[J]. 第三军医大学学报, 2003, 25(13): 1165-1167. LI X, SONG B, LI Y R, et al. Expressions and changes of Ca2+ channels in detrusor instability in rats[J]. Acta Academiae Medicinae Militaris Tertiae, 2003, 25(13): 1165-1167. DOI:10.3321/j.issn:1000-5404.2003.13.013 |
| [17] |
KUO I Y, EHRLICH B E. Signaling in muscle contraction[J]. Cold Spring Harbor Perspectives in Biology, 2015, 7(2): a006023. DOI:10.1101/cshperspect.a006023 |
| [18] |
林原, 唐泽耀, 陈华, 等. 平滑肌肌球蛋白轻链激酶对肌球蛋白的非钙依赖性磷酸化[J]. 科学技术与工程, 2002, 2(6): 37-40. LIN Y, TANG Z Y, CHEN H, et al. Ca2+-independent phosphorylation of myosin on smooth muscle myosin by myosin light chain kinase[J]. Science Technology and Engineering, 2002, 2(6): 37-40. |
| [19] |
张莉华, 许新德, 邵斌, 等. 植物甾醇毒理学安全性评价[J]. 中国油脂, 2010, 35(5): 19-22. ZHANG L H, XU X D, SHAO B, et al. Toxicological safety assessment of phytosterol[J]. China Oils and Fats, 2010, 35(5): 19-22. |
| [20] |
周志远, 卢群, 刘洋, 等. 豆甾醇的研究及开发进展[J]. 中国当代医药, 2015, 22(24): 15-17. ZHOU Z Y, LU Q, LIU Y, et al. Research and development progress of stigmasterol[J]. China Modern Medicine, 2015, 22(24): 15-17. |
| [21] |
程丽艳, 屠凌岚, 史红. 植物甾醇对慢性非细菌性前列腺炎症的干预作用及其机制研究[J]. 中国临床药理学与治疗学, 2015, 20(12): 1348-1353. CHENG L Y, TU L L, SHI H. Study of the effects of phytosterols in neuralgia in rats with chronic nonbacterial prostatitis and the mechanism[J]. Chinese Journal of Clinical Pharmacology and Therapeutics, 2015, 20(12): 1348-1353. |
| [22] |
LI C M, LIU Y, XIE Z, et al. Stigmasterol protects against Ang IIinduced proliferation of the A7r5 aortic smooth muscle cell-line[J]. Food & Function, 2015, 6(7): 2266-2272. |
| [23] |
LIANG Q L, YANG J, HE J J, et al. Stigmasterol alleviates cerebral ischemia/reperfusion injury by attenuating inflammation and improving antioxidant defenses in rats[J]. Bioscience Reports, 2020, 40(4): BSR20192133. |
| [24] |
AHMAD KHAN M, SARWAR A H M G, RAHAT R, et al. Stigmasterol protects rats from collagen induced arthritis by inhibiting proinflammatory cytokines[J]. International Immunopharmacology, 2020, 85: 106642. |
| [25] |
ZHAO H G, ZHANG X, WANG M, et al. Stigmasterol simultaneously induces apoptosis and protective autophagy by inhibiting Akt/mTOR pathway in gastric cancer cells[J]. Frontiers in Oncology, 2021, 11: 629008. |
| [26] |
VEGA M A, BOLAND R L. Presence of sterol-binding sites in the cytosol of French-bean (Phaseolus vulgaris) roots[J]. The Biochemical Journal, 1988. |
| [27] |
李庆勇, 姜春菲, 张黎, 等. β-谷甾醇、豆甾醇诱导人肝癌细胞SMMC-7721凋亡[J]. 时珍国医国药, 2012, 23(5): 1173-1175. LI Q Y, JIANG C F, ZHANG L, et al. Apoptosis-inducing effect of β-sitosterol and stigmasterol on human liver cancer SMMC-7721 cells[J]. Lishizhen Medicine and Materia Medica Research, 2012, 23(5): 1173-1175. |
2. Research Institute of Traditional Chinese Medicine, Tianjin University of Traditional Chinese Medicine, Tianjin 301617, China;
3. Key Laboratory of Formulary Science, Ministry of Education, Tianjin 301617, China
 2022, Vol. 39
2022, Vol. 39