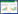文章信息
- 李梓宁, 靳雅, 李霄, 张晗, 张鹏
- LI Zining, JIN Ya, LI Xiao, ZHANG Han, ZHANG Peng
- 基于UPLC-Q-TOF-MS/MS结合网络药理学及分子对接研究益母草水提物治疗动脉粥样硬化的作用机制
- Mechanism of the aqueous extracts of Leonurus japonicus Houtt. in treatment of atherosclerosis based on UPLC-Q-TOF-MS/MS with network pharmacology and molecular docking
- 天津中医药, 2022, 39(11): 1459-1469
- Tianjin Journal of Traditional Chinese Medicine, 2022, 39(11): 1459-1469
- http://dx.doi.org/10.11656/j.issn.1672-1519.2022.11.18
-
文章历史
- 收稿日期: 2022-08-12
2. 方剂学教育部重点实验室, 天津 301617;
3. 天津中医药大学中医药研究院, 天津 301617
动脉粥样硬化(AS)是一种累及大中动脉的血管壁慢性炎症性疾病,其发病机制复杂,受遗传因素、环境因素、生活方式等多方面影响[1]。AS是心脑血管疾病与外周血管疾病的共同病理基础,常导致缺血性心脏病、缺血性中风等疾病的发生。随着西医的不断发展,以他汀类、抗血小板为主的药物治疗,以及以经皮冠状动脉介入治疗为主的外科介入治疗手段,在一定程度上减少了AS引发的心脑血管疾病的病死率。然而,他汀类药物具有一定的引发肌损伤及肝肾损伤的风险,且在他汀的降胆固醇治疗达标后,患者仍存在明显的心血管残留风险。此外,他汀单药不能满足极高危患者的治疗需求[2-4]。外科介入手术虽可临时缓解冠状动脉管腔狭窄及堵塞,但常易在术后几月或几年内出现“支架内再狭窄”情况,并未从根本上解决疾病状况,且患者术后需终身服药,增加医疗成本与负担[5]。因此,寻找可靠、有效、不良反应小的天然药物来防治AS疾病,一直以来被寄予厚望。
较之单一化学成分或单一作用靶点的药物而言,中药具有多成分、多靶点的优势,在AS的临床治疗方面已取得一定的效果[6]。益母草为唇形科植物益母草Leonurus japonicas Houtt.的新鲜或干燥地上部分,最早收录于《神农本草经》,被列为上品。其味辛、微苦,性微寒,入心包、肝经,具有活血化瘀、利尿消肿、清热解毒之效[7]。中医认为,AS疾病多以“痰、瘀、浊、毒、虚”等为主要病理因素,其“瘀”不仅贯穿其发生、发展始终,又常与痰、浊等相互交结加速疾病进程[8],是临床防治AS的关键之一。益母草虽为治疗月经不调、痛经经闭、产后恶露不尽的妇科良药,但长于活血养血,《本草汇言》云:“益母草,行血养血,性而不伤心血,养血而不滞血,诚为血家之圣药也”[9]。因此,益母草目前已常用于心脑血管疾病的防治,尤其是复方的组方配伍之中,如冠心康[10]、醒脑治瘫胶囊[11]等,取其活血养血、通利脉道之功。现代药理研究表明,益母草化学成分主要有萜类、生物碱、黄酮类和苯丙素类等,其中萜类成分显示出抗血栓、血管舒张、抗血小板聚集、抗炎等生物活性作用;生物碱类成分不仅具有抗炎、抗氧化活性,还可调节血管生成过程,并对子宫平滑肌具有双向收缩调节作用[12]。药效学研究发现,益母草能通过降低低密度脂蛋白胆固醇、总胆固醇和三酰甘油延缓AS的发展,还可通过减少氧化应激和减少炎症因子的表达,对肿瘤坏死因子-α(TNF-α)诱导的人脐静脉内皮细胞炎症起到保护作用,但缺乏对其机制的研究[13-15]。
网络药理学采用现代化的研究方法,将医学与计算机科学结合在一起,基于“多基因、多靶点、多途径”的互作网络,为中药治疗各种疾病的作用靶点和潜在作用机制提供了预测价值[16]。为了更好地探索益母草活性成分治疗AS的潜在分子机制,本研究借助超高压液相色谱串联四级杆飞行时间质谱联用(UPLC-Q-TOF-MS/MS)技术、网络药理学和分子对接的方法,从化学成分、作用靶点和信号传导通路多角度对益母草水提物干预AS的作用机制进行系统研究,以期为进一步揭示益母草的药理作用机制提供理论基础。
1 仪器与材料UPLC-Q-TOF-MS/MS仪UPLC Xevo G2-XS Q-TOF(Waters公司),ACQUITY UPLC HSS T3液相色谱柱(2.1 mm×100 mm,1.8 μm),高速冷冻离心机(赛默飞世尔科技有限公司,货号:75002440),电热套(北京中兴伟业有限公司,批号:2D4W),旋转蒸发仪(上海禾汽玻璃仪器有限公司,批号:RE5005BEX),电子天平(赛多利斯科学仪器有限公司,序列号:3137811120),色谱级甲酸(ASC公司),乙腈(Fisher公司),超纯水(屈臣氏),益母草药材2021年购于北京同仁堂,经天津中医药大学李天祥教授鉴定为唇形科植物益母草Leonurus japonicas Houtt.地上部分。
2 方法 2.1 益母草水提物的制备及处理称取适量益母草饮片加入蒸馏水回流提取3次,每次加入蒸馏水用量分别为10倍量、8倍量、8倍量,分别回流提取30 min、20 min、20 min,煮沸后计时,合并3次滤液,旋蒸,减压浓缩冻干。
2.2 益母草水提物的UPLC-Q-TOF-MS/MS分析鉴定称取益母草水提物药粉适量,采用50%甲醇超声提取20 min,提取液在转速13 000 r/min,离心半径8.6 cm,温度20 ℃下离心15 min,取上清液进样。液相色谱条件流速0.4 mL/min;柱温35 ℃;进样量10 μL;流动相为0.1%甲酸水溶液(A)-乙腈(B),梯度洗脱。洗脱时间见表 1。
采用电喷雾离子源(ESI),质谱扫描模式采用正、负离子2种扫描模式,毛细管电压为ESI+ 3.0 kV/ESI-2.5 kV,锥孔电压为40 V。离子源温度110 ℃,雾化器温度为450 ℃,雾化器流速为800 L/h,锥孔气流量为50 L/h。MSE Continuum扫描模式检测,质量扫描范围为m/z 100~1 200,碰撞气为氩气,碰撞电压为15~30 V、20~40 V、30~50 V,用亮氨酸脑啡肽LE(m/z 556.2677 [M+H]+)作为内标进行质量实时校正,体积流量为0.5 μL/min,进样量10 μL,数据采集软件为MassLynx 4.2,数据处理软件为UNIFI 1.9.4。
2.4 药物活性成分筛选及作用靶点预测利用有机小分子生物活性数据库(PubChem数据库,https://pubchem.ncbi.nlm.nih.gov)收集益母草水提物各成分化学结构。借助SwissADME数据库(http://www.swissadme.ch),根据益母草水提物各成分的化学结构或SMILES字符,预测其成分的ADME参数、药代动力学特性、类药物性质等,采用胃肠道吸收(GI-absorption=high)、类药性Druglikeness中Lipinski、Ghose、Veber、Egan和Muegge为yes且≥3为筛选标准,确定益母草水提物的主要活性成分。利用SwissTarget Prediction数据平台(http://www.swisstargetprediction.ch/),预测益母草水提物主要活性成分的潜在作用靶点。
2.5 疾病潜在作用靶点筛选及药物-疾病作用靶点获取通过GeneCards(https://www.genecards.org/)、OMIM(https://www.ncbi.nlm.nih.gov/omim)和DisGeNET(https://www.disgenet.org/search)等数据库挖掘与AS相关的靶基因;利用Excel对收集到的疾病靶点进行去重筛选,得到疾病相关的作用靶点。将AS相关的作用靶点映射至益母草水提物活性成分的潜在作用靶点上,借助Draw Venn Diagram在线绘图工具绘制益母草活性成分潜在作用靶点与AS疾病靶点的Venn图并得到交集靶点。
2.6 药物防治疾病的调控网络构建将AS相关的作用靶点映射至益母草水提物活性成分的潜在作用靶点上,得到成分-疾病靶点文件。借助Cytoscape 3.7.1软件进行网络可视化,构建活性成分-交集靶点调控网络。
2.7 靶点蛋白互作网络(PPI)构建及核心靶点选筛使用STRING数据库构建益母草抗AS的PPI网络图,生物体设置为“Homo”,得到PPI.tsv数据,借助Cytoscape3.7.1软件绘制并构建“共同作用靶点”的关系网络,PPI网络由代表目标蛋白质的节点和代表蛋白质-蛋白质相互作用的边组成。边缘的粗细代表组合分数。度是指直接连接到一个节点的其他节点的数量。度数越高,节点越重要。同时利用Cytoscape 3.7.1软件中CytoNCA和BisoGenet对PPI网络进行拓扑分析,以介度中心性(BC)、对接中心性(CC)、度自由性(DC)和Degree值等为筛选标准,筛选出核心靶点。
2.8 GO和京都基因和基因组百科全书(KEGG)通路富集分析使用DAVID在线分析软件将交集靶点进行GO生物过程和KEGG通路富集分析,得到通路富集文件,以P≤0.05为标准筛选通路,使用在线工具微生信进行可视化,得到GO柱状图和KEGG气泡图。
2.9 分子对接分析将益母草水提物有效成分与核心蛋白进行分子对接,从Pubchem数据库(https://pub-chem.ncbi.nlm.nih.gov/)和Chemspider数据库(http://www.8chemspider.com/)下载益母草水提物活性成分的SDF格式文件,使用Chem3D软件转化为Mol2格式文件。从Protein DataBank数据库(PDB,https://www.rcsb.org/)获取PPI网络中核心靶点的3D结构的PBD格式文件[白细胞介素(IL)-6(PDB:1ALU);肿瘤坏死因子(TNF,PDB:2E7A);IL-1β(PDB:1LZH);血管内皮生长因子A(VEGFA)(PDB:1MKK);CASP3(PDB:1NMS);myc(PDB:1NKP);表皮生长因子受体(EGFR,PDB:1XKK);SRC(PDB:1O41);丝裂原活化蛋白激酶3(MAPK3)(PDB:4QTB);HSP90AA1(PDB:1OSF)],导入PyMol软件去除水分子和异质分子。用Auto Dock Tools分子对接模拟软件对蛋白质进行添加氢原子等操作,再将化学成分和靶点文件均转化为pdbqt格式的文件,运用Grid模块设置蛋白原配体为对接盒子中心,利用Auto Dock Vina软件将受体(靶点)与配体(化学成分)进行半柔性对接,结合能小于0 k J/mol表明受体和配体具有自发结合潜力,结合能小于等于-5.0 kJ/mol说明化学成分与靶点对接效果较好[17]。
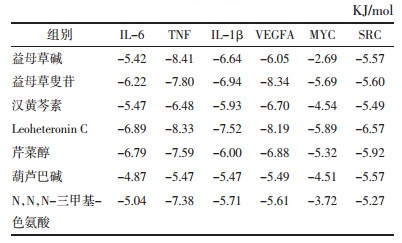
3 结果与分析 3.1 药物活性成分筛选及作用靶点预测益母草水提物UPLC-Q-TOF-MS/MS鉴定结果得到46个成分,具体信息见表 2,正离子及负离子模式图见图 1。借助SwissADME数据库,通过ADME筛选标准,得到7个活性成分,分别是益母草碱、益母草叟苷、Leoheteronin C、汉黄芩素、葫芦巴碱、N,N,N-三甲基-色氨酸和芹菜醇。利用Swiss Target Prediction数据平台,预测各成分的潜在作用靶点。其中得到13个益母草碱预测靶点,64个益母草叟苷潜在预测靶点,74个Leoheteronin C潜在靶点,103个汉黄芩素潜在靶点,34个葫芦巴碱潜在靶点,62个N,N,N-三甲基-色氨酸潜在靶点,92个芹菜醇潜在靶点。整合去重后共得到益母草水提物潜在作用靶点357个[1]。

|
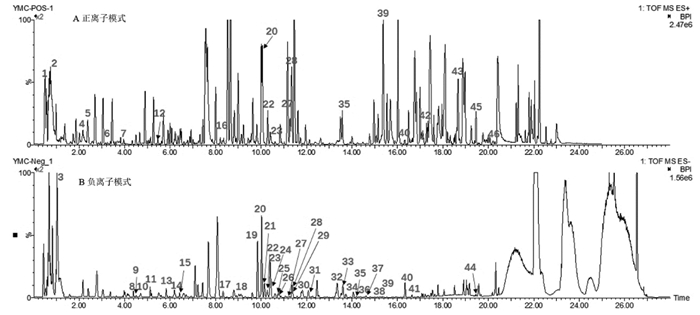
|
| 图 1 益母草水提物活性成分正离子(A)和负离子(B)模式质谱离子流图 Fig. 1 Positive (A) and negative (B) total ion chromatograms of LHAE active ingredients |
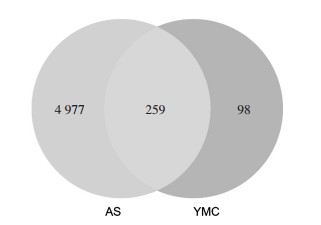
通过GeneCards、OMIM及DisGeNET数据库分别得到AS相关的疾病基因4 717个、188个、2 044个,整合去重后共得到5 237个疾病基因。随后与2.3得到的357个益母草成分作用靶点取交集,得到259个交集靶点并绘制Venn图,见图 2。进一步将交集靶点一一映射至成分潜在作用靶点上,得到药物成分-疾病靶点文件。
|
| 图 2 药物靶点和疾病靶点VENN图 Fig. 2 VENN diagram of drug targets and disease targets |
利用Cytoscape软件构建“药物-成分-靶点”网络,网络中有7个活性成分,259个靶点,相互作用的边共349条。见图 3。

|
| 图 3 益母草水提物治疗AS的“相关活性成分-潜在作用靶点”网络图 Fig. 3 Network of "related active components-potential targets" of LHAE in the treatment of AS |
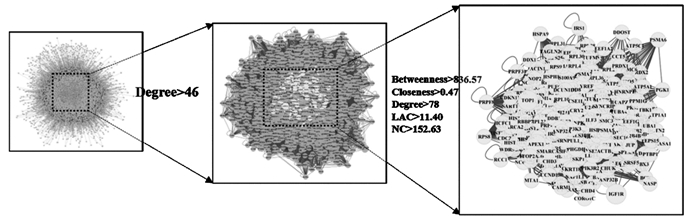
将得到的259个作用靶点导入STRING数据库进行PPI分析,利用Cytoscape3.7.1软件进行可视化处理,同时用软件中CytoNCA和BisoGenet插件对PPI网络进行拓扑分析,以BC、CC、DC、degree值等2倍中位数为筛选标准结果见图 4。并进一步筛选出核心靶点同时对核心靶点构建蛋白互作网络图,见图 5。
|
| 图 4 药物-疾病靶点筛选策略 Fig. 4 Screening strategies of drug-disease targets |

|
| 图 5 核心治疗靶点蛋白互作关系网络图 Fig. 5 Protein-protein interaction (PPI) network of hit related targets |
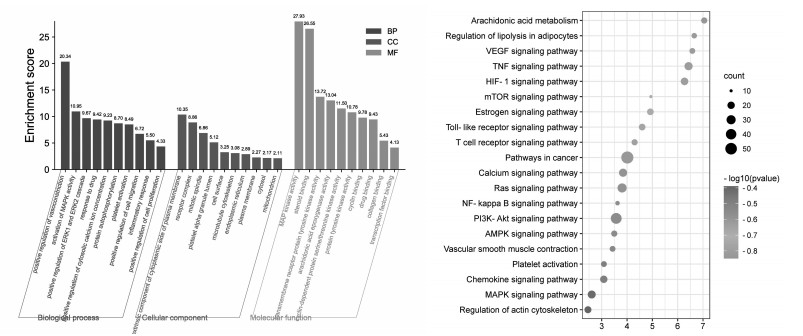
通过DAVID在线分析平台对作用靶点进行GO功能富集分析(P < 0.05),得到258个GOTERM-BP-DIRECT条目,259个GOTERM-CC-DIRECT条目,259个GOTERM-MF-DIRECT条目,分别取其前10条作图,通过微生信得到图 6。GO富集分析显示,益母草防治AS可能涉及:对药物的反应,对细胞外信号调节激酶ERK1、ERK2级联正调控、炎症反应等。
|
| 图 6 生物学过程(BP)、细胞成分(CC)、分子功能(MF)及KEGG通路富集结果 Fig. 6 Biological process(BP), cell component(CC), molecular function(MF) analysis of targets and KEGG pathway enrichment results |
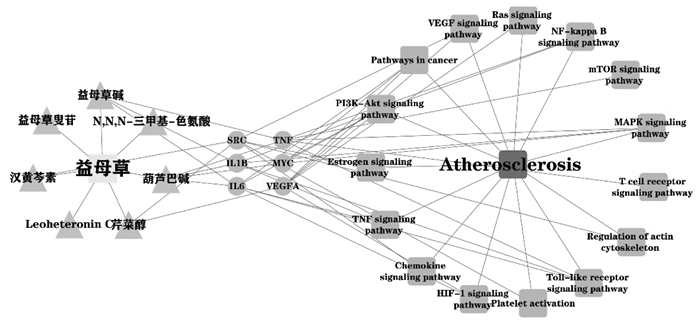
通过DAVID在线分析平台对作用靶点进行KEGG通路富集分析(P < 0.05),共得到240条信号通路,取相关性较高的20条作图,利用微生信得到图 6。KEGG富集分析显示,益母草可能通过影响磷酯酰肌醇3激酶-蛋白激酶B(PI3K-Akt)、TNF、低氧诱导因子-1(HIF-1)、肾素-血管紧张素系统(Ras)等信号通路发挥防治AS的作用。综合3.3与3.4的结果,通过Cytoscape软件对益母草7个核心成分,度值排名靠前的6个核心靶点,以及与其密切相关的15条核心信号通路进行“成分-靶点-通路”网络图的构建,见图 7。
|
| 图 7 成分-靶点-通路网络图 Fig. 7 Component-target-pathway interaction network |
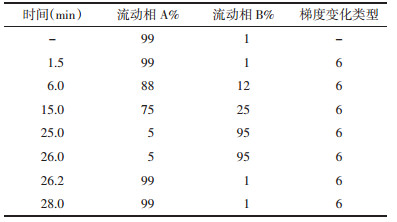
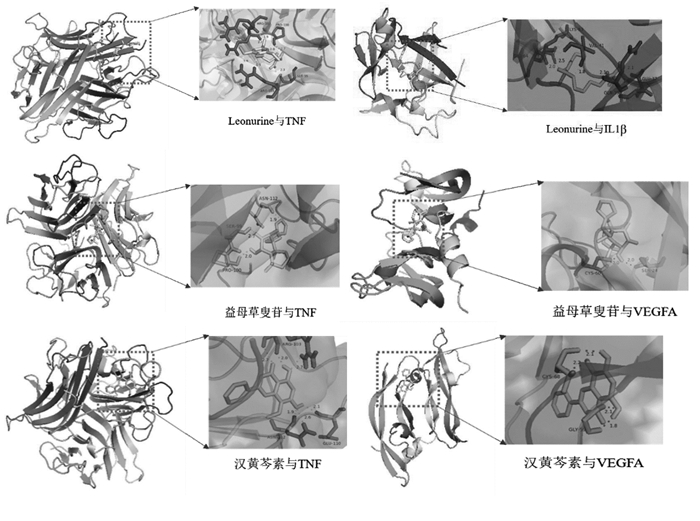
利用Auto Dock软件对核心药效成分和核心靶点进行分子对接模拟计算,见表 3。对部分结果用Pymol进行可视化分析,见图 8。对接结果显示,益母草提取物活性成分与AS核心靶点的最低结合能均小于0 kJ/mol,表示预测的成分与靶点可以自发进行结合,其中益母草叟苷、芹菜醇和Leoheteronin C与IL-6、TNF、IL-1β、VEGFA、MYC、SRC点的结合能均小于-5 kJ/mol,说明其与靶点对接效果好[17]。
|
| 图 8 分子对接模式图 Fig. 8 Molecular docking diagram |
本研究基于UPLC-Q-TOF-MS/MS与网络药理学活性成分筛选,发现益母草干预AS的主要活性成分可能是益母草碱、益母草叟苷、汉黄芩素、Leoheteronin C、芹菜醇、葫芦巴碱、N,N,N-三甲基-色氨酸。研究显示,益母草碱以剂量依赖性的方式显著减轻高胆固醇饮食诱导的新西兰雄兔AS的发展,高剂量益母草碱可升高高密度脂蛋白胆固醇、降低三酰甘油,减少VSMC由收缩表型向合成表型的转换和迁移,并改善巨噬细胞浸润,同时抑制血管细胞黏附分子-1(VCAM-1)、TNF-α、IL-6等炎症因子的水平。此外,益母草碱还可呈剂量依赖性地降低血清和肝脏的脂质过氧化水平[37]。Zhang等[38]从益母草中分离出的益母草叟苷A/B/C/D,在游离脂肪酸诱导的肝癌细胞中均有三酰甘油积聚的抑制作用。Ku等[39]发现汉黄芩素可以有效减少人脐静脉内皮细胞中由高糖诱导的血管炎症过程,减少血管通透性、单核细胞黏附、细胞黏附分子的表达,抑制活性氧的生成和核因子-κB(NF-κB)的激活。这些研究提示,益母草碱、益母草叟苷、汉黄芩素等可能是益母草水提物发挥抗AS药效的主要活性成分。
4.2 靶点分析通过网络药理学成分筛选、靶点预测和网络分析,可发现占据网络中心位置的主要为IL-6、TNF、IL-1β、VEGFA、c-myc等靶点,可能是益母草干预冠状动脉粥样硬化的关键作用靶点。既往研究表明,在AS的发展过程中,IL-6具有影响炎症细胞的聚集的作用,内皮细胞通过分泌趋化因子和增加细胞间黏附分子-1(ICAM-1)的表达来影响IL-6和可溶性IL-6受体复合物的结合,共同促进白细胞的募集和向内膜迁移。Ha等[40]发现胡枝子提取物可显著抑制TNF-α诱导的小鼠动脉内膜单核细胞的浸润、ICAM的表达,以及炎性细胞因子IL-1β、IL-6、TNF-α和VCAM1的表达,从而有效预防早期AS。Zhang等[41]发现TNF-α可能通过增加低密度脂蛋白跨内皮细胞的转运并促进NF-κB和过氧化物酶体增殖剂激活受体-γ(PPAR-γ)的激活,从而促进低密度脂蛋白在血管壁的滞留,加速AS。斑块内血管生成是增加斑块糜烂、破裂风险的重要因素。血管生成由各种生长因子诱导,例如VEGF家族。Mao等[42]发现,高胆固醇血症增加了炎性细胞因子TNF-α的释放,然后通过增强VEGFA/VEGFR-2和成纤维细胞生长因子-2(FGF-2)/纤维细胞生长因子受体-1(FGFR-1)表达促进斑块内血管生成,共同促进高胆固醇新西兰兔AS病变的不稳定性。血管平滑肌细胞过度迁移与病理性内膜增厚相关,Luo等[43]发现川芎内酯对病理性内膜增厚有保护作用,表现为抑制VSMC在体内和体外的迁移,并与下调c-myc蛋白和基质金属蛋白酶-2(MMP-2)蛋白的表达有关。可见,网络药理学预测的益母草水提物抗AS的关键靶点主要与炎症反应、血管新生及平滑肌细胞的增殖迁移有关,可为后续进一步实验提供参考。
4.3 生物富集分析通过GO功能富集分析可知,生物学进程包括对药物的反应,对ERK1、ERK2级联正调控、炎症反应等,主要涉及蛋白酪氨酸激酶活性、类固醇结合药物结合等方面的功能。通过KEGG富集分析预测,益母草水提物干预AS的信号通路主要是PI3K/Akt信号通路、HIF-1信号通路、肿瘤坏死因子信号通路、Ras信号通路。
PI3K/Akt信号已被证明参与许多生理和病理过程,包括细胞增殖、细胞凋亡、炎症、缺血性损伤和肿瘤进展[44]。巨噬细胞衍生的泡沫细胞是早期AS病变的主要细胞类型,PI3K/Akt信号通路介导巨噬细胞M1和M2极性改变和凋亡影响AS的各个阶段,包括早期病变、斑块进展和斑块稳定性[45]。
HIF-1信号通路可通过上调NF-κB、血管内皮生长因子及其受体、活性氧、自由基和一氧化氮合酶(iNOS)的表达,导致内皮细胞功能障碍、增殖、迁移和血管生成,从而促进AS的发展。此外,HIF-1通过促进巨噬细胞M1表型分化和骨桥蛋白、TNF-α、iNOS、IL-6和VEGF的表达,促进巨噬细胞的炎症和迁移。HIF-1α还通过减少胆固醇外流机制,促进泡沫细胞的形成[46]。Shan等[47]发现HIF-1α参与了缺氧诱导的KLF4表达上调,从而促进了血管平滑肌细胞的迁移,影响血管重塑。
Ras是多种细胞外信号通路的上游。Ras调节的信号通路控制包括增殖、生长和细胞周期进程在内的生物过程。Yu等[48]发现Ras在VSMCs中的作用包括ERK、FAK、PI3K/Akt的激活、MMPs的分泌以及其他小G蛋白的调节,阿卡波糖对A7r5细胞中Ras的表达有抑制作用,从而减少A7r5细胞的增殖、迁移。Lin等[49]发现哌嗪二酮衍生化合物TW-01能抑制Ras的激活,抑制MAPK及其下游c-fos、c-jun和c-myc mRNA表达,显著抑制血管平滑肌细胞的增殖以及大鼠颈总动脉球囊损伤后内膜增生。
5 结语本研究基于UPLC-Q-TOF-MS/MS技术定性表征益母草水提物的化学成分,并结合网络药理学、分子对接筛选并验证其主要活性成分的作用靶点,初步探讨了益母草水提物治疗AS的潜在作用机制。结果表明,益母草水提物可能通过调控IL-6、TNF、IL-1β、VEGFA和c-myc等核心靶点及PI3K/Akt信号通路、TNF信号通路、HIF-1信号通路发挥治疗AS作用。本研究为进一步阐明益母草水提物治疗AS机制提供了一定的研究方向和数据支持,但存在以下不足:1)仅对益母草水提物化学成分进行了定性分析,并未进行定量分析。2)通过网络药理学及分子对接研究得到的仅是预测性结果,益母草提取物及其活性成分防治AS的确切作用与机制仍需进一步实验研究验证。
| [1] |
VALANTI E K, DALAKOURA-KARAGKOUNI K, SIASOS G, et al. Advances in biological therapies for dyslipidemias and atherosclerosis[J]. Clinical and Experimental, 2021, 116: 154461. |
| [2] |
NIKOLIC D, BANACH M, CHIANETTA R, et al. An overview of statin-induced myopathy and perspectives for the future[J]. Expert Opinion on Drug Safety, 2020, 19(5): 601-615. DOI:10.1080/14740338.2020.1747431 |
| [3] |
ALMEIDA S O, BUDOFF M. Effect of statins on atherosclerotic plaque[J]. Trends in Cardiovascular Medicine, 2019, 29(8): 451-455. DOI:10.1016/j.tcm.2019.01.001 |
| [4] |
SIMIC I, REINER Ž. Adverse effects of statins-myths and reality[J]. Current Pharmaceutical Design, 2015, 21(9): 1220-1226. DOI:10.2174/1381612820666141013134447 |
| [5] |
FANELLI C, ARONOFF R. Restenosis following coronary angioplasty[J]. American Heart Journal, 1990, 119(2 Pt 1): 357-368. |
| [6] |
ZHAO C H, LI S, ZHANG J H, et al. Current state and future perspective of cardiovascular medicines derived from natural products[J]. Pharmacology & Therapeutics, 2020, 216: 107698. |
| [7] |
魏丽春, 李庆军. 益母草的药理与临床研究进展[J]. 西北药学杂志, 2009, 24(4): 333-335. WEI L C, LI Q J. Advances in pharmacological and clinical studies of Leonuri[J]. Northwest Pharmaceutical Journal, 2009, 24(4): 333-335. DOI:10.3969/j.issn.1004-2407.2009.04.056 |
| [8] |
张华, 倪昀, 王思静, 等. 动脉粥样硬化的发生机制和中医药干预研究进展[J]. 中西医结合心脑血管病杂志, 2019, 17(21): 3342-3347. ZHANG H, NI Y, WANG S J, et al. Research progress on the pathogenesis of atherosclerosis and intervention of traditional Chinese medicine[J]. Chinese Journal of Integrative Medicine on Cardio-Cerebrovascular Disease, 2019, 17(21): 3342-3347. DOI:10.12102/j.issn.1672-1349.2019.21.019 |
| [9] |
张雪, 宋玉琴, 杨雨婷, 等. 益母草活血化瘀化学成分与药理作用研究进展[J]. 药物评价研究, 2015, 38(2): 214-217. ZHANG X, SONG Y Q, YANG Y T, et al. Research progress on chemical components of Leonurus japonicus and their pharmacological effects of activating blood and resolving stasis[J]. Drug Evaluation Research, 2015, 38(2): 214-217. |
| [10] |
马贵萍, 陈冉, 章怡祎. 冠心康及其拆方对LDLR-/-动脉粥样硬化小鼠PERK-eIF2α-ATF4信号通路的影响[J]. 中华中医药杂志, 2020, 35(9): 4357-4362. MA G P, CHEN R, ZHANG Y Y. Effects of Guanxinkang and its decomposed formulas on PERK-eIF2α-ATF4 signaling pathway in LDLR-/- atherosclerotic mice[J]. China Journal of Traditional Chinese Medicine and Pharmacy, 2020, 35(9): 4357-4362. |
| [11] |
左扁头, 曲玉强, 汪刘根, 等. 醒脑治瘫胶囊治疗急性脑梗死患者颈动脉粥样硬化的临床研究[J]. 现代中药研究与实践, 2020, 34(1): 73-77. ZUO B T, QU Y Q, WANG L G, et al. Clinical study on Xingnao Zhitan Capsule in the treatment of carotid atherosclerosis in patients with aacute cerebral infarction[J]. Research and Practice on Chinese Medicines, 2020, 34(1): 73-77. |
| [12] |
MIAO L L, ZHOU Q M, PENG C, et al. Leonurus japonicus (Chinese motherwort), an excellent traditional medicine for obstetrical and gynecological diseases: a comprehensive overview[J]. Biomedecine & Pharmacotherapie, 2019, 117: 109060. |
| [13] |
ZHAI J X, REN Z H, WANG Y W, et al. Traditional Chinese patent medicine Zhixiong Capsule (ZXC) alleviated formed atherosclerotic plaque in rat thoracic artery and the mechanism investigation including blood-dissolved-component-based network pharmacology analysis and biochemical validation[J]. Journal of Ethnopharmacology, 2020, 254: 112523. DOI:10.1016/j.jep.2019.112523 |
| [14] |
ZHU Y Z, WU W J, ZHU Q, et al. Discovery of Leonuri and therapeutical applications: from bench to bedside[J]. Pharmacology & Therapeutics, 2018, 188: 26-35. |
| [15] |
JIANG T, REN K, CHEN Q, et al. Leonurine prevents atherosclerosis via promoting the expression of ABCA1 and ABCG1 in a pparγ/lxrα signaling pathway -dependent manner[J]. Cellular Physiology and Biochemistry, 2017, 43(4): 1703-1717. DOI:10.1159/000484031 |
| [16] |
JIAN G H, SU B Z, ZHOU W J, et al. Application of network pharmacology and molecular docking to elucidate the potential mechanism of Eucommia ulmoides-Radix Achyranthis Bidentatae against osteoarthritis[J]. BioData Mining, 2020, 13: 12. DOI:10.1186/s13040-020-00221-y |
| [17] |
WANG C L, LYU X H, LIU W, et al. Uncovering the pharmacological mechanism of motherwort (Leonurus japonicus Houtt.) for treating menstrual disorders: a systems pharmacology approach[J]. Computational Biology and Chemistry, 2020, 89: 107384. DOI:10.1016/j.compbiolchem.2020.107384 |
| [18] |
王宇卿, 黄涵. UPLC-Q-TOF/MS法分析瓜蒌薤白半夏汤中主要化学成分[J]. 中国医院药学杂志, 2018, 38(19): 2017-2021. WANG Y Q, HUANG H. Analysis of main chemical components in Gualou Xiebai Banxia Decoction based on UPLC-Q-TOF/MS[J]. Chinese Journal of Hospital Pharmacy, 2018, 38(19): 2017-2021. |
| [19] |
孙宁宁, 张可佳, 耿婉丽, 等. 基于UPLC-Q-TOF-MS的加参片提取物化学成分分析[J]. 中草药, 2018, 49(2): 293-304. SUN N N, ZHANG K J, GENG W L, et al. Analysis of chemical constituents of Jiashen Tablet extract by UPLC-Q-TOF-MS[J]. Chinese Traditional and Herbal Drugs, 2018, 49(2): 293-304. |
| [20] |
陈湘月, 殷世宁, 马晓青, 等. 牡蛎散中含氮类化学成分研究[J]. 中国海洋药物, 2020, 39(6): 59-66. CHEN X Y, YIN S N, MA X Q, et al. Studies on nitrogenous compounds in mulisan decoction[J]. Chinese Journal of Marine Drugs, 2020, 39(6): 59-66. |
| [21] |
安太勇, 陈晓虎, 张梅, 等. UPLC-Q-Exactive四极杆-静电场轨道阱高分辨质谱联用快速分析川党参的化学成分[J]. 中草药, 2018, 49(7): 1533-1542. AN T Y, CHEN X H, ZHANG M, et al. Rapid analysis on chemical constituents in roots of Codonopsis tangshen by UPLC coupled with Q-Exactive quadrupole-orbitrap mass spectrometry[J]. Chinese Traditional and Herbal Drugs, 2018, 49(7): 1533-1542. |
| [22] |
周菲, 林美斯, 李锐, 等. 基于UPLC-Q-TOF-MS技术分析百合地黄汤的化学成分[J]. 中国实验方剂学杂志, 2020, 26(7): 15-22. ZHOU F, LIN M S, LI R, et al. Analysis of chemical constituents in Baihe Dihuang Decoction by UPLC-Q-TOF-MS[J]. Chinese Journal of Experimental Traditional Medical Formulae, 2020, 26(7): 15-22. |
| [23] |
龚婧如, 王书芳. 刺五加的化学成分研究[J]. 中草药, 2012, 43(12): 2337-2341. GONG J R, WANG S F. Chemical constituents of Acanthopanax senticosus[J]. Chinese Traditional and Herbal Drugs, 2012, 43(12): 2337-2341. |
| [24] |
李洁, 刘子菡, 董凡, 等. 新绿原酸的大鼠体内代谢产物的UPLCQ-TOF MS鉴定[J]. 中国现代中药, 2020, 22(7): 1048-1055, 1071. LI J, LIU Z H, DONG F, et al. Metabolite identification of neochlorogenic acid in rats based on UPLC-Q-TOF MS[J]. Modern Chinese Medicine, 2020, 22(7): 1048-1055, 1071. |
| [25] |
胡金陵, 胡虹, 杨丽. 王不留行的化学成分研究[J]. 药学研究, 2014, 33(2): 71-72, 86. HU J L, HU H, YANG L. Studies on the chemical constituents from the seeds of Vaccaria segetalis[J]. Journal of Pharmaceutical Research, 2014, 33(2): 71-72, 86. |
| [26] |
THOMAS A G. 中西益母草比较研究[D]. 北京: 中国中医科学院, 2020. THOMAS A G. A compartive study of Leonurus cardiaca and Leonurus japonicus[D]. Beijing: China Academy of Chinese Medical Sciences, 2020. |
| [27] |
LI Y X, CHEN Z, FENG Z M, et al. Hepatoprotective glycosides from Leonurus japonicus houtt[J]. Carbohydrate Research, 2012, 348: 42-46. DOI:10.1016/j.carres.2011.10.034 |
| [28] |
袁露, 曹佩雪, 罗建华, 等. UHPLC-MS/MS鉴定心肌重构大鼠单次腹腔注射益母草碱后的血浆代谢产物[J]. 贵州中医药大学学报, 2021, 43(2): 33-38. YUAN L, CAO P X, LUO J H, et al. UHPLC-MS/MS was used to identify the plasma metabolites of leonurus after a single intraperitoneal injection in rats with myocardial remodeling[J]. Journal of Guizhou University of Traditional Chinese Medicine, 2021, 43(2): 33-38. |
| [29] |
李辰辰, 陆小, 童华荣. HPLC-Q-TOF-MS-MS测定桑椹中多酚类物质[J]. 食品科学, 2015, 36(2): 101-104. LI C C, LU X, TONG H R. Analysis of phenolic compounds in mulberry by high performance liquid chromatography-time of flight mass spectrometry[J]. Food Science, 2015, 36(2): 101-104. |
| [30] |
邓屾, 王涛, 吴春华, 等. 益母草黄酮类成分的分离与鉴定[J]. 中国药物化学杂志, 2013, 23(3): 209-212, 234. DENG S, WANG T, WU C H, et al. Isolation and identification of constituents from Leonurus japonicus[J]. Chinese Journal of Medicinal Chemistry, 2013, 23(3): 209-212, 234. |
| [31] |
李伟, 冯育林, 黎田儿, 等. UPLC-Q-TOF/MS技术结合诊断离子方法快速分析连钱草中黄酮类化合物[J]. 质谱学报, 2016, 37(6): 504-516. LI W, FENG Y L, LI T E, et al. Rapid analysis on flavonoids in Glechoma longituba (nakai)kupr by UPLC-Q-TOF/MS couple with diagnostic ions[J]. Journal of Chinese Mass Spectrometry Society, 2016, 37(6): 504-516. |
| [32] |
CONG Y, WANG J H, LI X. A new flavonoside from Leonurus heterophyllus[J]. Journal of Asian Natural Products Research, 2005, 7(3): 273-277. |
| [33] |
ZHANG Y, DENG S, QU L, et al. Rare syringyl acylated flavonol glycosides from the aerial parts of Leonurus japonicus Houtt[J]. Molecules (Basel, Switzerland), 2013, 18(3): 2967-2977. |
| [34] |
GIANG P M, SON P T, MATSUNAMI K, et al. New labdane-type diterpenoids from Leonurus heterophyllus SW[J]. Chemical & Pharmaceutical Bulletin, 2005, 53(8): 938-941. |
| [35] |
刘梦娇, 王云, 李玲云, 等. 三黄片化学成分的UPLC-Q-TOFMS/MS快速鉴定分析[J]. 中国中药杂志, 2017, 42(9): 1685-1692. LIU M J, WANG Y, LI L Y, et al. UPLC-Q-TOF/MS for rapid analysis of chemical constituents in Sanhuang Tablet[J]. China Journal of Chinese Materia Medica, 2017, 42(9): 1685-1692. |
| [36] |
CAI X H, CHE C T, LAM C K, et al. A new labdane diterpene from Leonurus heterophyllus[J]. Journal of Asian Natural Products Research, 2006, 8(7): 599-603. |
| [37] |
ZHANG Y F, GUO W, WEN Y D, et al. SCM-198 attenuates early atherosclerotic lesions in hypercholesterolemic rabbits via modulation of the inflammatory and oxidative stress pathways[J]. Atherosclerosis, 2012, 224(1): 43-50. |
| [38] |
ZHANG Y, DENG S, QU L, et al. Rare syringyl acylated flavonol glycosides from the aerial parts of Leonurus japonicus Houtt[J]. Molecules (Basel, Switzerland), 2013, 18(3): 2967-2977. |
| [39] |
KU S K, BAE J S. Baicalin, baicalein and wogonin inhibits high glucose-induced vascular inflammation in vitro and in vivo[J]. BMB Reports, 2015, 48(9): 519-524. |
| [40] |
HA S J, LEE J, SONG K M, et al. Ultrasonicated Lespedeza cuneata extract prevents TNF-α-induced early atherosclerosis in vitro and in vivo[J]. Food & Function, 2018, 9(4): 2090-2101. |
| [41] |
ZHANG Y Z, YANG X Y, BIAN F, et al. TNF-α promotes early atherosclerosis by increasing transcytosis of LDL across endothelial cells: crosstalk between NF-κB and PPAR-Γ[J]. Journal of Molecular and Cellular Cardiology, 2014, 72: 85-94. |
| [42] |
MAO Y, LIU X Q, SONG Y, et al. VEGF-A/VEGFR-2 and FGF-2/FGFR-1 but not PDGF-BB/PDGFR-β play important roles in promoting immature and inflammatory intraplaque angiogenesis[J]. PLoS One, 2018, 13(8): e0201395. |
| [43] |
LUO Z H, DENG H J, FANG Z C, et al. Ligustilide inhibited rat vascular smooth muscle cells migration via c-myc/MMP2 and ROCK/JNK signaling pathway[J]. Journal of Food Science, 2019, 84(12): 3573-3583. |
| [44] |
LORUSSO P M. Inhibition of the PI3K/AKT/mTOR pathway in solid tumors[J]. Journal of Clinical Oncology: Official Journal of the American Society of Clinical Oncology, 2016, 34(31): 3803-3815. |
| [45] |
LINTON M F, MOSLEHI J J, BABAEV V R. Akt signaling in macrophage polarization, survival, and atherosclerosis[J]. International Journal of Molecular Sciences, 2019, 20(11): 2703. |
| [46] |
JAIN T, NIKOLOPOULOU E A, XU Q B, et al. Hypoxia inducible factor as a therapeutic target for atherosclerosis[J]. Pharmacology & Therapeutics, 2018, 183: 22-33. |
| [47] |
SHAN F B, HUANG Z Z, XIONG R P, et al. HIF1α-induced upregulation of KLF4 promotes migration of human vascular smooth muscle cells under hypoxia[J]. Journal of Cellular Physiology, 2020, 235(1): 141-150. |
| [48] |
YU M H, LIN M C, HUANG C N, et al. Acarbose inhibits the proliferation and migration of vascular smooth muscle cells via targeting Ras signaling[J]. Vascular Pharmacology, 2018, 103/104/105: 8-15. |
| [49] |
LIN C F, HUANG H L, PENG C Y, et al. TW-01, a piperazinedionederived compound, inhibits Ras-mediated cell proliferation and angioplasty-induced vascular restenosis[J]. Toxicology and Applied Pharmacology, 2016, 305: 194-202. |
2. Key Laboratory of Pharmacology of Traditional Chinese Medical Formulae, Ministry of Education, Tianjin 301617, China;
3. Institute of Traditional Chinese Medicine, Tianjin University of Traditional Chinese Medicine, Tianjin 301617, China
 2022, Vol. 39
2022, Vol. 39