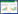文章信息
- 吕朝阳, 杨营军, 敖文, 李真真, 黄婷, 徐在革, 刘惠双
- LYU Chaoyang, YANG Yingjun, AO Wen, LI Zhenzhen, HUANG Ting, XU Zaige, LIU Huishuang
- 高良姜素抑制IRAK-1/MAPK/NF-κB信号通路对糖尿病大鼠心肌损伤的影响
- Impact of galangin on myocardial injury in diabetic rat by inhibiting IRAK-1/MAPK/NF-κB signaling pathway
- 天津中医药, 2022, 39(11): 1476-1482
- Tianjin Journal of Traditional Chinese Medicine, 2022, 39(11): 1476-1482
- http://dx.doi.org/10.11656/j.issn.1672-1519.2022.11.20
-
文章历史
- 收稿日期: 2022-07-28
2. 郑州市第七人民医院营养科, 郑州 450016
糖尿病会导致心肌肥大、心肌萎缩甚至间质纤维化等心肌结构异常,机制包括氧化应激损伤、炎症和细胞损伤等,最终引发心脏功能障碍,若不及时治疗,可发展为终末期心力衰竭[1]。目前,药物是治疗糖尿病心肌损伤的主要方法,但针对其病症尚无特效药进行医治。药物主要来源于植物,至今为止已有多种植物被用来治疗糖尿病及糖尿病引发的心肌损伤。因此,寻找从药用植物中提取的安全、有效的中药成分来治疗糖尿病及其心肌损伤已成为研究热点。高良姜素是从中药高良姜根部提取的黄酮类化合物,属于天然的抗氧化剂,具有较强的保护DNA免受活性氧攻击的能力[2];其能够调节大鼠心脏氧化应激、炎症和细胞凋亡进而减轻糖尿病心肌病[3],实现对心肌损伤的缓解,但具体机制尚需进一步研究。此外,高良姜素可抑制脂多糖诱导的RAW264.7细胞中白细胞介素-1受体相关激酶(IRAK-1)/丝裂原活化蛋白激酶(MAPK)/核因子-κB(NF-κB)信号通路的传导从而发挥抗炎作用[4],提示高良姜素可能通过抑制IRAK-1/MAPK/NF-κB信号通路表达从而影响疾病。因此,本研究观察了高良姜素对糖尿病后心肌损伤的影响,并探讨其缓解心肌损伤机制,为临床上高良姜素对糖尿病心肌病的治疗提供一定参考。
1 材料与方法 1.1 材料 1.1.1 实验动物43只健康SD大鼠、SPF级,均购自浙江维通利华实验动物技术有限公司桐乡分公司,许可证号:SCXK(浙)2020-0002,体质量180~200 g。所有大鼠均在温度21~23 ℃、湿度50%~60%、12 h光照12 h黑暗条件下饲养。本研究经郑州市第七人民医院动物实验伦理委员会审核并批准。
1.1.2 试剂与仪器链脲佐菌素(STZ)(北京索莱宝科技有限公司,货号:S8050);pc-NC、pc-IRAK-1由北京奥科生物科技有限公司设计并合成;Masson染色试剂盒(北京百奥莱博科技有限公司,货号:HR8326-THK);丙二醛(MDA)、超氧化物歧化酶(SOD)、乳酸脱氢酶(LDH)、一氧化氮(NO)、一氧化氮合成酶(NOS)检测试剂盒(碧云天生物科技有限公司,货号:S0131S、S0060、C0016、S0021S、S0025);肌酸激酶(CK)检测试剂盒(上海酶联生物科技有限公司,货号:ml076417);一抗兔源诱导型一氧化氮合酶(iNOS)、内皮型一氧化氮合酶(eNOS)、磷酸化的eNOS(p-eNOS)、IRAK-1、p38 MAPK、磷酸化的p38 MAPK(p-p38 MAPK)、NF-κB p65、磷酸化的NF-κB p65(p-NF-κB p65)、GAPDH,二抗羊抗兔及羊抗鼠(英国Abcam公司,货号:ab178945、ab199956、ab76199、ab238、ab170099、ab178867、ab239882、ab76302、ab9485、ab205718、ab205719)。血糖仪(上海玉研科学仪器有限公司,型号:JINKOU);小动物超声成像系统(日本S-Sharp公司,型号:S-Sharp Prospect T1);透射电镜(日立高新技术公司,型号:TM-1000);凝胶成像系统(上海天能公司,型号:5200)。
1.2 方法 1.2.1 动物分组及给药处理35只大鼠参考文献[5]高糖高脂连续饲养8周后,一次性腹腔注射30 mg/kg STZ进行造模,72 h后尾静脉采血,血糖≥16.7 mmol/L为糖尿病大鼠模型成功标准,建模成功32只,随机分为模型组、高良姜素组、高良姜素+pc-NC组、高良姜素+pc-IRAK-1组,每组8只。对照组8只大鼠正常饲养相同时间。除对照组和模型组外,其余各组参考文献[3]每天灌胃15 mg/kg高良姜素,连续给药6周。给药同时,高良姜素+pc-NC组、高良姜素+pc-IRAK-1组3 μL 100 μmol/L转染物注射到心脏左回旋区供血区域,每周1次,连续6周[6]。对照组和模型组灌胃等体积生理盐水、相同部位注射相同体积生理盐水。
1.2.2 样品采集实验结束后,收集大鼠尾静脉血,并进行心脏超声,大鼠处死后摘取心脏,部分置于4%多聚甲醛中固定,部分置于0.2%戊二醛中固定,部分置于-80 ℃冰箱保存。
1.2.3 快速血糖仪测量血糖取大鼠尾静脉血,快速血糖仪测量血糖水平。
1.2.4 心脏超声检测心脏功能小动物超声在左心长轴面上检测左心室舒张末期内径(LVEDD)、左心室收缩末期内径(LVESD),获得左心室射血分数(LVEF)。
1.2.5 Masson染色检测心肌组织纤维化情况4%多聚甲醛中取出心肌组织,石蜡切片(厚度5 μm),Masson染色试剂盒染色,光学显微镜观察心肌组织染色情况。在光学显微镜下心肌细胞呈红色,胶原纤维呈蓝色,拍照分析心肌胶原容积百分比(CVF)。
1.2.6 透射电镜观察心肌组织超微结构0.2%戊二醛中取出心肌组织,在2%四氧化锇中固定、丙酮脱水,包埋剂包埋组织,超薄切片机切片(厚度60 nm),碳酸铅染色,透射电镜观察心肌组织超微结构。
1.2.7 试剂盒检测MDA含量、SOD活性、LDH活性、CK含量、NO含量、NOS活力-80 ℃取部分心肌组织匀浆,检测MDA(TBA法)、SOD(羟胺法)、LDH(比色法)、CK(酶偶联法)、NO(比色法)、NOS(比色法)情况。
1.2.8 蛋白质免疫印迹检测心肌组织中IRAK-1、p38 MAPK、NF-κB p65蛋白表达-80 ℃冰箱中取部分心肌组织,冰上研磨,添加蛋白裂解液裂解蛋白,BCA蛋白试剂盒检测蛋白浓度,每孔上样25 μg总蛋白,聚丙烯酰胺凝胶电泳分离蛋白质,280 mA 45 min转至PVDF膜上;5%脱脂奶粉封闭2 h;清洗后分别加入一抗iNOS、eNOS、p-eNOS、IRAK-1、p38 MAPK、NF-κB p65、p-NF-κB p65、GAPDH,4 ℃孵育过夜;添加对应二抗,室温孵育1 h。显色试剂盒避光显色,蛋白凝胶成像系统拍照并定量分析。
1.3 统计学分析计量数据均采用平均数±标准差(x±s)表示,多组间比较用单因素方差分析,组间两两比较用SNK-q检验。P<0.05,差异有统计学意义。
2 结果 2.1 各组大鼠血糖情况建模后给药前,与对照组相比,模型组、高良姜素组、高良姜素+pc-NC组、高良姜素+pc-IRAK-1组血糖水平升高(P<0.05)。给药后,与对照组相比,模型组、高良姜素组、高良姜素+pc-NC组、高良姜素+pc-IRAK-1组血糖水平升高(P<0.05);与模型组相比,高良姜素组、高良姜素+pc-NC组、高良姜素+pc-IRAK-1组血糖水平降低(P<0.05);分别与高良姜素组、高良姜素+pc-NC组相比,高良姜素+pc-IRAK-1组血糖水平升高(P<0.05)。见表 1。
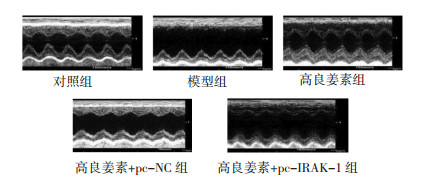
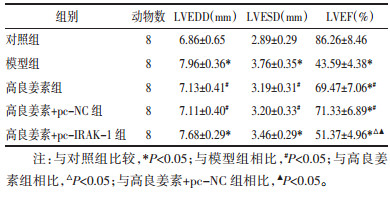
与对照组相比,模型组、高良姜素+pc-IRAK-1组大鼠LVEDD、LVESD水平升高(P<0.05),模型组、高良姜素组、高良姜素+pc-NC组、高良姜素+pc-IRAK-1组大鼠LVEF水平降低(P<0.05),差异均具有统计学意义;与模型组相比,高良姜素组、高良姜素+pc-NC组大鼠LVEDD、LVESD水平降低(P<0.05),LVEF水平升高(P<0.05),差异均具有统计学意义;分别与高良姜素组、高良姜素+pc-NC组相比,高良姜素+pc-IRAK-1组大鼠LVEF水平降低(P<0.05),差异具有统计学意义。见图 1,表 2。
|
| 图 1 各组大鼠超声心动图 Fig. 1 Echocardiography of rats in each group |
|
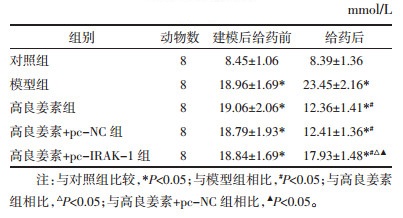
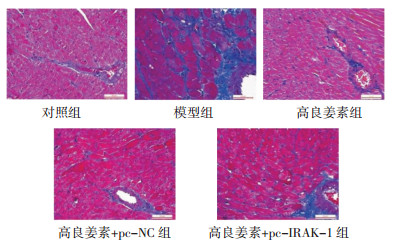
Masson染色显示心肌细胞为红色,胶原纤维为蓝色。对照组心肌细胞间隙清晰可见,细胞间质和血管旁胶原分布较稀、着色淡;模型组心肌细胞间质和血管旁着色深;高良姜素组、高良姜素+pc-NC组心肌细胞间质和血管旁着色减轻;高良姜素+pc-IRAK-1组心肌细胞间质和血管旁着色介于模型组和高良姜素组之间。见图 2。与对照组相比,模型组、高良姜素组、高良姜素+pc-NC组、高良姜素+pc-IRAK-1组大鼠CVF水平升高(P<0.05),差异具有统计学意义;与模型组相比,高良姜素组、高良姜素+pc-NC组、高良姜素+pc-IRAK-1组大鼠CVF水平降低(P<0.05),差异具有统计学意义;分别与高良姜素组、高良姜素+pc-NC组相比,高良姜素+pc-IRAK-1组大鼠CVF水平升高(P<0.05),差异具有统计学意义。见表 3。
|
| 图 2 各组大鼠心肌组织纤维化情况(Masson,×400) Fig. 2 Myocardial fibrosis of rats in each group (Masson, ×400) |
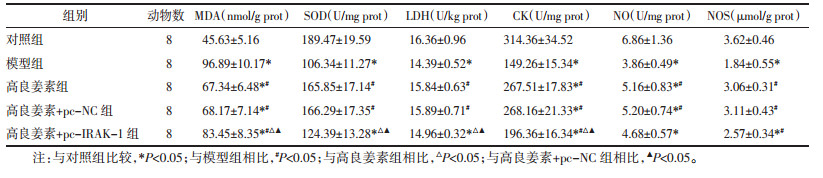
对照组心肌结构清晰、完整,肌纤维排列整齐,闰盘连接完整,明、暗带分布均匀清晰;模型组心肌结构紊乱,出现闰盘扭曲、断裂、参差不齐情况,明、暗带模糊,Z线和M线不清晰,部分肌丝溶解;高良姜素组、高良姜素+pc-NC组得到明显缓解,心肌结构清晰、完整,肌纤维排列整齐,闰盘基本完整,可见明、暗带;高良姜素+pc-IRAK-1组较高良姜素组心肌结构有所时混乱,闰盘参差不齐,部分肌丝溶解。见图 3。

|
| 图 3 各组大鼠心肌组织超微结构情况(×8 000) Fig. 3 Ultrastructure of myocardial tissue of rats in each group(×8 000) |
与对照组相比,模型组、高良姜素+pc-IRAK-1组心肌组织中MDA含量升高(P<0.05),CK、NO含量,SOD、LDH活性,NOS活力降低(P<0.05),高良姜素组、高良姜素+pc-NC组MDA含量升高(P<0.05),CK、NO含量降低(P<0.05),差异均具有统计学意义;与模型组相比,高良姜素组、高良姜素+pc-NC组心肌组织中MDA含量降低(P<0.05),CK、NO含量,SOD、LDH活性,NOS活力升高(P<0.05),高良姜素+pc-IRAK-1组MDA含量降低(P<0.05),CK含量、NOS活力升高(P<0.05),差异均具有统计学意义;分别与高良姜素组、高良姜素+pc-NC组相比,高良姜素+pc-IRAK-1组心肌组织中MDA含量升高(P<0.05),CK含量,SOD、LDH活性降低(P<0.05),差异均具有统计学意义。见表 4。
|
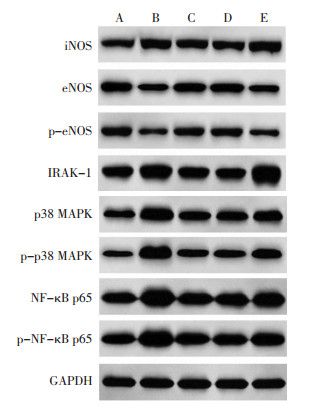
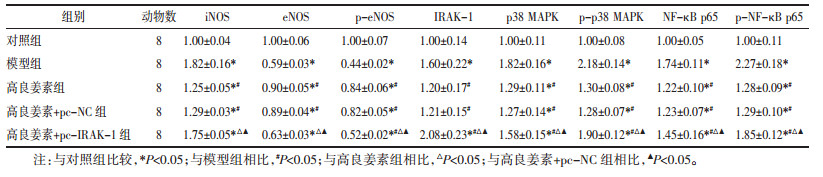
与对照组相比,模型组、高良姜素+pc-IRAK-1组心肌组织中iNOS、IRAK-1、p38 MAPK、p-p38 MAPK、NF-κB p65、p-NF-κB p65蛋白水平升高,eNOS、p-eNOS蛋白水平降低(P<0.05),高良姜素组、高良姜素+pc-NC组iNOS、p38 MAPK、NF-κB p65蛋白水平升高,eNOS、p-eNOS蛋白水平降低(P<0.05),差异均具有统计学意义;与模型组相比,高良姜素组、高良姜素+pc-NC组、高良姜素+pc-IRAK-1组心肌组织中iNOS、IRAK-1、p38 MAPK、NF-κB p65蛋白水平降低,eNOS、p-eNOS蛋白水平升高(P<0.05),差异具有统计学意义;分别与高良姜素组、高良姜素+pc-NC组相比,高良姜素+pc-IRAK-1组心肌组织中iNOS、IRAK-1、p38 MAPK、NF-κB p65蛋白水平升高,eNOS、p-eNOS蛋白水平降低(P<0.05),差异具有统计学意义。见图 4、表 5。
|
| 注:A.对照组;B.模型组;C.高良姜素组;D.高良姜素+pc-NC组;E.高良姜素+pc-IRAK-1组。 图 4 各组大鼠心肌组织中iNOS、eNOS、IRAK-1、p38 MAPK、NF-κB p65蛋白水平 Fig. 4 Protein levels of iNOS, eNOS, IRAK-1, p38 MAPK and NF-κB p65 in myocardium of rats in each group |
|
糖尿病在中医的描述可溯源至《黄帝内经》中“消渴”一词,《诸病源候论》中描述“消渴重,心中痛”,表明心中痛是消渴病重症表现,中医认为糖尿病发展到晚期表现为气血阴阳两虚,痰湿淤血互作,临床上表现为持续性胸痛、严重心率失常、心力衰竭等[7]。目前西药缺乏针对性药物,中药治疗在能改善疾病同时,不良反应小,且对糖尿病有明显的防治作用[8]。高良姜为单子叶植物中姜科植物,性辛热,归脾胃经,在中国分布较广,化学成分复杂,具有降血糖、抗氧化、抗炎、抗血栓等独特的药理学作用[9]。高良姜素为姜科植物高良姜根中提取物,具有广泛的药理活性,如抗炎、抗过敏、抗氧化以及清除自由基等,药理广泛且效果明显,有望成为开发的新药或保健品服务于人类,前景广阔[10]。在本研究中,发现高良姜素能够降低糖尿病大鼠血糖水平,缓解糖尿病引起的心肌组织损伤症状,改善心功能,实现对大鼠的保护,具体机制尚需进一步研究。
本研究中模型组心肌细胞间质和血管旁Masson染色着色深,Masson染色验证心肌纤维化情况,发现在糖尿病心肌组织中,心肌纤维化严重。高糖情况可促进抗氧化酶SOD的糖基化,使机体氧化、抗氧化平衡破坏,清除自由基能力降低,生成有毒性的MDA,引起心肌损伤[11]。心肌损伤导致心肌酶LDH、CK外漏,在心肌组织中含量下降[12]。NO被认为是机体内自由基清除剂,由L-精氨酸通过NOS的作用合成,NOS包括eNOS、iNOS和神经元型一氧化氮合酶(nNOS)3种亚型,iNOS和nNOS催化的NO不利于机体的抗氧化,而eNOS催化的NO使机体抗氧化能力增强。eNOS的降低与iNOS的升高使机体清除自由基能力减弱,机体损伤严重[13]。本研究中糖尿病大鼠心肌组织中有毒的MDA含量升高,而抗氧化酶SOD活性,清除自由基的NO、NOS含量,心肌酶LDH、CK含量,eNOS蛋白表达均降低,iNOS蛋白表达升高,表明糖尿病条件下,机体氧化与抗氧化失衡,引起心肌细胞损伤,损伤的心肌细胞心肌酶外漏。
高良姜素可通过抑制MAPK和NF-κB信号通路抑制RANKL诱导的破骨细胞生成[14],提示高良姜素可能参与IRAK-1/MAPK/NF-κB信号通路的表达过程。本研究中模型组心肌组织中IRAK-1、p38 MAPK、NF-κB p65蛋白水平升高。IRAK-1作为炎症信号通路关键信号调节分子,可诱导炎症因子白细胞介素-1、肿瘤坏死因子-α等的分泌,广泛参与炎症反应和免疫应答过程[15-16];此外,IRAK-1是TLRs与胞质内TRAF6之间的衔接分子,TLR/IL-1受体活化可使IRAK-1与TRAF6结合引起NF-κB激活,促进炎症发生[17]。IRAK-1蛋白激活在糖尿病肾病中发挥重要作用,在高糖诱导的肾小球上皮细胞损伤中沉默IRAK-1后能够明显抑制MAPK水平,进而抑制炎症和纤维化因子表达[18]。而MAPK活化后可促进NF-κB与NF-κB抑制蛋白解离,进而调节相关炎症细胞因子表达[19]。NF-κB静息状态下与抑制性蛋白IκB结合处于无活性状态,当受到信号刺激时,与IκB解离,NF-κB呈解离状态,从而发挥作用,使促纤维细胞发生增生并诱导分化,可促进炎症因子活化等,糖尿病心肌病中NF-κB表达量明显升高[20-21]。提示糖尿病大鼠心肌组织中IRAK-1激活MAPK水平,促进NF-κB活化,促进炎症、氧化应激过程,导致机体炎症损伤明显。进一步添加高良姜素后,糖尿病大鼠心肌组织中IRAK-1、MAPK、NF-κB均处于抑制状态,心肌损伤状态得到明显改善,心肌酶外漏现象得到缓解,氧化和抗氧化能力趋于平衡,提示高良姜素可以缓解心肌细胞损伤,实现对疾病的缓解。然而,高良姜素对心肌细胞损伤的影响是直接作用还是通过降血糖间接作用尚不清楚,还需进一步研究。此外,在高良姜素基础上升高IRAK-1表达后,高良姜素的作用效果明显减弱,提示高良姜素抑制IRAK-1实现对糖尿病大鼠心肌损伤的缓解。
综上所述,高良姜素抑制IRAK-1/MAPK/NF-κB信号通路实现对糖尿病大鼠心肌损伤的缓解,为高良姜素治疗糖尿病心肌病提供一定参考依据。但IRAK-1下游因子不仅有MAPK,亦可能是通过别的因子发挥作用,进一步研究的重点。
| [1] |
LI J M, CHEN F F, LI G H, et al. Soluble Klotho-integrin β1/ERK1/2 pathway ameliorates myocardial fibrosis in diabetic cardiomyopathy[J]. The FASEB Journal, 2021, 35(11): e21960. |
| [2] |
林好, 冯娇, 黄庆谱, 等. 高良姜素对DNA氧化损伤的保护作用及其机制研究[J]. 中国食品添加剂, 2021, 32(5): 1-7. LIN H, FENG J, HUANG Q P, et al. Study on the protective effect of galangin on DNA oxidative damage and its mechanism[J]. China Food Additives, 2021, 32(5): 1-7. |
| [3] |
ABUKHALIL M H, ALTHUNIBAT O Y, ALADAILEH S H, et al. Galangin attenuates diabetic cardiomyopathy through modulating oxidative stress, inflammation and apoptosis in rats[J]. Biomedicine & Pharmacotherapy, 2021, 138: 111410. |
| [4] |
ERUSAPPAN T, PARAMASIVAM S, EKAMBARAM S P. Identification of galangin as the bioactive compound from Alpinia calcarata (Haw.) Roscoe rhizomes to inhibit IRAK-1/MAPK/NF-κB p65 and JAK-1 signaling in LPS stimulated RAW 264.7 cells[J]. Journal of Ethnopharmacology, 2022, 288: 114975. DOI:10.1016/j.jep.2022.114975 |
| [5] |
隋艳波, 孙艺, 王瑞楠, 等. 洋参御糖丸对糖尿病大鼠心肌微血管病变的干预作用[J]. 吉林中医药, 2020, 40(2): 222-226. SUI Y B, SUN Y, WANG R N, et al. Effects of Yangshen Yutang Pill on myocardial microvascular disease in diabetic rats[J]. Jilin Journal of Chinese Medicine, 2020, 40(2): 222-226. DOI:10.13463/j.cnki.jlzyy.2020.02.025 |
| [6] |
王沈峰, 王秋野, 戚凤. miR-377-5p靶向IRAK1通过抑制JNK信号通路改善脑缺血再灌注大鼠神经损伤和炎性反应[J]. 医学分子生物学杂志, 2021, 18(2): 83-89. WANG S F, WANG Q Y, QI F. miR-377-5 p ameliorates nerve injury and inflammatory response in rats with cerebral ischemiareperfusion by targeting IRAK1 through inhibiting JNK signaling pathway[J]. Journal of Medical Molecular Biology, 2021, 18(2): 83-89. DOI:10.3870/j.issn.1672-8009.2021.02.002 |
| [7] |
于晓原, 王艳丽, 孙烨, 等. 参芪血府逐瘀汤对糖尿病心肌病的临床作用及机制[J]. 心脏杂志, 2021, 33(6): 619-623. YU X Y, WANG Y L, SUN Y, et al. Clinical effect and mechanism of Shenqi Xuefu Zhuyu Decoction in treatment of diabetic cardiomyopathy[J]. Chinese Heart Journal, 2021, 33(6): 619-623. |
| [8] |
覃文慧, 吴悠, 郝二伟, 等. 基于数据挖掘防治糖尿病慢性并发症中药专利复方概况和用药规律分析[J]. 国际中医中药杂志, 2022, 44(2): 195-200. QIN W H, WU Y, HAO E W, et al. Analysis of the patent of traditional Chinese medicine compound and medication rules for the prevention and treatment of diabetes chronic complications based on data mining technology[J]. International Journal of Traditional Chinese Medicine, 2022, 44(2): 195-200. DOI:10.3760/cma.j.cn115398-20200531-00296 |
| [9] |
李咪, 谭银丰. 高良姜提取物对2型糖尿病小鼠的降糖作用[J]. 海南医学, 2016, 27(6): 864-867. LI M, TAN Y F. Hypoglycemic effects of the extracts of alpinia officinarum hance on type 2 diabetic model mice[J]. Hainan Medical Journal, 2016, 27(6): 864-867. DOI:10.3969/j.issn.1003-6350.2016.06.002 |
| [10] |
张旭光, 尹航, 陈峰, 等. 高良姜素药理活性的研究进展[J]. 中国现代中药, 2016, 18(11): 1532-1536. ZHANG X G, YIN H, CHEN F, et al. Advances in study of pharmacological activities of galangin[J]. Modern Chinese Medicine, 2016, 18(11): 1532-1536. |
| [11] |
LIU J J, ZHAO G X, HE L L, et al. Lycium barbarum polysaccharides inhibit ischemia/reperfusion-induced myocardial injury via the Nrf2 antioxidant pathway[J]. Toxicology Reports, 2021, 8: 657-667. DOI:10.1016/j.toxrep.2021.03.019 |
| [12] |
ZHOU F T, MA K. Fasudil protects against isoproterenol-induced myocardial infarction in mice via inhibiting Rho/ROCK signaling pathway[J]. European Review for Medical and Pharmacological Sciences, 2020, 24(10): 5659-5667. |
| [13] |
ZHANG J, CHEN C, LI F P, et al. Different changing patterns of three NOS-NO system activities after ischemia-reperfusion in rabbit with AMI[J]. Cell Biochemistry and Biophysics, 2021, 79(4): 857-862. |
| [14] |
LI X C, JIANG J W, YANG Z F, et al. Galangin suppresses RANKLinduced osteoclastogenesis via inhibiting MAPK and NF-κB signalling pathways[J]. Journal of Cellular and Molecular Medicine, 2021, 25(11): 4988-5000. |
| [15] |
YANG G, ZHAO Y. Overexpression of miR-146b-5p ameliorates neonatal hypoxic ischemic encephalopathy by inhibiting IRAK1/TRAF6/TAK1/NF-αB signaling[J]. Yonsei Medical Journal, 2020, 61(8): 660-669. |
| [16] |
ZHANG M L, CHEN H, YANG Z, et al. 17β-estradiol attenuates LPS-induced macrophage inflammation in vitro and sepsis-induced vascular inflammation in vivo by upregulating miR-29a-5p expression[J]. Mediators of Inflammation, 2021, 2021: 9921897. |
| [17] |
梁运特, 廖志远, 赖斯华, 等. 安肠汤对正虚邪恋型溃疡性结肠炎大鼠miRNA-146a/IRAK-1/NF-κB信号通路的影响[J]. 现代中西医结合杂志, 2021, 30(16): 1717-1722, 1749. LIANG Y T, LIAO Z Y, LAI S H, et al. Effect of Anchang Decoction on miRNA-146a/IRAK-1/NF-κB signaling pathway in rats with ulcerative colitis of body resistance weakened while pathogenic factors protracted[J]. Modern Journal of Integrated Traditional Chinese and Western Medicine, 2021, 30(16): 1717-1722, 1749. |
| [18] |
高兰, 刘海蔚, 纪群. 厄贝沙坦通过抑制IRAK1介导p38MAPK信号通路对高糖诱导的肾小管上皮细胞增殖和凋亡的影响[J]. 中国老年学杂志, 2021, 41(6): 1289-1293. GAO L, LIU H W, JI Q. Effects of irbesartan on proliferation and apoptosis of renal tubular epithelial cells induced by high glucose by inhibiting IRAK1-mediated p38MAPK signaling pathway[J]. Chinese Journal of Gerontology, 2021, 41(6): 1289-1293. |
| [19] |
YUAN J W, ZHANG J H, CAO J, et al. Geniposide alleviates traumatic brain injury in rats via anti-inflammatory effect and MAPK/NF-κB inhibition[J]. Cellular and Molecular Neurobiology, 2020, 40(4): 511-520. |
| [20] |
YOUSSEF M E, ABDELRAZEK H M, MOUSTAFA Y M. Cardioprotective role of GTS-21 by attenuating the TLR4/NF-κB pathway in streptozotocin-induced diabetic cardiomyopathy in rats[J]. Naunyn-Schmiedeberg's Archives of Pharmacology, 2021, 394(1): 11-31. |
| [21] |
SHI H, ZHOU P, NI Y Q, et al. In vivo and in vitro studies of Danzhi Jiangtang Capsule against diabetic cardiomyopathy via TLR4/MyD88/NF-κB signaling pathway[J]. Saudi Pharmaceutical Journal, 2021, 29(12): 1432-1440. |
2. Department of Nutrition, The 7th People's Hospital of Zhengzhou, Zhengzhou 450016, China
 2022, Vol. 39
2022, Vol. 39