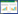文章信息
- 王靖阳, 韩立峰, 张晨, 赵亚楠, 徐强
- WANG Jingyang, HAN Lifeng, ZHANG Chen, ZHAO Yanan, XU Qiang
- 基于代谢组学分析注射用丹参多酚酸治疗缺血性脑卒中作用机制
- Investigation on the mechanism of salvianolic acid for injection in the treatment of ischemic stroke based on metabolomics
- 天津中医药, 2022, 39(12): 1502-1512
- Tianjin Journal of Traditional Chinese Medicine, 2022, 39(12): 1502-1512
- http://dx.doi.org/10.11656/j.issn.1672-1519.2022.12.02
-
文章历史
- 收稿日期: 2022-08-24
2. 天津中医药大学, 天津 301617;
3. 天津中医药大学第二附属医院心血管内科, 天津 300150
脑卒中(亦称中风)是最常见的脑血管疾病,是造成全球范围内死亡和残疾的第3大原因,缺血性卒中在新发卒中的比例可达60%以上,位居脑卒中数量之首[1-3],其病因主要是由脑部血液循环障碍,脑血流与氧气供给受限[4-5]。目前溶栓是缺血性卒中最常见的治疗方式,但其局限性主要是时间窗狭窄及禁忌症较多,并且对前循环卒中效果并不理想[6-7]。因此,采取局限性更少、受用群体更广,且有益于中风后期恢复的治疗方法来预防及治疗缺血性卒中已迫在眉睫。
丹参作为一种多年生草本植物,广泛分布于全国各地。丹参的根和根茎具有活血祛瘀、通经止痛、清心除烦、凉血消痈的功效[8]。注射用丹参多酚酸是国家食品药品监督管理局批准的中药注射剂(国药准字Z20110011),主要是丹参中的水溶性有效成分,因其具有良好的抗血栓、抗脑缺氧、缩小脑缺血及脑血栓所致梗塞面积,改善行为障碍、减轻水肿的作用,目前已被广泛应用于缺血性脑卒中的治疗[9]。虽然丹参药效研究较多,但目前关于注射用丹参多酚酸对代谢网络调控研究较少。
代谢组学是由Nicholson教授提出,主要定量研究生命体在病理、生理刺激下的小分子代谢物的动态变化,目前已被广泛应用于生命科学的各个研究领域[10-11]。有研究在动物模型上证实了中药及其提取物对缺血性卒中的治疗的作用机制及保护作用,为临床提供了可靠依据及实验基础[12-15]。在临床中,缺血性脑卒中患者的生理病理具有特异性改变,特别是其血液样本,会呈现出与本身中风前或与正常人具有明显差异及特定的指标改变,但指标的改变与药物使用与否之间的关系机制仍不明确。因此相应临床试验[16-21]从缺血性卒中的急性期与恢复期不同的角度,从人体生理病理改变的不同角度阐述其疾病发展原理,表明了药物的作用机制,证实了作用靶点的临床效应,并为疾病的预后及预防提供了方向。因此本研究通过代谢组学技术分析缺血性脑卒中恢复期患者使用注射用丹参多酚酸治疗前后体内血浆代谢的变化,从代谢水平探讨其治疗的作用机制,为临床的精准应用提供一定参考依据。
1 材料和方法 1.1 病例来源本研究经天津中医药大学第二附属医院伦理委员会批准,伦理号:2019-034-01,并获得所有受试者的书面知情同意。2020年10月—2021年7月从天津中医药大学第二附属医院、天津市北辰区中医院总计招募患者39人,其中男性32例,占比82.05%,女性7例,占比17.95%;年龄(62.33±8.11)岁;体重指数(24.57±3.53)kg/m2;合并高血压16例,占比41.03%,合并高脂血症2例,占比5.13%。
1.2 诊断标准与疾病分期标准西医诊断采用2018年中华医学会制定的《中国急性缺血性脑卒中诊治指南》[22],中医中风病的辨证及诊断参考周仲瑛主编的《中医内科学》[23]《中医临床诊疗指南释义》[24]及《中国脑梗死中西医结合诊疗指南(2017)》[25];疾病分期参照2018年《中国急性缺血性脑卒中诊治指南》[22]与《中国脑梗死中西医结合诊疗指南(2017)》[25],急性期:发病两周内;恢复期:轻型1周后,危重型2周~6个月。
1.3 纳入与排除标准 1.3.1 纳入标准1)缺血性脑卒中(恢复期:发病7 d~3个月,不包含7 d,包含3个月)者。2)美国国立卫生研究院卒中量表(简称NIHSS评分量表)评分在4~20分(包含边界值)。3)年龄18岁以上(包括18岁),无性别要求。4)首次发病或有发病史,但无肢体瘫痪等后遗症,不影响本研究评分,改良Rankin量表(简称mRS)评分≤1分。5)符合缺血性脑卒中诊断,经头颅CT或头颅MRI确诊为脑梗塞,且发病在要求以内的患者。
1.3.2 排除标准1)头颅影像学检查证实有脑肿瘤、脑炎、脑脓肿等导致相似症状的疾病,或证实有出血性脑梗死,硬膜外血肿,颅内血肿,脑室出血,蛛网膜下腔出血等。2)对研究中使用的药物成分过敏者。3)有消化道溃疡、出血病史者。4)有严重的内脏疾病者、血液疾病者、内分泌系统等严重原发性疾病者。5)妊娠期、哺乳期妇女。6)药物或酒精滥用者。7)精神疾病患者。8)短暂性脑缺血发作患者。9)1个月内参加过其他临床试验者。10)研究者认为不宜入选者。
1.4 研究方法 1.4.1 临床资料收集及方法步骤收集、记录相应入组患者的基本信息,完成NIHSS评分量表及Barthel指数评定表(以下简称BI指数),并在符合入组标准后连续静脉输液给药(14±2)d,分别于入组前、出组时,采集符合入组标准的患者血浆,进行后续代谢组学检测分析。
1.4.2 血浆样本采集及保存受试者在禁食过夜后,于空腹状态下抽取化验标本,使用肝素钠抗凝管采集5 mL静脉血,并于30 min内进行血浆分离,4 ℃下离心,离心半径8 cm,3 000 r/min离心10 min,取上层,分装至1.5 mL离心管中,封口膜密封后,按相应标准进行编号,进行书面记录。将样本于-80 ℃冰箱冻存。
1.5 血浆代谢组学分析 1.5.1 实验仪器超高效液相色谱质谱联用仪UHPLC/HESI-Q-Orbitrap MS(Thermo Fisher Scientific,USA);Mettler Toledo AL204型天平(Mettler Toledo仪器上海有限公司,中国);DW-86L628型-80 ℃立式超低温保存箱(海尔公司,中国);Eppendrof冷冻离心机5424R(艾本德股份有限公司,德国);XW-80A涡旋混合仪(上海沪西分析仪器厂,中国)。
1.5.2 实验试剂色谱纯乙腈、甲醇(Thermo Fisher Scientific,美国);超纯水(北京屈臣氏蒸馏水有限公司,中国);甲酸(ACS,Wilmington,美国);乙酸铵(Sigma-Aldrich公司,美国)。
1.5.3 血浆质谱代谢组学样品的制备每个样品分别吸取100 μL血浆,加入400 μL冰乙腈沉淀蛋白,离心半径10 cm,14 000 r/min离心10 min,吸取上清液,氮气吹干,100 μL 80%的甲醇(v/v)复溶,待测。QC样本:从每个样本中取10 μL,轻微震荡混匀,加4倍体积的乙腈,同法处理。空白样本:直接在进样小瓶中加入80%甲醇。
1.5.4 代谢组学色谱条件采用U3000超高效液相系统配备一个ACQUITY UPLC HSS T3色谱柱(2.1 mm×100 mm,1.8 μm),流动相0.1%甲酸水溶液(A)-乙腈(D)。梯度洗脱:0~7 min,3%~100%D;7~9 min,100%D;9~9.1 min,100%~3%D;9.1~10 min,3%D。流速0.4 mL/min,进样量2 μL,柱温35 ℃。
1.5.5 代谢组学质谱条件质谱分析在Thermo Fisher Q-Orbitrap MS(Q-Exative)系统下完成,离子源为高能电喷雾离子源(HESI源),扫描模式为Full-ms/dd-ms2,正负离子模式下同时采集,源参数:源喷雾电压(SV)正离子为3.5 kV,负离子为2.8 kV,毛细管温度320 ℃,离子源加热温度350 ℃,鞘气(N2)为35,辅助气(N2)为10,S-lens水平为50 V,归一化碰撞能量为20/40/60 V,扫描范围为m/z 100~1 500 Da,分辨率为70 000。
1.5.6 代谢组学数据处理原始数据进行预处理后导入SIMCA 14.1软件中进行无监督的主成分分析(PCA),Scaling(标度化)方式为等方差法(UV),随后对数据采用有监督的正交偏最小二乘法判别分析(OPLS-DA)对样品进行分析。结合t检验,筛选具有统计学意义(P < 0.05)和VIP值大于1.0的变量作为潜在生物标志物。将获得的生物标志物导入MetaboAnalyst 5.0在线分析软件的Pathway Analyst模块,进行代谢路径分析。
2 结果 2.1 临床资料的统计分析本研究共纳入符合入选标准的患者39例。经丹参多酚酸治疗2周后,患者的NIHSS评分、BI指数差异均有统计学意义(P < 0.01)。见表 1。

|
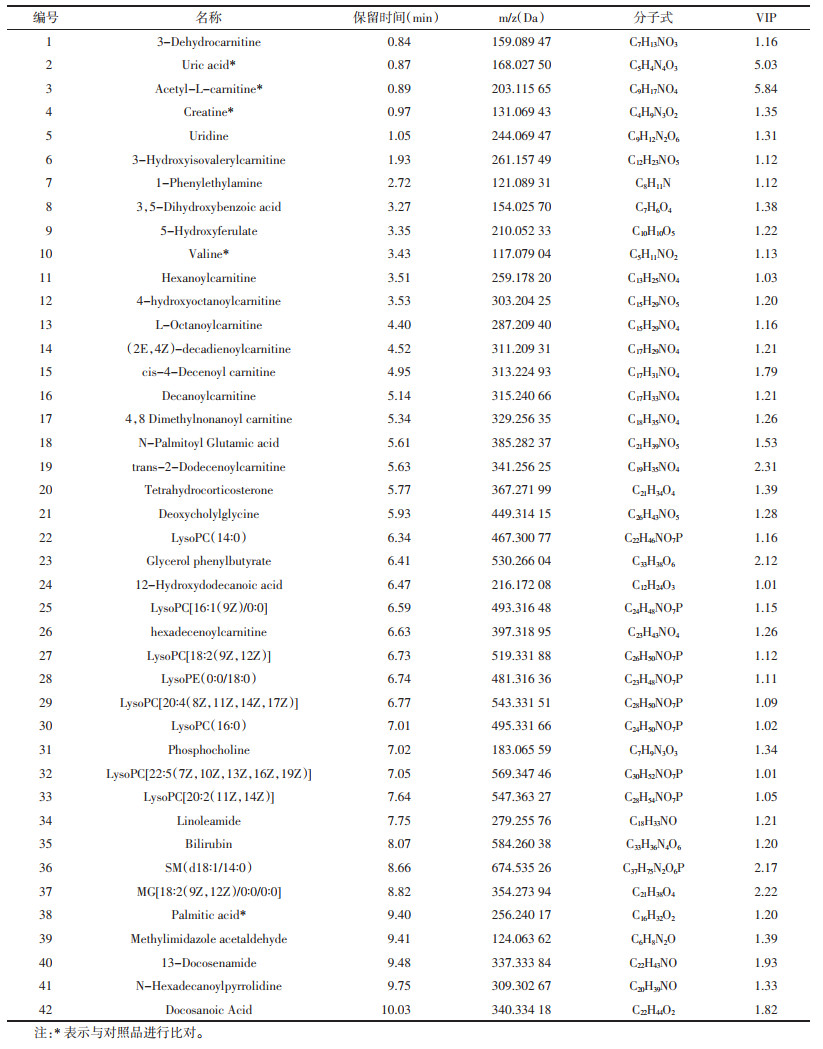
使用丹参多酚酸2周后,将患者血浆进行主成分分析后,PCA分析结果如图 1所示。患者给药前后各组间分离趋势明显,组内分布集中,表明给药前、给药后样本存在明显的差异。
|
| 图 1 主成分分析结果(PCA) Fig. 1 Principal component analysis (PCA) |
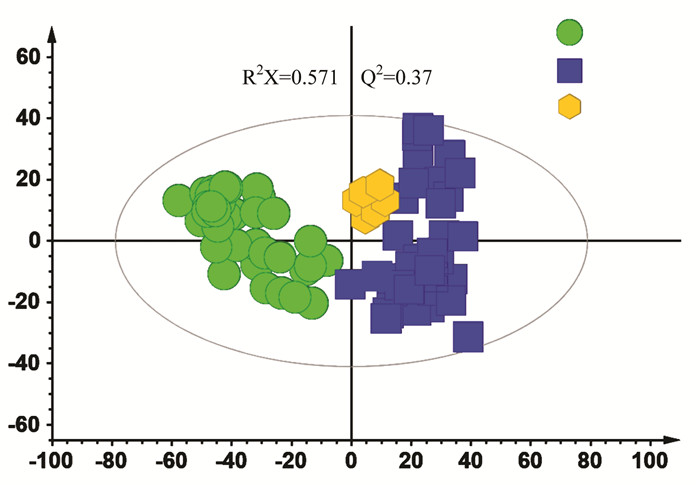
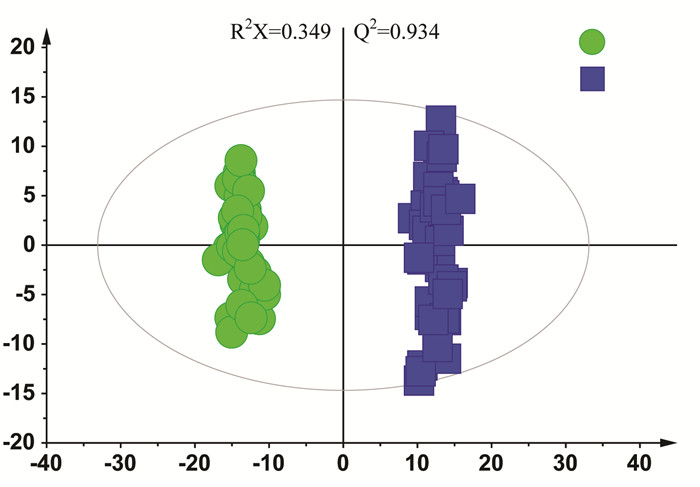
为了进一步筛选给药前后样品间的差异,采用有监督模式的识别方法OPLS-DA对样本进行进一步的分析,发现给药前后样本如图 2所示。给药前与给药后进一步分离。
|
| 图 2 有监督的OPLS-DA分析结果 Fig. 2 Results of supervised OPLS-DA analysis |
为了检验OPLS-DA有无过拟合,进行随机分组200次的置换检验OPLS-DA模型,结果见图 3,表明所建立的OPLS-DA模型无过拟合现象,能够准确描述数据。
|
| 图 3 置换验证图 Fig. 3 Permutation verification diagram |
基于OPLS-DA分析的VIP值识别和揭示给药前后各离子含量具有差别的代谢物基础上,进一步做火山图(Volcano Plot)得分图如图 4所示。当同时满足以下2个条件,t检验差异具有统计学意义(P<0.05)和VIP值在1.0以上时,候选代谢产物被认为是潜在的生物标记物。所得生物标记物根据m/z及元素组成数据,结合HMDB线数据库,对这些生物标记物进行初步确认,结果鉴定出42个与治疗相关的生物标记物,分别是:3-脱氢肉碱、尿酸、乙酰左旋肉碱、肌酸、尿嘧啶核苷、3-羟基异戊酰肉碱、1-苯乙胺、3,5-二羟基苯甲酸、5-羟基阿魏酸盐、缬氨酸、己酰肉碱、4-羟基辛酰基肉碱、L-辛酰基肉碱、癸二烯酰肉碱、顺式-4-癸烯酰肉碱、癸酰肉碱、4,8-二甲基壬酰基肉碱、N-棕榈酰谷氨酸、反式-2-十二碳烯酰肉碱、四氢皮质酮、脱氧胆酰甘氨酸、溶血磷脂酰胆碱(14∶0)、甘油苯基丁酸酯、12-羟基十二烷酸、胆红素、亚油酰胺、溶血磷脂酰胆碱(16∶1/0∶0)、溶血磷脂酰胆碱(18∶2)、溶血磷脂酰乙醇胺(0∶0/18∶0)、溶血磷脂酰胆碱(20∶4)、溶血磷脂酰胆碱(16∶0)、溶血磷脂酰胆(22∶5)、磷酸胆碱、十六碳烯酰肉碱、溶血磷脂酰胆碱(20∶2)、鞘磷脂(d18∶1/14∶0)、棕榈酸、甲基咪唑乙醛、单酰基甘油(18∶2/0∶0/0∶0)、13-二十二烯胺、N-十六烷基吡咯烷、二十二烷酸。差异代谢物具体信息见表 2。
|
| 图 4 火山图分析 Fig. 4 Volcanic map analysis |
对所鉴定的生物标记物作热图(heatmap)分析,结果见图 5,反映了各组的生物标记物相对增加(蓝色)或减少(红色)的情况。差异代谢物相关性分析如图 6。
|
| 图 5 差异代谢物热图 Fig. 5 Differential metabolite heat map |
|
| 图 6 差异代谢物相关性分析 Fig. 6 Correlation analysis of differential metabolites |
将获得的潜在生物标记物导入MetaboAnalyst 5.0在线分析软件的Pathway Analyst(通路分析)模块,进行代谢路径富集分析,结果见图 7。42个潜在生物标志物主要涉及到22个代谢通路,分别为:支链脂肪酸的氧化、磷脂生物合成、磷脂酰胆碱生物合成、超长链脂肪酸的β氧化、甘油脂代谢、短链饱和脂肪酸的线粒体β-氧化、胆汁酸生物合成、线粒体中的脂肪酸伸长率、脂肪酸生物合成、卟啉代谢、鞘脂代谢、丙酸酯代谢、组氨酸代谢、脂肪酸代谢、类固醇生成、类固醇生物合成、精氨酸和脯氨酸代谢、甘氨酸和丝氨酸代谢、嘧啶代谢、缬氨酸、亮氨酸和异亮氨酸降解、花生四烯酸代谢、嘌呤代谢。
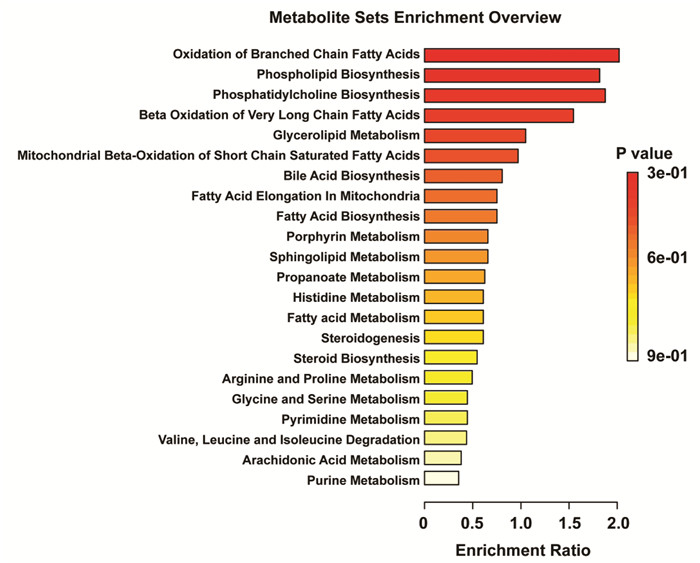
|
| 图 7 通路富集分析 Fig. 7 Pathway enrichment analysis |
使用气泡图进行表示,其中不同的颜色表明了不同代谢途径的重要性。从黄色到红色,重要程度逐渐增加,结果见图 8。可以确定在所有物质代谢途径中起到重要作用的共6种,分别为:磷脂生物合成、磷脂酰胆碱生物合成、卟啉代谢、组氨酸代谢、类固醇生成、嘧啶代谢。
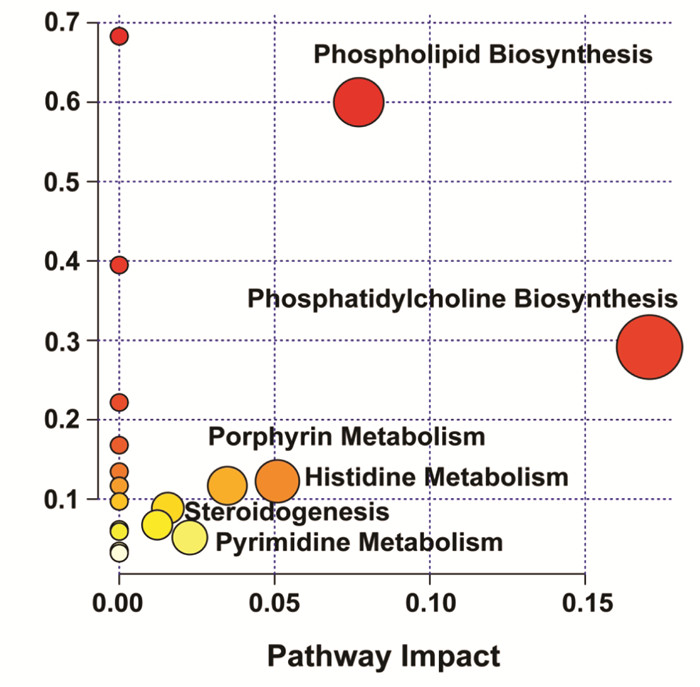
|
| 图 8 通路分析 Fig. 8 Pathway analysis |
中医始终强调整体观念,认为人体是不可分割的,疾病也是需要从整体角度去理解。因此在中医观念的“证候”及“病理产物”可能是在病理因素下,刺激体内基因、蛋白质的调控后,继而影响下游代谢产物发生偏离正常范围的一种情况。因此,代谢组学能够从微观角度阐明中医的相关理念,对疾病的发生机制、治疗效果提供更加客观的展现。
本实验中共鉴定出42个与治疗相关的生物标记物中,其中有31种在用药后呈相对增加,分别是尿酸、乙酰左旋肉碱、3-羟基异戊酰肉碱、3,5-二羟基苯甲酸、缬氨酸、己酰肉碱、4-羟基辛酰基肉碱、L-辛酰基肉碱、癸二烯酰肉碱、顺式-4-癸烯酰肉碱、癸酰肉碱、4,8-二甲基壬酰基肉碱、N-棕榈酰谷氨酸、反式-2-十二碳烯酰肉碱、四氢皮质酮、脱氧胆酰甘氨酸、溶血磷脂酰胆碱(14∶0)、甘油苯基丁酸酯、12-羟基十二烷酸、亚油酰胺、溶血磷脂酰胆碱(16∶1/0∶0)、溶血磷脂酰胆碱(18∶2)、溶血磷脂酰乙醇胺(0∶0/18∶0)、溶血磷脂酰胆碱(20∶4)、溶血磷脂酰胆碱(16∶0)、溶血磷脂酰胆(22∶5)、磷酸胆碱、十六碳烯酰肉碱、溶血磷脂酰胆碱(20∶2)、鞘磷脂(d18∶1/14∶0)、N-十六烷基吡咯烷;有11种在用药后相对减少,分别是3-脱氢肉碱、肌酸、尿嘧啶核苷、1-苯乙胺、5-羟基阿魏酸盐、胆红素、单酰基甘油(18∶2/0∶0/0∶0)、棕榈酸、甲基咪唑乙醛、13-二十二烯胺、二十二烷酸。基于42种生物标记物及代谢通路,本文将以磷脂与磷脂酰胆碱生物合成、卟啉代谢、组氨酸代谢、类固醇生成以及嘧啶代谢为重点进行讨论。
磷脂主要分为甘油磷脂与鞘磷脂,是哺乳动物细胞膜中含量最多的一种成分[26]。甘油磷脂主要包括磷脂酰胆碱(PC)、磷脂酰乙醇胺(PE)等。溶血磷脂酰胆碱与溶血磷脂酰乙醇胺是由磷脂酶A2水解磷脂酰胆碱及磷脂酰乙醇胺的产物之一,是维持细胞膜正常组成的磷脂成分,并与其上游产物的功能密切相关。PC可通过CDP-胆碱(Kennedy)途径及磷脂酰乙醇胺N-甲基转移酶(PEMT)催化磷脂酰乙醇胺两种途径生成[27]。对肝细胞内极低密度脂蛋白(VLDL)的合成以及分泌转运不可或缺。PEMT通路生成的PC可以限制胆固醇、低密度脂蛋白(LDL)的生成或分泌速率,保证高密度脂蛋白(HDL)的正常代谢[28-30]。PE又称脑磷脂,以脑和神经组织中含量较高,且相对浓度会因细胞器而异[31]。由于磷脂酰丝氨酸脱羧酶的存在,使线粒体内膜比其他细胞器存在更多的PE[32],因此,PE参与线粒体的生理功能,影响能量产生。继而在脑组织缺氧、缺血时,通过反馈调节增加脂肪酸的降解,维持能量的供应[33]。在脑组织缺氧的区域中,氧化应激会引起线粒体功能障碍并可能损害线粒体自身,导致脂质代谢发生变化[34],进一步加重缺血区域病变。因此在使用注射用丹参多酚酸后,PC、PE代谢较用药前发生改变,表明溶血磷脂酰胆碱与溶血磷脂酰乙醇胺含量的变化,可能与改善能量供应及调节血脂相关。
鞘磷脂是由鞘氨醇、脂肪酸、磷酸及胆碱组成,由鞘磷脂合酶1和鞘磷脂合酶2在高尔基体和质膜上催化形成。鞘磷脂是神经细胞髓鞘的主要成分,在脑和神经组织中含量比其它组织更丰富,参与关键的神经系统过程,可以调节神经细胞对外界的反应及生理和病理过程。鞘磷脂的代谢失调作为脑损伤的主要原因,会影响髓鞘的稳定性,参与炎症反应,促进动脉粥样硬化形成[35-36]。鞘磷脂在鞘磷脂酶作用下,会水解生成神经酰胺和磷酰胆碱,神经酰胺与细胞死亡及衰老相关,可以通过抑制线粒体诱导神经元凋亡[37]。本实验使用注射用丹参多酚酸后多种溶血磷脂酰胆碱、溶血磷脂酰乙醇胺(0∶0/18∶0)、鞘磷脂(d18∶1/14∶0)的代谢均发生改变,表明注射用丹参多酚酸可以影响磷脂的生物合成,可以改善缺血病灶情况及预防的双重作用。
卟啉因其分子结构的特异性,存在多种种类,并且不同的修饰对卟啉的物理性质均会产生影响。卟啉对人体损伤的主要机制是诱导的氧化应激反应,但在内脏器官中卟啉通过改变蛋白质核变形与聚集状态,扩张内质网进而导致内质网损伤,通过抑制蛋白质降解机制导致来蛋白质周转失常、细胞生长停滞,最终加剧了卟啉的蛋白毒性,破坏蛋白质稳态[38]。造成卟啉积累,引起卟啉症,使全身多器官病变。在卟啉症中,δ-氨基乙酰丙酸、胆色素原的增加会导致神经内脏症状,同时进入神经细胞诱导卟啉积累,导致蛋白质集聚[39]。
组氨酸在人体内代谢有脱羧与解氨两种途径[40],组氨酸脱羧酶作用下转化为组织胺(亦称组胺),具有扩张血管、降低血压、促进血管平滑肌及胃液分泌,同时脑组胺也是大脑中一种神经递质,具有强效兴奋性,可参与调节多种神经系统功能,包括睡眠觉醒周期、应激反应、记忆力[41-42]。有研究表明[43],组胺能神经系统的功能障碍与各种神经疾病有关,增加脑组胺的水平含量可能有助于脑部疾病的治疗改善。解氨途径则是在组氨酸解氨酶作用下生成多种中间产物,最终可转化为N5,N10-甲基四氢叶酸、谷氨酸和氨。N5,N10-甲基四氢叶酸参与核酸的合成以及参与能量代谢和信号传导[44]。谷氨酸和氨参与并影响体内氨的动态代谢平衡及脑组织能量代谢。
胆固醇因环核结构,无法在体内彻底分解,因此会代谢转化成多种化合物。胆固醇在细胞色素P450酶和羟基类固醇脱氢酶[45]的作用下以及部分转运蛋白及脂质结合蛋白的摄取及转运协作下,将胆固醇运输至线粒体内[46]。在上述酶的共同作用下,胆固醇转化为类固醇。由于类固醇结构特点及可在不同器官合成,所以其种类繁多,肾上腺合成糖皮质激素和盐皮质激素,性腺可合成孕激素、雄激素及雌激素[47]。脑组织可自主合成的具有生物活性的神经类固醇,参与调节各种神经生理和行为过程,同时神经类固醇的产生受到神经递质和神经肽的精细调节[48]。有研究表明[49-50],雌性动物的神经元对多巴胺的毒性作用具有更高的耐受性,并且在脑组织梗塞后面积明显比雄性动物更小、恢复时间更短。雌激素对脑组织的保护作用可能与增加神经元一氧化氮合酶的表达有关,同时在血管内皮细胞中释放一氧化氮,使得促进血管舒张成为可能。并且雌激素还可以促进前列环素的产生,增加血管的舒张[51-52]。动脉粥样硬化作为缺血性卒中的最常见病因,其本质是脂类的代谢异常。低密度脂蛋白是血浆脂蛋白的一种,由脂肪和胆固醇组成,其胆固醇含量较多,因此低密度脂蛋白的增加及结构不稳定,会导致血液中胆固醇累计、增加血液黏度,在血管壁沉着形成斑块,最终形成血小板血栓,造成不可逆的损伤。胆固醇作为斑块的根本原因,改善其代谢有益于对疾病治疗。胆酸是胆固醇的一种衍生物,且种类繁多。在体内大部分胆汁酸会形成胆盐,具有促进脂肪乳化和吸收,加速脂肪消化分解,也是体内胆固醇的最重要排泄途径。胆汁酸的生成量增加,有利于降低胆固醇含量。胆固醇生成减少,使更多的乙酰辅酶A可以进入三羧酸循环,增加三磷酸腺苷(ATP)生成,进一步恢复梗死组织的能量供应。在本实验中,胆固醇作为类固醇前体物质,后者生成途径的改变反应了胆固醇代谢途径的调整,表明注射液丹参多酚酸可通过调节类固醇与胆固醇代谢达到治疗卒中的目的,同时因激素的改变也可以起到保护及预防作用。
嘧啶作为组成核苷的碱基成分之一,与戊糖、磷酸共同组成了核酸,因此嘧啶碱参与并且影响着机体的所有生理活动。在细胞质中谷氨酰胺与二氧化碳在氨基甲酰磷酸合成酶的作用下合成的氨基甲酰磷酸,继而与天冬氨酸发生结合,经过一系列反应最终可生成尿嘧啶核苷酸[53]。在人体核酸中最常见的嘧啶有胞嘧啶、尿嘧啶、胸腺嘧啶3种。其在体内最终可分解为氨、二氧化碳与水,胞嘧啶可转化为尿嘧啶参与代谢反应,并且3种嘧啶在酶的作用下生成的代谢中间产物可进入三羧酸循环,进行彻底氧化。其分解的氨与二氧化碳会生成尿素,以尿液排出体外。由样本的代谢差异物可知,在使用注射液丹参多酚酸后,尿苷代谢增加,表明嘧啶分解增加,随尿液排出的氨也随之增加,可以减轻脑组织的氨含量,改善脑部能量供应,减轻脑梗死症状,达到治疗的目的。
综上所述,本研究通过代谢组学技术探究表明了注射液丹参多酚酸可以通过改变组氨酸代谢、磷脂代谢、核酸代谢及能量代谢通路产生相应效应,证实了丹参多酚酸的临床疗效。然而,由于本实验样本量较少,只能作为初步探索。希望以后有样本量更大多组学共同分析的高质量临床试验,继续深入研究,为缺血性脑卒中的早期诊断及诊治提供可靠的临床依据。
4 结论本研究使用代谢组学技术检测到42种差异代谢物与22条代谢通路改变,表明注射用丹参多酚酸的作用机制与调节磷脂代谢、氨基酸代谢、核酸代谢及能量代谢相关。通过代谢组学可以更加全面的分析中药在疾病治疗中的机制,对临床疾病的诊断及治疗可提供客观的理论依据,反映代谢组学与中医相互印证的可行性及广阔的发展前景。
| [1] |
GBD 2017 DALYs and HALE Collaborators. Global, regional, and national disability-adjusted life-years (DALYs) for 359 diseases and injuries and healthy life expectancy (HALE) for 195 countries and territories, 1990-2017:a systematic analysis for the Global Burden of Disease Study 2017[J]. Lancet, 2018, 392(10159): 1859-1922. DOI:10.1016/S0140-6736(18)32335-3 |
| [2] |
FEIGIN V L, NORRVING B, MENSAH G A. Global burden of stroke[J]. Circulation Research, 2017, 120(3): 439-448. DOI:10.1161/CIRCRESAHA.116.308413 |
| [3] |
GBD STROKE COLLABORATORS. Global, regional, and national burden of stroke and its risk factors, 1990-2019:a systematic analysis for the global burden of disease study 2019[J]. The Lancet Neurology, 2021, 20(10): 795-820. DOI:10.1016/S1474-4422(21)00252-0 |
| [4] |
王陇德, 刘建民, 杨弋, 等. 我国脑卒中防治仍面临巨大挑战: 《中国脑卒中防治报告2018》概要[J]. 中国循环杂志, 2019, 34(2): 105-119. WANG L D, LIU J M, YANG Y, et al. The prevention and treatment of stroke still face huge challenges—brief report on stroke prevention and treatment in China, 2018[J]. Chinese Circulation Journal, 2019, 34(2): 105-119. DOI:10.3969/j.issn.1000-3614.2019.02.001 |
| [5] |
王拥军, 王春雪, 缪中荣. 中国缺血性脑卒中和短暂性脑缺血发作二级预防指南2014[J]. 中华神经科杂志, 2015, 48(4): 258-273. WANG Y J, WANG C X, MIAO Z R. Chinese guidelines for secondary prevention of ischemic stroke and transient ischemic attack 2014[J]. Chinese Journal of Neurology, 2015, 48(4): 258-273. DOI:10.3760/cma.j.issn.1006-7876.2015.04.003 |
| [6] |
EMBERSON J, LEES K R, LYDEN P, et al. Effect of treatment delay, age, and stroke severity on the effects of intravenous thrombolysis with alteplase for acute ischaemic stroke: a meta-analysis of individual patient data from randomised trials[J]. Lancet (London, England), 2014, 384(9958): 1929-1935. DOI:10.1016/S0140-6736(14)60584-5 |
| [7] |
JAUCH E C, SAVER J L, ADAMS H P, et al. Guidelines for the early management of patients with acute ischemic stroke: a guideline for healthcare professionals from the American heart association/American stroke association[J]. Stroke, 2013, 44(3): 870-947. DOI:10.1161/STR.0b013e318284056a |
| [8] |
国家药典委员会. 中华人民共和国药典(2020年版): 一部[S]. 北京: 中国医药科技出版社, 2020, 77. National Pharmacopoeia Committee. Pharmacopoeia of the people's republic of China (2020 edition): Part 1[S]. Beijing: China Medical Science Press, 2020, 77. |
| [9] |
李德坤, 苏志刚, 万梅绪, 等. 注射用丹参多酚酸药理作用及临床应用研究进展[J]. 药物评价研究, 2019, 42(2): 353-361. LI D K, SU Z G, WAN M X, et al. Research progress on pharmacological effects and clinical application of salvianolic acids for injection[J]. Drug Evaluation Research, 2019, 42(2): 353-361. |
| [10] |
WISHART D S, CHENG L L, COPIÉ V, et al. NMR and metabolomics-a roadmap for the future[J]. Metabolites, 2022, 12(8): 678. DOI:10.3390/metabo12080678 |
| [11] |
TOLSTIKOV V, AKMAEV V R, SARANGARAJAN R, et al. Clinical metabolomics: a pivotal tool for companion diagnostic development and precision medicine[J]. Expert Review of Molecular Diagnostics, 2017, 17(5): 411-413. DOI:10.1080/14737159.2017.1308827 |
| [12] |
WU L L, CHEN C, LI Y B, et al. UPLC-Q-TOF/MS-based serum metabolomics reveals the anti-ischemic stroke mechanism of nuciferine in MCAO rats[J]. ACS Omega, 2020, 5(51): 33433-33444. DOI:10.1021/acsomega.0c05388 |
| [13] |
ZHU B J, CAO H T, SUN L M, et al. Metabolomics-based mechanisms exploration of Huanglian Jiedu Decoction on cerebral ischemia via UPLC-Q-TOF/MS analysis on rat serum[J]. Journal of Ethnopharmacology, 2018, 216(11): 147-156. |
| [14] |
YANG Y H, LEI L, BAO Y P, et al. An integrated metabolomic screening platform discovers the potential biomarkers of ischemic stroke and reveals the protective effect and mechanism of folic acid[J]. Frontiers in Molecular Biosciences, 2022, 9(1): 783793. |
| [15] |
JIANG T Y, JIAO J K, SHANG J F, et al. The differences of metabolites in different parts of the brain induced by Shuxuetong Injection against cerebral ischemia-reperfusion and its corresponding mechanism[J]. Evidence-Based Complementary and Alternative Medicine: ECAM, 2022, 2022(12): 9465095. |
| [16] |
DROZD A, SZCZUKO M, BOHATYREWICZ A, et al. High levels of thromboxane(TX) are associated with the sex-dependent non-dipping phenomenon in ischemic stroke patients[J]. Journal of Clinical Medicine, 2022, 11(9): 2652. DOI:10.3390/jcm11092652 |
| [17] |
KE C F, SHI M Y, GUO D X, et al. Metabolomics on vascular events and death after acute ischemic stroke: a prospective matched nested case-control study[J]. Atherosclerosis, 2022, 351(6): 1-8. |
| [18] |
BLADOWSKI M, SZAHIDEWICZ-KRUPSKA E, WINIEWSKI J, et al. Changes in the plasma and platelet nitric oxide biotransformation metabolites during ischemic stroke-a dynamic human LC/MS metabolomic study[J]. Antioxidants (Basel, Switzerland), 2022, 11(5): 955. |
| [19] |
LICARI C, TENORI L, GIUSTI B, et al. Analysis of metabolite and lipid association networks reveals molecular mechanisms associated with 3-month mortality and poor functional outcomes in patients with acute ischemic stroke after thrombolytic treatment with recombinant tissue plasminogen activator[J]. Journal of Proteome Research, 2021, 20(10): 4758-4770. DOI:10.1021/acs.jproteome.1c00406 |
| [20] |
YU F, LI X, FENG X J, et al. Phenylacetylglutamine, a novel biomarker in acute ischemic stroke[J]. Frontiers in Cardiovascular Medicine, 2021, 8(1): 798765. |
| [21] |
ZHOU W J, LI S Z, SUN G J, et al. Early warning of ischemic stroke based on atherosclerosis index combined with serum markers[J]. The Journal of Clinical Endocrinology and Metabolism, 2022, 107(7): 1956-1964. DOI:10.1210/clinem/dgac176 |
| [22] |
彭斌, 吴波. 中国急性缺血性脑卒中诊治指南2018[J]. 中华神经科杂志, 2018, 51(9): 666-682. PENG B, WU B. Chinese guidelines for diagnosis and treatment of acute ischemic stroke 2018[J]. Chinese Journal of Neurology, 2018, 51(9): 666-682. DOI:10.3760/cma.j.issn.1006-7876.2018.09.004 |
| [23] |
周仲瑛. 中医内科学[M]. 第二版. 北京: 中国中医药出社, 2007: 304-315. ZHOU Z Y. Internal Medicine in Chinese Medicine [M]. 2nd Edition. Beijing: China Press of Traditional Chinese Medicine, 2007: 304-315. |
| [24] |
高颖. 中医临床诊疗指南释义-脑病分册[M]. 北京: 中国中医药出版社, 2015: 18-30. GAO Y. Chinese medicine clinical guideline interpretation-encephalopathy booklet[M]. Beijing: China Press of Traditional Chinese Medicine, 2015: 18-30. |
| [25] |
高长玉, 吴成翰, 赵建国, 等. 中国脑梗死中西医结合诊治指南(2017)[J]. 中国中西医结合杂志, 2018, 38(2): 136-144. GAO C Y, WU C H, ZHAO J G, et al. Chinese guidelines for diagnosis and treatment of cerebral infarction with integrated traditional Chinese and western medicine (2017)[J]. Chinese Journal of Integrated Traditional and Western Medicine, 2018, 38(2): 136-144. |
| [26] |
HERMANSSON M, HOKYNAR K, SOMERHARJU P. Mechanisms of glycerophospholipid homeostasis in mammalian cells[J]. Progress in Lipid Research, 2011, 50(3): 240-257. DOI:10.1016/j.plipres.2011.02.004 |
| [27] |
VANCE D E, LI Z Y, JACOBS R L. Hepatic phosphatidylethanolamine N-methyltransferase, unexpected roles in animal biochemistry and physiology[J]. The Journal of Biological Chemistry, 2007, 282(46): 33237-33241. DOI:10.1074/jbc.R700028200 |
| [28] |
VANCE D E. Physiological roles of phosphatidylethanolamine N-methyltransferase[J]. Biochimica et Biophysica Acta, 2013, 1831(3): 626-632. DOI:10.1016/j.bbalip.2012.07.017 |
| [29] |
VAN MEER G, VOELKER D R, FEIGENSON G W. Membrane lipids: where they are and how they behave[J]. Nature Reviews Molecular Cell Biology, 2008, 9(2): 112-124. DOI:10.1038/nrm2330 |
| [30] |
IJÄS H K, LÖNNFORS M, NYHOLM T K M. Sterol affinity for phospholipid bilayers is influenced by hydrophobic matching between lipids and transmembrane peptides[J]. Biochimica et Biophysica Acta (BBA)-Biomembranes, 2013, 1828(3): 932-937. DOI:10.1016/j.bbamem.2012.11.034 |
| [31] |
KUMAR S, CHITRAJU C, FARESE R V, et al. Conditional targeting of phosphatidylserine decarboxylase to lipid droplets[J]. Biology Open, 2021, 10(3): bio058516. DOI:10.1242/bio.058516 |
| [32] |
WANG X, ZHANG L Y, SUN W X, et al. Changes of metabolites in acute ischemic stroke and its subtypes[J]. Frontiers in Neuroscience, 2020, 14(2): 580929. |
| [33] |
CALZADA E, ONGUKA O, CLAYPOOL S M. Phosphatidylethano- lamine metabolism in health and disease[J]. International Review of Cell and Molecular Biology, 2016, 321(7): 29-88. |
| [34] |
WANG X M, SHE H, MAO Z X. Phosphorylation of neuronal survival factor MEF2D by glycogen synthase kinase 3beta in neuronal apoptosis[J]. The Journal of Biological Chemistry, 2009, 284(47): 32619-32626. DOI:10.1074/jbc.M109.067785 |
| [35] |
WIDDER K, HARAUZ G, HINDERBERGER D. Myelin basic protein (MBP) charge variants show different sphingomyelin-mediated interactions with myelin-like lipid monolayers[J]. Biochimica et Biophysica Acta Biomembranes, 2020, 1862(2): 183077. DOI:10.1016/j.bbamem.2019.183077 |
| [36] |
CASTILLO R I, ROJO L E, HENRIQUEZ-HENRIQUEZ M, et al. From molecules to the clinic: linking schizophrenia and metabolic syndrome through sphingolipids metabolism[J]. Frontiers in Neuroscience, 2016, 10(2): 488. |
| [37] |
ADADA M, LUBERTO C, CANALS D. Inhibitors of the sphingomyelin cycle: sphingomyelin synthases and sphingomyelinases[J]. Chemistry and Physics of Lipids, 2016, 197(11): 45-59. |
| [38] |
MAITRA D, BRAGAZZI CUNHA J, ELENBAAS J S, et al. Porphyrin-induced protein oxidation and aggregation as a mecha-nism of porphyria-associated cell injury[J]. Cellular and Molecular Gastroenterology and Hepatology, 2019, 8(4): 535-548. DOI:10.1016/j.jcmgh.2019.06.006 |
| [39] |
BONKOVSKY H L, GUO J T, HOU W H, et al. Porphyrin and heme metabolism and the porphyrias[J]. Comprehensive Physiology, 2013, 3(1): 365-401. |
| [40] |
BROSNAN M E, BROSNAN J T. Histidine metabolism and function[J]. The Journal of Nutrition, 2020, 150(S1): 2570S-2575S. |
| [41] |
HAAS H L, SERGEEVA O A, SELBACH O. Histamine in the nervous system[J]. Physiological Reviews, 2008, 88(3): 1183-1241. DOI:10.1152/physrev.00043.2007 |
| [42] |
PASSANI M B, BLANDINA P. Histamine receptors in the CNS as targets for therapeutic intervention[J]. Trends in Pharmacological Sciences, 2011, 32(4): 242-249. DOI:10.1016/j.tips.2011.01.003 |
| [43] |
YOSHIKAWA T, NAKAMURA T, YANAI K. Histamine N-methyltransferase in the brain[J]. International Journal of Molecular Sciences, 2019, 20(3): E737. DOI:10.3390/ijms20030737 |
| [44] |
BROSNAN M E, MACMILLAN L, STEVENS J R, et al. Division of labour: how does folate metabolism partition between one-carbon metabolism and amino acid oxidation?[J]. The Biochemical Journal, 2015, 472(2): 135-146. DOI:10.1042/BJ20150837 |
| [45] |
MILLER W L, AUCHUS R J. The molecular biology, biochemistry, and physiology of human steroidogenesis and its disorders[J]. Endocrine Reviews, 2011, 32(1): 81-151. DOI:10.1210/er.2010-0013 |
| [46] |
KRISTIANA I, YANG H Y, BROWN A J. Different kinetics of cholesterol delivery to components of the cholesterol homeostatic machinery: implications for cholesterol trafficking to the endoplasmic Reticulum[J]. Biochimica et Biophysica Acta (BBA)-Molecular and Cell Biology of Lipids, 2008, 1781(11/12): 724-730. |
| [47] |
JEANNERET F, TONOLI D, ROSSIER M F, et al. Evaluation of steroidomics by liquid chromatography hyphenated to mass spectrometry as a powerful analytical strategy for measuring human steroid perturbations[J]. Journal of Chromatography A, 2016, 1430(11): 97-112. |
| [48] |
DO REGO J L, SEONG J Y, BUREL D, et al. Neurosteroid biosynthesis: enzymatic pathways and neuroendocrine regulation by neurotransmitters and neuropeptides[J]. Frontiers in Neuroendocrinology, 2009, 30(3): 259-301. DOI:10.1016/j.yfrne.2009.05.006 |
| [49] |
TANG T C, HU L B, LIU Y, et al. Sex-associated differences in neurovascular dysfunction during ischemic stroke[J]. Frontiers in Molecular Neuroscience, 2022, 15(2): 860959. |
| [50] |
SEARS S M S, ROBERTS S H, HEWETT S J. Hyperexcitability and brain morphological differences in mice lacking the cystine/glutamate antiporter, system xc[J]. Journal of Neuroscience Research, 2021, 99(12): 3339-3353. DOI:10.1002/jnr.24971 |
| [51] |
NEVZATI E, SHAFIGHI M, BAKHTIAN K D, et al. Estrogen induces nitric oxide production via nitric oxide synthase activation in endothelial cells[J]. Acta Neurochirurgica Supplement, 2015, 120(11): 141-145. |
| [52] |
KIM C, CUSHMAN M, KLEINDORFER D, et al. A review of the relationships between endogenous sex steroids and incident ischemic stroke and coronary heart disease events[J]. Current Cardiology Reviews, 2015, 11(3): 252-260. DOI:10.2174/1573403X1103150515110749 |
| [53] |
姚文兵. 生物化学[M]. 第八版. 北京: 人民卫生出版社, 2016: 96-97, 265. YAO W B. Biochemistry[M]. 8th Ed.. Beijing: People's Medical Publishing House, 2016: 96-97, 265. |
2. Tianjin University of Traditional Chinese Medicine, Tianjin 301617, China;
3. Department of Cardiovascular Medicine, Second Teaching Hospital of Tianjin University of Traditional Chinese Medicine, Tianjin 300150, China
 2022, Vol. 39
2022, Vol. 39