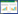文章信息
- 王彩君, 宋志会, 陈瑞, 陈思宇, 冯婉滢, 吕清波, 鄂秀辉, 王怡
- WANG Caijun, SONG Zhihui, CHEN Rui, CHEN Siyu, FENG Wanying, LYU Qingbo, E Xiuhui, WANG Yi
- 基于代谢组学探讨加参方对慢性心力衰竭模型大鼠的作用及机制
- Effect and mechanism of Jiashen Prescription on chronic heart failure model rats based on metabonomics
- 天津中医药, 2022, 39(12): 1574-1582
- Tianjin Journal of Traditional Chinese Medicine, 2022, 39(12): 1574-1582
- http://dx.doi.org/10.11656/j.issn.1672-1519.2022.12.14
-
文章历史
- 收稿日期: 2022-10-13
2. 天士力控股集团有限公司研究院现代中药开发中心, 天津 300410
慢性心力衰竭(CHF)是一种因心脏收缩及舒张功能下降,导致心脏排血量不足而诱发全身组织代谢异常的临床综合征,也是器质性心脏病发展的终末阶段[1],主要表现为呼吸困难、疲乏及液体潴留(肺淤血、体循环淤血及外周水肿)等,因病死率高、反复发作等特点已成为医学研究热点[2]。心力衰竭的主要生理病理机制是血流动力学障碍和神经内分泌系统的异常激活,后者参与并促进心肌重构,是CHF不断进展恶化的基础[3]。
加参方是张伯礼院士长期治疗轻、中度CHF的经验处方,组方以丹参、黄芪为君药,香加皮、葶苈子、桂枝为臣药,三七、益母草、陈皮为佐药。诸药合用,共奏益气活血,温阳利水功效。临床研究表明,加参方能治疗冠心病心力衰竭气虚血瘀证,改善患者心功能,提高生活质量[4-5]。既往研究显示加参方能通过抑制肾素-血管紧张素-醛固酮系统的过度激活、抑制炎症、减轻纤维化和减轻水钠潴留等治疗心梗后的CHF[6-9],并能抑制心肌细胞凋亡和纤维化[10-12]。
代谢组学技术通过对体内小分子内源性代谢物进行定性定量分析,再经过多元统计分析、代谢物鉴定及生物信息解析,发现疾病生物标记物并探索发病机制,进一步研究给予药物治疗后生物标记物的变化情况,以阐明药物治疗机制[13]。因此,本研究采用超高液相色谱-飞行时间质谱联用(UPLC-Q-TOF-MS)技术对CHF大鼠血清及尿液进行非靶向代谢组学研究,筛选CHF发生的潜在代谢标志物,构建加参方治疗CHF的代谢通路,以期从代谢物组学角度阐释加参方治疗CHF的作用机制。
1 实验材料 1.1 仪器VEVO 3100超高分辨率小动物超声成像系统(加拿大Visual Sonics公司);3D HISTECH数字病理扫描仪(济南丹吉尔电子有限公司);Waters ACQUITY UPLC色谱仪,Waters Xevo G2 Q-TOF/MS质谱仪,ACQUITY UPLC BEH C18色谱柱(2.1 mm×100 mm,1.7 μm,美国Waters公司)。
1.2 药品与试剂加参方提取物干膏粉由天士力研究院提供,批号:20200801,出膏率约为6.97%,其中丹酚酸B含量为69.4 mg/g,杠柳毒苷含量为1.09 mg/g。伊红染液、苏木素染液、马松(Masson)三色染色液、羧甲基纤维素钠(北京索莱宝科技有限公司);NT-proBNP ELISA试剂盒(武汉华美生物工程有限公司);甲醇(色谱纯,美国Merck公司);甲酸(色谱纯,Thermo Fisher Scientific公司)。
1.3 动物雄性SD大鼠,体质量(200±20) g,购自北京维通利华实验动物技术有限公司。实验动物许可证号:SCXK(京)2016-0006,温度25 ℃,湿度50%,12 h昼夜循环,自由饮食饮水,实验前适应性饲养1周。
2 实验方法 2.1 慢性心力衰竭模型大鼠的制备采用结扎大鼠左冠状动脉前降支法造成心肌梗死后形成CHF模型。将大鼠用5%水合氯醛(6 mL/kg)腹腔注射麻醉,仰卧位固定于鼠板,于大鼠左侧第三和第四肋间开胸,暴露并挤出心脏,于肺动脉圆锥与左心耳尖之间、距左心耳下缘2 mm处用5-0结扎线快速结扎,随后立即将心脏恢复原位,用2-0缝合线缝合。假手术组操作同模型组,但只穿线不结扎。空白组不做任何处理。造模5周后超声检测心功能,以左室射血分数(EF)下降到50%以下作为心衰模型成功标志。
2.2 分组及给药造模5周后,将成模的CHF大鼠根据EF值和体质量随机分为2组,每组9只,分别为模型组(CHF)、加参方组(JSF),另设假手术组(Sham)和空白组(Con),每组各10只。根据前期研究[9],加参方给药剂量为6 g/kg生药量,即本实验采用0.5% 羧甲基纤维素钠(CMC-Na)将加参方提取物干膏粉配制0.041 83 g/mL的药液,灌胃给药,模型组、假手术组和空白对照组同加参方组,均按大鼠体质量5 mL/kg给予溶剂0.5% CMC-Na,连续给药4周。
2.3 样本采集给药4周后,收集每组大鼠的12 h尿液,4 ℃条件下,离心半径10 cm,1 000 rpm/min离心10 min,去除颗粒污染物,后倒取上清,2 500 rpm/min离心10 min,离心半径10 cm,取上清液,加入终浓度2 mmol/L硼酸作为防腐剂[14],-80℃条件下保存。大鼠麻醉后腹主动脉取血置于含有促凝剂的采血管中,室温静置30 min,离心半径10 cm,4 500 r/min离心10 min,取上清,-80 ℃保存待测。大鼠取完血后进行心脏灌注,每组随机取3~4个取心脏,置于组织固定液中固定,其余心脏剪取左心室置于冻存管中,液氮冻存,-80 ℃保存。其中血清和尿液用于代谢组学研究,组织固定液固定的心脏用于组织病理观察,液氮冻存的心脏用于生物学指标检测。
2.4 药效学评价 2.4.1 大鼠心脏功能检测分别于造模5周后及取材前用异氟烷麻醉进行超声检测,检测大鼠EF、左室短轴缩短率(FS)。
2.4.2 大鼠心肌组织病理学变化和纤维化变化检测将组织固定液固定的大鼠心脏进行改刀,梯度乙醇脱水、二甲苯透明、浸蜡后用石蜡包埋,冷却后以5 μm厚度切片,常规脱蜡至水。采用苏木精-伊红(HE)染色观察心肌组织形态学变化及病理损伤;Masson染色观察心肌组织肌纤维及胶原纤维的形态和分布,并用Image J软件统计分析胶原容积分数(CVF)。
2.4.3 大鼠心肌组织NT-proBNP含量检测采用酶联免疫吸附法(ELISA)检测大鼠心肌组织中NT-proBNP水平。先将心脏组织左心室边缘区用1×磷酸盐缓冲液(PBS)匀浆,再参照ELISA剂盒说明书,检测NT-proBNP含量(ng/mL),同时采用考马斯亮蓝法(BCA法)对样本进行蛋白定量,最后计算心肌组织NT-proBNP相对含量(ng/mg)。
2.5 代谢组学研究 2.5.1 血清和尿液样本前处理及质控样品制备取“2.3”项下-80 ℃冻存的血清样本和尿液样本,4 ℃解冻,分别进行如下操作。
血清样本:分别取100 μL血清加入300 μL乙腈(1∶3体积比),涡旋混匀1 min,冰水浴超声10 min。以4 ℃,离心半径10 cm,12 000 rpm/min离心15 min,取100 μL上清液至液相内插管中待进样分析。
尿液样本:分别取150 μL尿液,加入150 μL蒸馏水(1∶1体积比),涡旋混匀1 min,以4 ℃,离心半径10 cm,12 000 rpm/min,离心15 min,取100 μL上清液至液相内插管中待进样分析。
质控(QC)样本:分别吸取4℃解冻后血清样品和尿液样品各50 μL,涡旋混匀1 min,使得QC样本包含了所有样品的生物学信息,并分别按照血清样品和尿液样品的前处理方法处理QC样品。
2.5.2 UPLC-Q-TOF-MS分析条件色谱条件:色谱柱:ACQUITY UPLC BEH C18(2.1 mm×100 mm,1.7 μm),流动相组成:A相:0.1%甲酸水;B相:0.1%甲酸乙腈,血清样本流速:0.3 mL/min;尿液样本流速:0.25 mL/min,柱温:45 ℃,血清样本进样量:2 μL;尿液样本进样量:1 μL,采用梯度洗脱。血清梯度洗脱条件为:0~0.5 min,1% B;0.5~2 min,1%~50% B;2~9 min,50%~99% B;9~10 min,99% B;10~10.5 min,99%~1% B;10.5~12 min,1% B。尿液梯度洗脱条件为:0~8.5 min,1%~25% B;8.5~11 min,25%~50% B;11~13 min,50%~99% B;13~14 min,99% B。
质谱条件:采用电喷雾电离源(ESI源),在正离子模式下进行质谱检测分析。使用高纯氮气作为辅助喷雾电离与脱溶剂气体,毛细管电压:3.0 Kv,脱溶剂气流速:800 L/h,锥孔电压:40 V,锥孔反吹氮气流速:50 L/h,脱溶剂气温度:450 ℃,电离源温度:120 ℃,四极杆扫描范围:m/z 50~1 000 Da。
2.5.3 方法学考察仪器精密度:取同一QC样本溶液,连续进样6次;方法精密度:平行制备6份QC样本,连续进样6次;样本稳定性:取同一QC样本溶液,分别在样本中间穿插进样分析,然后分别计算峰面积的相对标准偏差(RSD)值,以RSD < 30%的峰个数占所有峰个数的百分比大于70%可信,以此评价仪器稳定性,方法精密度和样本稳定性。
2.5.4 数据处理和分析将UPLC-Q-TOF-MS检测采集的原始数据经MarkerLynx 4.1(Waters,美国)软件数据处理系统进行峰发现、峰对齐和原始数据的峰值滤过,以找出潜在的判别变量,并导出数据,包括保留时间(tR)、质荷比(m/z)和峰面积;采用80%原则进行数据修约,利用“悟空”平台(https://www.omicsolution.org/wkomics/main/)根据K近邻法(KNN)进行缺失值填充;导入SIMCA 14.1软件进行多元统计分析,包括主成分分析(PCA)和正交偏最小二乘判别分析(OPLS-DA),筛选VIP > 1的作为候选差异代谢物;使用SPSS 21.0对候选差异代谢物进行独立样本t检验,筛选VIP > 1,且P < 0.05的代谢物作为差异代谢物;利用HMDB(http://www.hmdb.ca/)代谢物数据库和KEGG(http://www.genome.jp/kegg/)数据库及文献等信息匹配确认代谢标志物;利用MetaboAnalyst 5.0平台(https://www.metaboanalyst.ca/faces/ModuleView.xhtml)统计分析模块绘制热图,通过聚类分析进一步观察代谢标志物在各组间趋势,并通过MetaboAnalyst 5.0平台通路分析模块,进行代谢通路分析。
2.6 统计学分析采用SPSS 23.0软件进行数据分析,数据以均数±标准差(x±s)表示,多组间比较采用单因素方差分析进行分析,组间两两比较若方差齐采用最小显著差法(LSD),方差不齐采用Dunnett’s T3检验。以P < 0.05为差异有统计学意义。
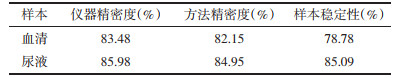
3 实验结果 3.1 加参方对CHF大鼠心脏功能的影响超声检测结果显示,与假手术组比较,模型组EF与FS均显著降低(P < 0.01);给药后,与模型组比较,加参方组EF与FS显著升高(P < 0.01)。见图 1。
|
| 注:与假手术组比较,**P < 0.01;与模型组比较,##P < 0.01 图 1 加参方对CHF大鼠左室射血分数、左室短轴缩短率的影响 Fig. 1 Effect of Jiashen Prescription on EF and FS of CHF rats |
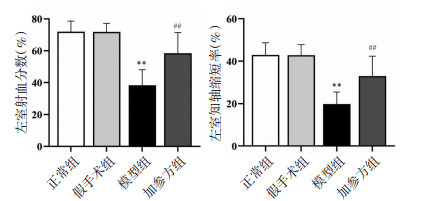
心肌组织进行HE染色,结果显示空白对照组与假手术组大鼠心肌细胞完整、排列整齐、着色均匀,细胞核、细胞浆完整,无炎性细胞浸润。模型组大鼠可见左心室腔扩大(全心横切面),出现明显的梗死灶,肌纤维排列紊乱,纤维细胞增多,心肌细胞减少、排列紊乱、细胞间质水肿,梗死灶及周围可见炎性细胞浸润。与模型组比较,加参方组大鼠心室腔相对缩小,梗死灶相对减小,上述现象减轻。见图 2。

|
| 图 2 加参方对CHF大鼠心肌病理损伤的影响(HE,n=3) Fig. 2 Effect of Jiashen Prescription on myocardial pathological injury in CHF rats (HE, n=3) |
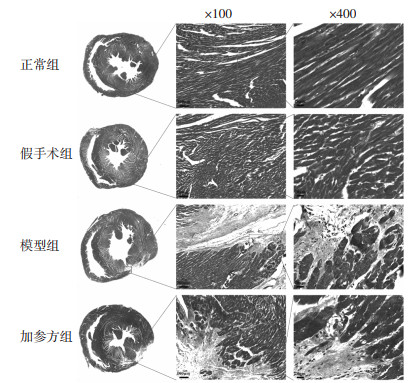
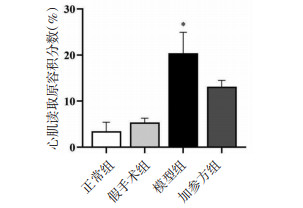
心肌组织进行Masson染色,结果显示空白对照组和假手术组大鼠心肌细胞间隙有少量胶原纤维,心肌细胞结构形态正常。模型组大鼠左心室前壁可见大量胶原纤维,呈片状分布,纤维可见明显肿胀、断裂,胶原纤维间有残存的心肌细胞。与模型组比较,加参方组大鼠胶原纤维面积缩小,胶原纤维间可见排列较整齐的心肌细胞,见图 3。与假手术组比较,模型组大鼠心肌组织心肌CVF明显升高(P < 0.05);与模型组比较,加参方组大鼠心肌组织CVF无明显降低(P > 0.05)。见图 4。
|
| 图 3 加参方对CHF大鼠心肌纤维化变化的影响(Masson,n=4) Fig. 3 Effect of Jiashen Prescription on myocardial fibrosis in CHF rats (Masson, n=4) |
|
| 注:与假手术组比较,*P < 0.05。 图 4 加参方对CHF大鼠心肌组织CVF的影响(n=4) Fig. 4 Effects of Jiashen Prescription on CVF of myocardial tissue in CHF rats (n=4) |
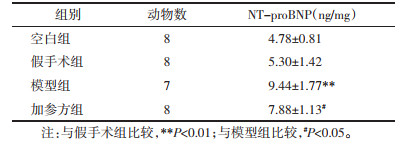
与假手术组比较,模型组大鼠心肌组织NT-proBNP含量显著升高(P < 0.01);与模型组比较,加参方组心肌组织NT-proBNP明显降低(P < 0.05)。见表 1。
|
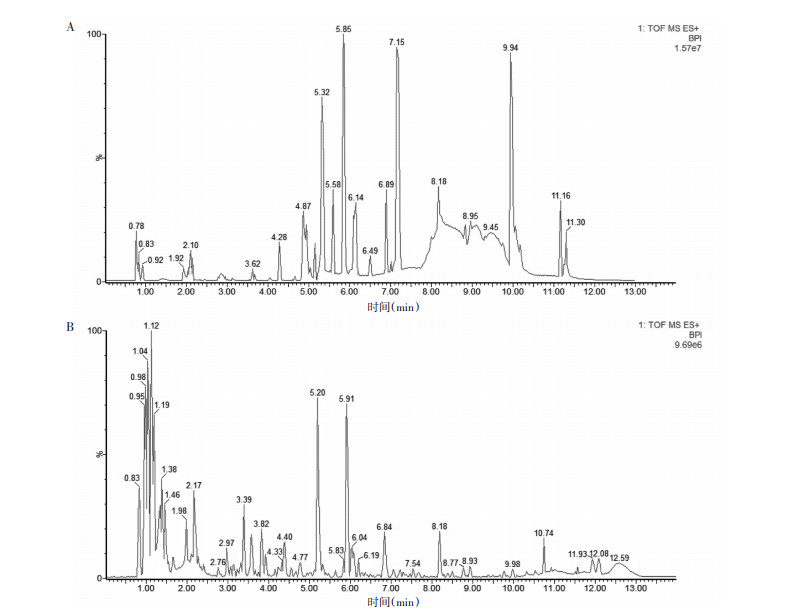
血清和尿液QC样本正离子模式下的BPI图,见图 5。方法学考察结果显示,血清和尿液样本的仪器精密度,方法精密度和样本稳定性峰面积的RSD < 30%的比例均大于70%,说明仪器和样本稳定,方法可靠,见表 2。
|
| 注:A.血清;B.尿液。 图 5 大鼠血清和尿液QC样本正离子模式下的BPI图 Fig. 5 BPI diagram of rat urine QC samples in positive ion mode |
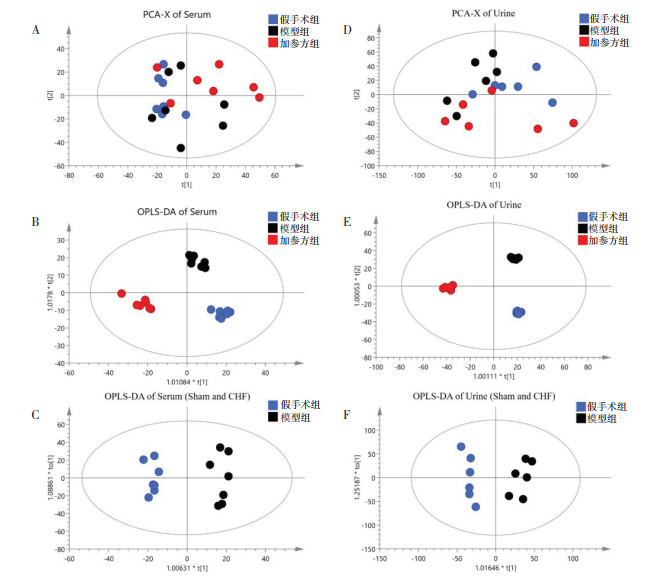
利用SIMCA 14.1软件对各组大鼠血清和尿液代谢谱图所得数据进行多元统计分析,首先,用无监督的PCA分析剔除异常值,并发现3个组不容易区分,见图 6A、6D。因此,进行有监督的OPLS-DA分析可以观察到3个组能够很好的分开,说明与假手术组相比,模型组大鼠体内内源性代谢物发生改变,给药后代谢水平区别于模型组,且趋近于假手术组,见图 6B、6E。在此基础上,采用拟合的OPLS-DA分析假手术组与模型组的差异代谢物,见图 6D、6F。R2Y代表模型的解释率,Q2代表模型的预测率,Q2 > 0.4,表明模型可靠,该值越接近于1,表明OPLS-DA模型拟合数据的效果越好。其中血清R2Y=0.977,Q2=0.501,尿液R2Y=0.947,Q2=0.465,说明所拟合的模型均可靠。然后筛选出假手术组和模型组之间VIP > 1且P < 0.05的差异代谢物,根据HMDB代谢物数据库等进行鉴定分析,结果显示,与假手术组比较,模型组得到33个与CHF相关的血清代谢标志物,主要为脂质和氨基酸及其衍生物;38个与CHF相关的尿液代谢标志物主要为氨基酸及其衍生物、长链脂肪酸和核苷类;大鼠血清、尿液代谢标志物见OSID。
|
| 注:A. 血清PCA得分图;B. 假手术组、模型组和加参方组血清OPLS-DA得分图;C. 假手术组和模型组血清OPLS-DA得分图;D. 尿液PCA得分图;E. 假手术组、模型组和加参方组尿液OPLS-DA得分图;F. 假手术组和模型组尿液OPLS-DA得分图 图 6 大鼠血清和尿液样本PCA和OPLS-DA得分图 Fig. 6 PCA and OPLS-DA scores of rat serum and urine samples |
与模型组比较,加参方组大鼠血清中有21个代谢标志物有回调趋势,其中MG(14:1)、MG(14:0)、MG(16:0)、MG(18:0)、5'-羧基-α-生育酚、DG(16:0/16:1)、α-亚麻基肉碱、LysoPC(20:1)和乳糖神经酰胺(d18:1/22:0)明显回调;尿液中29个代谢标志物有回调趋势,其中精氨酸赖氨酸、3-氧十四烷酸、3-羟基十四烷二酸和3-甲基组氨酸明显回调。具体结果见OSID。
3.4.4 加参方治疗CHF的代谢标志物聚类分析和代谢通路分析采用分层聚类分析即热图来展示加参方可回调的代谢标志物在不同组样本中的分布情况。以代谢标志物为纵坐标,样本为横坐标,图中颜色越深表明含量越高。通过分析发现,与假手术组相比,模型组血清和尿液代谢标志物有明显差异;与模型组比较,加参方组有不同程度的回调趋势,见图 7A,7C。为了进一步发现加参方对CHF的作用,对加参方可回调的血清和尿液代谢标志物进行代谢通路分析,结果发现,加参方对CHF大鼠血清代谢标志物的干预主要通过甘油磷脂代谢、鞘脂代谢及丙氨酸、天冬氨酸和谷氨酸代谢通路产生作用;对CHF大鼠尿液代谢标志物的干预主要通过泛酸和CoA生物合成、组氨酸代谢及嘌呤代谢通路产生作用,见图 7B,7D。
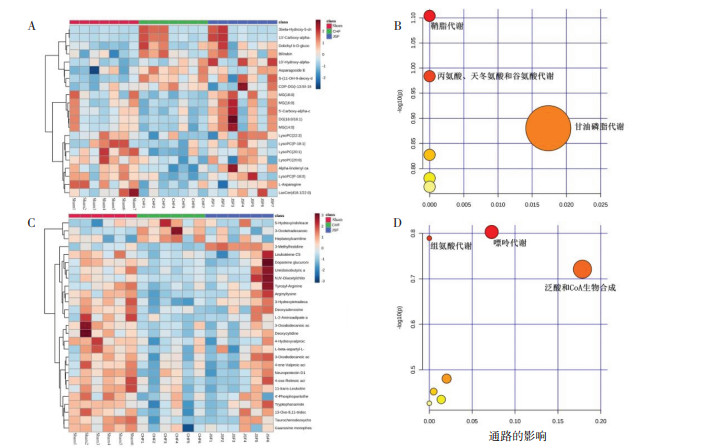
|
| 注:A. 血清聚类分析图;B. 血清代谢通路图;C. 尿液聚类分析图;D. 尿液代谢通路图。 图 7 加参方对CHF大鼠代谢标志物影响的聚类分析图和代谢通路图 Fig. 7 Cluster analysis and metabolic pathway analysis of the effect of Jiashen Prescription on serum and urine metabolic markers in CHF rats |
心肌梗死(简称心梗)是心力衰竭最常见、最重要的病因之一[15]。心梗后凋亡及坏死的心肌细胞引起免疫损伤,触发严重的炎症反应,加重组织功能受损;同时,心梗后心排出量的降低引起神经内分泌系统激活,如反射性激活交感神经系统、RAAS等;此外,心脏压力和(或)容量负荷增加,机械应力改变,也会直接导致一系列病理生理改变,加重心肌重构,最终导致心衰[16]。本研究结果显示加参方能降低CHF大鼠心肌组织NT-proBNP水平,升高CHF大鼠EF和FS值,减轻CHF大鼠心肌病理损伤和心肌纤维化,减缓心肌重构,改善CHF。
本研究发现CHF大鼠血清代谢标志物涉及的代谢通路包括类固醇激素生物合成、甘油磷脂代谢、鞘脂代谢、精氨酸和脯氨酸代谢、丙氨酸、天冬氨酸和谷氨酸代谢等;尿液代谢标志物涉及的代谢通路包括泛酸和CoA生物合成、嘌呤代谢、戊糖和葡萄糖醛酸相互转化、组氨酸代谢、花生四烯酸代谢等,与已有研究结果一致[17-19]。给予药物后,发现加参方通过干预甘油磷脂代谢和鞘脂代谢等脂质代谢通路、组氨酸代谢及丙氨酸、天冬氨酸和谷氨酸代谢等氨基酸代谢通路、泛酸和CoA生物合成等能量代谢通路、以及嘌呤代谢通路调节血清和尿液代谢标志物,改善CHF大鼠代谢紊乱,减轻CHF。
脂质在维持心肌细胞结构和心脏功能方面具有重要作用[20],其中甘油磷脂构成生物膜并参与细胞膜蛋白识别和信号转导[21]。研究表明CHF患者在磷脂代谢方面出现明显紊乱,磷脂酰胆碱(PCs)、溶血磷脂酰胆碱(Lyso PCs)和溶血磷脂酰乙醇胺(Lyso PE)显著下降[22]。而Lyso PCs是氧化损伤低密度脂蛋白的主要成分,可诱导心血管疾病中的炎症和血管功能障碍[23],加参方给药后与甘油磷脂代谢相关的脂质代谢标志物水平回调,说明药物可能通过减轻炎症的发展,减缓CHF的发展。与鞘脂代谢相关的神经酰胺可增加线粒体膜通透性,促进凋亡因子的释放,从而触发半胱氨酸蛋白酶(Caspase)级联反应,促进细胞凋亡,还可激活环磷酸腺苷(cAMP)反应元件结合蛋白3样蛋白1(CREB3L1)促进胶原蛋白沉积,促进纤维化[24-25]。本研究中给予加参方后血清中乳糖神经酰胺显著降低,心肌纤维化现象减轻,说明加参方可能通过抑制心肌细胞凋亡和减轻心肌纤维化,改善CHF。
氨基酸及其衍生物是生物体生命运动重要的代谢中间体[26]。天冬酰胺是草酰乙酸的前体之一,有研究表明心力衰竭患者生物标志物天冬酰胺降低[27]。组氨酸可清除氧自由基,保护心肌细胞肌膜Na+-K+-ATP酶、肌浆网Ca2+-ATP酶,改善心肌损伤[28-29]。本研究中加参方可回调CHF大鼠血清L-天冬酰胺和尿液3-甲基组氨酸,调节天冬氨酸代谢和组氨酸代谢。说明加参方可以通过调节氨基酸代谢改善CHF大鼠氧化应激和能量代谢,减缓心肌重构,减轻CHF。
泛酸是辅酶A(CoA)和酰基载体蛋白生物合成的重要前体物质,CoA对脂肪酸代谢和柠檬酸循环至关重要,参与能量代谢[30]。而酰基肉碱是参与脂肪酸氧化重要的脂质底物,缺血造成的CHF心肌脂肪酸氧化减少[31]。本研究中CHF大鼠血清代谢物中α-亚麻基肉碱水平显著下降,与泛酸和CoA生物合成通路相关的CHF大鼠尿液代谢物中4'-磷酸泛酰半胱氨酸水平降低,给药后均回调,说明加参方可以改善CHF大鼠能量代谢。
嘌呤代谢指核酸碱基腺嘌呤及鸟嘌呤等嘌呤衍生物的合成或分解,正常生理情况下,嘌呤合成与分解处于相对平衡状态。嘌呤代谢分解代谢终产物尿酸与CHF在内的心血管疾病密切相关,升高的尿酸水平与CHF患者的疾病严重程度和死亡风险增加相关[32]。本研究中CHF大鼠尿液中与嘌呤代谢相关的中间代谢物磷酸鸟苷和脱氧腺苷下降,给药后回调,说明加参方可能通过改善CHF大鼠嘌呤代谢减少尿酸生成。
综上所述,加参方能改善CHF大鼠心脏功能,减缓心肌重构,改善CHF,主要通过干预脂质代谢通路、氨基酸代谢通路、能量代谢通路和嘌呤代谢通路发挥作用。
| [1] |
SCHMALTZ A A. Chronic congestive heart failure in infancy and childhood: new aspects of diagnosis and treatment[J]. Klinische Padiatrie, 2015, 227(1): 3-9. DOI:10.1055/s-0034-1389974 |
| [2] |
PAN T, TU Z T, LIU J M. A retrospective study on the short-term effect of high-dose spironolactone(80 mg/d) on chronic congestive heart failure[J]. Medicine, 2021, 100(5): e23188. DOI:10.1097/MD.0000000000023188 |
| [3] |
中华医学会心血管病学分会心力衰竭学组, 中国医师协会心力衰竭专业委员会, 中华心血管病杂志编辑委员会. 中国心力衰竭诊断和治疗指南2018[J]. 中华心力衰竭和心肌病杂志(中英文), 2018, 2(4): 196-225. Heart Failure Group of Cardiovascular Society of Chinese Medical Association, Heart Failure Professional Committee of Chinese Medical Doctor Association, Editorial Committee of Chinese Journal of Cardiovascular Disease. Chinese guidelines for diagnosis and treatment of heart failure 2018[J]. Chinese Journal of Heart Failure and Cardiomyopathy, 2018, 2(4): 196-225. |
| [4] |
高新明. 加参强心方治疗冠心病心力衰竭气虚血瘀证疗效观察[J]. 临床医药文献电子杂志, 2018, 5(77): 30. GAO X M. Clinical observation on treating qi deficiency and blood stasis syndrome of coronary heart failure with Jiashen Qiangxin Prescription[J]. Journal of Clinical Medical Literature, 2018, 5(77): 30. |
| [5] |
仲伟琴, 张晓莉, 王保和. 加参强心方治疗冠心病心力衰竭气虚血瘀证疗效观察[J]. 河南中医, 2007, 27(7): 23-24. ZHONG W Q, ZHANG X L, WANG B H. Curative effects of Jiashen Qiangxin Prescription in treating coronary heart disease with the syndrome of heart failure and qi-deficiency and blood stasis[J]. Henan Traditional Chinese Medicine, 2007, 27(7): 23-24. DOI:10.3969/j.issn.1003-5028.2007.07.011 |
| [6] |
王怡, 郭志军, 徐强, 等. 加参方对CHF大鼠肾脏水通道蛋白(AQP)mRNA表达的影响[J]. 天津中医药大学学报, 2007, 26(4): 188-191. WANG Y, GUO Z J, XU Q, et al. Effect of Jiashen Prescription on the expression of AQP mRNA of CHF rats[J]. Journal of Tianjin University of Traditional Chinese Medicine, 2007, 26(4): 188-191. |
| [7] |
徐强, 高秀梅, 王保和, 等. 加参强心方对CHF大鼠神经内分泌系统的影响[J]. 光明中医, 2008, 23(11): 1645-1646. XU Q, GAO X M, WANG B H, et al. Effect of Jiashen Qiangxin Recipe on neuroendocrine system of CHF rats[J]. Guangming Journal of Chinese Medicine, 2008, 23(11): 1645-1646. DOI:10.3969/j.issn.1003-8914.2008.11.002 |
| [8] |
郭志军, 高秀梅, 王保和, 等. 加参方对CHF大鼠肺脏水通道蛋白mRNA表达的影响[J]. 环球中医药, 2009, 2(2): 106-108. GUO Z J, GAO X M, WANG B H, et al. Jiashen Prescription' effect on the expression of AQP in the lung of CHF rats[J]. Global Traditional Chinese Medicine, 2009, 2(2): 106-108. DOI:10.3969/j.issn.1674-1749.2009.02.007 |
| [9] |
杨钰沛. 加参优化方对心梗后心衰大鼠心肌纤维化的影响[D]. 郑州: 河南中医药大学, 2017. YANG Y P. The influence of the optimal preseription of Jiashen on myocardial fibrosis after myocardial infarction and heart failure in rats[D]. Zhengzhou: Henan University of Chinese Medicine, 2017. |
| [10] |
CUI L, WANG Y P, YU R, et al. Jiashen Decoction medicated serum inhibits angiotensin-Ⅱ induced cardiac fibroblast proliferation via the TGF-β1/Smad signaling pathway[J]. Molecular Medicine Reports, 2016, 14(2): 1610-1616. DOI:10.3892/mmr.2016.5405 |
| [11] |
王新陆, 崔琳, 王幼平, 等. 加参方对AngⅡ诱导的H9c2大鼠心肌细胞凋亡的干预作用研究[J]. 中华中医药杂志, 2017, 32(5): 2210-2215. WANG X L, CUI L, WANG Y P, et al. Jiashen Decoction exerts the inhibitory effects on the apoptosis of H9c2 rat cardiomyocytes induced by AngⅡ[J]. China Journal of Traditional Chinese Medicine and Pharmacy, 2017, 32(5): 2210-2215. |
| [12] |
郝轩轩, 王新陆, 崔琳, 等. 加参方浸膏对H2O2诱导的H9c2心肌细胞凋亡的干预作用研究[J]. 中国药房, 2018, 29(14): 1898-1903. HAO X X, WANG X L, CUI L, et al. Study on intervention effects of Jiashen Formula extractum on H2O2-induced apoptosis of H9c2 cardiomyocytes[J]. China Pharmacy, 2018, 29(14): 1898-1903. |
| [13] |
谢静, 李云鹃, 缪兴龙, 等. 基于代谢组学技术的中药复方药效物质基础与作用机制研究[J]. 药物评价研究, 2020, 43(7): 1439-1445. XIE J, LI Y J, MIAO X L, et al. Research on effective substances and mechanism of traditional Chinese medicine prescriptions based on metabolomics technology[J]. Drug Evaluation Research, 2020, 43(7): 1439-1445. |
| [14] |
肖瑶, 王美杰, 侯绍英. UPLC/Q-TOFMS/MS技术评价防腐剂硼酸和叠氮化钠对尿液代谢物的影响[J]. 癌变·畸变·突变, 2018, 30(6): 442-446, 451. XIAO Y, WANG M J, HOU S Y. Urine metabolites for two preservatives, boric acid and sodium azide: UPLC/Q-TOF MS/MS analyses[J]. Carcinogenesis, Teratogenesis & Mutagenesis, 2018, 30(6): 442-446, 451. |
| [15] |
JENA D, MELENOVSK V, STEHLIK J, et al. Heart failure after myocardial infarction: incidence and predictors[J]. ESC Heart Failure, 2021, 8(1): 222-237. |
| [16] |
2020心肌梗死后心力衰竭防治专家共识[J]. 中国循环杂志, 2020, 35(12): 1166-1180. 2020 expert consensus on the prevention and treatment of heart failure after myocardial infarction[J]. Chinese Circulation Journal, 2020, 35(12): 1166-1180. |
| [17] |
FU J Z, CHANG L P, HARMS A C, et al. A metabolomics study of Qiliqiangxin in a rat model of heart failure: a reverse pharmacology approach[J]. Scientific Reports, 2018, 8(3): 3688. |
| [18] |
XU J, LI X Y, ZHANG F B, et al. Integrated UPLC-Q/TOF-MS technique and MALDI-MS to study of the efficacy of YiXinshu Capsules against heart failure in a rat model[J]. Frontiers in Pharmacology, 2019, 10(1): 1474. |
| [19] |
YUAN Y, FAN S M, SHU L X, et al. Exploration the mechanism of doxorubicin-induced heart failure in rats by integration of proteomics and metabolomics data[J]. Frontiers in Pharmacology, 2020, 11(2): 600561. |
| [20] |
TOMCZYK M M, DOLINSKY V W. The cardiac lipidome in models of cardiovascular disease[J]. Metabolites, 2020, 10(6): 254. |
| [21] |
GONZALEZ-BARO M R, COLEMAN R A. Mitochondrial acyltransferases and glycerophospholipid metabolism[J]. Biochimica et Biophysica Acta (BBA)-Molecular and Cell Biology of Lipids, 2017, 1862(1): 49-55. |
| [22] |
MARCINKIEWICZ-SIEMION M, CIBOROWSKI M, PTASZYNSKA-KOPCZYNSKA K, et al. LC-MS-based serum fingerprinting reveals significant dysregulation of phospholipids in chronic heart failure[J]. Journal of Pharmaceutical and Biomedical Analysis, 2018, 154(7): 354-363. |
| [23] |
LIU P P, ZHU W, CHEN C, et al. The mechanisms of lysophosphatidylcholine in the development of diseases[J]. Life Sciences, 2020, 247(12): 117443. |
| [24] |
COLOMBINI M. Ceramide channels and mitochondrial outer membrane permeability[J]. Journal of Bioenergetics and Biomembranes, 2017, 49(1): 57-64. |
| [25] |
CHOI R H, TATUM S M, SYMONS J D, et al. Ceramides and other sphingolipids as drivers of cardiovascular disease[J]. Nature Reviews Cardiology, 2021, 18(10): 701-711. |
| [26] |
HOFFER L J. Human protein and amino acid requirements[J]. Journal of Parenteral and Enteral Nutrition, 2016, 40(4): 460-474. |
| [27] |
CONTAIFER D, BUCKLEY L F, WOHLFORD G, et al. Metabolic modulation predicts heart failure tests performance[J]. PLoS One, 2019, 14(6): e0218153. |
| [28] |
刘玲华. 组氨酸与心肌再灌注损伤[J]. 国外医学临床生物化学与检验学分册, 1994, 15(5): 209-211. LIU L H. Histone and myocardial reperfusion injury[J]. Foreign Medical Sciences, 1994, 15(5): 209-211. |
| [29] |
BROSNAN M E, BROSNAN J T. Histidine metabolism and function[J]. The Journal of Nutrition, 2020, 150(Suppl 1): 2570S-2575S. |
| [30] |
HUISJES R, CARD D J. Methods for assessment of pantothenic acid (Vitamin B5)-ScienceDirect[J]. Laboratory Assessment of Vitamin Status, 2019, 12(7): 173-179. |
| [31] |
LOPASCHUK G D, KARWI Q G, TIAN R, et al. Cardiac energy metabolism in heart failure[J]. Circulation Research, 2021, 128(10): 1487-1513. |
| [32] |
NDREPEPA G. Uric acid and cardiovascular disease[J]. Clinica Chimica Acta, 2018, 484(8): 150-163. |
2. Modern Chinese Medicine Development Center, Tianshili Pharmaceutical Group Co., Ltd., Tianjin 300410, China
 2022, Vol. 39
2022, Vol. 39