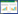文章信息
- 白璐, 陈志强
- BAI Lu, CHEN Zhiqiang
- 化瘀通络中药对糖尿病肾病大鼠肾脏足细胞密度的干预作用
- Intervention of Chinese herbs for stasis removing and collaterals dredging on podocyte density in the diabetic nephropathy rats
- 天津中医药, 2022, 39(12): 1583-1588
- Tianjin Journal of Traditional Chinese Medicine, 2022, 39(12): 1583-1588
- http://dx.doi.org/10.11656/j.issn.1672-1519.2022.12.15
-
文章历史
- 收稿日期: 2022-08-26
2. 河北中医学院第一附属医院肾内二科,石家庄 050011
蛋白尿是糖尿病肾病(DN)主要的临床表现,亦是肾小球滤过屏障受损的重要标志。肾小球滤过屏障由内皮细胞、肾小球基底膜(GBM)及足细胞组成,其结构和功能的改变是蛋白尿产生的病理生理基础[1-3]。足细胞贴附于GBM表面,是一种终末分化的多突状细胞,是维持整个肾小球滤过膜正常通透性的主要成份,其损伤及脱落对于蛋白尿的形成具有重要作用[4]。有研究表明DN患者从尿中丢失的足细胞数与患者的尿蛋白量呈正相关关系[5-6],说明足细胞对GBM的黏附失常造成其脱落,是DN蛋白尿发生的主要原因之一。α3β1整合素是介导足细胞与基底膜连接的膜蛋白,主要对足细胞的黏附功能起作用,使足细胞黏附于GBM的Ⅳ型胶原、层黏连蛋白和纤维连接蛋白上,其表达量的改变会使足细胞与GBM的黏附性下降,出现足细胞脱落,表明其与足细胞数量的丢失及蛋白尿的多少密切相关[7]。肾母细胞瘤抑制基因(WT1)是足细胞特异性标志基因,可以标记足细胞核数量,有研究报道DN足细胞损伤与WT1在肾脏的表达量下降有紧密关系[8],随着DN足细胞损伤脱落的发展,WT1在肾脏的表达量也明显下降。
随着瘀血阻络理论在DN发病中的重要作用进一步被认可,化瘀通络中药在治疗DN时成为组方中必要的组成部分,前期研究证实该类中药治疗DN蛋白尿疗效确切,能减轻DN大鼠肾脏纤维化、保护足细胞、抑制肾脏氧化应激、减轻炎症反应[9-12]。此本研究意在探讨化瘀通络中药能否通过干预α3β1整合素的表达减少足细胞脱落从而减少蛋白尿,以期为化瘀通络中药在临床上的推广应用提供依据。
1 材料与方法 1.1 动物健康雄性SD大鼠40只,清洁级,体质量(120±20)g,购买于河北医科大学实验动物中心,许可证号:SCXK(冀)2018-1-004。
1.2 药物化瘀通络中药颗粒剂:丹参(1.8 g/袋,相当于饮片10 g,批号501306T)、川芎(1.3 g/袋,相当于饮片6 g,批号412272T)、水蛭(1.5g/袋,相当于饮片3 g,批号408245T)、地龙(1.0 g/袋,相当于饮片10 g,批号501153T)、全蝎(1.0 g/袋,相当于饮片3 g,批号412299T),广东一方制药有限公司惠赠。厄贝沙坦片(0.15g/片,批号4A293),由赛诺菲(杭州)制药有限公司生产。
1.3 试剂仪器链脲佐菌素(STZ,Enzo公司,货号04081408),TRIquick Reagent(北京Solarbio公司,货号:R1100),FastQuant cDNA第一链合成试剂盒(北京天根生化科技有限公司,货号:KR202)、Platinum SYBR Green qPCR SuperMix-UDG(美国invitrogen公司,货号:11733046),引物(上海生工生物工程公司),脑脊液与尿蛋白测定试剂盒(终点法,北京利德曼生化股份有限公司,货号:2400134),兔多克隆抗体Integrin α3(ITGA3,武汉博士德生物工程有限公司,货号:BA0955),兔多克隆抗体Integrin β1(ITGB1,北京博奥森生物技术有限公司,货号:bs-0486P),兔多克隆抗体WT1(美国ABclone公司,货号:A2446)。稳豪型血糖仪(强生有限公司),NanoDrop2000C紫外分光光度计(美国Thermo Scientific公司),Eco实时定量PCR仪(美国illumina公司),BX63+DP72正置研究级显微镜(日本OLYMPUS株式会社),MICROM-340E石蜡切片机(德国Zeiss公司)。
1.4 造模、分组和给药健康雄性SD大鼠40只,适应性饲养1周。随机选取8只大鼠为正常组(C组),给予普通饲料饲养,剩余32只大鼠给予高糖高脂饲料饲养(由河北医科大学实验动物中心加工制作),饲养6周后所有大鼠禁食不禁水12 h,按35 mg/kg腹腔注射1% STZ溶液,72 h后尾静脉取血检测血糖,血糖≥16.7 mmol/L为糖尿病大鼠(DM)模型复制成功。共3只大鼠检测血糖不达标剔除,将成模大鼠随机分为模型组(M组)10只,厄贝沙坦组(I组)10只,中药组(Z组)9只。大鼠成模后给药干预,按照人用药的配伍比例及大鼠与人的体表面积计算,化瘀通络中药成人口服剂量:丹参15 g,川芎12 g,地龙10 g,水蛭6 g,全蝎6 g,大鼠每日灌胃给药剂量为丹参1.41 g/kg,川芎1.12 g/kg,地龙0.94 g/kg,水蛭0.56 g/kg,全蝎0.56 g/kg,厄贝沙坦组以14.12 mg/kg灌胃,连续给予20周。
1.5 标本的收集大鼠灌胃20周末,代谢笼收集24 h尿液并测量尿量,尿液离心半径8 cm,3 000 r/min离心15 min后取上清液,终点法行24 h尿蛋白定量检测。所有大鼠禁食8 h以10%水合氯醛0.35 mL/100 g腹腔注射麻醉,腹主动脉取血,离心后取血清用于血液指标检测,快速分离肾脏,留取肾皮质用于肾脏病理、实时聚合酶链反应(RT-PCR)、免疫组化(IHC)检测。
1.6 观察指标及方法 1.6.1 生化指标检测尿蛋白浓度采用终点法检测,尿蛋白浓度×24 h尿量得出24 h尿蛋白总量(24 h UTP)。所有大鼠禁食8 h尾静脉采血检测空腹血糖(FBG)。采用BECKMAN CX7全自动生化分析仪按试剂盒操作检测血肌酐(Scr)、尿素氮(BUN)。
1.6.2 光镜观察肾脏病理预冷的FAA固定液固定肾皮质,常规乙醇梯度脱水、二甲苯透明、石蜡包埋、切片(厚度2 μm)、二甲苯脱蜡、乙醇梯度水化后,苏木精-伊红染色(HE)、过典酸雪夫氏染色(PAS),封片,显微镜下放大400倍采集图像。
1.6.3 RT-PCR检测ITGA3、ITGB1、WT1 mRNA的表达采用TRIquick提取肾组织总RNA,检测其浓度及纯度,将OD260/OD280比值在1.8~2.0之间的RNA样品,反转录成cDNA,将cDNA放于荧光定量PCR仪扩增。采用Primer 5.0软件设计引物(引物序列见表 1),反应条件为UDG Incubation 50 ℃ 2 min、Polymerase Activation 95 ℃ 10 min、95 ℃ 10 s、60 ℃ 40 s共40个循环。融解曲线条件:95 ℃ 15 s、55 ℃ 15 s、95 ℃ 15 s,建立融解曲线检测扩增产物的特异性。数据分析采用ΔΔCq法进行相对定量,以β-actin作为内参,正常组设置为对照组,相对表达量(Relative Quantification)=2-ΔΔCq;ΔCq=目的基因Cq平均值-内参Cq平均值;ΔΔCq=实验组ΔCq-对照组ΔCq,以均数±标准差(x±s)表示。
切取肾组织标本用4%中性甲醛固定液固定,经梯度脱水后,石蜡包埋,制作4 μm厚石蜡切片,采用链霉菌抗生物素蛋白-过氧化物酶连结法(SP)法检测,常规石蜡切片脱蜡,微波修复,切片置于3% H2O2溶液中,PBS冲洗,滴加A液(10%正常山羊血清封闭液),室温孵育30 min,滴加一抗(ITGA3稀释比例1:100;ITGB1稀释比例1:200;WT1稀释比例1:200),4 ℃孵育过夜,冲洗后滴加二抗(B液)37 ℃孵育30 min,PBS冲洗,滴加C液37 ℃孵育30 min,DAB显色,苏木素复染3 min,乙醇梯度脱水,二甲苯透明,中性树胶封片。使用BX63+DP72正置研究级显微镜阅片观察并拍片。
1.6.5 肾小球内足细胞密度的检测采用WT1-C末端抗体标记足细胞核,IHC检测WT1的表达,计数足细胞数量。BX63显微成像系统放大400倍采集图像,应用Cell Sens Dimension软件采用逐点描绘区域法测量肾小球面积,计数肾小球内褐色细胞核数量即足细胞个数。以足细胞个数/肾小球面积,来表示足细胞密度。
1.6.6 统计学方法采用SPSS 21.0统计软件进行统计学处理,实验数据以(x±s)表示,若方差齐,采用单因素方差分析,两两比较采用SNK-q检验;若方差不齐,采用秩和检验,P<0.05为差异有统计学意义。
2 结果 2.1 各组大鼠一般情况C组大鼠毛色光泽,反应灵活,活动自然,饮食饮水量及尿量均正常;M组大鼠毛色晦暗,精神萎靡,体重逐渐下降,并出现明显多饮、多食、多尿的症状,造模后第7周,M组死亡1只,第15周末血糖不达标,剔除1只,第16周死亡1只;Z组大鼠于第10周、第14周各死亡1只,第13周血糖不达标,剔除1只;I组于第6、12、17周各死亡1只。
2.2 各组大鼠FBG、Scr、BUN、24 h UTP的比较与C组比较,造模各组大鼠FBG明显升高(P<0.05);与M组比较,I组及Z组FBG差异无统计学意义(P>0.05);与C组比较,M组大鼠Scr、BUN均明显升高,与M组比较,各干预组Scr差异无统计学意义(P>0.05),Z组BUN显著低于M组(P<0.05),I组BUN与M组差异无统计学意义(P>0.05),与I组比较,Z组BUN明显降低(P<0.05);与C组比较,M组大鼠24UTP明显升高(P>0.05),与M组比较,Z组及I组24UTP均明显下降(P<0.05),与I组比较,Z组24UTP明显下降(P<0.05)。见表 2。
|
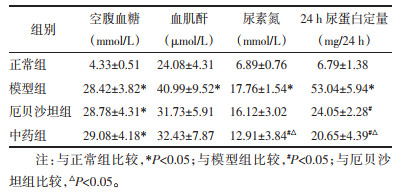
C组大鼠肾组织可见肾小球、肾小管未见明显异常;M组大鼠肾组织肾小球肥大,基底膜轻度增厚,系膜细胞和基质增多,肾小囊腔变窄;与M组比较,Z、I组病理改变有一定程度减轻。见图 1。
|
| 注:C组.正常组;M组.模型组;I组.厄贝沙坦组;Z组.中药组。 图 1 各组大鼠肾组织光镜(上图HE染色、下图PAS染色)观察(×400倍) Fig. 1 Kidney tissue observed by light microscopy(HE, PAS staining)of rats in each group(×400) |
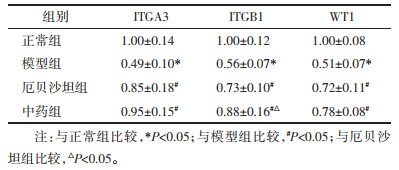
与C组比较,M组ITGA3,ITGB1,WT1 mRNA的表达均明显减少,差异有统计学意义(P<0.05);与M组比较,I、Z组ITGA3,ITGB1,WT1 mRNA的表达增加(P<0.05);与I组比较,Z组ITGB1 mRNA表达增加(P<0.05),ITGA3、WT1 mRNA无明显差异(P>0.05)。见表 3。
|
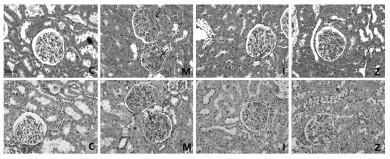
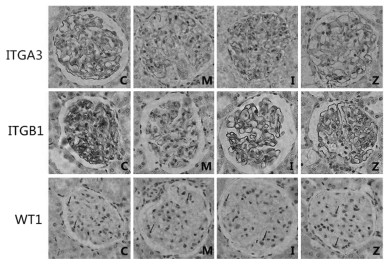
ITGA3,ITGB1主要分布于肾小球基底膜和系膜基质,少量分布于足细胞胞质中,两者在C组大鼠肾小球高表达;与C组相比,ITGA3、ITGB1在M组大鼠肾小球表达减少;与M组比较,I、Z组两者表达增多;WT1是足细胞的特异性蛋白,表达在肾小球中且位于足细胞的细胞核内;与C组相比,M组WT1表达减少;与M组比较,I、Z组WT1表达增多。见图 2。
|
| 注:C组.正常组;M组.模型组;I组.厄贝沙坦组;Z组.中药组。 图 2 各组大鼠肾组织ITGA3、ITGB1、WT1蛋白的表达(×400) Fig. 2 Expression of ITGA3, ITGB1, and WT1 protein in kidney tissues of rats in each group(×400) |
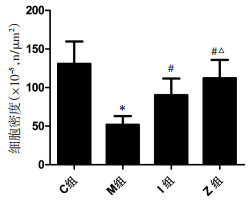
与C组比较,M组大鼠足细胞密度显著减少(P<0.05);与M组比较,I、Z组大鼠足细胞密度明显增加(P<0.05);与I组比较,Z组密度明显增加(P<0.05)。见图 3。
|
| 注:C组.正常组;M组.模型组;I组.厄贝沙坦组;Z组.中药组。与正常组比较,*P<0.05;与模型组比较,#P<0.05;与厄贝沙坦组比较,△P<0.05。 图 3 各组大鼠肾小球内足细胞密度的比较 Fig. 3 Comparison of podocyte density in the glomeruli of rats in each group |
DN是一种慢性渐进性疾病,其临床表现及病理特征随着病程的延长而逐渐加重,蛋白尿的发生是DN最明显的临床特征,表现为早期微量蛋白尿到临床期出现大量蛋白尿。肾小球滤过屏障可有效阻止白蛋白等大分子量物质进入尿液,其结构和功能的改变是蛋白尿产生重要的病理基础。足细胞作为滤过屏障重要的组成部分,覆盖于GBM的表面,它是肾小球中唯一一种高度终末分化细胞,不能进行正常的细胞分裂,其一但脱落将不可再生。足细胞损伤的表现一方面为足细胞相关蛋白的表达异常;另一方面是形态变化主要包括足细胞肥大、细胞足突融合、足细胞数量或密度减少、足细胞凋亡、足细胞上皮-间充质转分化等[13-14]。有针对DM患者的1项研究,结果显示足细胞的脱落与DN蛋白尿及肾功能的损害有关[15]。通过肾活检分析发现2型DM患者足细胞数明显低于正常人,且足细胞密度越小,尿白蛋白的排泄率越大[16]。正常状态下,足细胞通过整合素α3β1、dystroglycans黏附于GBM表面保持其结构和功能的完整性,而发挥滤过屏障的作用,一但足细胞损伤整合素α3β1表达降低,足细胞对GBM的黏附力降低,则会出现脱落。整合素是异质二聚体的穿膜蛋白,由ɑ和β亚基组成,本文主要研究了整合素α3(ITGA3)及整合素β1(ITGB1)在肾脏的表达水平,两者均是细胞与细胞外基质黏附的受体。α3β1整合素是在体内肾小球发育过程中唯一发挥重要作用的整合素,其由足细胞分泌并介导足细胞与GBM的黏附,足细胞主要通过ITGA3、ITGB1被覆于GBM的细胞外基质蛋白上,从而维持肾小球滤过功能的正常[17]。WT1表达于足细胞核,是成熟足细胞的特异性标志蛋白,其对维持成熟的足细胞表型可能是必要的[18],在肾小球中,WT1只在足细胞核表达,因此WT1可作为计数足细胞的标记物。
DN可累及约40%的DM患者,一旦出现持续蛋白尿,发生肾损伤,则病情常不可逆转,直至发展为终末期肾病。DN发病机制复杂,其防治目前尚缺乏针对性较强的特效手段。《金匮要略》云:“病人如热状,烦满,口干燥而渴,其脉反无热,此为阴伏,是瘀血也,当下之。”记载了瘀血致消渴的病理机制。DM病机在气阴两虚,气虚无力助血运行,血行艰涩致瘀;消渴日久不愈,阴津虚耗,津液亏虚,虚火内生,内热煎灼阴血而至血瘀;或燥热之邪煎熬津液,使津亏血稠、血行不畅而致瘀;或病久营卫之气运行不畅,经络失疏而生瘀。因此,随着DM病程迁延,导致肾络瘀阻,引起肾小球毛细血管团结构及功能受损,导致蛋白尿的漏出,由此可见DN病机重在瘀血阻络。据证立法,依法采方选取了化瘀通络中药进行DN干预,其降低蛋白尿及肾脏保护作用也得到前期临床及动物实验研究的证实[19-20]。通过多中心随机临床试验发现化瘀通络中药可有效改善Ⅲ、Ⅳ期DN患者的临床症状,降低尿蛋白,调节脂代谢,保护肾功能,提高患者生活质量。通过对DN大鼠的实验室检测发现化瘀通络中药能明显改善DN大鼠肾脏病理损伤,减少蛋白尿排泄,并且能通过多种信号通路减轻肾脏损伤,改善肾功能。方药选取丹参、川芎、地龙、水蛭、全蝎进行配伍,意在祛逐肾络瘀血、改善肾脏循环、延缓肾脏纤维化、减轻肾脏损伤。现代药理研究及临床实验证明丹参、川芎均具有扩血管、改善DN血液高凝高黏状态、降低血小板黏性、抑制血小板活化、改善肾脏微循环的作用[21]。地龙、水蛭、全蝎皆属虫类之品,性善走窜,驱逐肾络癥瘕,具有扩张毛细血管、改善血液动力学、抗血栓、减少肾脏Ⅳ型胶原表达,减轻肾小球硬化的作用[22-24]。因此本研究就化瘀通络中药能否通过干预α3β1整合素表达起到减少足细胞脱落的目的,从而对DN起到肾脏保护作用展开探讨。
研究结果显示,DN大鼠α3β1整合素表达明显减少,足细胞密度减少,表明α3β1整合素介导了足细胞与GBM的黏附,其表达与足细胞密度呈正相关。通过化瘀通络中药的干预能一定程度上对α3β1整合素表达起到良性调节作用,上调其在肾组织的表达量,减少足细胞脱落个数,从而起到足细胞保护作用,能够明显减少DN大鼠蛋白尿排泄和肾脏病理损伤。由此笔者推测,化瘀通络中药也能通过改善足细胞形态学的变化来达到肾保护作用,该作用机制可能也是化瘀通络中药干预DN重要的作用靶点之一。
| [1] |
张林, 刘伏友, 段绍斌. 肾小球滤过屏障与蛋白尿发生机制[J]. 国际泌尿系统杂志, 2006, 12(3): 387-391. ZHANG L, LIU F Y, DUAN S B. Mechanism of glomerular filtration barrier and proteinuria[J]. International Journal of Urology and Nephrology, 2006, 12(3): 387-391. DOI:10.3760/cma.j.issn.1673-4416.2006.03.031 |
| [2] |
周建华. 蛋白尿的发生机制研究进展[J]. 中国实用儿科杂志, 2016, 31(11): 808-812. ZHOU J H. Progress in study of proteinuria mechanism[J]. Chinese Journal of Practical Pediatrics, 2016, 31(11): 808-812. |
| [3] |
DURVASULA R V, PETERMANN A T, HIROMURA K, et al. Activation of a local tissue angiotensin system in podocytes by mechanical strain[J]. Kidney International, 2004, 65(1): 30-39. DOI:10.1111/j.1523-1755.2004.00362.x |
| [4] |
刘雅清, 纪泽泉. 足细胞与足细胞病[J]. 肾脏病与透析肾移植杂志, 2011, 20(1): 54-61. LIU Y Q, JI Z Q. Podocyte and podocytopathy[J]. Chinese Journal of Nephrology, Dialysis & Transplantation, 2011, 20(1): 54-61. DOI:10.3969/j.issn.1006-298X.2011.01.014 |
| [5] |
WEIL E J, LEMLEY K V, MASON C C, et al. Podocyte detachment and reduced glomerular capillary endothelial fenestration promote kidney disease in type 2 diabetic nephropathy[J]. Kidney International, 2012, 82(9): 1010-1017. DOI:10.1038/ki.2012.234 |
| [6] |
REIDY K, SUSZTAK K. Epithelial-mesenchymal transition and podocyte loss in diabetic kidney disease[J]. American Journal of Kidney Diseases, 2009, 54(4): 590-593. DOI:10.1053/j.ajkd.2009.07.003 |
| [7] |
CHEN C A, HWANG J C, GUH J Y, et al. Reduced podocyte expression of alpha3beta1 integrins and podocyte depletion in patients with primary focal segmental glomerulosclerosis and chronic PAN-treated rats[J]. The Journal of Laboratory and Clinical Medicine, 2006, 147(2): 74-82. DOI:10.1016/j.lab.2005.08.011 |
| [8] |
张堃, 池艳春, 郭静. 糖尿病肾病大鼠蛋白尿和肾组织WT1表达的相关性研究[J]. 中国医药导报, 2013, 10(28): 13-16. ZHANG K, CHI Y C, GUO J. The research of proteinuria in rat model of diabetic nephropathy and WT1 expression in kidney[J]. China Medical Herald, 2013, 10(28): 13-16. DOI:10.3969/j.issn.1673-7210.2013.28.005 |
| [9] |
王明霞. 从血瘀证论述糖尿病性肾病病机及治疗[J]. 中医临床研究, 2020, 12(29): 19-21. WANG M X. Discussion on the pathogenesis and treatment of diabetic nephropathy from the Xueyu syndrome[J]. Clinical Journal of Chinese Medicine, 2020, 12(29): 19-21. DOI:10.3969/j.issn.1674-7860.2020.29.006 |
| [10] |
徐晶, 马二卫, 白璐, 等. 糖尿病肾病大鼠模型瘀血阻络证的确认[J]. 中国中西医结合肾病杂志, 2014, 15(1): 12-15, 1. XU J, MA E W, BAI L, et al. Verification of stasis-blocking-collaterals syndrome in rat model with diabetic nephropathy[J]. Chinese Journal of Integrated Traditional and Western Nephrology, 2014, 15(1): 12-15, 1. |
| [11] |
郭帅, 方敬, 杨帆, 等. 化瘀通络中药通过抑制TGF-β1/ERK通路减轻糖尿病肾病大鼠肾纤维化研究[J]. 中草药, 2021, 52(10): 2996-3001. GUO S, FANG J, YANG F, et al. Huayu Tongluo Chinese medicines alleviate renal fibrosis by inhibiting TGF-β1/ERK pathway in diabetic nephropathy rats[J]. Chinese Traditional and Herbal Drugs, 2021, 52(10): 2996-3001. |
| [12] |
李雅纯, 方敬, 郭帅, 等. 化瘀通络中药对糖尿病肾病大鼠氧化应激和炎症的干预作用及其机制研究[J]. 中成药, 2022, 44(2): 568-573. LI Y C, FANG J, GUO S, et al. The intervention effect and mechanism of Huayu Tongluo Chinese medicines on oxidative stress and inflammation in diabetic nephropathy[J]. Chinese Traditional Patent Medicine, 2022, 44(2): 568-573. DOI:10.3969/j.issn.1001-1528.2022.02.044 |
| [13] |
LI J J, KWAK S J, JUNG D S, et al. Podocyte biology in diabetic nephropathy[J]. Kidney International, 2007, 72(7): S36-S42. |
| [14] |
MATHIESON P W. The podocyte as a target for therapies-new and old[J]. Nature Reviews Nephrology, 2012, 8(1): 52-56. DOI:10.1038/nrneph.2011.171 |
| [15] |
TOYODA M, NAJAFIAN B, KIM Y, et al. Podocyte detachment and reduced glomerular capillary endothelial fenestration in human type 1 diabetic nephropathy[J]. Diabetes, 2007, 56(8): 2155-2160. DOI:10.2337/db07-0019 |
| [16] |
DALLA VESTRA M, MASIERO A, ROITER A M, et al. Is podocyte injury relevant in diabetic nephropathy? Studies in patients with type 2 diabetes[J]. Diabetes, 2003, 52(4): 1031-1035. DOI:10.2337/diabetes.52.4.1031 |
| [17] |
KREIDBERG J A, DONOVAN M J, GOLDSTEIN S L, et al. Alpha3beta1 integrin has a crucial role in kidney and lung organogenesis[J]. Development (Cambridge, England), 1996, 122(11): 3537-3547. DOI:10.1242/dev.122.11.3537 |
| [18] |
郭丽琴, 陈孝文, 刘华锋. 足细胞标志蛋白及足细胞疾病[J]. 中国中西医结合肾病杂志, 2008, 9(2): 173-176. GUO L Q, CHEN X W, LIU H F. Podocyte marker proteins and podocyte disease[J]. Chinese Journal of Integrated Traditional and Western Nephrology, 2008, 9(2): 173-176. DOI:10.3969/j.issn.1009-587X.2008.02.032 |
| [19] |
白璐, 陈志强, 陈永哲, 等. 化瘀通络中药对糖尿病肾病大鼠肾脏病理及肾脏TGF-β1/Smad信号通路的影响[J]. 时珍国医国药, 2020, 31(6): 1285-1288. BAI L, CHEN Z Q, CHEN Y Z, et al. Effect of Chinese Herbs for Stasis Removing and Collaterals Dredging upon pathology of kidney and TGF-β1/Smad signaling pathways in the Renal of Diabetic Nephropathy Rats[J]. Lishizhen Medicine and Materia Medica Research, 2020, 31(6): 1285-1288. DOI:10.3969/j.issn.1008-0805.2020.06.002 |
| [20] |
陈志强, 王春宁, 王月华, 等. 益气养阴消癥通络中药对Ⅲ期和Ⅳ期糖尿病肾病的临床疗效观察[J]. 中华中医药杂志, 2020, 35(2): 1018-1021. CHEN Z Q, WANG C N, WANG Y H, et al. Clinical observation on phase Ⅲ and Ⅳ diabetic nephropathy treated with Yiqi Yangyin Xiaozheng Tongluo Formula[J]. China Journal of Traditional Chinese Medicine and Pharmacy, 2020, 35(2): 1018-1021. |
| [21] |
魏洪波. 丹参注射液对早期糖尿病肾病炎症指标及血液流变学的影响[J]. 现代中西医结合杂志, 2016, 25(10): 1071-1073. WEI H B. Effect of Salvia miltiorrhiza injection on inflammatory index and blood rheology in early diabetic nephropathy[J]. Modern Journal of Integrated Traditional Chinese and Western Medicine, 2016, 25(10): 1071-1073. DOI:10.3969/j.issn.1008-8849.2016.10.015 |
| [22] |
王雪英, 王群元, 赵晓华, 等. 水蛭地龙注射液治疗糖尿病肾病血流变学的评价[J]. 中国中西医结合肾病杂志, 2002, 3(1): 47. WANG X Y, WANG Q Y, ZHAO X H, et al. Evaluation of Leech Tydragon Injection on the blood rheology of diabetic nephropathy[J]. Chinese Journal of Integrated Traditional and Western Nephrology, 2002, 3(1): 47. DOI:10.3969/j.issn.1009-587X.2002.01.022 |
| [23] |
李琳, 邓晓明, 王淑玲. 水蛭对糖尿病肾病大鼠尿白蛋白影响的机制研究[J]. 四川中医, 2012, 30(9): 48-49. LI L, DENG X M, WANG S L. Mechanistic investigation on the effect of leech to the urinary albumin of diabetes nephrosis rat[J]. Journal of Sichuan of Traditional Chinese Medicine, 2012, 30(9): 48-49. |
| [24] |
彭延古, 徐爱良, 黄莺, 等. 全蝎纯化液对静脉血栓形成大鼠纤溶和凝血系统的影响[J]. 中国中医药信息杂志, 2011, 18(3): 47-48. PENG Y G, XU A L, HUANG Y, et al. Effects of scorpion purified liquid on fibrinolysis system and coagulation system in rats with thrombosis[J]. Chinese Journal of Information on Traditional Chinese Medicine, 2011, 18(3): 47-48. |
2. Second Department of Nephrology, First Affiliated Hospital of Hebei University of Traditional Chinese Medicine, Shijiazhuang 050011, China
 2022, Vol. 39
2022, Vol. 39