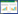文章信息
- 阙任烨, 戴彦成, 李勇, 周薏
- QUE Renye, DAI Yancheng, LI Yong, ZHOU Yi
- 白藜芦醇通过调控肝脏生物钟改善CCl4诱导的小鼠肝纤维化
- Resveratrol improves CCl4 induced liver fibrosis in mice by regulating liver circadian clock
- 天津中医药, 2022, 39(12): 1604-1610
- Tianjin Journal of Traditional Chinese Medicine, 2022, 39(12): 1604-1610
- http://dx.doi.org/10.11656/j.issn.1672-1519.2022.12.18
-
文章历史
- 收稿日期: 2022-09-18
2. 上海中医药大学附属市中医医院 脾胃病科,上海 200071
生物钟是自然界普遍存在的一种生命现象,它是机体一种内源性的调控系统,几乎存在于地球上所有生物中,是生物为适应环境周期性变化而长期演化出来的周期性变化的生理、生化和行为活动[1]。肝脏是人体重要的代谢器官,也是外周生物钟系统的重要组成部分,目前有研究表明肝脏生物钟紊乱可引起肝脏慢性炎症甚至肝纤维化的发生[2]。白藜芦醇是中药虎杖的有效成分之一,其具有显著保肝、抗肝纤维化作用,但其作用机制尚不完全明确。最新研究发现,白藜芦醇具有一定的调节生物钟基因表达的作用[3],可能是一种生物节律调节药物。本研究旨在研究生物钟基因在肝纤维化时的表达变化及白藜芦醇对生物钟基因是否具有调节作用。
1 实验材料与方法 1.1 实验动物雄性C57BL/6成年小鼠30只,体质量(18~22)g,购自上海市实验动物中心,动物合格证号:SCXK(沪)2017-0005,饲养于上海市中医医院无特异病原体(SPF)级动物房,恒温(25±2)℃、恒湿,人工光照12 h、黑暗12 h,自由进食饮水。本动物实验规程遵循:“实验动物关爱和使用指南。”
1.2 试剂四氯化碳(CCl4)生产批号:XW05623502,橄榄油购自国药集团化学试剂有限公司;白藜芦醇(纯度 > 99%)购自中国食品药品检定所(生产批号:20181201);苏木素-伊红染色液(P031IH)购于湖南艾佳生物科技股份有限公司,Masson染色液(G1340)、天狼星红染色液(G1471)购于北京雷根生物技术有限公司;辣根酶标记山羊抗鼠、兔IgG购自Cell signaling technology公司,α-平滑肌肌动蛋白(α-SMA)、I型胶原(COL-1)、Clock、芳香烃受体核转运样蛋白1(Bmal1)、周期基因1(Per1)、周期基因2(Per2)、隐花色素1(Cry1)、隐花色素2(Cry2)、β-actin抗体购自Abcam公司,电化学发光(ECL)试剂盒购自美国Millipore公司,生产批号:1115702;PCR引物购自上海生工生物工程有限公司,Trizol Reagent购自美国Sigma公司,生产批号:BCBN5665V;PrimeScriptTM RT Reagent Kit购自日本Takara公司,生产批号:AK2301;SYBRⓇ Green Realtime PCR Master Mix购自日本Takara公司,生产批号:AK5005。
1.3 药物配制依照CCl4与橄榄油1:5配制成20% CCl4油剂。白藜芦醇使用二甲基亚砜溶解配制成60 mg/mL原液,在药物干预前使用生理盐水来稀释至相应浓度[4]。
1.4 仪器快速研磨仪JXFSTPRP-48(上海净信实业发展有限公司),RM2016切片机(德国莱卡公司),生物组织摊烤片机YT-6C(亚光医用电子技术有限公司),防脱载玻片P031IH(湖南艾佳生物科技股份有限公司),鼓风干燥箱DHC-9070A(天津津立仪器设备科技发展有限公司),光学显微镜AE41(麦克奥迪实业集团有限公司),AU400型全自动生化分析仪(日本奥林巴斯公司),小型垂直电泳转印系统(美国Bio-rad公司),ChemiDocTMXRS+凝胶成像系统(美国Bio-rad公司),Neofuge 15R型台式高速冷冻离心机(中国Heal force公司),S1000 PCR仪、CFX 96 Touch实时荧光定量PCR仪(美国Bio-Rad公司)。
1.5 实验方法取30只雄性C57BL/6小鼠,随机分为正常组、模型组、白藜芦醇组,每组10只。模型组及白藜芦醇组按2.5 mL/kg腹腔注射体积分数为20% CCl4油剂溶液进行造模,每周2次,连续4周,对照组按同等剂量同等频次给予腹腔注射橄榄油。白藜芦醇以生理盐水稀释呈终浓度为30 mg/kg进行腹腔注射干预,每日1次,连续4周,对照组及模型组给予等量生理盐水按同等频次腹腔注射。所有小鼠在造模4周后处死,取血清、肝组织标本。血清标本用蛋白酶抑制剂处理,-20 ℃中保存备用;肝组织标本用含0.01%DEPC的生理盐水清洗后保存于-80 ℃中,部分标本用中性福尔马林固定12 h后经石蜡包埋,3~5 μm厚连续切片备检。
1.6 检测指标及方法 1.6.1 血清肝功能指标测定使用全自动生化分析仪检测各组小鼠血清丙氨酸氨基转移酶(ALT)、天门冬氨酸氨基转移酶(AST)、乳酸脱氢酶(LDH)水平。
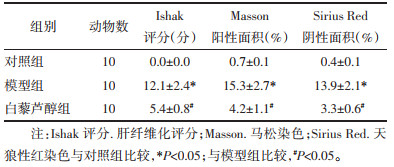
1.6.2 肝脏病理组织苏木精-伊红(HE)染色、马松(Masson)染色天狼星红(Sirius Red)染色观察取备检石蜡切片,经脱蜡、水化、染色、分化、透明、封片、镜检,分别观察各组切片肝脏病变严重程度,使用Ishak纤维化评分或ImagePro Plus软件对染色纤维化区域进行半定量分析评价肝纤维化程度。
1.6.3 免疫组织化学检测石蜡切片经脱蜡、水化,抗原修复冷却后,3% H2O2阻断内源性过氧化物酶的活性,血清封闭,孵育一抗、孵育二抗,DAB显色,苏木素复染、脱水、透明后封片、镜检,用ImagePro Plus软件对肝组织阳性表达面积进行半定量分析[5]。
1.6.4 蛋白质印迹法(Western blot)法检测取各组小鼠部分肝组织,裂解后提取蛋白,使用BCA蛋白试剂盒检测蛋白含量。以SDS-PAGE凝胶(5%浓缩胶,12%分离胶)进行电泳,分离蛋白,通过半干转法转移至PVDF膜,PVDF膜经5%的脱脂奶粉摇床上慢摇2 h封闭,分别与Clock、Bmal1、Per1、Per2、Cry1、Cry2、β-actin抗体4 ℃过夜,室温孵育二抗2 h,ECL光化学显色。最后应用Image J分析软件对扫描条带进行定量分析,计算各蛋白相对表达量。
1.6.5 实时聚合酶链反应(RT-PCR)检测[5]取小鼠肝组织加入Trizol研磨离心取上清,提取总RNA,Nanodrop 2000检测RNA的纯度和浓度,各组取2 μg总RNA,按20 μL总反应体积,反转录为cDNA,然后以cDNA为模板分别进行PCR扩增。Clock上游引物5'-GGCAAAATGTCATGAGCACTTA-3',下游引物5'-AGCCCTAACTTCTGCATAACTT-3';Bmal1上游引物5'-TGCCACCAATCCATACACAGAAGC-3',下游引物5'-ATCTTCCCTCGGTCACATCCTACG-3';Per1上游引物5'-CAGCTTTTTATTGAGTCTCGGG-3',下游引物5'-CAGTTGATCTGCTGGTAGGAG-3';Per2上游引物5'-CTTATTCACTGCCCGTGTTTC-3',下游引物5'-GGAAGGAATAACTGGGTAGCAT-3';Cry1上游引物5'-GACGCAGCTATTAAGAAACTGG-3',下游引物5'-TTTGCTGATGAGAGTCTGGAAT-3';Cry2上游引物5'-CTATGAGAGACCCCGAATGAAC-3',下游引物5'-CCGCTTCACCTTTTTATACAGG-3';β-actin上游引物5'-CTGTATGCCTCTGGTCGTAC-3',下游引物5'-TGATGTCACGCACGATTTCC-3'。采用三步法进行PCR扩增,反应结束后,得到各样本Ct值,然后利用2-△△Ct计算各组基因的相对表达量。
1.7 统计学方法实验结果采用SPSS 23.0软件进行数据分析。计量资料符合正态分布且方差齐,采用均数±标准差(x±s)表示,多组间比较采用单因素方差分析(One-way ANOVA),组间两两比较采用LSD检验,P < 0.05表示差异有统计学意义。
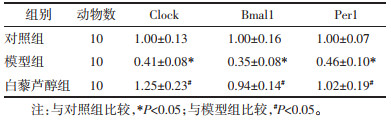
2 结果 2.1 各组小鼠血清肝功能指标水平与对照组比较,模型组小鼠血清ALT、AST、LDH水平均显著升高(均P < 0.05),而白藜芦醇干预后可显著降低肝纤维化小鼠血清ALT、AST、LDH水平,与模型组相比,差异具有统计学意义(P < 0.05)。见表 1。
|
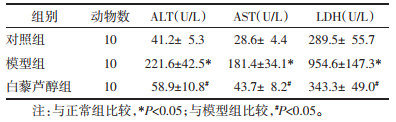
HE染色显示对照组肝细胞形态正常,汇管区无炎症细胞浸润,无脂肪浸润,肝小叶结构完整;CCl4组可见汇管区大量炎性细胞浸润、有脂肪空泡形成,纤维组织增生,肝小叶结构紊乱、有破坏,被沉积的胶原分割成大量假小叶。Res干预后纤维组织增生明显减少,肝组织少量炎症细胞,无明显脂肪浸润。见图 1A,表 2。
|
| 注:HE.苏木精-伊红染色;Masson.马松染色;Sirius Red.天狼星红染色。 图 1 各组小鼠肝脏病理组织HE、Masson、Sirius Red染色表现(×100) Fig. 1 HE, Masson and Sirius Red staining of liver pathological tissues of mice in each group (×100) |
|
Masson染色显示对照组肝组织结构清晰,肝细胞以肝小叶中央静脉为中心向四周放射状整齐排列,肝细胞无变性坏死,肝小叶结构清晰,肝小叶间未见明显纤维组织增生。CCl4组可见汇管区、中央静脉纤维组织增生明显,沿汇管区及中央静脉向外延伸,部分肝细胞脂肪样变,小叶结构紊乱,纤维条索粗大明显,互相连接,形成假小叶。Res干预后胶原纤维沉积明显减轻,细胞脂肪浸润不明显。见图 1B,表 2。
Sirius Red染色显示对照组肝细胞排列整齐,肝小叶清晰可见,未见明显胶原纤维。CCl4组在中央静脉壁和汇管区间有明显的胶原纤维沉积,以汇管区、中央静脉区为中心向肝实质衍生,沉积的胶原纤维沿增生的小胆管形成间隔,相互连接、包绕、分割,形成假小叶。Res干预后胶原沉积不明显,仅汇管区血管壁有少量胶原纤维(见图 1C,表 2)。
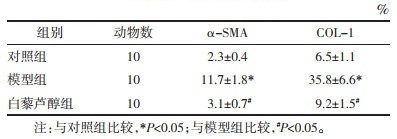
2.3 免疫组织化学检测免疫组化结果显示,模型组与对照组比较,肝组织α-SMA、COL-1阳性表达显著升高(P < 0.05),Res干预后肝组织α-SMA、COL-1阳性表达显著减少(P < 0.05)。见图 2,表 3。
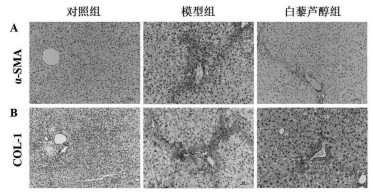
|
| 图 2 各组小鼠肝脏免疫组织化学检测α-SMA、COL-1表达(×400) Fig. 2 Expression of α-SMA and COL-1 in the liver of mice in each group by immunohistochemistry (×400) |
|
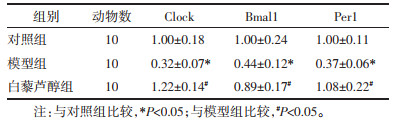
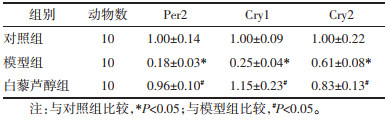
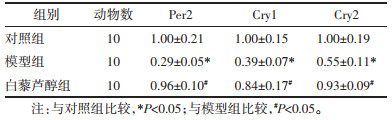
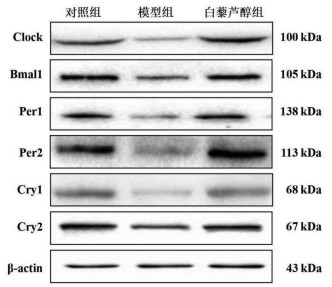
CCl4诱导的肝纤维化小鼠肝组织Clock、Bmal1、Per1、Per2、Cry1、Cry2 mRNA及蛋白表达较对照组显著下降(P < 0.05),而Res干预后可以显著增加Clock、Bmal1、Per1、Per2、Cry1、Cry2 mRNA及蛋白表达(P < 0.05)。见表 4-7,图 3。
|
|
|
|
|
| 图 3 各组小鼠生物钟基因蛋白表达条带 Fig. 3 Expression bands of circadian clock genes in mice in each group |
生物钟是自然界普遍存在的一种生命现象,它是机体一种内源性的调控系统,几乎存在于地球上的所有生物中,是生物为适应环境周期性变化而长期演化出来的周期性变化的生理、生化和行为活动[1]。研究发现人体主控钟位于下丘脑视交叉上核(SCN)的区域[6]。在外周组织器官中,如肝、肾、胰腺、骨骼肌、心肌等,也都存在各自的外周生物钟,它们通过生物钟基因表达变化而控制周期性节律振荡[7]。目前公认的生物钟基因有:Clock、Bmal1、Per1、Per2、Per3、Cry1、Cry2、Rev-erbα等,他们构成若干条转录-翻译反馈回路发挥生理功能。主控与外周生物钟协调控制内环境稳态、新陈代谢、免疫应答、神经反射、生长发育、衰老死亡等生命活动[8]。
目前研究发现,无论是主控生物钟亦或是外周生物钟任何一个环节的失调均可导致疾病的发生发展,例如流行病学研究显示由于昼夜节律紊乱(主控钟紊乱)的人群(如时差旅行、轮班工作等),其肿瘤、神经疾病、免疫疾病、内分泌疾病、消化疾病以及心血管疾病等的风险较正常增加[9]。近期发表于British Medical Journal,The Journal of the American Mdical assiciation等杂志[10-14]的文献表明轮班工作会打乱昼夜节律,导致2型糖尿病、高血压、冠心病等心血管事件的发生风险增高,更有甚者可能提高乳腺癌、结肠癌的发病率。而外周生物钟紊乱亦会导致相应脏器发生疾病。如近期的一些研究发现通过特定的条件如基因干扰、基因敲除靶向器官生物钟基因,可引起动物心、肺、肾、胰腺等脏器发生炎症、损伤,随着时间的延长,甚至会出现相应脏器的纤维化发生[15-17]。综上所述,无论是主控钟的紊乱,亦或是外周生物钟紊乱都有可能导致某些疾病的发生,而主控钟与外周生物钟也可相互影响,共同调节机体的生理病理过程。
肝脏是人体重要的代谢器官,也是外周生物钟系统的重要组成部分,与其他外周生物钟一样,肝脏生物钟具有高度的自主性(autonomous)和自我稳定性(self-sustained),同时受到SCN中枢的整合与调控[18]。肝脏生物钟是由输入通路(input)、中央振荡器(cen-traloscillator)和输出通路(output)3部分组成的。输入通路将感受到的外界变化信息传递给中央振荡器,在后者整合以后,经输出通路输送给肝脏,使之表现出昼夜节律性。其中,中央振荡器的反馈调节环路是生物钟基因昼夜节律性表达的主要调节途径。在分子水平上,它由两个调节环组成[19],在第1个调节环(Core Loop)中,转录激活因子Bmal1和Clock在细胞质中形成异源二聚体入核,结合在靶基因Per和Cry的启动子E-box序列上,启动转录。Cry蛋白在胞浆中的积累一旦到达极限,就约束Per蛋白,彼此结合形成稳定的复合物,重新入核结合在Bmal1和Clock的二聚体上,抑制它们的转录活性,从而导致细胞中Per和Cry的蛋白合成减少,如此循环,形成生物钟分子的振荡表达。第2个调节环(Stablizing Loop)是有关于Bmal1的表达,Bmal1和Clock二聚体能够与孤儿核激素受体(Rev-erbα)和视黄酸受体相关孤儿受体α(RORα)基因的启动子E-box结合,Rev-erbα和RORα又能够竞争性结合在Bmal1启动子的RRE位点,其中RORα能激活Bmal1的表达,而Rev-erbα则抑制Bmal1的表达。
肝脏生物钟的紊乱参与了肝炎、脂肪性肝病、肝纤维化、肝硬化以及肝癌等疾病的发生发展。有研究表明,Per1/2、Bmal1基因敲除小鼠所引起的肝脏生物钟紊乱会出现糖脂代谢异常,肝功能损伤,随之而来的是肝肿大、胆管增生、慢性肝脏炎症、肝细胞死亡以及肝纤维化[2],这一结果提示肝脏生物钟紊乱可引起肝脏慢性炎症甚至肝纤维化的发生。另外,有研究者发现在四氯化碳诱导的肝纤维化小鼠模型,及体外培养的肝星状细胞活化模型中,生物钟基因Clock、Bmal1、Per1、Per2、Per3、Cry1、Cry2等基因表达中位值及振幅显著降低[20-21],这些研究结果提示外源性输入刺激引起的慢性肝脏炎症可引起肝脏生物钟发生紊乱,进而促进疾病的进展。而通过外源性给予生物钟调节药物,如使用外源性褪黑素(褪黑素是钟基因RORα的天然配体,可有效诱导RORα表达升高)干预CCl4构建的肝纤维化小鼠模型,可以干预肝脏生物钟的基因表达,进而发挥抗纤维化的作用[20];又如给予外源性Rev-erbα激活剂SR9009亦可通过维持肝脏生物钟节律平衡改善或逆转肝纤维化进程[22]。因此,综合以上文献结果可以看出肝纤维化进展中存在肝脏生物钟基因表达的改变,肝脏生物节律发生变化又可进一步促进肝纤维化发生发展,而通过药物调整生物钟是一种潜在的治疗肝纤维化的新策略。
中医历来强调人体生理病理活动和自然界的变化息息相关。中医理论的“阴阳学说”中,阴阳消长节律从宏观概括了人体生理节律性变化的规律。“子午流注学说”更是强调天人合一,认为人是自然的一部分,外界环境的变化会影响人内环境的变化,中医的理念无不体现时间变化影响生物节律。中医药是中华文明的伟大宝库,从丰富的中药资源中筛选中药中的有效成分,寻找能够调控生物节律的药物,是具有中医特色的一个重要的研究领域。目前研究发现,一些中药方剂如加味四逆散、乌龙丹、生慧汤等,中药单药如合欢花、刺五加、五味子、黑水缬草等,中药提取物或单体如β-细辛醚、齐墩果酸、蛇床子素、海参皂苷、白藜芦醇等均具有调节生物钟环路中某些基因表达的作用,展现出中医药调控生物钟紊乱的可能性及潜在价值[23]。
最新研究发现中药虎杖的主要有效成分之一,白藜芦醇具有调控生物节律的功能。例如白藜芦醇可通过靶向调控生物钟基因Bmal1、Cry1抑制丙烯酰胺诱导肝细胞线粒体功能障碍和炎症反应[24]。另外又有研究发现白藜芦醇可逆转棕榈酸酯对Bmal1-Clock相互作用和时钟基因表达的抑制作用,纠正肝细胞中昼夜节律的振荡,发挥保护肝细胞的作用[25],提示白藜芦醇可能是一种潜在的生物节律调节药物。为此,本项目拟在CCl4诱导的肝纤维化小鼠模型中,观察肝脏生物钟基因表达变化,并使用白藜芦醇进行干预,观察白藜芦醇的抗肝纤维化作用是否与调节肝脏生物钟有关。结果表明,较之对照组,模型组小鼠肝功能指标如ALT、AST、LDH等均显著升高;病理切片HE染色提示模型组汇管区纤维组织增生,肝小叶间胆管明显增生,部分分割包绕肝小叶使其结构紊乱,Masson染色及天狼星红染色提示模型组汇管区胶原沉积显著增多,免疫组化显示α-SMA、COL-1阳性面积显著增多;RT-PCR及Western blot结果显示肝脏生物钟基因Clock、Bmal1、Per1、Per2、Cry1、Cry2的mRNA及蛋白表达均显著下降。白藜芦醇干预后可显著逆转上述指标变化。这些结果提示白藜芦醇的抗肝纤维化作用可能与调控肝脏生物钟有关。
综上所述,本文研究结果不仅对白藜芦醇的保肝抗肝纤维化药理机制及靶点提出全新的研究方向,更为白藜芦醇的药物临床转化及为其他生物钟紊乱相关疾病的治疗提出一种新的治疗方案,也可为进一步发掘新的具有调节生物钟紊乱的中药新药提供一定的研究思路及方法。另外,对中医学“子午流注”学术思想的探讨奠定了一定的实验基础,也符合当今“精准医疗”的趋势。但下一步仍需研究生物钟基因表达变化是如何引起或加重肝纤维化以及白藜芦醇调控肝脏生物钟的具体效应靶点。
| [1] |
YU Q. Biological clock: The oscillator of gene expression[J]. Science China Life Sciences, 2018, 61(1): 128-130. DOI:10.1007/s11427-017-9239-6 |
| [2] |
KETTNER N M, VOICU H, FINEGOLD M J, et al. Circadian homeostasis of liver metabolism suppresses hepatocarcinogenesis[J]. Cancer Cell, 2016, 30(6): 909-924. DOI:10.1016/j.ccell.2016.10.007 |
| [3] |
WANG Y L, LYU D J, LIU W W, et al. Disruption of the circadian clock alters antioxidative defense via the SIRT1-BMAL1 pathway in 6-OHDA-induced models of Parkinson's disease[J]. Oxidative Medi- cine and Cellular Longevity, 2018, 2018(11): 4854732. |
| [4] |
周薏, 阙任烨, 李勇, 等. 白藜芦醇对急性肝损伤小鼠NLRP3炎性体表达的影响[J]. 世界临床药物, 2020, 41(2): 104-110, 142. ZHOU Y, QUE R Y, LI Y, et al. The effects of resveratrol on NLRP3 inflammasome expression in a mouse model of acute liver injury[J]. World Clinical Drugs, 2020, 41(2): 104-110, 142. DOI:10.13683/j.wph.2020.02.006 |
| [5] |
周蒙恩, 陈懿榕, 张娜, 等. NLRP3炎性体在胆总管结扎诱导的肝纤维化大鼠模型中的表达特点[J]. 临床肝胆病杂志, 2021, 37(9): 2102-2108. ZHOU M E, CHEN Y R, ZHANG N, et al. Expression of NLRP3 inflammatory body in a rat model of liver fibrosis induced by common bile duct ligation[J]. Journal of Clinical Hepatology, 2021, 37(9): 2102-2108. DOI:10.3969/j.issn.1001-5256.2021.09.020 |
| [6] |
BROOKS J F 2nd, HOOPER L V. Interactions among microbes, the immune system, and the circadian clock[J]. Seminars in Immunopathology, 2020, 42(6): 697-708. DOI:10.1007/s00281-020-00820-1 |
| [7] |
RICHARDS J, GUMZ M L. Advances in understanding the peripheral circadian clocks[J]. The FASEB Journal, 2012, 26(9): 3602-3613. DOI:10.1096/fj.12-203554 |
| [8] |
SINTUREL F, PETRENKO V, DIBNER C. Circadian clocks make metabolism Run[J]. Journal of Molecular Biology, 2020, 432(12): 3680-3699. DOI:10.1016/j.jmb.2020.01.018 |
| [9] |
SULLI G, MANOOGIAN E N C, TAUB P R, et al. Training the circadian clock, clocking the drugs, and drugging the clock to prevent, manage, and treat chronic diseases[J]. Trends in Pharmacological Sciences, 2018, 39(9): 812-827. DOI:10.1016/j.tips.2018.07.003 |
| [10] |
SHAN Z L, LI Y P, ZONG G, et al. Rotating night shift work and adherence to unhealthy lifestyle in predicting risk of type 2 diabetes: results from two large US cohorts of female nurses[J]. BMJ (Clinical Research Ed), 2018, 363(3): k4641. |
| [11] |
FERGUSON J M, COSTELLO S, NEOPHYTOU A M, et al. Night and rotational work exposure within the last 12 months and risk of incident hypertension[J]. Scandinavian Journal of Work, Environment & Health, 2019, 45(3): 256-266. |
| [12] |
VETTER C, DEVORE E E, WEGRZYN L R, et al. Association between rotating night shift work and risk of coronary heart disease among women[J]. The Journal of the American Medical Association, 2016, 315(16): 1726-1734. DOI:10.1001/jama.2016.4454 |
| [13] |
WEGRZYN L R, TAMIMI R M, ROSNER B A, et al. Rotating night-shift work and the risk of breast cancer in the nurses' health studies[J]. American Journal of Epidemiology, 2017, 186(5): 532-540. DOI:10.1093/aje/kwx140 |
| [14] |
PAPANTONIOU K, DEVORE E E, MASSA J, et al. Rotating night shift work and colorectal cancer risk in the nurses' health studies[J]. International Journal of Cancer, 2018, 143(11): 2709-2717. DOI:10.1002/ijc.31655 |
| [15] |
FLETCHER E K, MORGAN J, KENNAWAY D R, et al. Deoxycorticosterone/salt-mediated cardiac inflammation and fibrosis are dependent on functional CLOCK signaling in male mice[J]. Endocrinology, 2017, 158(9): 2906-2917. DOI:10.1210/en.2016-1911 |
| [16] |
CUNNINGHAM P S, MEIJER P, NAZGIEWICZ A, et al. The circadian clock protein REVERBα inhibits pulmonary fibrosis development[J]. PNAS, 2020, 117(2): 1139-1147. DOI:10.1073/pnas.1912109117 |
| [17] |
CHEN W D, YEH J K, PENG M T, et al. Circadian CLOCK mediates activation of transforming growth factor-β signaling and renal fibrosis through cyclooxygenase 2[J]. The American Journal of Pathology, 2015, 185(12): 3152-3163. DOI:10.1016/j.ajpath.2015.08.003 |
| [18] |
MCCOMMIS K S, BUTLER A A. The importance of keeping time in the liver[J]. Endocrinology, 2020, 162(2): bqaa230. |
| [19] |
FARSHADI E, VAN DER HORST G T J, CHAVES I. Molecular links between the circadian clock and the cell cycle[J]. Journal of Molecular Biology, 2020, 432(12): 3515-3524. DOI:10.1016/j.jmb.2020.04.003 |
| [20] |
GONZÁLEZ-FERNÁNDEZ B, SÁNCHEZ D I, CRESPO I, et al. Melatonin attenuates dysregulation of the circadian clock pathway in mice with CCl4-induced fibrosis and human hepatic stellate cells[J]. Frontiers in Pharmacology, 2018, 9(1): 556. |
| [21] |
HU C X, ZHAO L F, TAO J J, et al. Protective role of melatonin in early-stage and end-stage liver cirrhosis[J]. Journal of Cellular and Molecular Medicine, 2019, 23(11): 7151-7162. DOI:10.1111/jcmm.14634 |
| [22] |
THOMES P G, BRANDON-WARNER E, LI T, et al. Rev-erb agonist and TGF-β similarly affect autophagy but differentially regulate hepatic stellate cell fibrogenic phenotype[J]. The International Journal of Biochemistry & Cell Biology, 2016, 81(Partt A): 137-147. |
| [23] |
李欢, 徐尚福, 刘杰. 生物钟基因: 中药作用的新靶点[J]. 中华中医药杂志, 2017, 32(12): 5464-5467. LI H, XU S F, LIU J. Circadian clock genes: New targets of traditional Chinese medicine[J]. China Journal of Traditional Chinese Medicine and Pharmacy, 2017, 32(12): 5464-5467. |
| [24] |
TAN X T, LI L, WANG J, et al. Resveratrol prevents acrylamide-induced mitochondrial dysfunction and inflammatory responses via targeting circadian regulator Bmal1 and Cry1 in hepatocytes[J]. Journal of Agricultural and Food Chemistry, 2019, 67(31): 8510-8519. DOI:10.1021/acs.jafc.9b03368 |
| [25] |
TONG X, ZHANG D Q, ARTHURS B, et al. Palmitate inhibits SIRT1-dependent BMAL1/CLOCK interaction and disrupts circadian gene oscillations in hepatocytes[J]. PLoS One, 2015, 10(6): e0130047. DOI:10.1371/journal.pone.0130047 |
2. Department of Gastroenterology, Shanghai Municipal Hospital of Traditional Chinese Medicine Affiliated to Shanghai University of Traditional Chinese Medicine, Shanghai 200071, China
 2022, Vol. 39
2022, Vol. 39