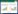文章信息
- 赵晰, 张笑恬, 李蔓, 王耀光
- ZHAO Xi, ZHANG Xiaotian, LI Man, WANG Yaoguang
- 扶肾方对UUO大鼠肾脏病理及CTGF、FN、Vimentin表达的影响
- Effect of Fushen Decoction on the expression of CTGF, FN and Vimentin proteins in renal tissues of UUO rats
- 天津中医药, 2022, 39(2): 232-237
- Tianjin Journal of Traditional Chinese Medicine, 2022, 39(2): 232-237
- http://dx.doi.org/10.11656/j.issn.1672-1519.2022.02.22
-
文章历史
- 收稿日期: 2021-11-20
2. 天津市北辰区中医医院, 天津 300400
肾间质纤维化(RIF)是各种慢性肾脏疾病进展为终末期肾功能衰竭共同的病变过程。RIF是一个缓慢的动态变化过程,涉及到各种细胞因子的释放、炎症细胞的浸润、肾小管上皮细胞-间充质细胞转分化(EMT)、肾小管上皮细胞的凋亡、细胞外基质(ECM)的过度沉积及降解失衡等因素[1-2]。EMT是RIF的关键致病机制,虽然目前大量研究已证实EMT是一个复杂有序且有机统一的细胞生物学过程,但目前关于EMT形成的关键机制仍未完全阐明[3]。研究证实结缔组织生长因子(CTGF)能在肾脏纤维化中起着非常重要的作用,纤连蛋白(FN)对肾脏的作用包括参与RIF的进程,维持ECM的形态稳定,介导细胞增殖、分化与黏附、移动,因而CTGF、FN可作为治疗RIF的靶点[4-6]。EMT是有序渐进的过程,首先上皮细胞紧密连接被破坏、细胞结构微丝蛋白重构,继而上皮表型标志紧密连接蛋白(ZO-1)表达减少,间充质表型标志波形蛋白(Vimentin)表达增加,Vimentin表达增高、上皮完整性破坏,是EMT过程的早期事件,因此检测Vimentin可以了解EMT的进程[7-8]。
扶肾方是在探究经典著作与总结临床经验的基础上,历经十余年发展衍化而成的具有确切疗效的中药复方,本课题前期研究显示,扶肾方可降低腹膜透析患者证候积分、改善腹膜透析效能,保护残肾功能[9-10]。基于此,本研究旨在探讨扶肾方对单侧输尿管梗阻(UUO)大鼠肾组织CTGF、FN、Vimentin表达的影响,阐明扶肾方延缓肾间质纤维化的机制,为中医药临床防治肾纤维化提供实验依据。
1 材料与方法 1.1 实验材料 1.1.1 实验动物与分组50只SPF级雄性健康SD大鼠,体质量200~220 g,购自北京维通利华实验动物技术有限公司,许可证号SCXK(京)2014-0004。饲养于中国医学科学院放射医学研究所,实验期间自由饮水、摄食,室内温度控制在20~24 ℃,通风,湿度良好,每周换2次垫料。大鼠适应性饲养1周后,按照随机原则将大鼠分为假手术组(12只)与造模组(38只),造模组在手术后7 d随机选取大鼠2只以验证造模是否成功,余造模组大鼠随机分为模型组(12只)、中药低、高剂量组(各12只)。
1.1.2 主要试剂CTGF抗体购于Proteintech公司,兔多克隆抗体FN(FN Rabbit Polyclonal antibody)和Vimentin抗体购自Abcam公司,BCA蛋白浓度测定试剂盒(BCA Protein Assay Kit)购自博士德公司。
1.1.3 实验药物扶肾方(组成为:黄芪15 g,当归10 g,仙灵脾15 g,陈皮15 g,半夏15 g,丹参30 g,熟大黄10 g,鬼箭羽30 g)中药材购自天津中医药大学第一附属医院,并委托其药物研究院进行煎煮、浓缩至5.04 g生药/mL药液,无菌装瓶密封,于4 ℃冰箱保存备用。
1.2 实验方法 1.2.1 UUO模型的建立及给药方法用10% 水合氯醛(3 mL/kg)腹腔注射麻醉大鼠,在腹部正中偏左依次切开剥离左肾和输尿管,用4-0缝合线结扎输尿管2道(近肾盂段及远端),假手术组仅游离输尿管,后用3-0缝合线按顺序缝合腹壁组织关闭腹腔。造模1周后所有大鼠均按照每只每日2 mL进行灌胃,中药高剂量组、低剂量组分别灌服高浓度(5.04 g/mL,相当于70 kg体质量成人单位剂量的4倍)药物、低浓度(2.52 g/mL)药物,假手术组与模型组灌服生理盐水。
1.2.2 标本采集术后7 d随机抽取2只造模大鼠;术后14、28 d每组随机抽取6只大鼠。颈椎脱臼处死大鼠,取出左肾,其中一部分置于4%多聚甲醛中以供光镜标本制作,一部分置于戊二醛电镜固定液中以供电镜标本制作。另一部分剪碎后放入冻存管中,置于-80 ℃冰箱中速冻,用于蛋白免疫印迹(Western Blot)检测。
1.2.3 肾组织病理学变化的观察取出固定的肾组织,按常规方法制作石蜡包埋,组织切片,分别进行苏木精-伊红(HE)染色和马松(Masson)染色。取另一固定的肾组织脱水30 min,环氧树脂包埋,切片后予双重染色,进行电镜观察。
1.2.4 Western Blot实验制备匀浆离心后,取上清按照蛋白浓度检测试剂盒的说明操作。用已获的各组蛋白质按照常规操作方法进行电泳、转膜、分别加入用一抗稀释液稀释后的一抗[甘油醛-3-磷酸脱氢酶(GAPDH)1∶2 000、CTGF 1∶125、FN 1∶10 000、Vimentin 1∶1 000],摇床摇动30 min,4 ℃孵育过夜,洗涤缓冲液,再加入用二抗稀释液稀释后的二抗(1∶20 000)孵育1 h,并洗涤缓冲液,后用增强型化学发光试剂(ECL)显色。应用Image J软件测定每一个目的条带及相应内参(用GAPDH作为内参照)的灰度值(目的蛋白的相对表达量=目的条带灰度值/内参灰度值)。
1.3 统计学方法得出的数据资料均利用SPSS 24.0统计分析软件进行分析,计量资料以均数±标准差(x±s)表示,各组数据比较前先进行正态性及方差齐性检验。多组间差异比较采用单因素方差分析(One-Way ANOVA),组间两两比较时若方差齐时采用LSD检验,方差不齐时采用Dunnett's T3检验。P < 0.05为差异有统计学意义。
2 结果 2.1 光镜(HE染色)HE染色细胞核呈蓝色;细胞浆、基底膜、胶原纤维及肌纤维呈红色。假手术组:肾小球大小形态完整,染色均匀;肾小管结构正常、清晰,未见肾小管扩张、萎缩,肾小管间呈“背靠背”状,小管间隙无增宽;肾间质正常,未见明显炎症细胞浸润,无纤维化改变。模型组:术后7 d,部分肾小管扩张,管腔内散在蛋白管型、炎症细胞、变性和脱落的上皮细胞;肾间质水肿,有炎症细胞呈灶性浸润。术后14 d,肾小球结构基本正常;肾皮质变薄,皮髓质不清;肾小管明显扩张,部分肾小管出现萎缩、坏死、消失,蛋白管型较前增多;肾间质水肿加重,以远端肾小管病变较为明显,间质增宽,可见大量炎症细胞浸润,细胞增殖明显,纤维细胞和胶原纤维明显增多,肾间质纤维化。术后28 d,肾小球大小、形态未见明显异常,数量减少;肾皮质较前显著变薄;肾小管萎缩、坏死、消失明显;间质内炎细胞浸润,肾间质纤维化程度进一步加重。中药低、高剂量组,肾组织病变较模型组减轻。见图 1。
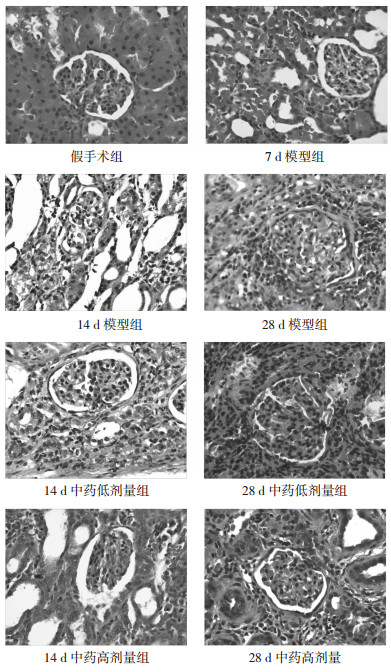
|
| 图 1 光镜下HE染色各组肾组织病理学变化(×400) Fig. 1 Histopathological changes of each group with HE staining under light microscope (×400) |
基底膜、细胞外基质、胶原呈绿色或蓝色;肾内的一些特殊蛋白物质包括抗原抗体复合物呈红色。模型组:模型组可见到大量的蓝色胶原纤维,沿肾间质区域相互交织呈网状分布,并且随着梗阻时间的延长,蓝色胶原纤维呈现明显增多的趋势。中药低、高剂量组:术后14、28 d肾组织间质内蓝染胶原面积较模型组减少,胶原沉积均有不同程度的减轻。见图 2。
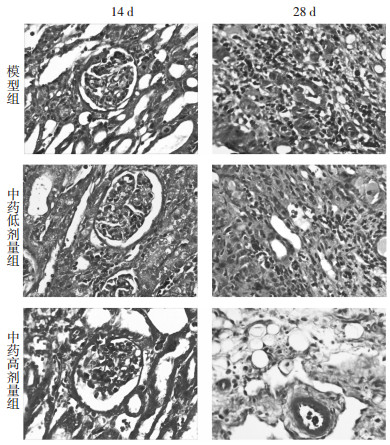
|
| 图 2 光镜下Masson染色各组肾组织病理学变化(×400) Fig. 2 Histopathological changes of each group with Masson staining under light microscope (×400) |
模型组:术后14 d相邻肾小管间隙明显增宽,基底膜厚薄不均,局部断裂;管腔直径扩大,肾小管上皮细胞绒毛稀疏、大部分脱落;上皮细胞胞浆内线粒体数量减少,大部分线粒体肿胀,线粒体嵴消失;细胞间隙增宽,间质水肿,巨噬细胞数量增多。与术后14 d相比,术后28 d肾小管上皮细胞绒毛基本脱落,残存少量绒毛;上皮细胞溶解坏死、胞浆内细胞器基本消失、残存少量肿胀的线粒体。
中药低剂量组:术后14 d相邻肾小管间隙明显增宽,基底膜厚薄不均;肾小管上皮细胞绒毛基本脱落,残存少量绒毛;肾小管上皮细胞溶解坏死、胞浆内细胞器基本消失、残存少量肿胀的线粒体;细胞间隙增宽,间质水肿,巨噬细胞数量与正常组相比稍增多。术后28 d相邻肾小管间隙增宽,基底膜未见明显病变;有的肾小管上皮细胞绒毛脱落,残存少量绒毛,有的肾小管上皮细胞绒毛排列整齐、完整,但密度减少,稀疏;肾小管上皮细胞萎缩,间隙增宽,胞浆内线粒体比正常组减少,部分线粒体肿胀,胞浆内可见空泡。
中药高剂量组:术后14 d相邻肾小管间隙增宽明显,基底膜部分消失;有的肾小管萎缩明显,绒毛完全脱落,有的肾小管上皮变的极不规则;肾小管上皮细胞胞浆内线粒体数量减少,线粒体肿胀,线粒体嵴肿胀、稀疏;间质水肿明显,巨噬细胞数量明显增多。术后28 d相邻肾小管间隙增增宽明显,基底膜不规则,部分消失;有的肾小管萎缩明显,绒毛完全脱落,有的肾小管上皮变的极不规则;肾小管上皮细胞胞浆内线粒体数量减少,线粒体肿胀,线粒体嵴肿胀、稀疏,可见大量空泡。见图 3。
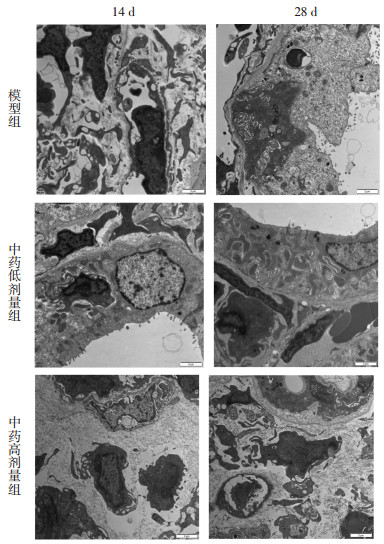
|
| 图 3 电镜各组肾组织病理学变化(EM×6 000) Fig. 3 Histopathological changes of kidney in each group under electron microscope (EM×6 000) |
术后14 d,与假手术组相比,模型组、中药低剂量组、高剂量组值升高(P < 0.05);与模型组相比,中药低剂量组值降低(P < 0.05),差异均具有统计学意义。术后28 d,与假手术组相比,模型组、中药低剂量组、高剂量组值升高(P < 0.05),差异具有统计学意义。与模型组相比,中药低剂量组、高剂量组值降低(P < 0.05);与中药低剂量组相比,高剂量组值降低(P < 0.05),差异均具有统计学意义。见表 1。
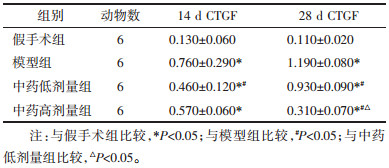
术后14 d,与假手术组相比,模型组、中药低剂量组、高剂量组值升高(P < 0.05),差异具有统计学意义。术后28 d,与假手术组相比,模型组、中药低剂量组、高剂量组值升高(P < 0.05);与模型组相比,中药高剂量组值降低(P < 0.05),差异均具有统计学意义。与中药低剂量组相比,中药高剂量组值降低(P < 0.05),差异具有统计学意义。见表 2。
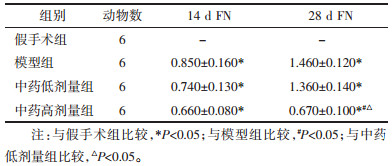
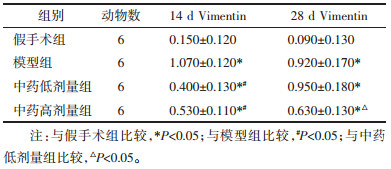
术后14 d,与假手术组相比,模型组、中药低剂量组、高剂量组值升高(P < 0.05);与模型组相比,中药低剂量组、高剂量组值降低(P < 0.05),差异均具有统计学意义。术后28 d,与假手术组相比,模型组、中药低剂量组、高剂量组值升高(P < 0.05);与中药低剂量组相比,高剂量组值降低(P < 0.05),差异均具有统计学意义。见表 3、图 4、图 5。
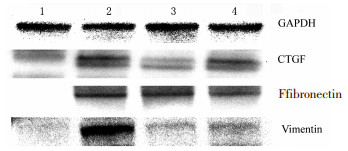
|
| 注:1.假手术组;2.模型组;3.中药低剂量组;4.中药高剂量组。 图 4 14 d时各组目的蛋白表达水平 Fig. 4 Target protein expression levels of each group on day 14 |
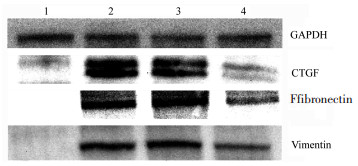
|
| 注:1.假手术组;2.模型组;3.中药低剂量组;4.中药高剂量组。 图 5 28 d时各组目的蛋白表达水平 Fig. 5 The protein expression levels of each group on day 28 |
RIF是肾脏疾病最重要的病理特点之一,研究证实RIF的程度与肾功能的相关性比肾小球硬化与肾功能的相关性更为密切,是反映肾功能下降严重程度和判断预后的最重要的可靠指标,所以对肾间质纤维化发病机制及治疗的研究是目前多数学者共同关注的问题[11-13]。UUO模型是研究RIF、EMT和评价治疗效果最常用的动物模型[14]。
EMT是肾间质纤维化进展的核心过程,研究证据表明,转化生长因子β1(TGF-β1)被认为EMT的重要调节剂,它通过激活下游Smad信号通路而增加各种促纤维因子的表达,诱导EMT发生[15]。EMT发生时表达上调的蛋白质包括α-平滑肌肌动蛋白(α-SMA)、Vimentin、纤维粘连蛋白(Fibronectin)、胶原蛋白Ⅰ型(CollagenⅠ)、胶原蛋白Ⅳ型(CollagenⅣ)、基质金属蛋白酶(MMP)-2、MMP-9等,表达下降蛋白包括E-钙黏蛋白(E-cadherin)等[16]。
研究证实CTGF能刺激EMT发生,刺激FN、胶原、层粘连蛋白、整合素等ECM成分合成,在肾脏纤维化中起着非常重要的作用[17-18]。本实验结果显示,14 d时,扶肾方低剂量组可以下调CTGF蛋白的表达量;28 d时扶肾方低、高剂量组均可以下调CTGF蛋白的表达量,且高剂量组效果更好。
FN是一种具有较强细胞黏附活性的高分子糖蛋白,是ECM的主要成分,当细胞、组织受损发生应激反应或炎症时,肾脏组织、细胞FN的表达量明显增加而形成积聚,它也随着IV胶原蛋白及其他ECM继续分泌、增殖而积聚,始终参与RIF的进程[19-20]。实验结果显示,28 d时,扶肾方高剂量组可以下调FN的表达量。
Vimentin是一种重要的细胞骨架蛋白,在28 d高剂量组下调更为显著,提示扶肾方可以通过影响Vimentin的表达而治疗肾间质纤维化,且效果与剂量呈正相关。
肾间质纤维化是西医病理名词,其总的病机为本虚标实,本虚为肾及相关脏腑的气血阴阳亏虚,标实为外邪、湿浊、湿热、水饮、瘀血、浊毒等。扶肾方中黄芪、当归、仙灵脾补益脾肾、益气养血,为君药,体现为“补”;陈皮、半夏和中降浊,为臣药,体现为“和”;熟大黄、丹参、鬼箭羽活血化瘀、泻浊解毒,为佐使药,体现为“消”,诸药合用,既能补脾肾等脏之不足,又能清除体内的湿浊、瘀血等病邪,标本兼治。本研究发现,扶肾方干预后,大鼠肾脏肾纤维化病理损伤明显减轻,且中药低剂量组和中药高剂量组CTGF、FN、Vimentin明显下调。
综上所述,扶肾方治疗肾间质纤维化可能与CTGF、Vimentin、FN的表达有关。其机制可能为抑制上皮细胞转分化及细胞外基质沉积。本研究为临床上扶肾方延缓肾间质纤维化的进程提供新的可靠的实验依据。
| [1] |
LI J, QU X, BERTRAM J F. Endothelial-myofibroblast transition contributes to the early development of diabetic renal interstitial fibrosis in streptozotocin-induced diabetic mice[J]. American Journal of Pathology, 2009, 175(4): 1380-1388. DOI:10.2353/ajpath.2009.090096 |
| [2] |
KASINATH B S, FELIERS D. The complex world of kidney microRNAs[J]. Kidney International, 2011, 80(4): 334-337. DOI:10.1038/ki.2011.165 |
| [3] |
GRANDE M T, LÓPEZ-NOVOA J M. Fibroblast activation and myofibroblast generation in obstructive nephropathy[J]. Nature Reviews Nephrology, 2009, 5(6): 319-328. DOI:10.1038/nrneph.2009.74 |
| [4] |
LI J, BERTRAM J F. Review: endothelial-myofibroblast transition, a new player in diabetic renal fibrosis[J]. Nephrology (Carlton), 2010, 15(5): 507-512. DOI:10.1111/j.1440-1797.2010.01319.x |
| [5] |
LAMOUILLE S, XU J, DERYNCK R. Molecular mechanisms of epithelial-mesenchymal transition[J]. Nature Reviews Molecular Cell Biology, 2014, 15(3): 178-196. |
| [6] |
HU C, SUN L, XIAO L, et al. Insights into the mechanisms involved in the expression and regulation of extracellular matrix proteins in diabetic nephropathy[J]. Current Medicinal Chemistry, 2015, 22(24): 2858-2870. DOI:10.2174/0929867322666150625095407 |
| [7] |
WANG Z, DIVANYAN A, JOURD'HEUIL F L, et al. Vimentin expression is required for the development of EMT-related renal fibrosis following unilateral ureteral obstruction in mice[J]. American Journal of Physiology-Renal Physiology, 2018, 315(4): F769-F780. DOI:10.1152/ajprenal.00340.2017 |
| [8] |
PEERAPEN P, THONGBOONKERD V. Protective roles of trigone- lline against oxalate-induced epithelial-to-mesenchymal transition in renal tubular epithelial cells: an in vitro study[J]. Food and Chemical Toxicology, 2020, 135: 110915. DOI:10.1016/j.fct.2019.110915 |
| [9] |
杨洪涛, 鲁盈, 邓跃毅, 等. 扶肾颗粒辨证干预腹膜透析患者的多中心临床研究[J]. 中国中西医结合肾病杂志, 2012, 13(5): 410-412. YANG H T, LU Y, DENG Y Y, et al. A multicentre clinical study on Fushen granules in the dialectical treatment of peritoneal dialysis patients[J]. Chinese Journal of Integrated Traditional and Western Nephrology, 2012, 13(5): 410-412. DOI:10.3969/j.issn.1009-587X.2012.05.011 |
| [10] |
唐阁, 杨洪涛, 林燕, 等. 扶肾颗粒改善腹膜超滤功能的分子机制[J]. 中国实验方剂学杂志, 2017, 23(23): 103-108. TANG G, YANG H T, LIN Y, et al. Molecule mechanism of Fushen granules in improving peritoneal ultrafiltration function[J]. Chinese Journal of Experimental Traditional Medical Formulae, 2017, 23(23): 103-108. |
| [11] |
MIYAZAWA K, SHINOZAKI M, HARA T, et al. Two major Smad pathways in TGF-beta superfamily signalling[J]. Genes Cells, 2002, 7(12): 1191-1204. DOI:10.1046/j.1365-2443.2002.00599.x |
| [12] |
朱可可, 杨波. 肾间质纤维化发病机制研究进展[J]. 广东医学, 2015, 36(2): 324-326. ZHU K K, YANG B. Progress in the pathogenesis of renal interstitial fibrosis[J]. Guangdong Medical Journal, 2015, 36(2): 324-326. |
| [13] |
孙阳, 赵艳红, 卢永新, 等. 肾脏纤维化的发病机制及治疗进展[J]. 实用临床医药杂志, 2015, 19(9): 173-176. SUN Y, ZHAO Y H, LU Y X, et al. Pathogenesis and treatment progress of renal fibrosis[J]. Journal of Clinical Medicine in Practice, 2015, 19(9): 173-176. |
| [14] |
CHEVALIER R L, FORBES M S, THORNHILL B A. Ureteral obstruction as a model of renal interstitial fibrosis and obstructive nephropathy[J]. Kidney International, 2009, 75(11): 1145-1152. DOI:10.1038/ki.2009.86 |
| [15] |
ANNALDAS S, SAIFI M A, KHURANA A, et al. Nimbolide ameliorates unilateral ureteral obstruction-induced renal fibrosis by inhibition of TGF-β and EMT/Slug signalling[J]. Molecular Immunology, 2019, 112: 247-255. DOI:10.1016/j.molimm.2019.06.003 |
| [16] |
LIU Y. New insights into epithelial-mesenchymal transition in kidney fibrosis[J]. Journal of The American Society of Nephrology, 2010, 21(2): 212-222. DOI:10.1681/ASN.2008121226 |
| [17] |
DING Y, CHOI M E. Regulation of autophagy by TGF-β: emerging role in kidney fibrosis[J]. Seminars in Nephrology, 2014, 34(1): 62-71. DOI:10.1016/j.semnephrol.2013.11.009 |
| [18] |
TANG Y, YANG Q, LU J, et al. Zinc supplementation partially prevents renal pathological changes in diabetic rats[J]. Journal of Nutritional Biochemistry, 2010, 21(3): 237-246. DOI:10.1016/j.jnutbio.2008.12.010 |
| [19] |
GRIGGS L A, HASSAN N T, MALIK R S, et al. Fibronectin fibrils regulate TGF-β1-induced epithelial-mesenchymal transition[J]. Matrix Biology, 2017, 60-61: 157-175. DOI:10.1016/j.matbio.2017.01.001 |
| [20] |
贺李娴, 谭钢. ZO-1/ZONAB信号通路与细胞的增殖分化[J]. 中国细胞生物学学报, 2017, 39(1): 128-135. HE L X, Tan G. The ZO-1/ZONAB signaling pathways and cell proliferation and differentiation[J]. Chinese Journal of Cell Biology, 2017, 39(1): 128-135. |
2. Tianjin Beichen Traditonal Chinese Medicine Hospital, Tianjin 300400, China
 2022, Vol. 39
2022, Vol. 39