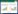文章信息
- 禹鹏鑫, 陈颖, 张丽娟, 余河水, 宋新波, 李正
- YU Pengxin, CHEN Ying, ZHANG Lijuan, YU Heshui, SONG Xinbo, LI Zheng
- 基于UPLC-DAD指纹图谱结合化学计量学及6种成分含量测定的桑叶质量研究
- Study on the quality of mulberry leaves based on UPLC-DAD fingerprint combined with chemometrics and determination of 6 index components
- 天津中医药, 2022, 39(2): 244-250
- Tianjin Journal of Traditional Chinese Medicine, 2022, 39(2): 244-250
- http://dx.doi.org/10.11656/j.issn.1672-1519.2022.02.24
-
文章历史
- 收稿日期: 2021-10-28
2. 组分中药国家重点实验室, 天津 301617;
3. 中药制药工程市级实验教学示范中心, 天津 301617
桑叶为桑科植物桑Morus alba L.的干燥叶片,2020版《中国药典》收载桑叶为初霜后釆收,性味甘、苦、寒,归肺、肝经,具有疏散风热,清肺润燥,清肝明目的功效,用于风热感冒,肺热燥咳,头晕头痛,目赤昏花等症[1]。桑叶首载于《神农本草经》,能下气益阴,又能止咳,有补益之功,是中医清热解毒之要药[2]。现代文献研究表明,桑叶中主要含有黄酮类、酚酸类、生物碱类、香豆素类、氨基酸类、多糖类等化学成分[3-10]。现代药理研究表明,桑叶具有降血糖、调血脂、预防粥样动脉硬化、抑制肥胖、抗肿瘤、抗炎、降压、抗病毒和抗抑郁等多种药理作用[11-18]。目前文献报道的桑叶含量测定主要是测定绿原酸[19-20]、芦丁[21]、异槲皮苷、阿魏酸[22]、儿茶素[23]和1-脱氧野尻霉素等[24]。桑叶产地丰富,主要分布在湖北、湖南、四川、河北、安徽和浙江等地区,桑叶的质量参差不齐,目前对桑叶质量控制的标准尚不完整。本研究通过建立超高效液相色谱法(UPLC)-DAD指纹图谱方法,结合化学计量学与多指标含量测定方法综合评价本实验中的22批桑叶质量,初步建立用于桑叶质量评价的方法,以期为桑叶质量标准的建立提供科学实验依据,使桑叶得到更深度的开发利用。
1 仪器与材料 1.1 仪器Agilent 1290超高效液相色谱仪(Agilent公司);AGILENT UPLC® EC C18色谱柱(2.1 mm×100 mm,1.7 μm,Agilent公司);KQ2200DBV型数控超声波清洗器(昆山超声仪器有限公司);AL204型电子天平(梅特勒-托利多仪器上海有限公司);超纯水系统(美国Millipore公司)。
1.2 药品与试剂没食子酸甲酯(批号:99-24-1,纯度≥98%),隐绿原酸(批号:905-99-7,纯度≥98%),异槲皮苷(批号:482-35-9,纯度≥98%),山奈酚-3-O-芸香糖苷(批号:17650-84-9,纯度≥98%),紫云英苷(批号:480-10-4,纯度≥98%)均购自上海源叶生物科技有限公司;芦丁(批号:8AQD-GGPK,纯度≥91.9%)购自中国食品药品检定研究院。乙腈、甲醇、磷酸均为色谱醇(Fisher公司),无水乙醇为分析级(朝阳赫成化学试剂有限公司),水为超纯水。
22批桑叶药材购自河北、河南、安徽、湖北、江苏、浙江、四川,经由天津中医药大学中药鉴定教研室李天祥教授鉴定均为桑科桑属植物桑(Morus alba L.)的干燥成熟树叶。22批药材来源信息详见表 1。
色谱柱为Agilent EC-C18(2.1 mm×100 mm,1.7 μm);流动相:0.2%磷酸水(A)-乙腈(B),梯度洗脱:0~8 min,8%~15% B;8~16 min,15%~30% B;16~18 min,30%~55% B;18~23 min,55%~95% B;流速:0.2 mL/min;柱温35 ℃;进样体积:2 μL;检测波长:0~7 min,290 nm;7~23 min,360 nm。
2.2 溶液的制备 2.2.1 供试品溶液的制备取桑叶粉末(过3号筛)约1 g,精密称定,加80%乙醇溶液40 mL,密塞,超声(360 W,40 kHz)45 min,过滤,滤渣复提一次,合并滤液,减压浓缩至干,加100%甲醇溶解,并转移至10 mL的容量瓶中,加100%甲醇定容至刻度,摇匀,测定前用0.22 μm的微孔滤膜过滤。
2.2.2 对照品溶液的制备精密称取没食子酸甲酯、隐绿原酸、芦丁、异槲皮苷、山奈酚-3-O-芸香糖苷、紫云英苷对照品适量,至5 mL容量瓶,加100%甲醇溶解定容至刻度,配置成质量浓度1.244、0.478、0.288、0.596、0.328、0.278 mg/mL的混合对照品溶液。测定前用100%甲醇稀释0,2,4,8,16和32倍,得到系列质量浓度的混合对照品溶液,备用。
2.3 UPLC指纹图谱建立 2.3.1 方法学考察按照方法学考察要求,取“2.2.1”项下供试品溶液,按“2.1”项下色谱条件进样测定,以芦丁峰为参照,计算各共有峰的相对保留时间和相对峰面积。结果,各共有峰相对保留时间和相对峰面积的RSD均小于3.0 %(n=6),表明本方法精密度、稳定性、重复性良好。
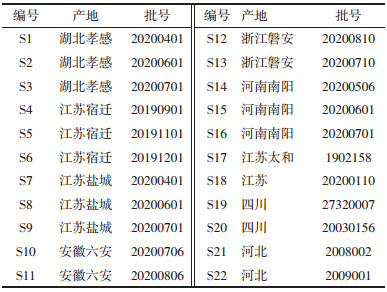
2.3.2 方法建立及相似度评价分别取22批桑叶样品粉末,按“2.2.1”项下方法制备供试品溶液,再按“2.1”项下色谱条件进样测定,将22批桑叶粉末的色谱图导入“中药色谱指纹图谱相似度评价系统(2012版)”,以S18样品的指纹图谱为参照图谱,中位数法进行自动匹配,多点校正,生成指纹图谱共有模式及叠加图谱,选择桑叶中的主要成分且分离较好的色谱峰作为共有峰,共标定了16个共有峰,其中峰7(芦丁)稳定性好,色谱响应值较高,分离度好,保留时间适中,故选择其作为参照峰(S)。经对照品指认,鉴定出6个成分,峰4为没食子酸甲酯,峰5为隐绿原酸,峰7为芦丁,峰8为异槲皮苷,峰9为山奈酚-3-O-芸香糖苷,峰10为紫云英苷。将22批桑叶药材指纹图谱与对照指纹图谱匹配,计算相似度,相似度结果见表 2,色谱图见图 1。由表 2可知,22批桑叶相似度差异较大,说明化学成分存在一定的差异;因此计算各指纹图谱共有色谱峰的相对保留时间和相对峰面积,由结果可知共有峰相对保留时间差异较小,RSD值为0~0.83%,说明不同批次的桑叶化学成分相似,但各共有峰相对峰面积差值较大,RSD值为0~158.16%,说明不同批次的桑叶化学成分含量存在一定的差异,可能由于受到气候、土壤等环境因素以及采收加工过程中人为因素的影响,导致药材内在化学成分的含量存在一定差异。相似度的比较并不能完全显著区分成分的差异性,故选取16个共有峰的峰面积进行聚类分析和主成分分析。
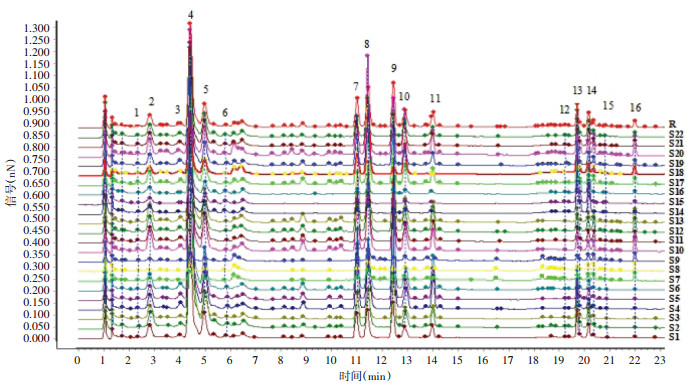
|
| 图 1 22批桑叶药材UPLC-DAD指纹图谱 Fig. 1 UPLC-DAD fingerprint of 22 batches of mulberry leaves |
将22批桑叶药材样品中各共有峰的峰面积为原始数据,运用SPSS 25.0软件,利用“描述统计”方法标准化后,采用组间平均数联结法,以夹角余弦作为样品相似度的距离公式,对22批桑叶药材进行聚类分析。相似度越大,两个样品之间的距离越近,22批桑叶药材样品分为4类,S7、S8、S9、S14、S15、S16号样品聚为一类;S1、S2、S3、S10、S11、S12、S13、S17、S19、S20、S21、S22号样品聚为一类;S4、S5、S6号样品聚为一类;S18号样品单独聚为一类。分析结果表明,22批桑叶药材出现产地交叉现象,说明桑叶药材并不能以产地区分,药材质量还受采收时间、降水、温度等其他影响,需要综合整体化学成分的含量进行质量评价。同时,聚类分析结果验证了指纹图谱相似度评价结果,也说明了22批桑叶药材质量差异较大,化学成分含量相差较大。
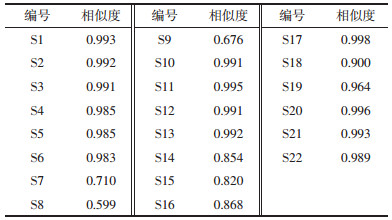
2.3.4 主成分分析及因子分析为了进一步分析22批桑叶药材之间的差异,更好的筛选品质上佳的桑叶,采用SPSS 25.0软件对22批不同产地的桑叶药材共有峰峰面积进行标准化处理,通过降维因子分析,以主成分的方差贡献率及特征值为依据,提取16个共有峰进行主成分分析,计算相关矩阵的特征值及其方差贡献率。16个共有峰中特征值> 1的主成分,对总方差的累积贡献率达91.083%,表明该主成分对桑叶有很好的代表性,能基本反映出样品的主要信息。选取前3个主成分进行方差分析,主成分得分系数载荷矩阵见表 3,以主成分的绝对值大小作为评价依据,主成分1的信息来自峰2、3、4、5、7、8、9、10、11,12,且峰12与主成分1成负相关,其中峰4、5、7、8、9和10对主成分1具有较大的贡献,经对照品指认,峰4为没食子酸甲酯,峰5为隐绿原酸,峰7为芦丁,峰8为异槲皮苷,峰9为山奈酚-3-O-芸香糖苷,峰10为紫云英苷,其余峰未知,主成分2的信息来自峰6、13、15、16,主成分3的信息来自于峰1、14。为保证桑叶药材的质量稳定,可对指标性成分进行含量测定,即对主成分1中的得分系数较大的成分予以重点关注。以16个共有峰的峰面积为变量,利用Origin 2019b作图软件绘制主成分分析得分图。根据得分图可知,22批桑叶药材分散不集中,主成分得分存在较大的差异,大致可以分成4类,其结果与聚类分析结果一致,故在实际应用中,应该固定药材来源,固定药用品种,明确采摘时间,为桑叶质量评价提供可行性。见图 2。
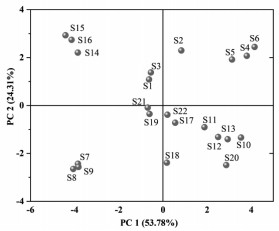
|
| 图 2 主成分得分图 Fig. 2 Principal component score chart |
在“2.1”项下色谱条件下,精密吸取系列浓度的混合对照品溶液注入超高效液相色谱仪,记录色谱图。记录各对照品相应保留时间处的峰面积,以色谱峰面积为纵坐标(Y),质量浓度为横坐标(X),绘制标准曲线,计算回归方程,结果显示其线性关系良好,其回归方程,决定系数及线性范围见表 4。
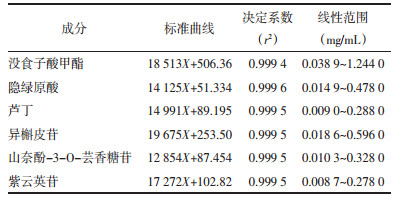
|
精密吸取混合对照品溶液2 μL,按“2.1”项下色谱条件连续进样6次,记录峰面积,计算没食子酸甲酯、隐绿原酸、芦丁、异槲皮苷、山奈酚-3-O-芸香糖苷、紫云英苷峰面积的RSD值分别为0.14%、0.31%、0.13%、0.09%、0.21%、0.11%,RSD < 1.0%,表明仪器精密度良好。
2.4.3 重复性实验取同一批样品6份,按“2.2.1”项下方法制备供试品溶液,按“2.1”项下色谱条件进样测定,记录峰面积,计算没食子酸甲酯、隐绿原酸、芦丁、异槲皮苷、山奈酚-3-O-芸香糖苷、紫云英苷的含量及平均含量的RSD值,结果分别为2.05%、2.35%、2.25%、1.95%、2.85%、2.01%,RSD < 3.0%,表明该方法重复性良好。
2.4.4 稳定性实验按“2.2.1”项下方法制备供试品溶液,取同一批供试品溶液,按“2.1”项下色谱条件进样测定,分别于制备后0,2,4,8,12,24 h进样2 μL,记录峰面积,计算没食子酸甲酯、隐绿原酸、芦丁、异槲皮苷、山奈酚-3-O-芸香糖苷、紫云英苷峰面积的RSD值,经计算6种成分的RSD分别为2.44%、2.72%、2.65%、2.69%、1.24%、2.63%,RSD < 3.0%,表明供试品溶液在24 h内稳定。
2.4.5 加样回收率实验精密称取6份已知含量的桑叶粉末约0.5 g,分别加入各对照品适量,按“2.2.2”项下方法制备供试品溶液,按“2.1”项下色谱条件进样测定,记录峰面积,计算没食子酸甲酯、隐绿原酸、芦丁、异槲皮苷、山奈酚-3-O-芸香糖苷、紫云英苷的含量及平均加样回收率,依次为99.42%、101.75%、99.08%、97.42%、102.69%、100.33%,RSD值分别为1.00%、2.11%、2.58%、1.89%、1.99%、2.01%,RSD < 3.0%,表明该方法的准确度符合要求。
2.4.6 样品测定结果取22批桑叶药材粉末共22份,每份约1 g,精密称定,按照“2.2”项下方法制备供试品溶液,按“2.1”项下色谱条件测定峰面积,计算22批桑叶药材中没食子酸甲酯、隐绿原酸、芦丁、异槲皮苷、山奈酚-3-O-芸香糖苷、紫云英苷的含量见表 5。由表 5可知,22批桑叶药材指标性成分含量存在较大差异,江苏宿迁S6桑叶药材6个指标性总含量达到14.589 mg/g以上,而江苏盐城S7桑叶药材仅达0.372 mg/g。通过对22批桑叶6个指标性成分含量对比,没食子酸甲酯、芦丁、山奈酚-3-O-芸香糖苷的相对含量差异较大,分别为6.622~0.039、1.419~0.011、3.259~0.018 mg/g;隐绿原酸、异槲皮苷、紫云英苷相对含量差异较小,分别为1.679~0.088、1.034~0.023、0.846~0.019 mg/g,说明桑叶药材之间质量存在很大的差异,对桑叶的质量控制是一项严峻的考验。
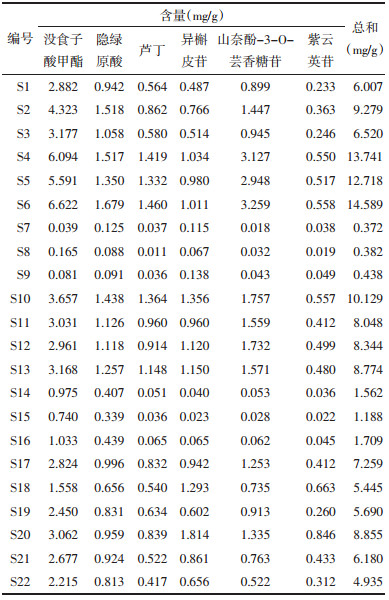
|
本研究考察了不同提取溶剂、不同提取方式对桑叶中主要指标成分的影响,最终选择80%乙醇,超声提取45 min,提取2次,100%甲醇复溶作为供试品溶液的制备方法。同时,本研究进行200~400 nm下全波长扫描,发现酚酸类在290 nm处,黄酮类在360 nm处,各成分均有较强吸收,色谱峰分布均匀,故选择分段波长进行分析。研究中还考察流动相(乙腈-水、甲醇-水、乙腈-0.2%的甲酸水溶液、乙腈-0.05%的磷酸水溶液、乙腈-0.2%的磷酸水溶液)、柱温(30、35、40 ℃)、流动相流速(0.1、0.2、0.3 mL/min)、进样量(1、2、3 μL),最终确定色谱条件为乙腈-0.2%磷酸溶液梯度洗脱,柱温35 ℃,流速0.2 mL/min,进样量2 μL时所得色谱图可以获得较为平稳的基线,且各待测成分的峰形较好,分离度较高。
桑叶是典型的多产地的中药材,其生长过程中影响因素较多,比如气温、降水、紫外线、土壤、遗传等[25-26],并且采收时间[27]、干燥方式[28]等,均会影响桑叶药材的质量,导致市场上的桑叶药材质量参差不齐[29]。本研究建立的基于UPLC-DAD指纹图谱结合化学计量学与多指标含量测定的方法,对22批桑叶进行一致性评价和定量研究,同时测定桑叶药材中没食子酸甲酯、隐绿原酸、芦丁、异槲皮苷、山奈酚-3-O-芸香糖苷和紫云英苷6种化学成分的含量。实验结果表明,22批桑叶药材相似度有一定的差距,共有峰峰面积RSD比值较大,说明本实验所用22批桑叶药材化学成分的含量存在较大的差异性。聚类分析验证了相似度评价的准确度,仅说明了不同批次间桑叶药材化学成分相似,将22批桑叶进行主成分分析,分析结果可知主成分1中经对照品指认的6种成分可反映桑叶药材的基本信息,因此可用于评价桑叶的质量研究,通过对6种指标成分进行含量测定,结果显示22批次桑叶药材的化学成分的含量存在较大差异,可能与桑叶地理环境、气候条件、品种、采收时间和烘干方式等均有关,对药物次生代谢产物的积累产生影响,从而导致桑叶药材相似度以及含量的差异性,即使同一产地的生态环境相似,但药材质量也会受种植方式人为等因素的影响。
为了保证药食两用桑叶原料的质量和品质,可考虑加强对桑叶采收加工规范化研究,提高和完善国家桑叶药材标准,进一步提升桑叶的质量,对不同品种、不同产地、不同采收期和不同生育期的桑叶进行进一步细致的研究,以期使桑叶得到更有效的利用。综上所述,本研究采用UPLC-DAD技术建立指纹图谱结合化学计量学对桑叶药材成分进行差异性分析,并对6个指标性成分进行含量测定,直观的评价桑叶药材品质的一致性,还同时体现化学成分的差异性,该方法操作便捷、结果准确、重复性好,为桑叶药材的质量控制和相关产品开发提供科学参考。
| [1] |
国家药典委员会. 中华人民共和国药典[S]. 北京: 中国医药科技出版社, 2020. National Pharmacopoeia Commission. Pharmacopoeia of the People's Republic of China[M]. Beijing: China Medical Science Press, 2020. |
| [2] |
白华. 《神农本草经》桑叶考证[J]. 内蒙古中医药, 2016, 35(1): 102-103. BAI H. Textual research on mulberry leaves in Shennong's Materia Medica[J]. Nei Mongol Journal of Traditional Chinese Medicine, 2016, 35(1): 102-103. DOI:10.3969/j.issn.1006-0979.2016.01.103 |
| [3] |
于小凤. 经霜对桑叶黄酮类成分积累影响的分子机制研究[D]. 南京: 江苏大学, 2018. YU X F. The molecular mechanism of the influence of Jingshuang on the accumulation of flavonoids in mulberry leaves[D]. Nanjing: Jiangsu University, 2018. |
| [4] |
张丽丽, 白永亮, 宿树兰, 等. 不同品种不同生长期桑叶中生物碱类与黄酮类化学成分的积累动态分析评价[J]. 中国中药杂志, 2014, 39(24): 4822-4828. ZHANG L L, BAI Y L, SU S L, et al. Dynamic analysis of alkaloids and flavonoids in Genus Morus L.in China during different harvesting time[J]. China Journal of Chinese Materia Medica, 2014, 39(24): 4822-4828. |
| [5] |
王婷婷, 马天宇, 李琪, 等. 桑叶化学成分及生物活性研究进展[J]. 食品与药品, 2018, 20(5): 390-393. WANG T T, MA T Y, LI Q, et al. Research progress in Mori Folium[J]. Food and Drugs, 2018, 20(5): 390-393. DOI:10.3969/j.issn.1672-979X.2018.05.019 |
| [6] |
吕丹, 王海波, 邸学, 等. 桑叶药材中总黄酮含量的测定[J]. 中国药房, 2016, 27(6): 844-845. LYU D, WANG H B, DI X, et al. Content determination of total flavonoids in Morus alba[J]. China Pharmacy, 2016, 27(6): 844-845. |
| [7] |
陆城宇, 李俊松, 狄留庆, 等. 不同产地桑叶氨基酸、核苷、生物碱成分的含量测定及多元统计分析[J]. 中国现代应用药学, 2020, 37(9): 1052-1057. LU C Y, LI J S, DI L Q, et al. Determination and multivariate statistical analysis of Amino acids, nucleosides and alkaloids in mulberry leaves from different origins[J]. Chinese Journal of Modern Applied Pharmacy, 2020, 37(9): 1052-1057. |
| [8] |
WAN L, CHEN G, JIAN S P, et al. Antioxidant and xanthine oxidase inhibitory properties and LC-MS/MS identification of compounds of ethanolic extract from mulberry leaves[J]. Acta Scientiarum Polonorum Technologia Alimentaria, 2018, 17: 313. |
| [9] |
张华, 孟博, 王莉, 等. 桑叶多糖超声-微波协同提取工艺优化及其抗氧化活性[J]. 中成药, 2020, 42(8): 1972-1977. ZHANG H, MENG B, WANG L, et al. Ultrasonic-microwave synergistic extraction process optimization and anti-oxidant activity for polysaccharides from Mori Folium[J]. Chinese Traditional Patent Medicine, 2020, 42(8): 1972-1977. DOI:10.3969/j.issn.1001-1528.2020.08.002 |
| [10] |
ZHANG L L, BAI Y L, SHU S L, et al. Simultaneous quantitation of nucleosides, nucleobases, amino acids, and alkaloids in mulberry leaf by ultra high performance liquid chromatography with triple quadrupole tandem mass spectrometry[J]. Journal of Separation Science, 2014, 37(11): 1265-1275. DOI:10.1002/jssc.201301267 |
| [11] |
MU X Y, LI X J. Influence of Mori Folium total flavonoid on β-cells in rats with type-2 diabetic mellitus[J]. Chinese Journal of Experimental Traditional Medical Formulae, 2013, 19(11): 213-216. |
| [12] |
韦芳媚. 桑叶提取物、茶多酚及其复配物的抗氧化和降血糖活性[D]. 广州: 华南理工大学, 2019. WEI F M. Antioxidant and hypoglycemic activity of mulberry leaf extract, tea polyphenols and their combinations[D]. Guangzhou: South China University of Technology, 2019. |
| [13] |
孟庆海, 殷秋忆, 郭静, 等. 4种不同桑叶提取物降血糖作用的筛选[J]. 中成药, 2014, 36(6): 1288-1291. MENG Q H, YIN Q Y, GUO J, et al. Screening of 4 different mulberry leaf extracts for hypoglycemic effect[J]. Chinese Traditional Patent Medicine, 2014, 36(6): 1288-1291. DOI:10.3969/j.issn.1001-1528.2014.06.039 |
| [14] |
季涛, 宿树兰, 郭盛, 等. 桑叶防治糖尿病的效应成分群及其作用机制研究进展[J]. 中草药, 2015, 46(5): 778-784. JI T, SU S L, GUO S, et al. Research progress on bioactive component groups and their action mechanisms of Mori Folium for prevention and treatment of diabetes[J]. Chinese Traditional and Herbal Drugs, 2015, 46(5): 778-784. |
| [15] |
吴雯, 梁凯伦, 陈波, 等. 桑叶提取物对食源性肥胖大鼠的减肥作用及机制研究[J]. 中国中药杂志, 2017, 42(9): 1757-1761. WU W, LIANG K L, CHEN B, et al. Effects of Mori Folium extract on diet-induced obesity mechanism in rats[J]. China Journal of Chinese Materia Medica, 2017, 42(9): 1757-1761. |
| [16] |
张映. 桑叶活性成分及抗肿瘤作用研究进展[J]. 时珍国医国药, 2014, 25(9): 2223-2224. ZHANG Y. Research progress on active ingredients and anti-tumor effects of mulberry leaves[J]. Lishizhen Medicine and Materia Medica Research, 2014, 25(9): 2223-2224. |
| [17] |
黄思雨. 绿茶、桑叶和臭黄荆叶细粉抗氧化、抗炎及肠道益生性探究[D]. 重庆: 西南大学, 2020. HUANG S Y. Research on the anti-oxidation, anti-inflammatory and intestinal probiotic properties of green tea, mulberry leaf and odorous yellow wattle leaf powder[D]. Chongqing: Southwest University, 2020. |
| [18] |
曾瑜, 李远杰, 马健雄, 等. 广西产桑叶调节血脂作用及成分鉴定研究[J]. 中国药业, 2020, 29(5): 75-78. ZENG Y, LI Y J, MA J X, et al. Regulation effect on blood lipids and components identification of mulberry leaves in Guangxi[J]. China Pharmaceuticals, 2020, 29(5): 75-78. DOI:10.3969/j.issn.1006-4931.2020.05.018 |
| [19] |
邸学, 谷丽艳, 王海波, 等. HPLC同时测定桑叶中绿原酸、芦丁、异槲皮苷、紫云英苷、槲皮素含量[J]. 中国实验方剂学杂志, 2014, 20(15): 92-95. DI X, GU L Y, WANG H B, et al. Simultaneous determination of chlorogenic acid, rutin, isoquercitrin, astragalin, and quercetin in mulberry leaves by HPLC[J]. Chinese Journal of Experimental Traditional Medical Formulae, 2014, 20(15): 92-95. |
| [20] |
白娟, 朱倩云, 白华, 等. 高效液相色谱法同时测定桑叶中绿原酸及4种黄酮类成分的含量[J]. 中药新药与临床药理, 2020, 31(4): 469-472. BAI J, ZHU Q Y, BAI H, et al. Simultaneous determination of chlorogenic acid and four flavonoids in Mori folium by HPLC[J]. Traditional Chinese Drug Research and Clinical Pharmacology, 2020, 31(4): 469-472. |
| [21] |
程聪梅, 毛菊华, 余乐. HPLC法同时测定桑叶药材及其炮制品中绿原酸、芦丁和异槲皮苷的含量[J]. 中国药房, 2016, 27(21): 2990-2992. CHENG C M, MAO J H, YU L. Simultaneous determination of chlorogenic acid, rutin and isoquercitrin in Morus alba and its processed products by HPLC[J]. China Pharmacy, 2016, 27(21): 2990-2992. DOI:10.6039/j.issn.1001-0408.2016.21.36 |
| [22] |
成胜荣. 同源异效桑源药材(桑叶、桑枝、桑白皮、桑椹)的物质基础研究[D]. 南京: 江苏大学, 2019. CHENG S R. Study on the material basis of mulberry medicinal materials (mulberry leaf, mulberry branch, mulberry white bark, mulberry fruit) of the same origin and different effect[D]. Nanjing: Jiangsu University, 2019. |
| [23] |
代燕丽. 桑叶多酚的质量标准及其抗氧化和脂质代谢调节作用研究[D]. 广州: 广东药科大学, 2016. DAI Y L. Study on the quality standard of mulberry leaf polyphenols and their antioxidant and lipid metabolism regulating effects[D]. Guangzhou: Guangdong Pharmaceutical University, 2016. |
| [24] |
李名洁, 王玉, 陈搏, 等. 不同产地及季节桑叶中DNJ的含量测定[J]. 食品与发酵科技, 2020, 56(5): 123-127. LI M J, WANG Y, CHEN B, et al. Content of 1-deoxynojirimycin in Mulberry leaf from different regions and different harvest time[J]. Sichuan Food and Fermentation, 2020, 56(5): 123-127. DOI:10.3969/j.issn.1674-506X.2020.05.023 |
| [25] |
孟凡芳. 桑树的主要栽培技术及病虫害防治[J]. 农业开发与装备, 2019, 25(6): 203-207. MENG F F. The main cultivation techniques and pest control of mulberry trees[J]. Agricultural Development and Equipments, 2019, 25(6): 203-207. DOI:10.3969/j.issn.1673-9205.2019.06.149 |
| [26] |
韦俊贞. 桑树高产栽培管理技术[J]. 现代农业科技, 2019, 48(3): 203-210. WEI J Z. High-yield cultivation and management techniques for mulberry trees[J]. Xiandai Nongye Keji, 2019, 48(3): 203-210. DOI:10.3969/j.issn.1007-5739.2019.03.122 |
| [27] |
曲永胜, 王亮, 郭威. 基于成分特征的桑叶经霜质量标志物探索[J]. 中国实验方剂学杂志, 2019, 25(23): 145-150. QU Y S, WANG L, GUO W. Study on frosting quality markers of Mori Folium based on component characteristic[J]. Chinese Journal of Experimental Traditional Medical Formulae, 2019, 25(23): 145-150. |
| [28] |
赵慧玲, 王佳燕, 吕慧, 等. 干燥方式对桑叶主要活性成分及抗氧化活性的影响[J]. 食品工业, 2020, 41(8): 191-195. ZHAO H L, WANG J Y, LU H, et al. Effects of drying methods on the main active ingredients and the antioxidant activity of Mulberry leaves[J]. The Food Industry, 2020, 41(8): 191-195. |
| [29] |
邓明慧, 路娟, 柴瑞平, 等. 基于指纹图谱、聚类分析、主成分分析评价不同产地桑叶质量[J]. 时珍国医国药, 2020, 31(5): 1139-1142. DENG M H, LU J, CHAI R P, et al. Evaluation of the quality of mulberry leaves from different origins based on fingerprint, cluster analysis, and principal component analysis[J]. Lishizhen Medicine and Materia Medica, 2020, 31(5): 1139-1142. DOI:10.3969/j.issn.1008-0805.2020.05.031 |
2. State Key Laboratory of Component-based Chinese Medicine, Tianjin 301617, China;
3. Municipal Experimental Teaching Demonstration Center of Traditional Chinese Medicine Pharmaceutical Engineering, Tianjin 301617, China
 2022, Vol. 39
2022, Vol. 39