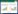文章信息
- 安然, 蔡铭祺, 覃小燕, 韦秋, 杨云, 毛浩萍
- AN Ran, CAI Mingqi, QIN Xiaoyan, WEI Qiu, YANG Yun, MAO Haoping
- 墨旱莲提取物促进小鼠骨髓来源的间充质干细胞迁移和成骨方向分化作用研究
- Effects of eclipta extract on migration and osteogenic differentiation of mouse bone marrow-derived mesenchymal stem cells
- 天津中医药, 2022, 39(2): 259-265
- Tianjin Journal of Traditional Chinese Medicine, 2022, 39(2): 259-265
- http://dx.doi.org/10.11656/j.issn.1672-1519.2022.02.26
-
文章历史
- 收稿日期: 2021-10-27
骨质疏松症(OP)是一种常见的代谢性骨骼疾病,其特点是骨小梁结构消失、骨量降低,骨折的风险升高[1]。骨质疏松患者主要是老年人和绝经期后女性,OP基本发病机制是骨代谢失衡,破骨细胞介导的骨吸收大于成骨细胞负责的骨形成[2]。目前对于OP的治疗应主要是通过刺激骨形成或抑制骨吸收。临床用药主要有双膦酸盐、地诺单抗和罗莫珠单抗。他们多数是通过调节破骨细胞增生、分化及凋亡从而减少骨吸收。研究表明,双膦酸盐药物和地诺单抗只能抑制骨吸收,不具备增加骨形成的能力[3-4]。罗莫珠单抗是作用于骨硬化蛋白的单克隆抗体,是唯一具有双重作用的抗骨质疏松药物,它既可以抑制骨吸收又可以通过调控成骨细胞分化和增殖作用促进骨形成[5]。然而罗莫珠单抗产生严重心血管事件问题尚未解决,寻找新的治疗药物是迫切需要的,具有重要意义[6]。
小鼠骨髓来源的间充质干细胞(BMMSCs)具有增殖能力和向多种细胞分化潜能[7]。在OP导致的骨损伤发生后,BMMSCs及其周围的骨膜、软组织间充质等前体细胞增生,迁移到受损部位,分化为成骨细胞、成软骨细胞,从而促进骨组织恢复[8]。因此,调控BMMSCs迁移和分化平衡,促进BMMSCs趋于向成骨细胞分化,有助于骨形成,对治疗OP具有重要意义。
墨旱莲为菊科植物鳢肠Eclipta prostrate L.的干燥地上部分,化学成分主要分为三萜类、黄酮类、噻吩类、香豆素类、甾体类[9]。墨旱莲主治肝肾不足,眩晕耳鸣,视物昏花,腰膝酸软等症状[10]。多项研究表明,墨旱莲提取物(EHE)可改善多种骨质疏松模型小鼠的骨微结构损伤,且具有抑制破骨细胞骨吸收活性的作用[11-13]。其中,墨旱莲有效成分蟛蜞菊内酯通过Wnt/GSK3β/β-连环蛋白信号通路促进成骨细胞生成[14],而墨旱莲是否促进BMMSCs的迁移和分化作用未见报道,需要进一步阐明。本研究通过探究EHE对BMMSCs的迁移和分化的作用及可能的作用机制,为后续墨旱莲治疗OP的作用机制提供研究方向。
1 材料 1.1 动物SPF级6周雌性C57BL/6J小鼠,购自北京华阜康生物科技股份有限公司,动物许可证编号:SCXK(京)2014-0004。动物饲养于天津中医药大学动物房。
1.2 药品与主要试剂墨旱莲药材购自安国祁安药业有限公司;基础培养基(αMEM)、胎牛血清、聚氰基丙烯酸正丁酯(BCA)检测试剂盒、聚偏二氟乙烯(PVDF)膜(赛默飞世尔科技,美国);青霉素-链霉素混合液(10 000 U/mL青霉素G钠盐,10 mg/mL硫酸链霉素)、成骨诱导剂、成脂诱导剂、油红O检测试剂盒(BI,以色列);5-溴-4-氯-3- 吲哚基-磷酸盐/氯化硝基四氮唑兰(BCIP/NBT)显色试剂盒、蛋白裂解液(RIPA)(上海碧云天生物技术有限公司,中国);茜素红粉末、甲苯胺蓝粉末(北京索莱宝科技有限公司,中国);基质细胞衍生因子-1(SDF-1)(R&D Systems,美国);兔抗鼠β-肌动蛋白(β-actin)一抗、兔抗鼠CXC趋化因子受体4(CXCR4)一抗、山羊抗兔免疫球蛋白G(IgG)二抗(赛信通生物试剂有限公司,美国);增强型化学发光液(ECL发光液)(默克,美国)
1.3 仪器二氧化碳(CO2)恒温培养箱(赛默飞世尔科技,美国);超净工作台(苏州净化设备有限公司,中国);细胞迁移侵袭(Transwell)小室(美天旎生物技术公司,德国);倒置显微镜(尼康,日本);台式高速离心机(贝克曼库尔特有限公司,美国);-40 ℃低温冰箱(三洋,日本);电泳槽、半干转(伯乐,美国)。
2 方法 2.1 EHE的制备2 kg墨旱莲药材用70%乙醇回流2次,每次2 h。将提取物浓缩至200 g,4 ℃条件下储存。凭证标本(编号20161229)保存在天津市中药化学与分析重点实验室。采用多反应监测(MRM)的超高效液相色谱-串联四级杆质谱(UPLC-MS/MS)法测定了7种主要化合物的浓度,0.233±0.005 mg/g(旱莲苷IV),1.021±0.004 mg/g(旱莲苷A),0.272±0.003 mg/g(芹菜素),0.115±0.00 mg/g(3’-羟基生物素A),0.306±0.004 mg/g(木犀草素),0.125±0.008 mg/g(木犀草素-7-O-葡糖苷),0.271±0.001 mg/g(蟛蜞菊内酯)[15]。
2.2 小鼠原代BMMSCs的提取与培养在无菌条件下,取小鼠双侧股骨和胫骨,置于含10%双抗的磷酸盐缓冲液(PBS)中,剔除肌肉组织,使用用含有10%血清和1%双抗的α-MEM的培基冲洗骨髓腔至无菌细胞培养皿中,收集细胞悬液。经70 μm细胞筛过滤,过滤后培养于25 cm2的培养瓶中,每2~3 d换液,待细胞融合度达到90%后可进行传代,传至第3代后用于后续实验。
2.3 小鼠原代BMMSCs表面抗原鉴定BMMSCs使用胰酶消化后,加入预冷PBS,调整细胞密度为3×107个细胞/mL。采用流式细胞仪鉴定,分别加入不同的荧光标记的单克隆抗体涡旋混匀,在冰上避光孵育30 min,采用流式细胞仪鉴定。
2.4 小鼠原代BMMSCs诱导分化鉴定第3代BMMSCs接种于96孔板,细胞密度为6×104个细胞/mL,加入成骨细胞诱导剂,培养72 h后弃细胞培养液,用PBS润洗细胞2次,进行碱性磷酸酶(ALP)染色;培养2周后进行茜素红染色;加入软骨细胞诱导剂培养2周后进行甲苯胺蓝染色;加入脂肪细胞诱导剂,培养10 d后进行油红O染色。
2.5 细胞迁移侵袭(Transwell)检测第3代BMMSCs铺板于8 μm孔径的Transwell小室上层,小室下层加入50 ng/mL SDF-1、0.1 μg/mL和1μg/mL EHE,6 h后用棉签擦去小室上层还未穿过薄膜的细胞,进行结晶紫染色,显微镜下观察并拍照迁移后的细胞。
2.6 蛋白质印迹法(Western Blot)方法检测CXCR4蛋白表达加入细胞蛋白裂解液,冰上裂解15 min。12 000 r/min,离心半径10 cm,4 ℃离心15 min,离心后取上清,使用BCA蛋白质分析试剂盒测定上清液中的蛋白质浓度。将各组蛋白浓度调整至1.5 mg/mL。加入5×蛋白上样缓冲液,金属浴100 ℃加热5 min,制备样品结束。样品通过十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE),然后将蛋白转移到用滤纸包裹PVDF膜中。三乙醇胺-吐温缓冲(TBST)配置的5%牛奶中进行封闭2 h。PVDF膜在4 ℃下在TBST制备的一抗体稀释液中孵育过夜。第2天回收一抗,用TBST洗膜3次。加入二抗室温孵育2 h。用TBST洗膜3次。最后使用化学发光试剂ECL显影,用Image j软件测定蛋白质条带的灰度值。
2.7 ALP活性检测第3代BMMSCs接种于96孔板,细胞密度为6×104个细胞/mL,设置对照组和成骨诱导剂组。成骨诱导剂组给予EHE,剂量分别为0.1和1 μg/mL。72 h后进行ALP活性检测。
2.8 统计学方法使用SPSS 26.0统计软件,计量资料用均数±标准差(x±s)表示,多组间均数比较采用单因素方差分析(one-way ANOVA),多重比较采用Dunnett检验。P < 0.05表示差异有统计学意义。
3 结果 3.1 小鼠原代BMMSCs培养和鉴定分离提取得到的BMMSCs正常培养状态下,镜下观察如图 1所示。培养3 d后的小鼠BMMSCs呈圆形;培养7 d后贴壁细胞呈长梭形。采用流式细胞仪检测结果显示,培养的细胞表面分子sca-1的表达率为86%、分化簇(CD)29的表达率为99%、CD140α的表达率为88.7%、CD90的表达率为63.7%以及CD45的表达率为14%、CD34的表达率为1%。
|
| 注:A.为培养3 d的图像;B.为培养5 d的图像;C.为培养7 d的图像;D. P1门内细胞为单个核细胞群;E. sca-1检查;F. CD29检查;G. CD140α检查;H. CD90检查;I. CD45检查;J. CD34检测;K. ALP染色;L.茜素红染色;M.甲苯胺蓝染色;N.油红O染色。 图 1 小鼠原代BMMSCs培养与鉴定 Fig. 1 Culture and identification of mouse primary BMMSCs |
BMMSCs经成骨细胞诱导剂诱导后,ALP染色观察发现被黑染的成骨细胞,茜素红染色观察发现红色矿化结节样的成骨细胞;经软骨诱导后,甲苯胺蓝染色观察发现被蓝染的软骨细胞;经成脂诱导后,油红O染色观察发现橘红色脂滴样的脂肪细胞。以上结果表明提取得到的细胞符合BMMSCs的特性。
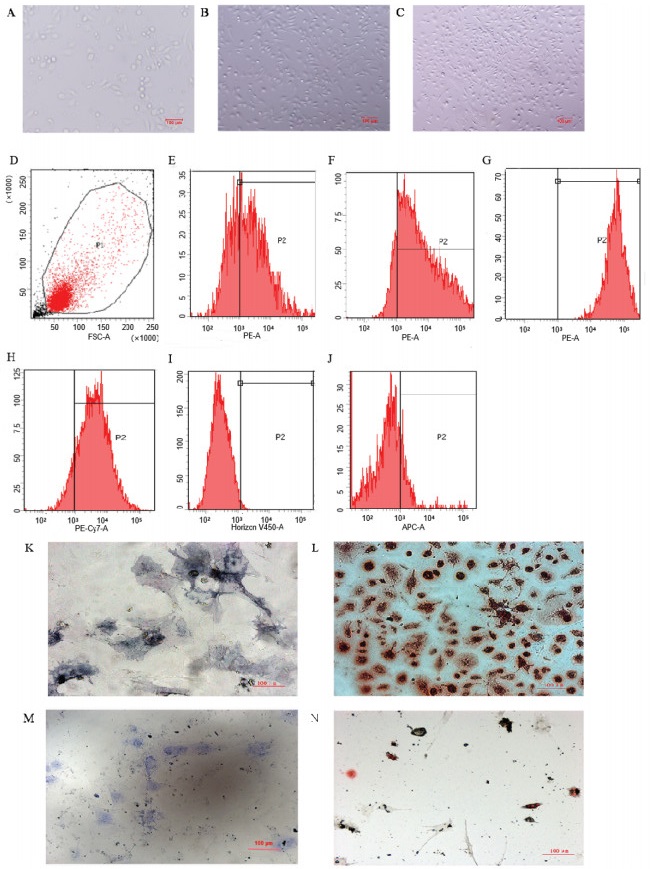
3.2 墨旱莲提取物对小鼠BMMSCs迁移能力的影响结果表明,与对照组相比,0.1和1 μg/mL EHE能显著提高BMMSCs的迁移能力,差异具有统计学意义(P < 0.05)。见图 2。
|
| 注:A.倒置显微镜拍照,50 μg/mL SDF-1、0.1和1 μg/mL EHE各组结晶紫染色情况;B.结晶紫染色阳性细胞个数量化图。与对照组相比,*P<0.05。 图 2 Transwell实验探究EHE对小鼠BMMSCs迁移能力的影响 Fig. 2 Transwell experiment to explore the effect of Eclipta chinensis extract on the migration ability of mouse BMMSCs |
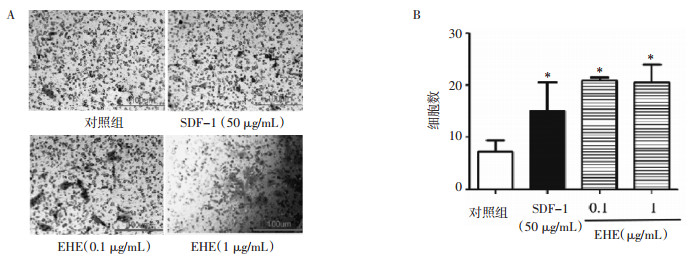
Western Blot实验结果显示,与对照组相比,1 μg/mL EHE具有提高CXCR4蛋白表达的趋势,0.1 μg/mL EHE显著提高CXCR4蛋白的表达(P < 0.05),差异具有统计学意义。见图 3。
|
| 注:A.给予0.1和1 μg/mL EHE各组BMMSCs中CXCR4蛋白表达情况;B.各组CXCR4蛋白表达情况量化图。与对照组相比,*P < 0.05。 图 3 Western Blot检测EHE对小鼠BMMSCs中CXCR4蛋白表达的影响 Fig. 3 Western blot detection of eclipta extract on the expression of CXCR4 protein in mouse BMMSCs |
ALP是BMMSCs向成骨细胞分化的标志性指标之一,ALP活性检测结果显示,与对照组相比,给予成骨诱导剂显著升高ALP浓度(P < 0.05);与给予成骨诱导剂相比,1 μg/mL EHE具有升高ALP浓度的作用,差异具有统计学意义(P < 0.05)。
ALP染色观察发现,与给予成骨诱导剂相比,0.1和1 μg/mL EHE组细胞形态由长梭型变为圆形,细胞体积变大,被黑染的成骨细胞数量增多;茜素红染色观察发现,与给予成骨诱导剂相比,0.1和1 μg/mL EHE组细胞形态由长梭型变为圆形,细胞体积变大,红色矿化结节样的成骨细胞数量增多。见图 4。
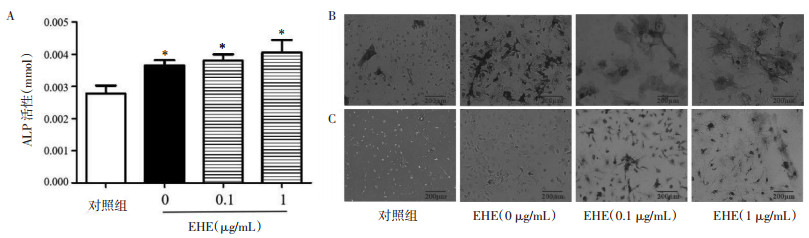
|
| 注:A. ALP活性检测;B. ALP染色;C.茜素红染色。与对照相比,*P < 0.05。 图 4 EHE对小鼠BMMSCs向成骨细胞分化作用 Fig. 4 The effect of eclipta extract on the differentiation of mouse BMMSCs into osteoblasts |
OP是一种系统性、多因素的骨病。由于骨微结构消失,骨密度降低,骨质疏松性骨折成为OP最常见的临床症状,从而使患者面临慢性疼痛和经济负担[16]。BMMSCs被认为是发育成骨细胞的主要来源,BMMSCs的功能对骨形成和骨微环境具有重要意义[17]。在OP患者中,BMMSCs可能会失去自我更新能力,且容易分化为脂肪细胞而不是骨细胞,从而导致骨丢失和脂肪堆积[18]。促进BMMSCs的向成骨细胞分化是恢复不平衡骨代谢的潜在策略。国际细胞治疗学会[19]提出BMMSCs具有以下特点:1)在正常培养条件下贴壁生长。2)细胞表面标志物的表达。3)缺乏造血标志物的表达。4)具有多向分化的能力。本实验提取分离获得的BMMSCs,培养7 d后贴壁生长,呈长梭形。流式细胞仪检测发现细胞表面标志物阳性表达的有sca-1、CD29、CD140α、CD90,阴性表达的有CD45和CD34,符合BMMSCs表型。实验可成功诱导BMMSCs分化为成骨细胞,软骨细胞和脂肪细胞。以上结果表明提取的细胞符合BMMSCs特性。
BMMSCs可以通过较强的迁移和归巢能力,到达受损组织部位,抑制炎症并进行多向分化使受损组织进行伤口修复[20]。所以BMMSCs向骨表面迁移对骨形成和骨折愈合至关重要。CXCR4是SDF-1的G蛋白耦连特异性受体,可在细胞表面和胞浆中检测到[21]。SDF-1/CXCR4信号通路参与各种细胞过程,常见于调控细胞迁移[22],CXCR4蛋白在促进BMMSCs的迁移能力可能发挥着重要的作用[23]。研究发现,通过生物发光成像技术确定了BMMSCs在骨折部位的迁移是依赖时间和CXCR4表达量的,SDF-1与BMMSCs表面的CXCR4蛋白受体结合,促进BMMSCs的迁移能力[24-25]。所以促进CXCR4的表达可以提高BMMSC迁移能力、加快组织修复效率[26]。目前,提高BMMSCs迁移和分化能力的有多种方法,包括支架、水凝胶构建、基因修饰和改变细胞膜表面受体,但这些方法具有潜在的诱变和致癌风险,需要更多的研究来解决安全性问题[27]。
近年来,BMMSCs已成为OP治疗研究的主要焦点。中医对OP患者进行补肾治疗。《灵枢》有云:“人始生,先成精,精成而脑髓生。”“肾藏精,主骨生髓”,故此从来源、分布、功能等方面发现“肾精”与现代医学的干细胞形似[28-29]。因此推测BMMSCs向成骨分化的调节可能是OP治疗中使用的补肾治疗的部分科学依据。进而思考补肾类中药是否可对BMMSCs的功能发挥促进作用。大量实验研究表明,补肾类中药及补肾活血复方可以促进BMMSCs增殖、定向迁移,尤其是对成骨分化作用明显[30]。本课题组前期研究发现,滋阴补肾中药墨旱莲有效改善骨质疏松模型小鼠骨密度低,骨微结构破坏的情况。研究报道,墨旱莲的乙酸乙酯提取物及其成分蟛蜞菊内酯具有促进BMMSCs增殖的作用[31],且蟛蜞菊内酯可以促进BMMSCs向成骨细胞分化[32]。为“肾”与骨代谢的中医理论提供了科学依据。因此,推测EHE可能通过调控BMMSCs的增值,迁移和分化从而发挥治疗OP的作用。本研究结果显示,EHE能促进BMMSCs的迁移和向成骨细胞分化,显著提高CXCR4蛋白表达。
综上,EHE具有促进BMMSCs迁移和向成骨分化作用,其调控BMMSCs迁移的作用机制可能与促进CXCR4蛋白表达相关。本课题组后续将研究EHE对诱导BMMSCs向成骨细胞分化的作用机制,为后续墨旱莲治疗骨质疏松的作用机制提供研究思路。
| [1] |
AWASTHI H, MANI D, SINGH D, et al. The underlying pathophysiology and therapeutic approaches for osteoporosis[J]. Medicinal Research Reviews, 2018, 38(6): 2024-2057. DOI:10.1002/med.21504 |
| [2] |
QI M, ZHANG L Q, MA Y, et al. Autophagy maintains the function of bone marrow mesenchymal stem cells to prevent estrogen deficiency-induced osteoporosis[J]. Theranostics, 2017, 7(18): 4498-4516. DOI:10.7150/thno.17949 |
| [3] |
BARON R, FERRARI S, RUSSELL R G. Denosumab and bisphosphonates: different mechanisms of action and effects[J]. Bone, 2011, 48(4): 677-692. DOI:10.1016/j.bone.2010.11.020 |
| [4] |
王文汇. 抗骨质疏松药物的作用及进展[J]. 中国医刊, 2021, 56(11): 1189-1192. WANG W H. Effects and research progress of anti-osteoporosis drugs[J]. Chinese Journal of Medicine, 2021, 56(11): 1189-1192. DOI:10.3969/j.issn.1008-1070.2021.11.007 |
| [5] |
PAIK J, SCOTT L J. Romosozumab: a review in postmenopausal osteoporosis[J]. Drugs & Aging, 2020, 37(11): 845-855. |
| [6] |
PRATHER C, ADAMS E, ZENTGRAF W. Romosozumab: a first-in-class sclerostin inhibitor for osteoporosis[J]. American Journal of Health-System Pharmacy, 2020, 77(23): 1949-1956. DOI:10.1093/ajhp/zxaa285 |
| [7] |
FRENETTE P S, PINHO S, LUCAS D, et al. Mesenchymal stem cell: keystone of the hematopoietic stem cell niche and a stepping-stone for regenerative medicine[J]. Annual Review of Immunology, 2013, 31: 285-316. DOI:10.1146/annurev-immunol-032712-095919 |
| [8] |
陆吴超, 钱伟宏, 姚志宏, 等. 补肾、活血中药及补肾活血复方对骨髓间充质干细胞增殖、定向迁移及成骨分化的影响及作用机制的研究进展[J]. 中医正骨, 2018, 30(7): 36-38. LU W C, QIAN W H, YAO Z H, et al. Advancement of research on influence of Bushen drugs(TCD), Huoxue drugs(TCD) and BushenHuoxue Compound on proliferation, directional migration and osteogenic differentiation of bone marrow derived mesenchymal stem cells and the mechanism of action[J]. The Journal of Traditional Chinese Orthopedics and Traumatology, 2018, 30(7): 36-38. DOI:10.3969/j.issn.1001-6015.2018.07.011 |
| [9] |
CHUNG I M, RAJAKUMAR G, LEE J H, et al. Ethnopharmacological uses, phytochemistry, biological activities, and biotechnological applications of Ecliptaprostrata[J]. Applied Microbiology and Biote- chnology, 2017, 101(13): 5247-5257. DOI:10.1007/s00253-017-8363-9 |
| [10] |
席庆菊. 墨旱莲的化学成分、药理作用、加工炮制及临床应用研究进展[J]. 中国处方药, 2018, 16(8): 15-17. XI Q J. Research progress on chemical constituents, pharmacological effects, processing and clinical application ofEclipta chinensis[J]. Journal of China Prescription Drug, 2018, 16(8): 15-17. DOI:10.3969/j.issn.1671-945X.2018.08.009 |
| [11] |
ZHANG Z G, BAI D, LIU M J, et al. Therapeutic effect of aqueous extract from Ecliptaeherba on bone metabolism of ovariectomized rats[J]. Menopause (New York, N Y), 2013, 20(2): 232-240. DOI:10.1097/GME.0b013e318265e7dd |
| [12] |
田涛, 傅强, 朱健奎, 等. 二至丸治疗斑马鱼骨质疏松模型效益观察及破骨细胞自噬机制[J]. 南京中医药大学学报, 2020, 36(3): 352-357. TIAN T, FU Q, ZHU J K, et al. Observation on the effect of Erzhi Wan on zebrafish osteoporosis model and study on autophagy mechanism of osteoclast[J]. Journal of Nanjing University of Traditional Chinese Medicine, 2020, 36(3): 352-357. |
| [13] |
刘艳秋, 马慧朋. 墨旱莲提取物调控RANKL/RANK/NF-κB途径抑制破骨细胞骨吸收活性[J]. 中华中医药杂志, 2017, 32(2): 774-777. LIU Y Q, MA H P. Inhibition of osteoclast's bone resorption activity by extract of Ecliptaeherba through controlling RANKL/RANK/NF-κB expression[J]. China Journal of Traditional Chinese Medicine and Pharmacy, 2017, 32(2): 774-777. |
| [14] |
LIU Y Q, HONG Z L, ZHAN L B, et al. Wedelolactone enhances osteoblastogenesis by regulating Wnt/β-catenin signaling pathway but suppresses osteoclastogenesis by NF-κB/c-fos/NFATc1 pathway[J]. Scientific Reports, 2016, 6: 32260. DOI:10.1038/srep32260 |
| [15] |
DU G Y, FU L L, JIA J, et al. Validated UPLC-MS/MS method for quantification of seven compounds in rat plasma and tissues: application to pharmacokinetic and tissue distribution studies in rats after oral administration of extract of Ecliptaprostrata L[J]. Biomedical Chromatography: BMC, 2018, 32(6): e4191. DOI:10.1002/bmc.4191 |
| [16] |
HUANG H K, LIN S M, LOH C H, et al. Association between cataract and risks of osteoporosis and fracture: a nationwide cohort study[J]. Journal of the American Geriatrics Society, 2019, 67(2): 254-260. DOI:10.1111/jgs.15626 |
| [17] |
GUO Q, CHEN Y S, GUO L J, et al. miR-23a/b regulates the balance between osteoblast and adipocyte differentiation in bone marrow mesenchymal stem cells[J]. Bone Research, 2016, 4(1): 16022. DOI:10.1038/boneres.2016.22 |
| [18] |
HOFFMAN C M, HAN J M, CALVI L M. Impact of aging on bone, marrow and their interactions[J]. Bone, 2019, 119(7): 1-7. |
| [19] |
NOLTA JA, GALIPEAU J, PHINNEY DG. Improving mesenchymal stem/stromal cell potency and survival: proceedings from the international society of cell therapy (ISCT) MSC preconference held in May 2018, Palais des Congrès de Montréal, Organized by the ISCT MSC Scientific Committee[J]. Cytotherapy, 2020, 22(3): 123-126. DOI:10.1016/j.jcyt.2020.01.004 |
| [20] |
SU P H, TIAN Y, YANG C F, et al. Mesenchymal stem cell migration during bone formation and bone diseases therapy[J]. International Journal of Molecular Sciences, 2018, 19(8): 2343. DOI:10.3390/ijms19082343 |
| [21] |
MENG S S, XU X P, CHANG W, et al. LincRNA-p21 promotes mesenchymal stem cell migration capacity and survival through hypoxic preconditioning[J]. Stem Cell Research & Therapy, 2018, 9(1): 280. |
| [22] |
张博, 刘娜, 刘洪臣. SDF-1/CXCR-4生物轴的研究进展[J]. 中华老年口腔医学杂志, 2015, 13(2): 101-104. ZHANG B, LIU N, LIU H C. Research progress of SDF-1/CXCR-4 biological axis[J]. Chinese Journal of Geriatric Dentistry, 2015, 13(2): 101-104. DOI:10.3969/j.issn.1672-2973.2015.02.011 |
| [23] |
GRANERO-MOLTÓ F, WEIS J A, MIGA M I, et al. Regenerative effects of transplanted mesenchymal stem cells in fracture healing[J]. Stem Cells (Dayton, Ohio), 2009, 27(8): 1887-1898. DOI:10.1002/stem.103 |
| [24] |
林剑彪, 黄国锋, 叶文斌, 等. SDF-1α/CXCR4信号通路在轴向应力刺激促进骨再生中的作用研究[J]. 中国修复重建外科杂志, 2019, 33(6): 689-697. LIN J B, HUANG G F, YE W B, et al. Effect of stromal cell-derived factor 1α/cysteine X cysteine receptor 4 signaling pathway on axial stress stimulation promoting bone regeneration[J]. Chinese Journal of Reparative and Reconstructive Surgery, 2019, 33(6): 689-697. |
| [25] |
RODRÍGUEZ-MERCHÁN E C. A review of recent developments in the molecular mechanisms of bone healing[J]. International Journal of Molecular Sciences, 2021, 22(2): 767. DOI:10.3390/ijms22020767 |
| [26] |
王志红, 林芸, 叶海燕, 等. 过表达CXCR4促进小鼠骨髓间充质干细胞的归巢和增殖[J]. 细胞与分子免疫学杂志, 2019, 35(5): 393-398. WANG Z H, LIN Y, YE H Y, et al. Over-expression of CXCR4 promotes homing and proliferation of mouse bone marrow mesenchymal stem cells[J]. Chinese Journal of Cellular and Molecular Immunology, 2019, 35(5): 393-398. |
| [27] |
UDALAMATHTHA V L, JAYASINGHE C D, UDAGAMA P V. Potential role of herbal remedies in stem cell therapy: Proliferation and differentiation of human mesenchymal stromal cells[J]. Stem Cell Research & Therapy, 2016, 7(1): 110. |
| [28] |
何丽娟, 初杰. 从中医肾精论干细胞[J]. 辽宁中医药大学学报, 2015, 17(7): 142-144. HE L J, CHU J. Identification of relationship between kidney essence and stem cells[J]. Journal of Liaoning University of Traditional Chinese Medicine, 2015, 17(7): 142-144. |
| [29] |
邵向阳, 张志明, 雍文兴, 等. 补肾中药干预BMSCs增殖分化与"肾藏象理论"的相关性探讨[J]. 时珍国医国药, 2020, 31(4): 913-914. SHAO X Y, ZHANG Z M, YONG W X, et al. Study on the correlation between kidney-tonifying traditional Chinese medicine and the "kidney-storage-symptom theory" in the intervention of BMSCs proliferation and differentiation[J]. Lishizhen Medicine and Materia Medica Research, 2020, 31(4): 913-914. DOI:10.3969/j.issn.1008-0805.2020.04.044 |
| [30] |
ZHAO X, AI J Q, MAO H P, et al. Effects of Ecliptaprostrata on gut microbiota of SAMP6 mice with osteoporosis[J]. Journal of Medical Microbiology, 2019, 68(3): 402-416. DOI:10.1099/jmm.0.000936 |
| [31] |
LIU Y Q, ZHAN L B, LIU T G, et al. Inhibitory effect of Ecliptaeherbaextract and its component wedelolactone on pre-osteoclastic proliferation and differentiation[J]. Journal of Ethnopharmacology, 2014, 157(12): 206-211. |
| [32] |
LIN X H, WU Y B, LIN S, et al. Effects of volatile components and ethanolic extract from Ecliptaprostrata on proliferation and differentiation of primary osteoblasts[J]. Molecules (Basel, Switzerland), 2010, 15(1): 241-250. DOI:10.3390/molecules15010241 |
 2022, Vol. 39
2022, Vol. 39