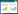文章信息
- 郑旭, 韩燕燕, 顾丽丽, 李翀
- ZHENG Xu, HAN Yanyan, GU Lili, LI Chong
- 消岩汤通过WNT通路抑制肺腺癌A549细胞增殖、促进细胞凋亡的机制研究
- Study on the mechanism of Xiaoyan Decoction inhibiting proliferation and promoting apoptosis of lung adenocarcinoma A549 cells through WNT pathway
- 天津中医药, 2022, 39(3): 369-374
- Tianjin Journal of Traditional Chinese Medicine, 2022, 39(3): 369-374
- http://dx.doi.org/10.11656/j.issn.1672-1519.2022.03.20
-
文章历史
- 收稿日期: 2021-11-25
2. 国家中医针灸临床医学研究中心,天津 300381
中国是世界上肺癌最多的国家,近年来肺癌发病率和病死率仍呈现不断攀升的趋势[1]。肺腺癌约占肺癌的50%,是肺癌最常见组织学类型,总体生存率较低[2]。肺为娇脏,肺癌的病因病机以正虚之内因为主,外因为恶毒内侵,合而生变,终成癌变。治疗上以扶正为主、解毒祛瘀。消岩汤可扶正固本,是在“解毒祛瘀,扶正抗癌”中医肿瘤治则基础上依据现代药理研究开发出的院内制剂,具有多种抗肿瘤活性,临床治疗效果较好[3-4]。但消岩汤调控肿瘤细胞的作用机制仍有待研究。本研究发现了消岩汤对肺腺癌细胞增殖、凋亡等生物学行为的影响,以及消岩汤对WNT/β-catenin通路的调控作用。为消岩汤治疗肺腺癌的机制研究提供了新思路。
1 实验材料 1.1 细胞人肺腺癌A549细胞购自ATCC。
1.2 试剂中药消岩汤(制剂号40019)是天津中医药大学第一附属医院院内制剂,由黄芪、太子参、夏枯草、姜黄、郁金、白花蛇舌草组成。其主要化学成分为黄芪多糖、太子参环肽、夏枯草皂苷、姜黄素、齐墩果酸、熊果酸等[5-10]。经严格回流提取,其终浓度为含生药0.3 g/mL。中药消岩汤10 000 r/min,离心半径10 cm,离心3 min,用0.22 μm过滤器除菌,用培养基稀释成梯度浓度的溶液。
WNT通路激动剂SKL2001,WNT通路抑制剂XAV939,均购自美国Selleck.cn公司。CCK8(江苏凯基生物技术股份有限公司,南京),聚合酶链式反应(RT-PCR)提取试剂盒及扩增试剂盒(北京康为世纪生物科技有限公司,北京),凋亡试剂盒(南京诺唯赞生物科技股份有限公司,南京),双荧光报告检测试剂盒(普洛麦格生物技术有限公司,北京),乳酸脱氢酶(LDH)试剂盒(Roche Applied Science,美国)。
2 实验方法 2.1 A549肺腺癌细胞培养A549细胞使在含10%胎牛血清的RPMI-DMEM培养液中常规培养,细胞密度达80%~90%时进行实验。
2.2 乳酸脱氢酶(LDH)检测将A549细胞接种在96孔板中,密度为1×108/L,设3个复孔,每孔100 μL,培养24 h待细胞贴壁后,分别加入不同药物,实验分组空白对照组、梯度浓度消岩汤组(100、50、10 g/L),梯度浓度XAV939组(10、5、1 μmol/L),梯度浓度SKL2001组(20、10、50 μmol/L)、消岩汤(10 g/L)加SKL2001组(10 μmol/L),继续培养48 h后,取上清液60 μL到新的孔中,加入已经配置好的30 μL的LDH检测工作液,避光孵育30 min,测定A值(490 nm)。LDH释放率(%)=培养液LDH含量/(培养液LDH含量+细胞裂解液LDH含量)×100%。
2.3 CCK8法检测将A549细胞接种于96孔板中(5 000个/孔)。实验分组对照组、为消岩汤组(浓度10 g/L)、消岩汤(10 g/L)加SKL2001组(10 μmol/L),SKL2001组(10 μmol/L)、XAV939组(5 μmol/L)每孔200 μL,对照组加入200 μL培养基。培养24、48、72 h后每孔加入20 μL CCK8溶液,37 ℃再孵育4 h后取出。检测各孔吸光度(A值)波长为490 nm,实验重复3次。
2.4 细胞凋亡率检测药物处理细胞48 h后收集细胞,加入PBS把细胞浓度调整到2×106/mL,每组取1 mL的细胞悬液,1 000 r/min,离心半径8 cm,4 ℃离心10 min,在细胞沉淀中用冰预冷PBS洗涤两次,在细胞中加入缓冲液200 μL混合均匀,依次加入5 μL碘化丙啶(PI)和5 μL的膜联蛋白V-FITC(Annexin V-FITC),避光环境,室温,静置15 min,加300 μL缓冲液,用流式细胞仪分析测定对照组、XAV939组、消岩汤组、WNT通路激动剂SKL2001组及消岩汤联合SKL2001组的细胞凋亡率。实验重复3次。
2.5 RT-PCR检测β-catenin、c-myc、Bcl-2、Caspase-3表达情况实验分组为对照组、中药组和XAV939组,给药后48 h提取细胞RNA,检测mRNA浓度,反转录(85 ℃ 45 min,4 ℃ 10 min)合成cDNA。最后进行PCR扩增,根据RT-PCR试剂盒说明书,设定程序为:95 ℃预变性10 min,95 ℃变性10 s,58 ℃退火30 s,72 ℃延伸32 s,40个循环。内参基因为GAPDH,实验重复3次,2-ΔΔCt法计算DNA水平。反应引物见表 1。
向各组细胞中共转染WNT信号传导通路活性报告基因质粒pGL3-OT或pGl3-OF,pRL-TK质粒为荧光素酶内对照质粒。转染48 h后检测报告基因表达情况。检测最终值为各给药组WNT通路活性比值与内对照的比值(WNT信号传导通路活性以pGL3-OT/pGL3-OF比值表示,以内对照质粒组值作为对照值),所有实验重复3次。
2.7 统计学分析数据应用SPSS18.0软件分析。数据资料用均数±标准差(x±s)表示,多组间比较采用单因素方差分析,组间两两比较用LSD-t检验,P < 0.05为差异具有统计学意义。
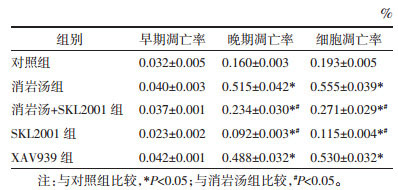
3 结果 3.1 消岩汤抑制A549细胞增殖的效果及对LDH释放的影响为筛选最适给药浓度,应用LDH检测梯度浓度XAV939组、消岩汤组、SKL2001组细胞毒性。结果发现与对照组比较,10 μmol/L XAV939组,100 g/L和50 g/L消岩汤组及20 μmol/L SKL2001组均具有显著的细胞毒性(P < 0.01)。所以为排除细胞毒性影响,选择药物浓度为5 μmol/L XAV939,10 g/L消岩汤,10 μmol/L SKL2001(图 1A)进行后续实验。CCK8检测对照组、消岩汤组,消岩汤加SKL2001组、SKL2001组、XAV939组细胞存活率。SKL2001组与对照组比较,细胞存活率上升,说明SKL2001作用后,细胞增殖率升高。而消岩汤组、消岩汤+SKL2001组、XAV939组与对照组比较,均可抑制细胞存活率,差异有统计学意义(P < 0.05)。结果表明3组均可以抑制细胞增殖。此外,消岩汤组细胞存活率明显低于消岩汤+SKL2001组,表明消岩汤+SKL2001组对单独消岩汤组细胞增殖的抑制有恢复作用(见图 1B)。
|
| 注:A.不同药物、不同浓度对细胞毒性的影响;B.各实验组不同时间OD值。1.对照组;2. XAV939 10 μmol/L;3. XAV939 5 μmol/L;4. XAV939 1 μmol/L;5. 消岩汤组100 g/L;6. 消岩汤组50 g/L;7. 消岩汤组10 g/L;8. SKL2001 20 μmol/L;9. SKL2001 10 μmol/L;10.SKL2001 5 μmol/L;11.消岩汤组+SKL2001;与对照组比较,*P < 0.05。 图 1 消岩汤抑制A549细胞增殖 Fig. 1 Xiaoyan Decoction inhibited the proliferation of A549 cells |
采用AnnexinV-FITC/PI双染法检测A549细胞凋亡情况,消岩汤组、消岩汤+SKL2001组与对照组细胞晚期凋亡率、细胞凋亡率比较,差异有统计学意义(P < 0.05)。见表 2。结果表明,消岩汤组作用后细胞晚期凋亡明显增多,而各组早期凋亡率无明显差异。SKL2001组与对照组比较细胞晚期凋亡率减少,表明WNT通路激动剂SKL2001能够抑制肿瘤细胞凋亡。消岩汤组与消岩汤联合SKL2001组比较晚期凋亡率更高,表明消岩汤组促进细胞凋亡能力优于消岩汤联合SKL2001组,SKL2001可以减弱消岩汤的促细胞凋亡作用。而消岩汤组与XAV939组比较晚期凋亡率更高,表明消岩汤组促进细胞凋亡能力优于XAV939抑制剂组。
为探究消岩汤对WNT通路的作用。检测了消岩汤组、WNT通路抑制剂XAV939组、对照组给药48 h后β-catenin、c-myc的表达。结果消岩汤组、XAV939组与对照组比较,β-catenin表达明显下调,均有统计学意义(P < 0.05),各实验组与对照组比较,c-myc表达明显下调,差异均有统计学意义(P < 0.05),说明消岩汤和XAV939均可以下调低β-catenin和c-myc表达,两者作用效果无明显差异。见图 2。
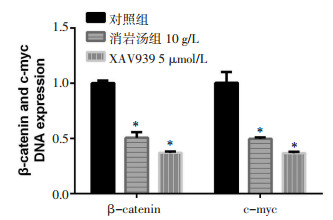
|
| 注:与对照组比较,*P < 0.05。 图 2 各组β-catenin、c-myc的DNA表达水平 Fig. 2 β-catenin and c-myc DNA expression levels in each group |
转染荧光素酶报告基因质粒以检测WNT信号传导通路的活性,消岩汤、XAV939给药后WNT通路的活性显著降低,见图 3。与对照组比较,WNT通路活性明显降低(P < 0.05)。该检测明确了消岩汤可以降低WNT通路的活性,同时也佐证了RT-PCR实验结果与WNT通路相关性。
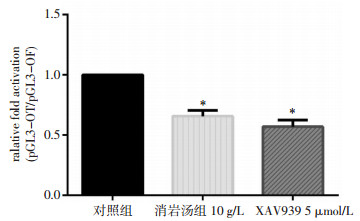
|
| 注:与对照组比较,*P < 0.05。 图 3 各组中WNT通路活性表达情况 Fig. 3 Activity expression of WNT pathway in each group |
检测了消岩汤和XAV939抑制剂给药48 h后凋亡通路相关基因Bcl-2、Caspase-3的表达。结果消岩汤组、XAV939组与对照组比较,抗凋亡基因Bcl-2表达明显下调,差异均有统计学意义(P < 0.05),说明消岩汤和XAV939均可以显著降低Bcl-2表达。各实验组与对照组比较,Caspase-3表达明显上调,差异均有统计学意义(P < 0.05),见图 4。
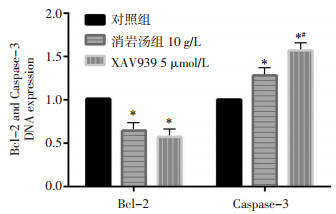
|
| 注:与对照组比较,*P < 0.05。 图 4 各组中凋亡相关基因Bcl-2、Caspase-3的DNA表达 Fig. 4 DNA expression of apoptosis-related genes Bcl-2 and Caspase-3 in each group |
WNT经典通路又称为Wnt/β-catenin通路,该通路激活后导致细胞质内β-catenin稳定并积累而不能被降解,进而进入细胞核内可激活下游靶基因的表达及转录等[11-12]。研究发现,在膀胱癌中,下调WNT通路可以提高癌细胞的化学敏感性[13]。基因表达图谱分析表明,WNT信号传导主要参与乳腺癌的扩散和转移过程[14]。在结直肠癌中,异常的WNT信号对肿瘤干细胞的肿瘤发生和维持至关重要[15]。WNT通路抑制剂XAV939与紫杉醇联合使用,可以通过抑制WNT信号传导来抑制乳腺癌的转移、血管生成和生长[16]。WNT通路抑制剂—2,4-二氨基喹唑啉,可以抑制胃癌的进展和转移[17]。随WNT/β-catenin信号在许多类型的癌症中被激活被证实,WNT通路抑制剂也逐渐成为肿瘤治疗新靶点[18-22].
近年来,无论是中药单体还是中药复方,在肿瘤治疗中的作用越来越受到重视,其作用机制研究也越来越深入。研究发现人参皂苷Rh1可以通过WNT通路抑制肺腺癌A549细胞增殖[23]。灵芝三萜可以通过WNT通路调节下游靶蛋白c-myc、Caspase-3,CyclinD-1表达,从而调节细胞周期和凋亡[24]。益肺逐积方通过下调EGFR、GPRR30蛋白表达水平,进而抑制人肺腺癌A549细胞增殖并诱导其发生凋亡[25]。消岩汤抗肿瘤机制可能是诱导肿瘤细胞凋亡[26]。
本课题根据“扶正、解毒、祛瘀”的肺癌治疗原则,应用临床经验方剂“消岩汤”治疗肺腺癌,该制剂抗肿瘤活性强,临床应用广泛[27]。其中,黄芪、太子参共为君药,滋阴气,扶正抗肿瘤;夏枯草、牡蛎、白花蛇舌草为臣药,清热解毒,软坚散结;佐以姜黄、郁金行气散结,活血解瘀。全方扶正抗癌、解毒祛瘀,全面调节,祛邪而不伤正[28]。
本研究首先证实了消岩汤具有抑制肺腺癌A549细胞增殖、促进其凋亡的生物学特点。为进一步验证消岩汤可以通过WNT通路抑制细胞增殖,促进细胞凋亡,应用消岩汤组联合WNT通路激动剂进行重复实验。首先采用CCK8测定对照组、XAV939组、SKL2001组、消岩汤组和消岩汤联合SKL2001组细胞存活率,发现后者两组均可以抑制肿瘤细胞增殖,但是消岩汤组细胞存活率明显低于消岩汤联合SKL2001组,说明消岩汤虽然可以抑制WNT通路活性,但是消岩汤联合WNT通路激动剂SKL2001后,抑制WNT通路的活性减弱了,从而对肿瘤细胞的抑制增殖作用也削减了。进一步采用AnnexinV-FITC/PI双染法检测各组A549细胞凋亡率,发现早期凋亡率各组间无明显差异。消岩汤组以诱导细胞晚期凋亡为主,且该组晚期凋亡率和细胞凋亡率均高于消岩汤联合SKL2001组,说明消岩汤组促进肿瘤细胞凋亡的能力优于联合组,推测联合组通过恢复激活WNT通路降低了消岩汤的促肿瘤凋亡能力,进一步证实了消岩汤通过下调WNT通路促进A549细胞凋亡的药理学效应。为进一步发现消岩汤对WNT信号转导通路的作用方式和机制,在裂解肺腺癌A549细胞核后,选取了RT-PCR方法和WNT通路活性分析检测核RNA的表达和WNT通路活性表达情况,结果发现对照组A549细胞核β-catenin基因、c-myc基因表达较强;而经消岩汤作用48 h后,β-catenin、c-myc基因的表达均下调(P < 0.05)。提示消岩汤可能通过抑制胞质内β-catenin蛋白入核,下调WNT信号转导通路活性,进而减少下游靶基因c-myc的表达。WNT通路活性检测也证实了消岩汤可以明显降低WNT通路活性,其作用与WNT通路抑制剂XAV939组效果基本一致。此外,通过检测各组凋亡相关基因Bcl-2、Caspase-3的表达,发现消岩汤可以显著降低抗凋亡基因Bcl-2表达,上调Caspase-3基因表达。由此,推测消岩汤可能是通过阻止β-catenin入核,下调了WNT通路活性,抑制肺腺癌细胞增殖。通过抑制WNT通路后,进而下调下游靶基因c-myc表达,并通过对凋亡相关基因Bcl-2、Caspase-3的调控促进了细胞凋亡。
综上,扶正祛瘀解毒法经典复方“消岩汤”对肺腺癌肿瘤细胞促凋亡和抗增殖作用明显,且对WNT经典通路抑制作用突出,但是本研究对机制调节的探讨尚不完善,仍有待进一步研究。
| [1] |
NASIM F, SABATH B F, EAPEN G A. Lung cancer[J]. The Medical clinics of North America, 2019, 103(3): 463-473. DOI:10.1016/j.mcna.2018.12.006 |
| [2] |
HONG J H, PARK S, KIM H, et al. Volume and mass doubling time of lung adenocarcinoma according to WHO histologic classification[J]. Korean Journal of Radiology, 2021, 22(3): 464-475. DOI:10.3348/kjr.2020.0592 |
| [3] |
陈阳昊, 姚奇谷, 彭心怡, 等. 中药对人肺腺癌A549细胞的作用及机制研究进展[J]. 浙江中医药大学学报, 2019, 43(4): 382-386, 392. CHEN Y H, YAO Q G, PENG X Y, et al. The experimental researches advances in traditional Chinese medicine on human pulmonary adenocarcinoma A549 cells[J]. Journal of Zhejiang Chinese Medical University, 2019, 43(4): 382-386, 392. |
| [4] |
杨佩颖, 贾英杰, 陈军, 等. 消岩汤不同时段给药联合化疗对气虚毒瘀证非小细胞肺癌免疫功能影响的临床研究[J]. 新中医, 2011, 43(4): 64-65. YANG P Y, JIA Y J, CHEN J, et al. Clinical study on the effect of different time-period administration of Xiao Yan Decoction combined with chemotherapy on immune function of non-small cell lung cancer[J]. Journal of New Chinese Medicine, 2011, 43(4): 64-65. |
| [5] |
胡妮娜, 张晓娟. 黄芪的化学成分及药理作用研究进展[J]. 中医药信息, 2021, 38(1): 76-82. HU N N, ZHANG X J. Research progress on chemical constituents and pharmacological effects of Astragalus Membranaceus[J]. Information on Traditional Chinese Medicine, 2021, 38(1): 76-82. |
| [6] |
宋叶, 林东, 梅全喜, 等. 太子参化学成分及药理作用研究进展[J]. 中国药师, 2019, 22(8): 1506-1510. SONG Y, LIN D, MEI Q X, et al. Study advances in chemical constituents and pharmacological activities of Radix Pseudostellariae[J]. China Pharmacist, 2019, 22(8): 1506-1510. DOI:10.3969/j.issn.1008-049X.2019.08.034 |
| [7] |
卢旻昱, 刘铜华, 侯毅, 等. 夏枯草的药理作用及研究进展述要[J]. 世界最新医学信息文摘, 2019, 19(31): 31-33. LU M Y, LIU T H, HOU Y, et al. Summary of pharmacological action and research progress of Prunella Vulgaris[J]. World Latest Medicine Information, 2019, 19(31): 31-33. |
| [8] |
魏雨菲, 于海川, 刘雪玲, 等. 姜黄主要化学成分及药理作用研究进展[J]. 新乡医学院学报, 2020, 37(10): 990-995. WEI Y F, YU H C, LIU X L, et al. Research progress of chemical constituents and pharmacological action of Curcuma Longa L.[J]. Journal of Xinxiang Medical University, 2020, 37(10): 990-995. |
| [9] |
袁晓旭, 杨明明, 赵桂琴. 郁金化学成分及药理作用研究进展[J]. 承德医学院学报, 2016, 33(6): 487-489. YUAN X X, YANG M M, ZHAO G Q. Advances in chemical constituents and pharmacological action of Curcuma Longa L.[J]. Journal of Chengde Medical College, 2016, 33(6): 487-489. |
| [10] |
浦飞飞, 陈凤霞, 夏平. 白花蛇舌草抗肿瘤化学成分和作用机制的研究进展[J]. 癌症进展, 2019, 17(17): 1985-1988, 1996. PU F F, CHEN F X, XIA P. Advances in antitumor chemical constituents and mechanisms of Spreading Hedyotis Herb[J]. Oncology Progress, 2019, 17(17): 1985-1988, 1996. |
| [11] |
WU G L, WENG W D, XIA P F, et al. Wntsignalling pathway in bladder cancer[J]. Cellular Signalling, 2021, 79(6): 109886. |
| [12] |
RUAN Y, OGANA H, GANG E, et al. Wnt signaling in the tumor microenvironment[J]. Adv Exp Med Biol, 2021, 1270(8): 107-121. |
| [13] |
SHAN G, ZHOU X K, GU J, et al. Correction to: downregulated exosomal microRNA-148b-3p in cancer associated fibroblasts enhance chemosensitivity of bladder cancer cells by downregulating the Wnt/β-catenin pathway and upregulating PTEN[J]. Cellular Oncology (Dordrecht), 2021, 44(4): 959. |
| [14] |
XU X F, ZHANG M F, XU F Y, et al. Wnt signaling in breast cancer: biological mechanisms, challenges and opportunities[J]. Molecular Cancer, 2020, 19(1): 165. DOI:10.1186/s12943-020-01276-5 |
| [15] |
ZHAN T Z, AMBROSI G, WANDMACHER A M, et al. MEK inhibitors activate wnt signalling and induce stem cell plasticity in colorectal cancer[J]. Nature Communications, 2019, 10(2): 2197. |
| [16] |
SHETTI D, ZHANG B, FAN C H, et al. Low dose of paclitaxel combined with XAV939 attenuates metastasis, angiogenesis and growth in breast cancer by suppressing Wnt signaling[J]. Cells, 2019, 8(8): E892. DOI:10.3390/cells8080892 |
| [17] |
CHANG T S, LU C K, HSIEH Y Y, et al. 2, 4-diamino-quinazoline, a Wnt signaling inhibitor, suppresses gastric cancer progression and metastasis[J]. International Journal of Molecular Sciences, 2020, 21(16): E5901. DOI:10.3390/ijms21165901 |
| [18] |
HE S Y, WANG W, WAN Z Y, et al. Correction to: FAM83B inhibits ovarian cancer cisplatin resistance through inhibiting Wnt pathway[J]. Oncogenesis, 2021, 10(2): 14. DOI:10.1038/s41389-021-00303-4 |
| [19] |
YE J Q, CHU C M, CHEN M, et al. TROAP regulates prostate cancer progression via the WNT3/survivinsignalling pathways[J]. Oncology Reports, 2019, 41(2): 1169-1179. |
| [20] |
CHEN D S, LIN X T, ZHANG C, et al. Activated Wnt signaling promotes growth and progression of AFP-producing gastric cancer in preclinical models[J]. Cancer Management and Research, 2019, 11(1): 1349-1362. |
| [21] |
YANG F, GUO Z F, HE C, et al. Cancer-associated fibroblasts promote cell proliferation and invasion via paracrine Wnt/IL-1β signaling pathway in human bladder cancer[J]. Neoplasma, 2021, 68(1): 79-86. DOI:10.4149/neo_2020_200202N101 |
| [22] |
WANG J, MOOK R A, REN X R, et al. Identification of DK419, a potent inhibitor of Wnt/β-catenin signaling and colorectal cancer growth[J]. Bioorganic & Medicinal Chemistry, 2018, 26(20): 5435-5442. |
| [23] |
谭晖, 李恩孝, 李毅, 等. 人参皂苷Rh1通过Wnt通路抑制肺腺癌A549细胞增殖的机制探讨[J]. 现代肿瘤医学, 2020, 28(18): 3134-3137. TAN H, LI E X, LI Y, et al. Investigation of the involvement of Wnt pathway in the inhibitory effect of ginsenoside Rh1 on the proliferation of lung adenocarcinoma A549 cells[J]. Journal of Modern Oncology, 2020, 28(18): 3134-3137. |
| [24] |
蔡蕤. 灵芝三萜通过Wnt/β-catenin信号通路对肝癌细胞增殖和凋亡的影响[J]. 中成药, 2020, 42(5): 1320-1324. CAI R. Effect of teriter pen es of ganoderma lucidum on liver cancer cell proliferation and ap opto sis by Wnt/β-catenin signaling pathway[J]. Chinese Traditional Patent Medicine, 2020, 42(5): 1320-1324. |
| [25] |
蒋时红, 吴耀松, 孙超龙, 等. 益肺逐积方诱导人肺腺癌A549细胞凋亡机制[J]. 中国实验方剂学杂志, 2018, 24(5): 131-136. JIANG S H, WU Y S, SUN C L, et al. Mechanism of Yifei Zhuji Prescription on inducing human lung adenocarcinoma A549 cells apoptosis[J]. Chinese Journal of Experimental Traditional Medical Formulae, 2018, 24(5): 131-136. |
| [26] |
张欣, 张莹, 杨佩颖, 等. 基于RNA干扰技术探讨消岩汤对肺腺癌A549细胞凋亡的影响[J]. 药物评价研究, 2015, 38(3): 288-291. ZHANG X, ZHANG Y, YANG P Y, et al. Investigation on influence of Xiaoyan Decoction on lung adenocarcinoma cancer cell A549 apoptosis based on siRNA interference[J]. Drug Evaluation Research, 2015, 38(3): 288-291. |
| [27] |
张欣, 贾英杰, 杨佩颖, 等. 消岩汤含药血清介导下Survivin siRNA对人肺腺癌A549细胞增殖及凋亡的影响[J]. 天津中医药, 2017, 34(2): 113-116. ZHANG X, JIA Y J, YANG P Y, et al. Effect of survivin siRNA on human lung adenocarcinoma A549 cell proliferation and apoptosis mediated by drug-containing serum of Xiaoyan Decoction[J]. Tianjin Journal of Traditional Chinese Medicine, 2017, 34(2): 113-116. |
| [28] |
朱津丽, 贾英杰, 张硕, 等. 消岩汤联合大株红景天注射液改善恶性肿瘤患者血液高凝状态的临床研究[J]. 天津中医药, 2018, 35(11): 813-815. ZHU J L, JIA Y J, ZHANG S, et al. Clinical study on Xiaoyan Decoction combined with Sofren injection in improving hypercoagulability of malignant tumor patients[J]. Tianjin Journal of Traditional Chinese Medicine, 2018, 35(11): 813-815. |
2. National Clinical Research Center for Chinses Medicine Acupuncture and Moxibustion, Tianjin 300381, China
 2022, Vol. 39
2022, Vol. 39