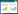文章信息
- 李娜, 吴阳阳, 段锦龙, 郑旭彤, 姚魁武
- LI Na, WU Yangyang, DUAN Jinlong, ZHENG Xutong, YAO Kuiwu
- 解郁祛痰化浊方干预高脂饮食大鼠肠道菌群多样性的探讨
- Study on the intervention of Jieyu Qutan Huazhuo Prescription on diversity of intestinal flora in rats with high fat diet
- 天津中医药, 2022, 39(3): 375-379
- Tianjin Journal of Traditional Chinese Medicine, 2022, 39(3): 375-379
- http://dx.doi.org/10.11656/j.issn.1672-1519.2022.03.21
-
文章历史
- 收稿日期: 2021-12-12
2. 洛阳市中医院心血管科二病区,洛阳 471000;
3. 中国中医科学院广安门医院,北京 100053
高脂血症在中医学上一般将其归属于“胸痹”“眩晕”“痰湿”等范畴。多以脾失健运、肾精不足、肝失疏泄为本,痰浊、内湿、瘀血为标,是一种本虚标实证。《灵枢·本输》云:“大肠、小肠皆属于胃。”中医脾胃包含大肠、小肠在内的整个消化系统。同时肠道菌群是人体的第二基因组,中药汤剂经口服进入消化道,势必影响肠道菌群的结构,从而影响肠道微生物群而发挥作用[1-2]。国医大师薛伯寿认为肝气郁结,阻碍气机,脾失健运,水湿内停,导致高脂血症的发生。姚魁武教授在传承薛教授学术思想基础上,以二陈汤合越鞠丸加减组成解郁祛痰化浊方,临床治疗气郁痰阻型高脂血症效果良好。但解郁祛痰化浊方发挥临床作用的机制未明。本研究旨在探讨解郁祛痰化浊方干预高脂饮食大鼠肠道菌群的多样性及对相关血清学指标的影响。
1 材料 1.1 动物雄性SPF级别Wistar大鼠70只,体质量(200±20)g,由北京维通利华实验动物技术有限公司提供,许可证号:SCXK(京)2016-0006,所有动物饲养在中国中医科学院广安门医院动物房清洁级环境内,室温控制在21~24 ℃,相对湿度维持在40%~50%,光照12 h(白日光照12 h,夜间黑暗12 h),自由取食动物饮用水,大鼠适应性喂养1周后,称重,剔除异常大鼠。
1.2 实验药品解郁祛痰化浊方组成:香附10 g,陈皮8 g,法半夏9 g,茯苓10 g,苍术10 g,砂仁5 g,神曲15 g,焦山楂15 g,炒栀子10 g,川芎9 g。由中国中医科学院广安门医院药剂科提取,浓缩制成颗粒剂。立普妥片(辉瑞制药有限公司,批号:AL6069);血脂康胶囊(北京北大维信生物科技有限公司,批号:20180204)。解郁祛痰化浊方的临床用量参照《药理实验方法学》[3],故所对应的中剂量颗粒剂为0.8 g/kg。低剂量组为0.4 g/kg,高剂量组为1.6 g/kg。立普妥组为2 mg/kg。血脂康组为0.1 g/kg。
1.3 试剂水合氯醛(国药集团化学试剂北京有限公司);10%中性福尔马林、无水乙醇(致远化学科技有限公司);TIANGEN粪便基因组DNA提取试剂盒(天根生化科技北京有限公司);KAPA HiFi HotStart DNA Polymerase(美国KAPA Biosystems公司);Midori Green Advance DNA Stain(德国Midori Greeng公司);AMPure XP(德国Beackman公司)。
1.4 仪器DW-25L92超低温保存箱(海尔生物医疗);VORTEX-5涡旋振荡仪(美国ScientificIndustries公司);Centrifuge 581015810R高速冷冻离心机(德国Eppendorf公司);2720热循环PCR仪(中国赛默飞世尔科技有限公司);Alpha凝胶成像系统(美国ProteinSimple公司);Hiseq2500/1500测序仪(美国Illumina公司)。
2 方法 2.1 高脂血症大鼠模型的制备及给药70只SPF大鼠适应性饲养1周后,采用随机数字表法分为正常组、模型组、血脂康组、立普妥组、解郁祛痰化浊方低、中、高剂量组,每组10只。正常组大鼠给予普通饲料喂养饲料由斯贝尔(北京)生物技术有限公司提供,许可证号:SCXK(京)2015-0015,其余组给予高脂饲料。饲料由北京华阜康生物科技股份有限公司提供,许可证号:SCXK(京)2019-0008。喂养期间自由摄食、饮水12周,建立高脂血症动物模型。在饲喂12周后,解郁祛痰化浊方剂量低、中、高剂量分别灌胃给予0.8、0.4、1.6 g/kg,立普妥组予立普妥2 mg/kg,血脂康组予血脂康0.1 g/kg,正常组和模型组大鼠灌胃同等量蒸馏水,8周后取材。
2.2 大鼠血液生化指标的测定在药物干预8周后,大鼠腹主动脉采血4~6 mL检测血清中测胆固醇(TC)、三酰甘油(TG)、低密度脂蛋白(LDL-C)、高密度脂蛋白(HDL-C)的含量。
2.3 粪便取样与检测药物干预8周后取材,收集大鼠粪便将其放入-80 ℃冰箱中保存,进行大鼠粪便总DNA提取建库及质检,扩增16S V3-4区等16S rRNA基因测序检测。
2.4 数据处理应用SPSS 24.0统计软件进行统计分析计算,结果以均数±标准差(x±s)表示。数据若符合正态分布及方差齐,多组间比较采用单因素方差分析(ANOVA),组间多重比较采用LSD-t检验;若不符合正态分布或方差齐,组间比较采用秩和检验,P < 0.05为差异有统计学意义。
3 结果 3.1 大鼠体质量的测定称取给药8周后大鼠的体质量,观察每组大鼠的体质量的变化。如表 1,与正常组比较,模型组大鼠体质量明显增加(P < 0.01)。药物干预8周后,与模型组比较,血脂康组、解郁祛痰化浊方低、高剂量组大鼠体质量明显下降(P < 0.05),差异具有统计学意义。
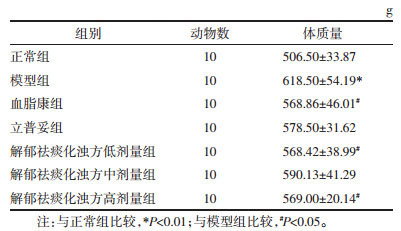
如表 2,同正常组比较,模型组大鼠血脂4项TC、TG、LDL-C均见明显升高,HDL-C降低(P < 0.01)。同模型组比较,血脂康组TC、TG显著性下降(P < 0.01),HDL-C升高(P < 0.05)、立普妥组TC、TG明显降低(P < 0.01);中药低剂量组TC、TG显著降低(P < 0.01);解郁祛痰化浊方中剂量组TC、TG、LDL-C显著降低(P < 0.01),差异具有统计学意义;解郁祛痰化浊方高剂量组TC、TG显著降低(P < 0.01),HDL-C升高(P < 0.05),差异具有统计学意义。
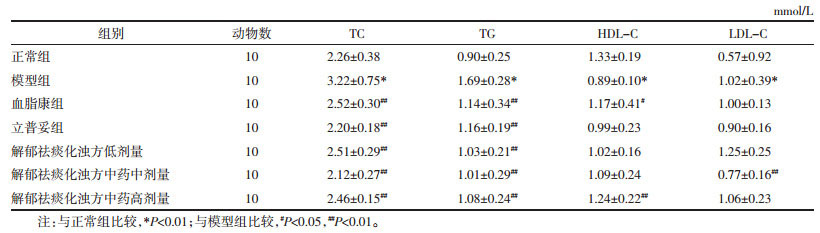
基于丰度前15的物种进行样本间的物种组成差异分析,从门层次结构分类上看,大鼠肠道菌群相对丰度中前5位的主要的菌种为厚壁菌门、拟杆菌门、变形菌门、放线菌门、疣微菌门。从纲层次结构分类上看,主要的菌群主要有梭菌纲、芽孢杆菌纲、拟杆菌纲、丹毒丝菌纲、变形菌纲。从目层次结构分类上看,主要的菌群包括梭菌、乳杆菌、拟杆菌、丹毒丝菌、脱硫弧菌。从科层次结构分类上看,前五位的菌群是毛螺菌科、瘤胃球菌科、乳杆菌科、韦荣球菌科、拟杆菌S24-7。从属层次菌落结构图上看主要为:布劳特氏菌属、乳杆菌属、瘤胃菌UCG-005等。见图 1。
|
| 图 1 物种在门、纲、目、科、属各层次上的分类结果 Fig. 1 Classification results of species at the levels of phylum, class, order, family, and genus |
LEfSe采用线性判别分析(LDA)来估算每个组分(物种)丰度对差异效果影响的大小,在组与组之间寻找组间差异显著的物种。结果在菌门中得出差异:正常组厚壁菌门较模型组低(P < 0.01),拟杆菌门较模型组高(P < 0.01)。拟杆菌门解郁祛痰化浊方中剂量组较模型组增高(P < 0.05)。F/B模型组显著高于正常组(P < 0.01),解郁祛痰化浊方中剂量组低于模型组(P < 0.01),见图 2。
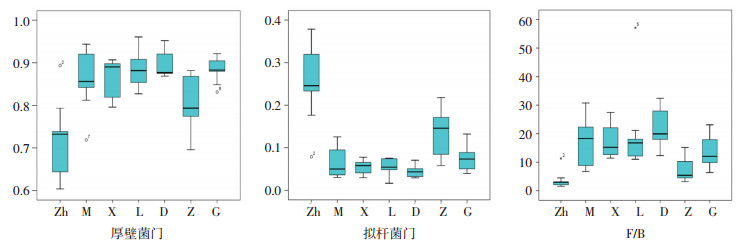
|
| 注:Zh.正常组;M.模型组;X.血脂康组;L.立普妥组;D.解郁祛痰化浊方低剂量组;Z.解郁祛痰化浊中剂量组;G.解郁祛痰化浊高剂量组。 图 2 厚壁菌门,拟杆菌门及F/B箱型图 Fig. 2 Firmicutes, Bacteroidetes and F/B box plots |
国医大师薛伯寿认为气郁痰阻为血脂异常当下的主要病理因素,嗜食肥甘厚味者,膏脂积存胃中,脾脏转输不及,变为痰浊积存胃中,影响气血生化。肝胆脾胃同居中焦,肝胆疏泄有度,脾胃才能运化正常,今脾胃痰浊雍滞,升降失常,肝胆疏泄之气受到影响,亦会出现雍滞,从而病变涉及肝胆,出现土壅木郁之状况。在此认识的基础上,姚魁武教授依据薛教授经验,创立解郁祛痰化浊方在临床中治疗血脂异常,效果显著。该方由越鞠丸加二陈丸化裁而成,越鞠丸疏解六郁,二陈汤祛痰理气,两者合用共奏解郁祛痰,化浊调气之效。研究表明[4]肠道菌群生物物种丰度度降低与血脂异常相关。根据本实验物种结构分析中,发现正常组与模型组大鼠的肠道菌群结构发生了明显差异,高脂饮食诱使大鼠肠道菌群的物种多样性及丰度显著下降,经各药物组干预后物种的多样性较模型组均增高。
短链脂肪酸其受体在激活后能促进脂肪细胞的分化,影响脂质沉积和体质量情况[5]。模型组大鼠的血脂4项TC、TG、LDL-C均见明显升高,HDL-C降低,说明高脂血症大鼠造模成功。同模型组比较,在药物干预8周后,发现各用药组可明显调节高脂血症大鼠血脂水平,TC、TG均可见显著降低,另外解郁祛痰化浊方中剂量组显著降低LDL-C水平,解郁祛痰化浊方高剂量组以及血脂康组可提高HDL-C水平。牟菲等[6]发现高脂血症组与非高脂血症组患者肠道菌群有30个差异菌群,而拟杆菌属为高脂血症与非高脂血症间的关键菌群。据研究,F/B值的升高与肥胖密切相关,F/B比值越高,产生的氧化三甲胺(TMAO)越多,而TMAO可以促进肝脏脂肪变性、胆固醇代谢失衡等的发生[7-8]。另有文献指出,从心论治方可以调节高脂饮食小鼠的血脂水平,在肠道菌群中提高拟杆菌门[9]。小檗碱可通过调节肠道微生物降低厚壁门的比例,从而降低血脂水平、减低体质量[10]。由此可见拟杆菌门与厚壁菌门在调脂方面的重要性。本实验发现血脂康组,解郁祛痰化浊方低剂量组、高剂量组大鼠体质量均下降。统计所有样本在门类上的分类结果,从门层次结构分类上看,大鼠肠道菌群相对丰度中前5位的主要的菌种为厚壁菌门、拟杆菌门、变形菌门、放线菌门、疣微菌门。LDA组间差异分析发现中药组的F/B值与模型组相比显著降低,且解郁祛痰化浊方中剂量组的比值最接近于正常组,同时模型组厚壁菌门多于拟杆菌门,这与上述研究结果相一致,解郁祛痰化浊方可能通过调节肠道菌群F/B的丰度从而改善血脂水平,降低体质量。
脂质代谢异常作为心血管疾病的重要接触点,本实验结果分析了高脂饮食大鼠肠道菌群的物种结构,统计样本在门、纲、目、科、属各层次上的分类结果。同时证实了解郁祛痰化浊方以气郁痰阻为病机立方,可以调节高脂饮食大鼠血脂,降低体质量,调节F/B的比值及其他菌群多样性。
| [1] |
郑礼胜, 邰文, 兰新新, 等. 基于肠道菌群新靶点的中药防治糖尿病研究进展[J]. 药物评价研究, 2017, 40(8): 1173-1181. ZHENG L S, TAI W, LAN X X, et al. Research progress on traditional Chinese medicine against diabetes based on intestinal flora new targets[J]. Drug Evaluation Research, 2017, 40(8): 1173-1181. |
| [2] |
CHEN F, WEN Q, JIANG J, et al. Could the gut microbiota reconcile the oral bioavailability conundrum of traditional herbs?[J]. Journal of Ethnopharmacology, 2016, 179(7): 253-264. |
| [3] |
徐叔云. 药理实验方法学[M]. 北京: 人民卫生出版社, 1982: 1535. XU S Y. Pharmacological experiment methodology[M]. Beijing: People's Medical Publishing House, 1982: 1535. |
| [4] |
KIMURA I, INOUE D, MAEDA T, et al. Short-chain fatty acids and ketones directly regulate sympathetic nervous system via G protein-coupled receptor 41 (GPR41)[J]. Proceedings of the National Academy of Sciences of the United States of America, 2011, 108(19): 8030-8035. DOI:10.1073/pnas.1016088108 |
| [5] |
KAMEYAMA K, ITOH K. Intestinal colonization by a lachnospiraceae bacterium contributes to the development of diabetes in obese mice[J]. Microbes and Environments, 2014, 29(4): 427-430. DOI:10.1264/jsme2.ME14054 |
| [6] |
牟菲, 赵娟娟, 纪泽敏, 等. 基于16S rDNA高通量测序技术挖掘影响高脂血症的核心菌群[J]. 中国药物与临床, 2020, 20(5): 701-704. MOU F, ZHAO J J, JI Z M, et al. 16S rDNA-based high-throughput sequencing techniques for mining of core flora affecting hyperlipidemia[J]. Chinese Remedies & Clinics, 2020, 20(5): 701-704. |
| [7] |
KOLIADA A, SYZENKO G, MOSEIKO V, et al. Association between body mass index and Firmicutes/Bacteroidetes ratio in an adult Ukrainian population[J]. BMC Microbiology, 2017, 17(1): 120. DOI:10.1186/s12866-017-1027-1 |
| [8] |
CHO C E, TAESUWAN S, MALYSHEVA O V, et al. Trimethylamine-N-oxide (TMAO) response to animal source foods varies among healthy young men and is influenced by their gut microbiota composition: a randomized controlled trial[J]. Molecular Nutrition & Food Research, 2017, 61(1): 1770016. |
| [9] |
XIE W D, GU D Y, LI J N, et al. Effects and action mechanisms of berberine and Rhizomacoptidis on gut microbes and obesity in high-fat diet-fed C57BL/6J mice[J]. PLoS One, 2011, 6(9): e24520. DOI:10.1371/journal.pone.0024520 |
| [10] |
TOMASOVA L, KONOPELSKI P, UFNAL M. Gut bacteria and hydrogen sulfide: the new old players in circulatory system homeostasis[J]. Molecules (Basel, Switzerland), 2016, 21(11): E1558. DOI:10.3390/molecules21111558 |
2. Department of Cardiology Second Ward, Luoyang Hospital of Traditional Chinese Medicine, Luoyang 471000, China;
3. Guang'anmen Hospital, China Academy of Chinese Medical Sciences, Beijing 100053, China
 2022, Vol. 39
2022, Vol. 39