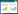文章信息
- 刘立柱, 李超艺, 林诗炜, 曲野, 许海军
- LIU Lizhu, LI Chaoyi, LIN Shiwei, QU Ye, XU Haijun
- 虫草素通过抑制氧化应激和炎症反应对骨折愈合的影响研究
- Study on the effect of cordycepin on fracture healing by inhibiting oxidative stress and inflammation
- 天津中医药, 2022, 39(3): 380-385
- Tianjin Journal of Traditional Chinese Medicine, 2022, 39(3): 380-385
- http://dx.doi.org/10.11656/j.issn.1672-1519.2022.03.22
-
文章历史
- 收稿日期: 2021-12-27
2. 海南医学院基础医学与生命科学学院,海口 571199
骨折是临床上患者最常遇到的创伤性损伤[1]。尽管骨骼具有自我更新的能力,但仍有约10%~20%的骨折导致愈合延迟[2]。因此,迫切需要开发新的治疗策略以促进骨折后骨组织的再生。骨折愈合是一个多阶段的生物过程,包括初始的炎症反应,随后形成软骨痂,然后形成硬骨痂及骨骼组织的最终重塑。骨折愈合再生受生长因子、激素、趋化因子和细胞因子以及许多其他调节剂的精确控制[3-4]。
虫草素是传统中草药冬虫夏草的主要活性成分之一,是一种腺苷衍生物,具有抗病毒、抗炎、抗氧化及抗肿瘤等多种活性[5-7]。虫草素可以抑制人关节炎软骨细胞中白细胞介素-1β(IL-1β)诱导的炎症介质表达[8]。另外,虫草素可以缓解碘乙酸单钠和手术引起的关节炎大鼠软骨损伤[9]。虫草素促进氧化应激诱导的成骨细胞分化,并促进骨形成[10]。虫草素在闭合性股骨骨折大鼠模型中通过缺氧促进骨髓间充质干细胞(BMMSC)的成骨分化并加速骨折愈合。上述均说明虫草素对骨损伤具有保护作用,但虫草素对骨折愈合的作用机制尚未阐明,因此,本研究探究了虫草素对骨折愈合的作用及相关调节机制。
1 材料与方法 1.1 动物分组与给药50只SPF级SD大鼠(购自海南医学院实验动物中心),体质量240~270 g,随机分为假手术组(Sham组)、模型组、虫草素2.5 mg/kg、虫草素5 mg/kg、虫草素10 mg/kg,每组10只大鼠。根据之前文献所述稍作调整[10],手术后腹腔注射给药不同剂量的虫草素,Sham组和模型组腹腔注射等体积生理盐水,连续给药10周,麻醉大鼠,取材。
1.2 骨折模型大鼠制备本研究参考之前文献描述[11],采用标准的大鼠闭合性股骨横行骨折内固定模型,大鼠腹腔注射戊巴比妥钠(50 mg/kg)麻醉,将大鼠局部脱毛,碘伏消毒,大鼠膝盖内侧用18号针头于切口处打一个孔,然后将直径为1.2 mm的AK线插入右股骨髓腔,使用三点弯曲装置和500 g金属钝刀片从35 cm的高度掉落,于缝合切口后在右股骨中轴产生闭合骨折。Sham组的大鼠,将手术切口缝合回去而不会造成骨折,连续4 d肌肉注射抗生素(氨苄青霉素,4×104 U/d)。
1.3 材料骨源性碱性磷酸酶(BAP)试剂盒、核因子-κB受体激活因子(RANKL)试剂盒、抗酒石酸酸性磷酸酶(TRAP)试剂盒、丙二醛测定(MDA)试剂盒、过氧化氢酶(CAT)测定试剂盒均购自南京建成生物工程研究所;白细胞介素-1β(IL-1β)、白细胞介素-6(IL-6)、肿瘤坏死因子-α(TNF-α)大鼠酶联免疫吸附试验(ELISA)试剂盒购自达科为生物技术有限公司。
1.4 放射学检测采用微型CT扫描仪(Micro-CT)(SkyScan,Kontich,比利时)分析大鼠股骨结构,分辨率为18 μm。扫描系统于350 ms内以70 kV,851A和1 000个/180°投影校准。采用CT Analyzer V 1.11软件(SkyScan)提取横截面仅包含松质骨的目标体积(VOI),用于形态分析。VOI从生长板的下端1 mm开始,向远侧延伸110个横截面(高2 mm)。3D分析松质骨的每个VOI骨微结构参数,包括骨体积分数(BV/TV),骨小梁厚度(Tb.Th),骨小梁数(Tb.N)和骨密度(BMD)。
1.5 氧化应激和骨代谢分子检测采用商用融合检测试剂盒检测组织和血清中氧化应激和骨代谢分子的水平。收集液氮冷冻的骨组织,组织研磨仪匀浆处理,然后加入磷酸盐缓冲液(PBS)超声匀浆,1 000 rpm/min,离心半径20 cm,4 ℃离心10 min,收集上清,保存于-80 ℃或根据试剂盒说明书检测氧化应激和骨代谢分子的含量。
1.6 组织病理学检测收集病灶中心附近的股骨组织(见图 1A),置于4%多聚甲醛中固定24 h,随后置于乙二胺四乙酸(EDTA,15%)脱钙3周,每3 d换一次,然后石蜡包埋,用石蜡切片机切成5 μm薄片。根据制造商说明书分别进行苏木精-伊红(HE)染色、番红固绿染色和马松染色,采用显微镜观察并拍照。
|
| 注:A.大鼠股骨的Micro-CT分析图像;B. Tb.Th,骨小梁厚度;C. BV/TV,骨体积百分比;D. BMD,骨密度;E. Tb.N,骨小梁数量。n=10,与假手术组比,*P < 0.01;与模型组比,#P < 0.01;与2.5 mg/kg虫草素组相比,△P < 0.05。 图 1 虫草素对骨折大鼠股骨放射学参数的影响 Fig. 1 Effect of cordycepin on radiological parameters of femur in fractured rats |
采用ELISA试剂盒检测血清促炎细胞因子的含量。大鼠眼球取血,室温静置30 min,1 000 rpm/min,离心半径20 cm,离心10 min,取上清液,根据制造商说明书检测大鼠血清IL-1β、IL-6和TNF-α的含量。
1.8 统计学分析所有数据均采用GraphPad Prism 5.0软件分析,结果用均数±标准差(x±s)表示,多组数据的比较用单因素方差分析(One-Way ANOVA),组间两两比较采用LSD法。P < 0.05为具有统计学差异。
2 结果 2.1 虫草素对骨折大鼠股骨放射学参数的影响采用Micro-CT分析骨折大鼠股骨的愈合情况,并用Tb.Th,BV/TV,BMD,和Tb.N定量分析。股骨图像表明与Sham组相比,术后10周模型组骨折大鼠的股骨有明显的愈伤组织,骨皮质厚度和骨量减少,小梁骨微结构明显受损,给予虫草素治疗组大鼠的骨折部位明显愈合,骨微结构损伤和骨皮质厚度及骨量明显改善恢复(见图 1A)。与Sham组比较,模型组大鼠Tb.Th,BV/TV,BMD,和Tb.N均明显降低(P < 0.05),虫草素5 mg/kg和10 mg/kg组较模型组和虫草素2.5 mg/kg组大鼠的Tb.Th,BV/TV,BMD,和Tb.N显著增加(P < 0.05),但虫草素5 mg/kg和10 mg/kg组差异无统计学意义(P > 0.05)(见图 1B-E),这些结果均表明虫草素能够促进大鼠骨折愈合,并改善骨折大鼠的骨微结构参数变化和损伤。
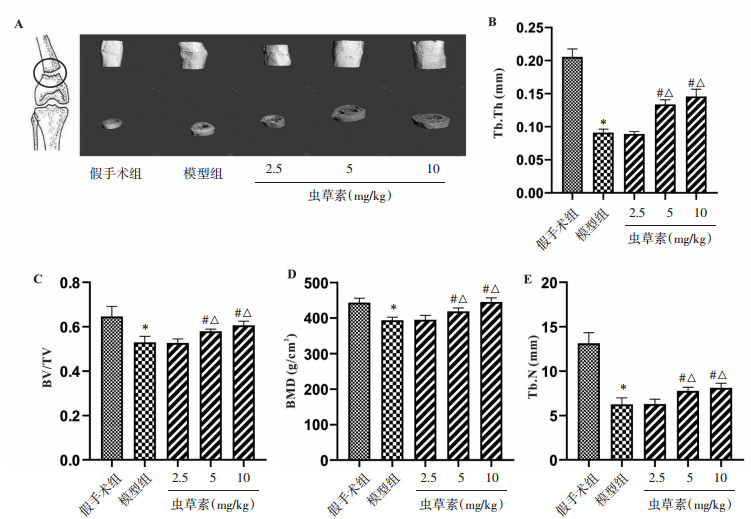
2.2 虫草素对骨折大鼠骨代谢分子的影响骨代谢分子检测结果显示,与Sham组比,模型组大鼠股骨组织中BAP、RANKL和TRAP含量均显著增加(P < 0.05)。虫草素5 mg/kg组和10 mg/kg组较模型组和2.5 mg/kg组大鼠明显降低了BAP和TRAP的含量(P < 0.05),虫草素2.5 mg/kg组、5 mg/kg组和10 mg/kg组较模型组大鼠RANKL的含量呈剂量依赖性降低(P < 0.05),同时,虫草素10 mg/kg组较5 mg/kg组大鼠BAP和TRAP的含量明显降低(P < 0.05),见图 2A,2B和C,上述结果表明虫草素可以直接调节骨折大鼠骨再生和骨折愈合过程。
|
| 注:A.骨折大鼠骨组织中BAP的含量;B.骨折大鼠骨组织中RANKL的含量;C.骨折大鼠骨组织中TRAP的活性。与假手术组比,*P < 0.01;与模型组比,#P < 0.01;与2.5 mg/kg虫草素组相比,△P < 0.05;与5 mg/kg虫草素组相比,▲P < 0.05。 图 2 虫草素对骨折大鼠骨代谢分子的影响 Fig. 2 The effect of cordycepin on bone metabolism molecules in fractured rats |
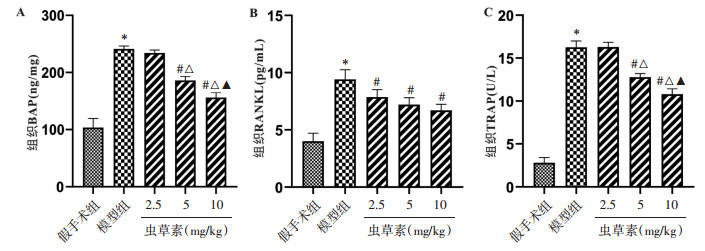
HE染色结果显示,模型组和虫草素2.5 mg/kg组观察到排列疏松的大量编织骨,虫草素5 mg/kg组和10 mg/kg组观察到纵向排列整齐的板层状骨,且编织骨减少。番红固绿染色结果显示,观察模型组和虫草素2.5 mg/kg组大鼠出现大量的软骨组织(红色),虫草素5 mg/kg组和10 mg/kg组大鼠观察到软骨组织减少,成骨组织(绿色)增加。马松染色结果显示,虫草素5 mg/kg组和10 mg/kg组观察到大量的成熟骨组织(见图 3)。上述结果表明虫草素对骨折大鼠的股骨的骨折愈合过程具有潜在的促进作用。
|
| 图 3 虫草素对骨折大鼠股骨病理学的影响 Fig. 3 The effect of cordycepin on the pathology of femur in fractured rats |
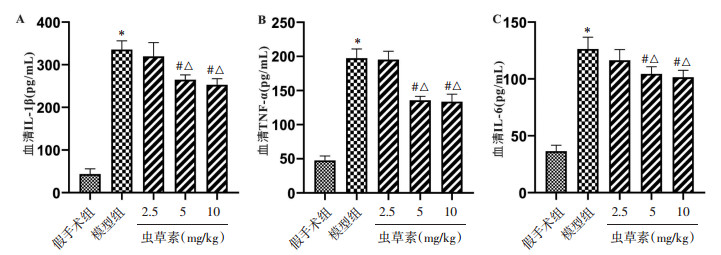
与Sham组比,模型组大鼠血清中IL-1β、IL-6和TNF-α的含量显著增加(P < 0.05)。虫草素5 mg/kg组和10 mg/kg组较模型组和2.5 mg/kg组大鼠血清中IL-1β、IL-6和TNF-α的含量明显降低(P < 0.05),虫草素5 mg/kg组和10 mg/kg组差异无统计学意义(P > 0.05)(见图 4A,4B和C),上述结果表明虫草素对骨折大鼠的炎症反应具有潜在调节作用。
|
| 注:A.骨折大鼠血清中IL-1β的含量;B.骨折大鼠血清中TNF-α的含量;C.骨折大鼠血清中IL-6的含量。与假手术组比,*P < 0.01;与模型组比,#P < 0.01;与2.5 mg/kg虫草素组相比,△P < 0.05。 图 4 虫草素对骨折大鼠炎症反应的影响 Fig. 4 The effect of cordycepin on inflammatory response in fractured rats |
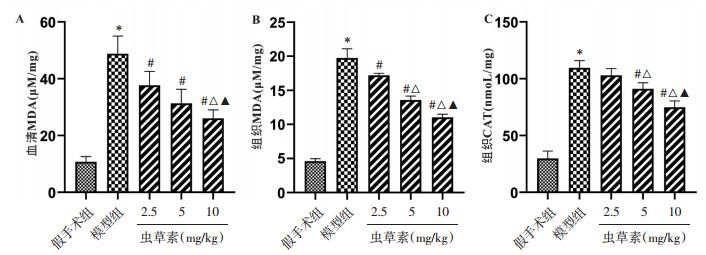
结果显示与Sham组比,模型组大鼠血清MDA含量及组织中MDA和CAT的含量显著增加(P < 0.05)。虫草素2.5 mg/kg组、5 mg/kg组和10 mg/kg组较模型组大鼠血清MDA含量及组织中MDA和CAT的含量呈剂量依赖性降低(P < 0.05)。与虫草素2.5 mg/kg组和5 mg/kg组比较,虫草素10 mg/kg组大鼠血清MDA含量及组织中MDA和CAT的含量明显降低(P < 0.05)(见图 5A,5B和5C),结果表明虫草素对骨折大鼠的氧化应激具有潜在调节作用。
|
| 注:A.骨折大鼠血清中MDA的含量;B.骨折大鼠组织中MDA的含量;C.骨折大鼠组织中CAT的含量。与假手术组比,*P < 0.01;与模型组比,#P < 0.01;与2.5 mg/kg虫草素组相比,△P < 0.05;与5 mg/kg虫草素组相比,▲P < 0.05。 图 5 虫草素对骨折大鼠氧化应激的影响 Fig. 5 Effect of cordycepin on oxidative stress in fractured rats |
虫草素是一种中药活性成分,具有抗炎、抗氧化和抗肿瘤等广泛的生物学活性,并且可以调节成骨细胞分化,对骨组织损伤具有保护活性。本研究发现虫草素加速了大鼠骨折的愈合,改善了骨微结构和骨代谢分子,同时抑制了炎症反应和氧化应激,是一种促进骨折愈合的潜在先导化合物。
本研究采用标准的大鼠闭合性股骨骨折内固定模型评价虫草素对骨折愈合的作用。此模型用SD大鼠造模,可以更好的模拟临床人类愈合症状,并类似患者疾病模式。骨折愈合过程复杂,主要包括初期的血肿急性炎症期、原始骨痂形成期和骨板形成塑形期。血肿形成的半刚性纤维软骨痂给早期的骨折愈合提供了初始稳定性。本研究放射学检测结果虫草素治疗组大鼠的骨折部位明显愈合,并且Tb.Th,BV/TV,BMD,和Tb.N显著增加。同时,组织病理学结果表明模型组大鼠观察到排列疏松的编织骨和大量软骨组织,虫草素组大鼠观察到纵向排列整齐的板层状骨,这些结果表明虫草素能够促进大鼠骨折愈合,并改善骨折大鼠的骨微结构参数变化和受损,对骨折愈合具有治疗作用。
研究表明虫草素可以缓解大鼠的氧化应激反应[12]。同样的,本研究结果表明虫草素能够显著减少骨折大鼠血清MDA含量及组织中MDA和CAT的含量,抑制大鼠的氧化应激反应。氧化应激级联会导致骨折部位的骨再生抑制,骨再生对骨折正常愈合是必需的。破骨细胞和成骨细胞之间的平衡对骨丢失和骨形成至关重要[13]。TRAP和RANKL是破骨细胞成熟的标志,本研究表明骨折大鼠骨组织中TRAP和RANKL的含量显著增加,给予虫草素治疗能够显著减少大鼠骨组织中TRAP和RANKL的含量。上述研究结果表明虫草素对骨折愈合的促进过程与调节氧化应激有关。
骨折愈合最早始于炎症反应过程,促炎细胞因子在组织愈合过程起着至关重要的作用[14-15]。促炎细胞因子包括IL-1β、TNF-α和IL-6对骨折愈合具有重要调节作用[16]。骨折愈合不仅仅是破骨细胞和成骨细胞之间的平衡作用,也是不同促炎细胞因子间的相互调节过程。研究表明骨折初期血清中IL-1β、TNF-α和IL-6的含量显著增加,后续逐渐下降[17]。其中TNF-α作为炎症反应初期的主要细胞因子,其能够通NF-κB信号通路和OPG/RANKL/RANK信号通路介导骨相关细胞细胞的凋亡过程,并且促进破骨细胞增殖和活化。除此之外,IL-1β和IL-6能够与TNF-α发生协同作用,能够促进软骨细胞增殖和活化,并介导氧化应激反应[18]。本研究结果表明骨折大鼠血清中IL-1β、TNF-α和IL-6的含量显著增加,给予虫草素治疗显著减少骨折大鼠血清中IL-1β、TNF-α和IL-6的含量。结果表明虫草素对骨折愈合的促进过程与调节炎症反应有关。
综上,本研究表明虫草素能够促进骨折愈合,并且与抑制氧化应激和炎症反应有关。但是,虫草素的具体调节信号通路仍需后续研究进一步探索。
| [1] |
EINHORN T A, GERSTENFELD L C. Fracture healing: mechanisms and interventions[J]. Nature Reviews Rheumatology, 2015, 11(1): 45-54. DOI:10.1038/nrrheum.2014.164 |
| [2] |
EINHORN T A. New technologies for the enhancement of skeletal repair: challenges and opportunities[J]. Indian Journal of Orthopaedics, 2011, 45(6): 489-491. DOI:10.4103/0019-5413.87113 |
| [3] |
LI Y H, LIU G Z, YU J, et al. Effects of continuous or intermittent low-magnitude high-frequency vibration on fracture healing in sheep[J]. International Orthopaedics, 2018, 42(4): 939-946. DOI:10.1007/s00264-018-3759-4 |
| [4] |
JOHNSON C T, WROE J A, AGARWAL R, et al. Hydrogel delivery of lysostaphin eliminates orthopedic implant infection by staphylococcus aureus and supports fracture healing[J]. Proceedings of the National Academy of Sciences of the United States of America, 2018, 115(22): E4960-E4969. |
| [5] |
JIN M L, PARK S Y, KIM Y H, et al. The neuroprotective effects of cordycepin inhibit glutamate-induced oxidative and ER stress-associated apoptosis in hippocampal HT22 cells[J]. Neurotoxicology, 2014, 41(7): 102-111. |
| [6] |
JEONG J W, JIN C Y, PARK C, et al. Induction of apoptosis by cordycepin via reactive oxygen species generation in human leukemia cells[J]. Toxicology in Vitro: an International Journal Published in Association With BIBRA, 2011, 25(4): 817-824. |
| [7] |
CHENG Z Y, HE W, ZHOU X X, et al. Cordycepin protects against cerebral ischemia/reperfusion injury in vivo and in vitro[J]. European Journal of Pharmacology, 2011, 664(1-3): 20-28. DOI:10.1016/j.ejphar.2011.04.052 |
| [8] |
TULI H S, SHARMA A K, SANDHU S S, et al. Cordycepin: a bioactive metabolite with therapeutic potential[J]. Life Sciences, 2013, 93(23): 863-869. DOI:10.1016/j.lfs.2013.09.030 |
| [9] |
TAO X M, LIU P F, GU H Y, et al. Cordycepin alleviates anterior cruciate ligament transection (ACLT)-induced knee osteoarthritis through regulating TGF-β activity and autophagy[J]. Drug Design, Development and Therapy, 2020, 14(3): 2809-2817. |
| [10] |
WANG F, YIN P P, LU Y, et al. Cordycepin prevents oxidative stress-induced inhibition of osteogenesis[J]. Oncotarget, 2015, 6(34): 35496-35508. DOI:10.18632/oncotarget.6072 |
| [11] |
王希强, 孙仁光, 孙仕润, 等. 丹参接骨胶囊对闭合性股骨骨折模型大鼠骨折愈合的影响[J]. 中国组织工程研究, 2016, 20(5): 622-627. WANG X Q, SUN R G, SUN S R, et al. Effects of Danshen Jiegu Capsule on fracture healing in a rat model of closed femoral fractures[J]. Chinese Journal of Tissue Engineering Research, 2016, 20(5): 622-627. |
| [12] |
CHEN C, LIU X P, JIANG W, et al. Anti-effects of cordycepin to hypoxia-induced membrane depolarization on hippocampal CA1 pyramidal neuron[J]. European Journal of Pharmacology, 2017, 796(9): 1-6. |
| [13] |
ZHOU S Y, HUANG G L, CHEN G Y. Synthesis and biological activities of drugs for the treatment of osteoporosis[J]. European Journal of Medicinal Chemistry, 2020, 197(11): 112313. |
| [14] |
LOI F, CORDOVA L A, PAJARINEN J, et al. Inflammation, fracture and bone repair[J]. Bone, 2016, 86(6): 119-130. |
| [15] |
BURSKA A N, GIANNOUDIS P V, TAN B H, et al. Dynamics of early signalling events during fracture healing and potential serum biomarkers of fracture non-union in humans[J]. Journal of Clinical Medicine, 2020, 9(2): E492. DOI:10.3390/jcm9020492 |
| [16] |
SCHLUNDT C, REINKE S, GEISSLER S, et al. Individual effector/regulator T cell ratios impact bone regeneration[J]. Frontiers in Immunology, 2019, 10(4): 1954. |
| [17] |
KO K I, SYVERSON A L, KRALIK R M, et al. Diabetes-induced NF-κB dysregulation in skeletal stem cells prevents resolution of inflammation[J]. Diabetes, 2019, 68(11): 2095-2106. DOI:10.2337/db19-0496 |
| [18] |
RATHER H A, JHALA D, VASITA R. Dual functional approaches for osteogenesis coupled angiogenesis in bone tissue engineering[J]. Materials Science & Engineering C, Materials for Biological Applications, 2019, 103(6): 109761. |
2. School of Basic Medicine and Life Sciences, Hainan Medical University, HaiKou 571199, China
 2022, Vol. 39
2022, Vol. 39