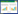文章信息
- 陈远兴, 申茜, 王骥, 杨静文, 庄朋伟, 郭虹
- CHEN Yuanxing, SHEN Qian, WANG Ji, YANG Jingwen, ZHUANG Pengwei, GUO Hong
- 红芪口服液增强免疫力的药理作用研究
- Pharmacological effect of Hongqi oral liquid on enhancing immunity
- 天津中医药, 2022, 39(4): 498-502
- Tianjin Journal of Traditional Chinese Medicine, 2022, 39(4): 498-502
- http://dx.doi.org/10.11656/j.issn.1672-1519.2022.04.19
-
文章历史
- 收稿日期: 2021-11-23
2. 甘肃中天金丹药业有限公司,甘肃 748100
免疫力作为身体防御最基本的机制具有重要意义,其作用主要体现在维持机体内环境稳定,抵抗细菌、病毒或病原体入侵等[1]。免疫功能低下,机体识别和排除“异己”的能力不足,身体呈现不抵抗状态。近年来天然药物对于各种疾病的治疗起到了关键作用,尤其在增强机体免疫力方面效果显著[2]。
红芪作为甘肃的道地中药材,来源于豆科植物多序岩黄芪Hedysarumpolybotrys Hand.-Mazz.的干燥根。文献报道,红芪具有抗肿瘤、抗纤维化和调节免疫系统等作用[3-5]。红芪在免疫调节方面的临床疗效较黄芪更具有优势,其补中益气药效作用可能强于黄芪[6]。红芪口服液主要由红芪提取物精制而成,临床用于气虚所致的身体乏力,心悸失眠,食少便溏,面色无华,研究者对其质量标准进行了系统研究[7],但目前关于其药理作用尤其增强免疫作用的系统研究尚无报道。因此,本研究通过考察红芪口服液对免疫低下小鼠免疫器官脏器指数、外周血细胞计数、淋巴细胞功能以及单核-巨噬细胞吞噬能力等指标的影响,评价红芪口服液提高免疫力的作用。
1 材料与方法 1.1 材料 1.1.1 实验动物SPF级雄性昆明小鼠(20±2)g,购自北京维通利华实验动物技术有限公司,许可证号:SCXK(京)2016-0006。小鼠饲养于天津中医药大学动物房,室内温度(22±2)℃,相对湿度45%~75%。
1.1.2 药物与试剂红芪口服液(批号200502)由甘肃中天金丹药业有限公司提供;环磷酰胺(批号20100202)购自山西普德药业有限公司;刀豆蛋白(Con A,C8110)、脂多糖(LPS,L8880)、红细胞裂解液(R1010)、小鼠外周血淋巴细胞分离液(P8620)、4%绵羊红细胞(S9450)、鸡红细胞(批号S7300)均购自北京索莱宝科技有限公司;CCK-8试剂盒(CK04)购自日本同仁化学研究所。
1.1.3 主要仪器B5185全自动血液分析仪(美国,爱德士),spark多功能酶标仪(奥地利,帝肯),DM750显微镜(德国,徕卡)。
1.2 方法 1.2.1 实验分组、造模和给药将小鼠随机分为正常组、模型组、红芪口服液低(红芪低)、中(红芪中)、高(红芪高)剂量组。适应性饲养3 d后,除正常组外,其余各组小鼠连续7 d腹腔注射环磷酰胺(35 mg/kg),建立免疫低下小鼠模型。模型建立同时,红芪口服液低、中、高剂量组分别灌胃给予5.2 mL/kg(临床等效剂量)、20.8 mL/kg(临床4倍等效剂量)、41.6 mL/kg(临床8倍等效剂量)的红芪口服液,正常组和模型组给予等量蒸馏水。各组小鼠于末次灌胃给药24 h后,检测各项指标。
1.2.2 小鼠脾脏和胸腺指数末次给药24 h后,各组小鼠进行称质量,颈椎脱臼处死,分离脾脏、胸腺,精密称量并记录,计算小鼠脾脏和胸腺指数。脾脏指数为脾脏质量/体质量(mg/g),胸腺指数为胸腺质量/体质量(mg/g)。
1.2.3 小鼠外周血的测定各组小鼠摘眼球取血,取适量全血用枸橼酸钠进行抗凝处理,全自动血液分析仪对外周血中血细胞计数。
1.2.4 小鼠脾淋巴细胞悬液制备实验结束后,颈椎脱臼处死小鼠,于75%乙醇中浸泡5 min,无菌条件下分离各组小鼠脾脏置于一次性平皿中,小心剔除脂肪和结缔组织,并用RPMI 1 640培养液进行冲洗。冲洗后使用一次性注射器对小鼠脾脏进行反复吹打直至脾脏外膜变得透明,使细胞分离出来。将分离的细胞转入离心管中,转速2 500 rpm,离心半径8 cm,离心5 min弃上清,收集下层脾细胞。红细胞裂解液对红细胞进行破除,破除2次后再次离心收集细胞。加入含10%胎牛血清的RPMI 1 640完全培养液重悬,0.4%台盼蓝染液染色,细胞计数板计数,调整细胞数为5×106/mL个,备用。
1.2.5 脾淋巴细胞增殖实验将已制备好的脾淋巴细胞悬液加入到96孔板中,每孔100 μL,同时每孔加入100 μL终浓度为5 μg/mL的Con A或终浓度为20 μg/mL的LPS。将96孔板置于细胞培养箱中培养44 h,加入10% CCK-8溶液,孵育30 min,酶标仪在450 nm波长处测量OD值。
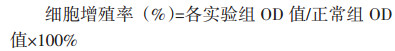 |
(1) |
取小鼠抗凝血与等量生理盐水混匀,缓慢加入到装有淋巴分离液的离心管中,2 500 rpm离心20 min,离心半径8 cm,小心吸出淋巴细胞层,加入平衡盐溶液洗涤两次,弃上清,加入0.4 mL的10%新生牛血清培养液制备成细胞悬液。加入等量的4%绵羊红细胞混匀,37 ℃孵育5 min后,1 000 rpm离心5 min,离心半径8 cm。4 ℃下放置2 h,涂片,染色后油镜(×100)观察玫瑰花结阳性数,计数200个淋巴细胞,以结合3个以上绵羊红细胞的淋巴细胞为玫瑰花结形成细胞,同时计算得出百分率。
1.2.7 碳廓清指数和吞噬指数的测定实验结束后,各组小鼠按照0.05 mL/10 g剂量,尾静脉注射经生理盐水4倍稀释的印度墨汁,分别在注射后2 min(记为时间点1)和10 min(记为时间点2)眼眶采血20 μL,并加入0.1%碳酸钠溶液2 mL处理,酶标仪测定600 nm处吸光度值。取血完毕后立即颈椎脱臼处死小鼠,取肝脏和脾脏,用滤纸吸干脏器表面血污,称质量并记录。计算廓清指数(K)和吞噬指数(α)。
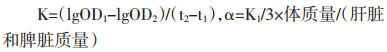 |
(2) |
实验结束后,各组小鼠腹腔注射鸡红细胞悬液0.5 mL,并于注射后1~2 h,颈椎脱臼处死,剪开腹部皮肤,注入2 mL生理盐水,轻揉小鼠腹部,吸取腹腔液1 mL,平均分滴在两个载玻片上,37 ℃孵育30 min,孵育后于生理盐水中漂洗,以除去未贴片细胞。以1∶1丙酮甲醇溶液固定3 min,Giemsa染液染色8 min,洗片,油镜观察,计算吞噬率和吞噬指数。
 |
(3) |
用SPSS 23. 0数据统计软件处理各组数据,结果以均数±标准差(x±s)表示,多组间数据比较使用单因素方差分析(One-way ANOVA),组间两两比较采用LDS法,P < 0.05为差异有统计学意义。
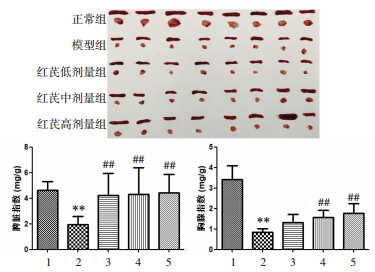
2 结果 2.1 红芪口服液对免疫低下小鼠脾脏和胸腺指数的影响脾脏和胸腺是机体的主要免疫器官,其质量的改变可以反映受试药物对免疫系统的刺激作用。因此,脾脏和胸腺指数被认为是测试免疫功能的重要指标。如图 1所示,与正常组比较,模型组小鼠的脾脏指数和胸腺指数均显著下降,说明成功复制了小鼠免疫低下模型。与模型组比较,红芪低、红芪中、红芪高剂量组均能不同程度增加模型小鼠的脾脏指数和胸腺指数。表明红芪口服液能够有效改善免疫低下小鼠脾脏和胸腺损伤,促进免疫器官的发育,增强机体免疫能力。
|
| 注:1.正常组;2.模型组;3.红芪低剂量组;4.红芪中剂量组;5.红芪高剂量组。与正常组比较,**P < 0.01;与模型组比较,##P < 0.01。 图 1 红芪口服液对免疫低下小鼠脾脏和胸腺指数的影响 Fig. 1 Effects of Hongqi oral liquid on spleen and thymus indices in immunocompromised mice |
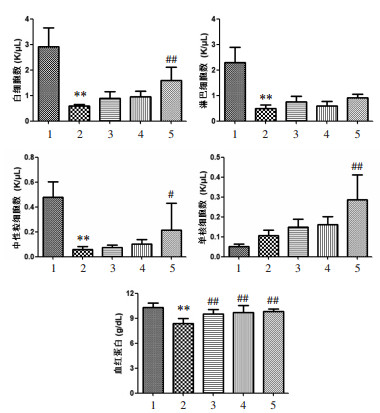
如图 2所示,与正常组比较,模型组小鼠全血白细胞、淋巴细胞、中性粒细胞数以及血红蛋白浓度均显著减少,同时单核细胞数明显增加,表明环磷酰胺导致免疫低下小鼠血细胞异常变化。与模型组比较,红芪低、红芪中、红芪高剂量组均能不同程度升高小鼠白细胞、淋巴细胞、中性粒细胞、单核细胞数量,增加血红蛋白浓度,其中以高剂量组效果最为显著。
|
| 注:1.正常组;2.模型组;3.红芪低剂量组;4.红芪中剂量组;5.红芪高剂量组。与正常组比较,**P < 0.01;与模型组比较,#P < 0.05,##P < 0.01。 图 2 红芪口服液对免疫低下小鼠外周血细胞的影响 Fig. 2 The effect of Hongqi oral liquid on peripheral blood cells of immunocompromised mice |
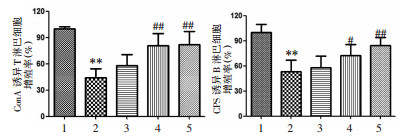
ConA和LPS可以分别诱导T、B淋巴细胞的增殖活化。本实验中,笔者以ConA和LPS诱导刺激体外分离的脾淋巴细胞,结果发现,与正常组比较,模型组T、B淋巴细胞增殖率均明显降低;而小鼠灌胃红芪口服液后,体外脾淋巴细胞增殖率均有不同程度的促进作用,其中红芪中、高剂量组可以同时显著提升T、B淋巴细胞增殖率,明显提高机体免疫能力。结果见图 3。
|
| 注:1.正常组;2.模型组;3.红芪低剂量组;4.红芪中剂量组;5.红芪高剂量组。与正常组比较,**P < 0.01;与模型组比较,#P < 0.05,##P < 0.01。 图 3 红芪口服液对免疫低下小鼠脾淋巴细胞增殖率的影响 Fig. 3 The effect of Hongqi oral liquid on the proliferation rate of spleen lymphocytes in immunocompromised mice |
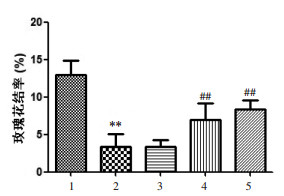
结果如图 4所示,与正常组比较,模型组玫瑰花结百分率明显减少;而小鼠灌胃红芪口服液后,与模型组比较,红芪中、红芪高剂量组均能明显增加玫瑰花结百分率;结果表明红芪口服液可非特异性地增强细胞免疫,进而提高机体免疫功能。
|
| 注:1.正常组;2.模型组;3.红芪低剂量组;4.红芪中剂量组;5.红芪高剂量组。与正常组比较,**P < 0.01;与模型组比较,##P < 0.01。 图 4 红芪口服液对免疫低下小鼠淋巴细胞玫瑰花结形成的影响 Fig. 4 The effect of Hongqi oral liquid on lymphocyte rosette formation in immunocompromised mice |
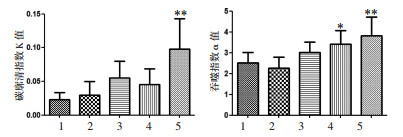
巨噬细胞碳廓清实验是观察机体非特异性免疫功能的经典方法,廓清指数和吞噬指数愈大,吞噬功能愈强;反之则弱。因此本研究通过测定小鼠巨噬细胞碳廓清指数K和吞噬系数α来观察单核-巨噬细胞系统的吞噬廓清能力强弱。研究结果表明,与正常组比较,模型组的碳廓清指数和吞噬指数均无明显变化;但小鼠灌胃红芪口服液后,碳廓清指数K值和吞噬指数α值均有所升高,其中以红芪高剂量组效果最为显著;表明红芪口服液能促进机体单核-巨噬细胞的吞噬作用,增强非特异性免疫功能。结果见图 5。
|
| 注:1.正常组;2.模型组;3.红芪低剂量组;4.红芪中剂量组;5.红芪高剂量组。与模型组比较,*P < 0.05,**P < 0.01。 图 5 红芪口服液对免疫低下小鼠巨噬细胞碳廓清指数和吞噬指数的影响 Fig. 5 Effects of Hongqi oral liquid on the carbon clearance index and phagocytosis index of macrophages in immunocompromised mice |
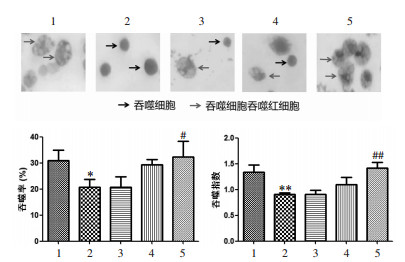
鸡红细胞对于小鼠是一种较强的抗原,当与巨噬细胞混合孵育一定时间后,鸡红细胞会被吞噬,涂片染色镜检,根据吞噬率和吞噬指数可以反映小鼠腹腔巨噬细胞的吞噬能力。如图 6所示,与正常组比较,模型组巨噬细胞吞噬率和吞噬指数均显著性降低,说明巨噬细胞的吞噬活性被抑制。小鼠给予红芪口服液后,红芪高剂量组能显著升高巨噬细胞吞噬率和吞噬指数,与模型组比较差异显著;红芪中剂量组有升高吞噬率和吞噬指数的趋势。结果提示,红芪口服液能增强免疫抑制小鼠腹腔巨噬细胞的吞噬能力,发挥增强免疫的作用。
|
| 注:1.正常组;2.模型组;3.红芪低剂量组;4.红芪中剂量组;5.红芪高剂量组。与正常组比较,*P < 0.05,**P < 0.01;与模型组比较,#P < 0.05,##P < 0.01。 图 6 红芪口服液对免疫低下小鼠腹腔巨噬细胞吞噬率和吞噬指数的影响 Fig. 6 Effects of Hongqi oral liquid on phagocytic rate and phagocytic index of peritoneal macrophages in immunocompromised mice |
环磷酰胺常被用于构建免疫抑制动物模型[8]。本实验采用连续多次注射环磷酰胺(35 mg/kg)的方法建立小鼠免疫抑制模型。小鼠注射环磷酰胺后,可见毛发脱落,体质量明显下降,脾脏萎缩,以及外周血中白细胞计数减少等,说明环磷酰胺成功造成小鼠免疫系统的损伤。红芪口服液是中药红芪的提取物,研究发现应用红芪口服液治疗后,模型小鼠的脾脏和胸腺指数显著提升,外周血中白细胞计数、血红蛋白水平等明显升高,表明红芪口服液具有调节机体免疫功能的作用。
淋巴细胞增殖和玫瑰花结形成实验一直作为免疫性疾病不可缺少的依据。本实验结果显示,红芪口服液能显著促进ConA诱导的脾T淋巴细胞及LPS诱导的B淋巴细胞增殖,且可以明显增加淋巴细胞玫瑰花结的形成,提高细胞免疫应答。
碳廓清实验和鸡红细胞吞噬实验,常用以评价巨噬细胞的吞噬清除功能[9-10]。在碳廓清实验中,小鼠尾静脉注射墨汁后,模型组的碳廓清指数和吞噬指数与正常组比较无明显差异,推测这可能与外周血中单核细胞计数未见明显变化有关。小鼠灌胃红芪口服液治疗后,碳廓清指数和吞噬指数均有所升高,其中以高剂量组效果最为明显。同样,小鼠腹腔巨噬细胞吞噬实验结果也表明,红芪口服液高剂量组小鼠的吞噬百分率和吞噬指数均显著升高。提示,红芪口服液可以通过增加巨噬细胞吞噬清除活性,从而提高机体免疫力。
综上所述,红芪口服液对由环磷酰胺致免疫抑制小鼠具有较好的免疫保护作用,其在细胞免疫、体液免疫、单核-巨噬细胞功能等方面均表现出正向调节作用。红芪口服液在增强免疫力方面具有很好的研究价值与应用前景,在明确其药理作用的基础上,其调节机体免疫功能的具体分子机制是今后进一步深入研究的重点方向。
| [1] |
王文婷, 施展, 林向辉, 等. 基于环磷酰免疫抑制模型研究鲜人参膏增强小鼠免疫力的作用[J]. 特产研究, 2020, 42(3): 30-34. WANG W T, SHI Z, LIN X H, et al. Study on the effect of fresh ginseng pasteon enhancing immunity in mice based on cyclophosphoryl immunosuppression model[J]. Special Wild Economic Animal and Plant Research, 2020, 42(3): 30-34. |
| [2] |
FAN K J, LI Y W, WU J, et al. The traditional Chinese medicine fufang Shatai heji (STHJ) enhances immune function in cyclophos-phamide-treated mice[J]. Evidence-Based Complementary and Alter-native Medicine, 2020, 2020: 3849847. |
| [3] |
闫立萍, 刘华, 王小军, 等. 红芪多糖1联合吉非替尼对肺癌A549细胞凋亡的作用及机制探讨[J]. 国际呼吸杂志, 2020, 40(16): 1216-1220. YAN L P, LIU H, WANG X J, et al. Effect of Hedysarum polysaccharides 1 combined Gefitinib on apoptosis of lung cancer A549 cells and its mechanism research[J]. International Journal of Respiration, 2020, 40(16): 1216-1220. DOI:10.3760/cma.j.cn131368-20191213-01749 |
| [4] |
MA C, ZHAO X, CHANG J, et al. Radix Angelica sinensis and Radix hedysari ultrafiltration extract protects against X-irradiation-induced cardiac fibrosis in rats[J]. Evidence-Based Complementary and Alternative Medicine, 2020, 2020: 4675851. |
| [5] |
胡萍, 魏琳琳, 崔建伟, 等. 红芪提取物对小鼠免疫功能的影响[J]. 毒理学杂志, 2021, 35(3): 236-240. HU P, WEI L L, CUI J W, et al. Influence of hedysari Radix extracts on the immune function of the mice[J]. Journal of Toxicology, 2021, 35(3): 236-240. |
| [6] |
张育贵, 张淑娟, 牛江涛, 等. 炙黄芪和炙红芪干预脾气虚大鼠的药效比较研究[J]. 中国中药杂志, 2021, 46(21): 5641-5649. ZHANG Y G, ZHANG S J, NIU J T, et al. Comparative study of Astragali Radix Praeparata cum Melle and Hedysari Radix Praeparata cum Melle on spleen qi deficiency rats[J]. China Journal of Chinese Materia Medica, 2021, 46(21): 5641-5649. |
| [7] |
赵端玮. 红芪药材及红芪口服液质量标准的提高研究[D]. 兰州: 兰州大学, 2014. ZHAO D W. Study on the improvement of the quality standard of Hongqi medicinal materials and Hongqi oral liquid[D]. Lanzhou: Lanzhou University, 2014. |
| [8] |
LI M Z, HUANG X J, HU J L, et al. The protective effects against cyclophosphamide (CTX)-induced immunosuppression of three glucomannans[J]. Food Hydrocolloids, 2020, 100. |
| [9] |
刘露丝, 张乐, 邵安良, 等. 基于Gal抗原缺失小鼠的腹腔巨噬细胞吞噬鸡血红细胞试验敏感性初探[J]. 中国药事, 2021, 35(3): 300-306. LIU L S, ZHANG L, SHAO A L, et al. On sensitivities of phagocytosis of mouse peritoneal macrophages on chicken erythrocytes based on gal antigen-deficient mice[J]. Chinese Pharmaceutical Affairs, 2021, 35(3): 300-306. |
| [10] |
吴琼, 张丽艳, 黄颖, 等. 参芪茯苓片拆方对小鼠免疫功能的影响[J]. 贵州中医药大学学报, 2021, 43(1): 29-33. WU Q, ZHANG L Y, HUANG Y, et al. Effects of Shenqi Fuling tablets on immune function in mice[J]. Journal of Guizhou University of Traditional Chinese Medicine, 2021, 43(1): 29-33. |
2. Gansu Zhongtian Jindan Pharmaceutical Co., LTD., Gansu 748100, China
 2022, Vol. 39
2022, Vol. 39