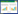文章信息
- 李振华, 李姣, 张健
- LI Zhenhua, LI Jiao, ZHANG Jian
- 补肾活血汤对子宫内膜异位症大鼠Nrf2/Keap1通路的调节作用研究
- Regulatory effect of Bushen Huoxue Decoction on Nrf2/Keap1 pathway in rats with endometriosis
- 天津中医药, 2022, 39(4): 503-508
- Tianjin Journal of Traditional Chinese Medicine, 2022, 39(4): 503-508
- http://dx.doi.org/10.11656/j.issn.1672-1519.2022.04.20
-
文章历史
- 收稿日期: 2021-12-30
2. 湖南中医药大学第一附属医院中医妇科,长沙 430000
子宫内膜异位症作为一种常见的妇科疾病,好发于育龄妇女,并会引发痛经及不孕等多种并发症,临床中使用孕激素类及卵巢功能抑制剂进行治疗,但由于用药疗程过长且不良反应较多,所以在临床应用中效果并不理想。同时,除根治性手术外,其余药物治疗及手术治疗的方法均有较高的复发风险,所以对于子宫内膜异位症药物的研发亟待解决[1-3]。补肾活血汤作为一种传统的中药成方制剂,其被用于治疗损伤后期肝肾虚弱之症,因其具有通络止痛活血之功效,现代医学众多学者开始探究其在子宫内膜异位症治疗中的作用,并随着研究的深入,众多学者报道了补肾活血汤在子宫内膜异位症临床应用中均表现出显著疗效[4-5]。Nrf2/Keap1通路是与炎症损伤及氧化应激过程密切相关的重要通路,近年来研究证实Nrf2/Keap1通路相关蛋白水平异常,在子宫内膜异位症的发病机制中的起到关键作用[6-7]。Marcelli等[8]研究发现,Nrf2水平的升高会导致子宫内膜异位症的发生及进展;Kapoor等[9]研究表明,Nrf2水平的升高及Keap1水平降低均会导致子宫内膜异位症的进一步加重。本文通过研究补肾活血汤对子宫内膜异位症大鼠Nrf2/Keap1通路的调节作用,为补肾活血汤在子宫内膜异位症中的药理机制研究提供依据。
1 材料 1.1 实验动物SD大鼠90只,雌性,8周龄,体质量200~220 g,SPF级,购自兰州大学实验动物中心[许可证号:SCXK(甘)2018-0002]。
1.2 药品与试剂补肾活血汤(由熟地黄10 g,补骨脂10 g,菟丝子10 g,杜仲3 g,枸杞子3 g,当归尾3 g,山萸肉3 g,肉苁蓉3 g,没药3 g,独活3 g,红花2 g组成)药材饮片购自北京同仁堂药业,由药材饮片制成生药含量为1 g/mL的制剂。达那唑(批号:201812161)购自杭州民生药业有限公司;大鼠雌二醇(E2)ELISA检测试剂盒(货号:CSB-E05110r-1)购自上海恒斐生物公司;大鼠CA125ELISA试剂盒(货号:ER0788)购自武汉菲恩生物科技有限公司;组织蛋白裂解液(货号:ZY-14497)购自上海泽叶生物公司;Nrf2、Keap1兔多克隆抗体(货号:PA5-27882、PA5-99434)购自赛默飞世尔科技公司;cDNA合成试剂盒(货号:D7168)、总RNA提取试剂盒(货号:R0016)、GAPDH兔单克隆抗体(货号:AF1186)、辣根过氧化物酶标记山羊抗兔IgG抗体(货号:A0208)购自碧云天生物科技有限公司;荧光定量PCR试剂盒(货号:JKG039)购自上海经科化学科技有限公司;BCA蛋白法含量测试盒(货号:BCAP-1-W)购自北京康佳宏原生物科技有限公司;大鼠白介素-6(IL-6)ELISA试剂盒(货号:EK0412)购自美国Sciencell公司;大鼠白介素-8(IL-8)ELISA试剂盒(货号:YS03585B)购自美国GTX公司;前列腺素F-2α(PGF-2α)ELISA试剂盒(货号:GD-AW1766)购自上海古朵生物科技公司。
1.3 主要仪器GIS-500凝胶成像仪(杭州米欧仪器公司);Allegra X-15R台式冷冻离心机(贝克曼库尔特商贸有限公司);IX71-F22FL/PH荧光倒置显微镜(日本奥林巴斯公司);LUMIstar Omega酶标仪(德国BMG公司);HM355S石蜡切片机(日本亚速旺公司);BE6085电泳槽(柏奥易杰科技有限公司)。
2 方法 2.1 建立子宫内膜异位症模型大鼠并给药90只大鼠适应性喂养1周后,随机分为假手术组、模型组、补肾活血汤低、中、高剂量组及达那唑组,15只/组,参照文献[10-12]方法采用自体子宫内膜移植法建立子宫内膜异位症模型大鼠,先使用0.5 mg/kg的戊酸雌二醇使大鼠动情,然后将大鼠麻醉,开腹,分离左侧部分子宫,并将子宫内膜缝合至右侧腹壁,关腹缝合,术后使用青霉素预防感染,假手术组只开腹不进行子宫内膜移植等操作。补肾活血汤低、中、高剂量组按照2.5、5、10 g/kg灌胃给予补肾活血汤[13-14],达那唑组给予达那唑(0.02 g/kg)[12],假手术组及模型组给予生理盐水;1次/日,连续干预4周[8]。
2.2 血清E2、CA125的测定大鼠取血清,使用E2、CA125 ELISA试剂盒测定各组大鼠血清E2、CA125水平。
2.3 腹腔灌洗液IL-6、IL-8、PGF-2α的测定末次给药24 h后将大鼠麻醉,开腹,使用蒸馏水灌洗并收集腹腔液,采用IL-6、IL-8、PGF-2α ELISA试剂盒测定大鼠腹腔灌洗液IL-6、IL-8、PGF-2α水平。
2.4 HE染色取大鼠异位子宫组织(假手术组取在位子宫组织)在中性甲醛中固定后石蜡包埋,切成4 μm厚的切片,行HE染色,在200倍显微镜下采用盲法观察子宫内膜组织病理学特征。
2.5 实时PCR检测Nrf2、Keap1mRNA大鼠处死并分离异位子宫组织(对照组取在位子宫组织)200 mg,使用试剂盒提取RNA,使用逆转录试剂盒逆转录为cDNA,按照试剂盒方法检测Nrf2、Keap1 mRNA水平,以GAPDH为内参,采用2-ΔΔCt法计算表达量,引物序列为Nrf2:Forward:GGTGCCTATGTCTCAGCCTCTT,Reverse:GCCATAGAACTGATGA GAGGGAG;Keap1:Forward:GGCATTTGGAGAAAGCAGTAGTC,Reverse:AGTGGAACGCATCCAAGTC GGC;GAPDH:Forward:GACTACAGGCATTGTGGAGACC,Reverse:GGTCGTAATCACTGAGAGCCAC。
2.6 Westrn blot取大鼠异位子宫组织(对照组取在位子宫组织)加入裂解液研磨,离心取上清液,水浴煮沸变性并进行总蛋白定量,取适量蛋白进行电泳分离、转膜、封闭,使用1∶500倍稀释后的Nrf2、Keap1抗体孵育,再使用山羊抗兔IgG抗体孵育,最后使用凝胶成像系统,以GAPDH为内参,使用Image J软件对组织内Nrf2、Keap1水平定量分析。
2.7 统计学处理使用SPSS 20.0进行统计学分析,数据以均数±标准差(x±s)表示,组间比较采用单因素方差分析,组间两两比较采用SNK检验,P < 0.05为差异有统计学意义。
3 结果 3.1 补肾活血汤对子宫内膜异位症大鼠血清E2、CA125的影响补肾活血汤对子宫内膜异位症大鼠血清E2、CA125的影响见表 1。结果表明,与假手术组大鼠相比,模型组大鼠血清E2、CA125水平升高,差异有统计学意义(P < 0.05);与模型组子宫内膜异位症大鼠相比,补肾活血汤低、中、高剂量组及达那唑组大鼠血清E2、CA125水平降低,差异有统计学意义(P < 0.05),且大鼠血清E2、CA125水平随着补肾活血汤剂量的增加而降低。
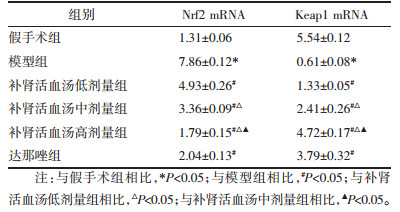
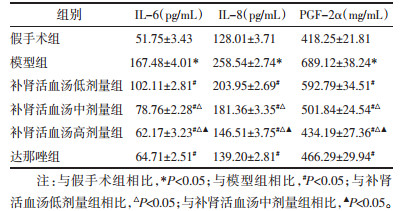
补肾活血汤对子宫内膜异位症大鼠腹腔IL-6、IL-8、PGF-2α的影响见表 2。结果表明,与假手术组大鼠相比,模型组大鼠腹腔IL-6、IL-8、PGF-2α水平升高,差异有统计学意义(P < 0.05);与模型组子宫内膜异位症大鼠相比,补肾活血汤低、中、高剂量组及达那唑组大鼠腹腔IL-6、IL-8、PGF-2α水平降低,差异有统计学意义(P < 0.05),随着补肾活血汤剂量的增加,大鼠腹腔IL-6、IL-8、PGF-2α水平逐渐降低。
|
大鼠子宫内膜组织病理学检查结果如图 1所示,结果表明,假手术组大鼠在位内膜上皮细胞呈柱状,无明显病理性改变;模型组子宫内膜异位症大鼠异位内膜增厚,腺上皮和浅上皮形成高柱,可见明显的增生;补肾活血汤各剂量组及达那唑组大鼠异位内膜增厚减轻,柱状结构接近正常,腺体和腺上皮细胞数量接近正常。
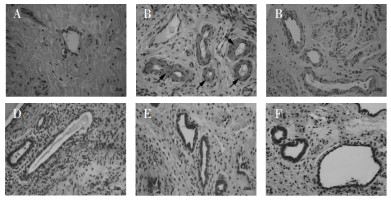
|
| 注:A.假手术组;B.模型组;C.补肾活血汤低剂量组;D.补肾活血汤中剂量组;E.补肾活血汤高剂量组;F.达那唑组。黑色箭头:子宫内膜增厚。 图 1 大鼠子宫内膜病理学检查(HE,×200) Fig. 1 Pathological examination of rat endometrium (HE, ×200) |
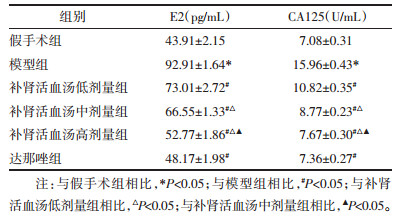
补肾活血汤对子宫内膜异位症大鼠Nrf2、Keap1mRNA的影响见表 3。结果表明,与假手术组相比,模型组大鼠异位子宫内膜组织Nrf2 mRNA水平升高,Keap1mRNA水平降低,差异有统计学意义(P < 0.05);与模型组子宫内膜异位症大鼠相比,补肾活血汤低、中、高剂量组大鼠子宫内膜组织Nrf2 mRNA水平降低,Keap1 mRNA水平升高,差异有统计学意义(P < 0.05)。
补肾活血汤对子宫内膜异位症大鼠Nrf2、Keap1水平的影响见图 2。结果表明,与假手术组大鼠相比,模型组大鼠异位子宫内膜Nrf2水平升高,Keap1水平降低,差异有统计学意义(P < 0.05);与模型组子宫内膜异位症大鼠相比,补肾活血汤低、中、高剂量组大鼠子宫内膜组织Nrf2水平降低,Keap1水平升高,差异有统计学意义(P < 0.05)。
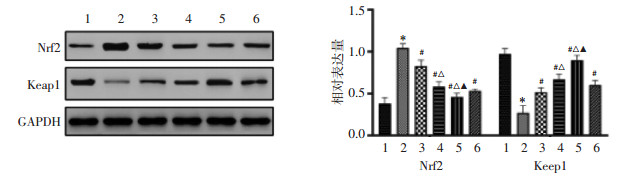
|
| 注:1.假手术组;2.模型组;3.补肾活血汤低剂量组;4.补肾活血汤中剂量组;5.补肾活血汤高剂量组;6.达那唑组。与假手术组相比,*P < 0.05;与模型组相比,#P < 0.05;与补肾活血汤低剂量组相比,△P < 0.05;与补肾活血汤中剂量组相比,▲P < 0.05。 图 2 补肾活血汤对子宫内膜异位症大鼠Nrf2、Keap1水平的影响 Fig. 2 Effects of Bushen Huoxue decoction on Nrf2 and Keap1 levels in endometriosis rats |
子宫内膜异位症是临床中常见的女性妇科疾病,临床表现为痛经、月经异常、不孕等症状,其发病机制与女性经血逆流、性激素及炎症刺激、免疫缺陷、遗传等因素有关[15]。中医学认为子宫内膜异位症与女性经络气血壅滞不通,脏腑气血运行失常,聚集与盆腔留滞胞络;又由于外邪内生,正气耗损,邪气藏于体内,久聚不散,若遇到情志失调、劳思伤神,则邪气伺机而出;此外,正气不足加之卫外不固,外感风寒、血液黏滞、痰湿气短等病症均为诱因。所以,对于子宫内膜异位症的治疗中医学强调活血化瘀、补正益气、通络止痛是关键。
补肾活血汤出自中国古代医学著作《伤科大成》,由熟地黄、菟丝子、杜仲等药材组成,有活血止痛之功效,用于治疗肝肾虚弱等病症。中医理论认为,肝肾亏损则导致筋骨失养,进而引起血行瘀滞,经脉不畅,使用补益肝肾之药材,则起到活血通络止痛的功效。补肾活血汤中熟地黄、杜仲、补骨脂等药材起到滋阴补血,补精益肾,阴阳调和之功效,当归尾来源于中药材当归尾部,有活血祛瘀之功效,对经闭不通有奇效,没药散瘀消肿,去痛生肌,独活通痹止痛,除风祛湿,红花活血通经,散瘀止痛的作用,对于闭经、通经等症状有显著疗效,诸药合用,标本兼治,驱邪扶正,起到通络活血的功效。现代医学研究表明[16-17],补肾活血汤对于子宫内膜异位症有一定的治疗作用,补肾活血汤在治疗子宫内膜异位症的临床应用中,刘凯丽等[18]研究发现补肾活血汤能够调节子宫内膜厚度,改善子宫动脉血流动力学参数及子宫内膜的容受性;汤丽婷[19]通过临床回顾性研究报道,补肾活血汤对子宫内膜异位症引起的不孕症患者最大卵泡直径、内膜囊肿体积等均有明显改善作用,可见补肾活血汤对于子宫内膜异位症的治疗表现出巨大潜力。
研究发现[20-21],在子宫内膜异位症患者体内,E2及CA125水平显著升高,并提示E2及CA125能够促进子宫内膜异位症的疾病进展,影响预后;IL-6及IL-8是体内重要的炎症因子,机体细胞受到各种刺激信号时,体内IL-6及IL-8水平明显升高并促进体内炎症水平的进展加重[22],PGF-2α则能够起到放大疼痛信号并诱导炎症进一步加剧[21],在子宫内膜异位症患者及动物模型腹腔液中均提示IL-6、IL-8及PGF-2α水平的升高。本实验结果表明,与模型组大鼠相比,补肾活血汤各剂量组大鼠血清E2、CA125水平及腹腔灌洗液IL-6、IL-8及PGF-2α水平随着补肾活血汤剂量的增加而逐渐降低,这提示补肾活血汤能够呈剂量依赖性的降低子宫内膜异位症大鼠腹腔炎症水平并抑制子宫内膜异位症进一步恶化进展。
Nrf2能够通过调节抗氧化蛋白和II相解毒酶的表达,进而参与细胞氧化应激反应,Keap1与肌动蛋白结合存在细胞浆中,并能够与Nrf2在细胞质中的结合以复合物的形式存在[23]。在氧化应激条件下,Keap1被氧化,进而使Keap1-Nrf2复合物的稳定状态被破坏,促进细胞Nrf2水平的升高,激活下游与细胞周期、增殖等生理活动相关的蛋白通路,促进细胞的存活[24]。有研究表明[25-28],Nrf2能够参与细胞中嘌呤合成的合成过程,诱导葡萄糖和谷氨酰胺进入合成代谢途径,进而促进细胞增殖,同时Nrf2水平的升高能够保护细胞免受氧化应激损伤,进而加速了子宫内膜异位症的疾病进展。本实验结果表明,给予子宫内膜异位症大鼠不同剂量的补肾活血汤后,与模型组大鼠相比较,补肾活血汤各剂量组大鼠异位子宫组织内Nrf2 mRNA及蛋白水平降低,而Keap1mRNA及蛋白水平升高,且与补肾活血汤的剂量表现出依赖性,提示补肾活血汤能够通过调节子宫内膜异位症大鼠体内Nrf2/Keap1通路相关蛋白水平,进而发挥对子宫内膜异位症大鼠体内炎症水平的抑制作用及病理改变的修复作用。同时,由于时间及实验条件的限制,本实验未能进一步研究补肾活血汤对子宫内膜异位症大鼠Nrf2/Keap1通路下游相关通路的调节作用,本课题拟在今后研究中对上述问题做深入探讨。
综上所述,补肾活血汤能够降低大鼠血清雌二醇及CA125水平,缓解子宫内膜异位症大鼠腹腔炎症水平,其机制可能与调节Nrf2/Keap1通路有关。
| [1] |
FARELLA M, CHANAVAZ-LACHERAY I, VERSPICK E, et al. Pregnancy outcomes in women with history of surgery for endometriosis[J]. Fertility and Sterility, 2020, 113(5): 996-1004. DOI:10.1016/j.fertnstert.2019.12.037 |
| [2] |
HUIJS E, NAP A. The effects of nutrients on symptoms in women with endometriosis: a systematic review[J]. Reproductive Biomedicine Online, 2020, 41(2): 317-328. DOI:10.1016/j.rbmo.2020.04.014 |
| [3] |
NNOAHAM K E, HUMMELSHOJ L, WEBSTER P, et al. Reprint of impact of endometriosis on quality of life and work productivity: a multicenter study across ten countries[J]. Fertility and Sterility, 2019, 112(4): e137-e152. DOI:10.1016/j.fertnstert.2019.08.082 |
| [4] |
沈明霞. 补肾活血汤为主治疗子宫内膜异位症不孕40例[J]. 浙江中医杂志, 2012, 47(1): 27. SHEN M X. 40 cases of endometriosis infertility treated with Bushen Huoxue decoction[J]. Zhejiang Journal of Traditional Chinese Medicine, 2012, 47(1): 27. DOI:10.3969/j.issn.0411-8421.2012.01.020 |
| [5] |
岳会群. 补肾活血汤治疗子宫内膜异位症不孕的临床疗效[J]. 世界最新医学信息文摘, 2016, 16(29): 136-136, 139. YUE H Q. Clinical effect of Bushen Huoxue decoction on endometriosis infertility[J]. World Latest Medicine Information, 2016, 16(29): 136-136, 139. DOI:10.3969/j.issn.1671-3141.2016.29.104 |
| [6] |
CHEN N, DU B, ZHOU H, et al. Abnormal expression of Nrf2 may play an important role in the pathogenesis and development of adenomyosis[J]. PLoS One, 2017, 12(8): e0182773. DOI:10.1371/journal.pone.0182773 |
| [7] |
HAYES J D, ASHFORD M L. Nrf2 orchestrates fuel partitioning for cell proliferation[J]. Cell Metabolism, 2012, 16(2): 139-141. DOI:10.1016/j.cmet.2012.07.009 |
| [8] |
MARCELLIN L, SANTULLI P, CHOUZENOUX S, et al. Alteration of Nrf2 and glutamate cysteine ligase expression contribute to lesions growth and fibrogenesis in ectopic endometriosis[J]. Free Radical Biology & Medicine, 2017, 110(2): 1-10. |
| [9] |
KAPOOR R, SIROHI V K, GUPTA K, et al. Naringenin ameliorates progression of endometriosis by modulating Nrf2/Keap1/HO1 axis and inducing apoptosis in rats[J]. The Journal of Nutritional Biochemistry, 2019, 70(1): 215-226. |
| [10] |
刘泽滨, 林立鹏, 晁艳, 等. 桂枝茯苓丸对子宫内膜异位症大鼠血清免疫球蛋白和炎症因子水平的影响[J]. 国际检验医学杂志, 2018, 39(16): 1955-1957. LIU Z B, LIN L P, CHAO Y, et al. The effect of Guizhi Fuling pills on serum immunoglobulin and inflammatory factor in rats with endometriosis[J]. International Journal of Laboratory Medicine, 2018, 39(16): 1955-1957. DOI:10.3969/j.issn.1673-4130.2018.16.006 |
| [11] |
王金霞, 崔宇红, 成映霞, 等. 少腹逐瘀汤对子宫内膜异位症大鼠MAPK/ERK信号通路的影响[J]. 中国病理生理杂志, 2019, 35(1): 181-187. WANG J X, CUI Y H, CHENG Y X, et al. Effect of Shaofu-Zhuyu decoction on MAPK/ERK signaling pathway in rats with endometriosis[J]. Chinese Journal of Pathophysiology, 2019, 35(1): 181-187. DOI:10.3969/j.issn.1000-4718.2019.01.028 |
| [12] |
肖艳平, 付久园, 王晓华, 等. 重组人内皮抑素对子宫内膜异位症大鼠的影响研究[J]. 中国临床药理学杂志, 2019, 35(22): 2881-2883. XIAO Y P, FU J Y, WANG X H, et al. Effect of recombinant human endostatin in endometriosis rats[J]. The Chinese Journal of Clinical Pharmacology, 2019, 35(22): 2881-2883. |
| [13] |
施乐, 张超, 季文辉, 等. 补肾活血汤通过抑制Wntβ-catenin信号通路对激素性股骨头坏死大鼠疗效及血管形态、VEGF的影响[J]. 四川中医, 2020, 38(2): 59-62. SHI L, ZHANG C, JI W H, et al. Effects of Bushen Huoxue decoction on efficacy, vascular morphology and VEGF of rats with steroid-induced femoral head necrosis by inhibiting Wntβ-catenin signaling pathway[J]. Journal of Sichuan Traditional Chinese Medicine, 2020, 38(2): 59-62. |
| [14] |
杨届, 吴官保, 冯帅华, 等. 补肾活血汤对去势后大鼠腰椎间盘p38MAPK蛋白含量影响的研究[J]. 中医药导报, 2017, 23(2): 17-20. YANG J, WU G B, FENG S H, et al. Effects of bushen Huoxue decoction on lumbar intervertebral disc p38MAPK protein level in rats without ovary[J]. Guiding Journal of Traditional Chinese Medicine and Pharmacy, 2017, 23(2): 17-20. |
| [15] |
HINDMAN N, VANBUREN W. Imaging spectrum of endometriosis (endometriomas to deep infiltrative endometriosis)[J]. Radiologic Clinics of North America, 2020, 58(2): 275-289. DOI:10.1016/j.rcl.2019.11.001 |
| [16] |
曾勇梅, 林兰娟, 李水云. 补肾活血汤对子宫内膜异位囊肿术后卵巢功能及妊娠结局的影响[J]. 陕西中医, 2017, 38(1): 53-55. ZENG Y M, LIN L J, LI S Y. Effect of Bushen Huoxue decoction on ovarian function and pregnancy outcome in patients with ovarian endometriosis[J]. Shaanxi Journal of Traditional Chinese Medicine, 2017, 38(1): 53-55. DOI:10.3969/j.issn.1000-7369.2017.01.026 |
| [17] |
汤伟伟, 马小平, 朱利, 等. 补肾活血汤对子宫内膜异位症相关性不孕患者子宫内膜容受性的影响[J]. 中国医药导报, 2016, 13(25): 122-124, 129. TANG W W, MA X P, ZHU L, et al. Influence of bushen Huoxue decoction on endometrial receptivity of patients with endometriosis-induced infertility[J]. China Medical Herald, 2016, 13(25): 122-124, 129. |
| [18] |
刘凯丽, 汤伟伟, 万贵平. 补肾活血汤对子宫内膜异位症相关性不孕患者宫腔冲洗液中HOXA10表达水平的影响[J]. 中国医药导报, 2019, 16(30): 97-100. LIU K L, TANG W W, WAN G P. Influence of Bushen Huoxue decoction on HOXA10 expression in uterine flushing fluid of patients with endometriosis-related infertility[J]. China Medical Herald, 2019, 16(30): 97-100. |
| [19] |
汤丽婷. 补肾活血汤治疗子宫内膜异位症不孕的临床观察[J]. 中国当代医药, 2013, 20(24): 123-124. TANG L T. Clinical observation of Bushen Huoxie Decoction for treatment of endometriosis infertility[J]. China Modern Medicine, 2013, 20(24): 123-124. |
| [20] |
肖新春, 崔晓萍. 消异方对子宫内膜异位症大鼠血清E2、P含量的影响[J]. 中国中医药科技, 2013, 20(5): 465-466. XIAO X C, CUI X P. Effects of Xiaoyi recipe on serum E2 and P contents of endometriosis rats[J]. Chinese Journal of Traditional Medical Science and Technology, 2013, 20(5): 465-466. DOI:10.3969/j.issn.1005-7072.2013.05.017 |
| [21] |
徐慧军, 孙明娥, 纪令士, 等. 消癥汤对子宫内膜异位症模型大鼠腹腔液PGF2α和血清CA125水平的影响[J]. 中国实验方剂学杂志, 2010, 16(8): 169-172. XU H J, SUN M E, JI L S, et al. Influence and of endometriosis model mouse's liquid of abdominal cavity PGF2α and serum CA125which treated with Xiaozheng decoction[J]. Chinese Journal of Experimental Traditional Medical Formulae, 2010, 16(8): 169-172. DOI:10.3969/j.issn.1005-9903.2010.08.051 |
| [22] |
张晓峰, 张明亮. 祛瘀解毒消癥汤对子宫内膜异位症大鼠腹腔液中IL-6、IL-8水平的影响[J]. 陕西中医, 2013, 34(12): 1676-1678. ZHANG X F, ZHANG M L. Effects of Quyu Jiedu Xiaozheng decoction on the levels of IL-6 and IL-8 in the peritoneal fluid of endometriosis rats[J]. Shaanxi Journal of Traditional Chinese Medicine, 2013, 34(12): 1676-1678. DOI:10.3969/j.issn.1000-7369.2013.12.058 |
| [23] |
COLARUSSO S, DE SIMONE D, FRATTARELLI T, et al. Optimization of linear and cyclic peptide inhibitors of KEAP1-NRF2 protein-protein interaction[J]. Bioorganic & Medicinal Chemistry, 2020, 28(21): 115738. |
| [24] |
MADDEN S K, ITZHAKI L S. Structural and mechanistic insights into the Keap1-Nrf2 system as a route to drug discovery[J]. Biochimica et Biophysica Acta Proteins and Proteomics, 2020, 1868(7): 140405. DOI:10.1016/j.bbapap.2020.140405 |
| [25] |
REN X, YU J, GUO L, et al. TRIM16 protects from OGD/R-induced oxidative stress in cultured hippocampal neurons by enhancing Nrf2/ARE antioxidant signaling via downregulation of Keap1[J]. Experimental Cell Research, 2020, 391(1): 111988. DOI:10.1016/j.yexcr.2020.111988 |
| [26] |
ABED D A, LEE S, HU L. Discovery of disubstituted xylylene derivatives as small molecule direct inhibitors of Keap1-Nrf2 protein-protein interaction[J]. Bioorganic & Medicinal Chemistry, 2020, 28(6): 115343. |
| [27] |
LIU Y, GE M, ZHANG T, et al. Exploring the correlation between deltamethrin stress and Keap1-Nrf2-ARE pathway from Drosophila melanogaster RNASeq data[J]. Genomics, 2020, 112(2): 1300-1308. DOI:10.1016/j.ygeno.2019.07.019 |
| [28] |
REN L, ZHAN P, WANG Q, et al. Curcumin upregulates the Nrf2 system by repressing inflammatory signaling-mediated keap1 expression in insulin-resistant conditions[J]. Biochemical and Biophysical Research Communications, 2019, 514(3): 691-698. DOI:10.1016/j.bbrc.2019.05.010 |
2. Department of Traditional Chinese Medicine and Gynecology, The First Hospital of Hunan University of Chinese Medicine, Changsha 430000, China
 2022, Vol. 39
2022, Vol. 39