文章信息
- 张红梅, 李方怿, 赵春霞, 王春华, 颜晓晖, 余河水, 李正
- ZHANG Hongmei, LI Fangyi, ZHAO Chunxia, WANG Chunhua, YAN Xiaohui, YU Heshui, LI Zheng
- 五味子多糖的分离、纯化及结构表征
- Isolation, purification and characterization of polysaccharide from Schisandra chinensis
- 天津中医药, 2022, 39(4): 509-515
- Tianjin Journal of Traditional Chinese Medicine, 2022, 39(4): 509-515
- http://dx.doi.org/10.11656/j.issn.1672-1519.2022.04.21
-
文章历史
- 收稿日期: 2022-01-15
2. 省部共建组分中药国家重点实验室,天津 301617
五味子为木兰科植物五味子[Schisandra chinensis(Turcz.)Baill.]的干燥成熟果实。最早列于《神农本草经》上品中药,具有抗氧化、抗肿瘤、保肝、免疫调节等药理作用[1-3]。子味子作为一种传统中药,也是经典方剂生脉散和现代制剂生脉注射液的主要组成药物,其主要化学成分包括木脂素类[4]、挥发油[5]、多糖及有机酸类[6-7]等。
多糖是五味子的重要组成成分,与其生物活性密切相关。现代药理研究表明,五味子多糖具有调节免疫、抗癌、抗氧化等多种药理活性[8],且对机体几乎无毒副作用,具有高效低毒的特点[9]。因此,本实验对五味子多糖进行分离纯化,综合运用现代仪器分析技术系统和全面的研究五味子多糖的分子量、单糖组成等结构特征,以期为五味子多糖的进一步研究及开发利用提供一定借鉴与参考。
1 材料 1.1 药材五味子(批号:17110604)由苏中药业集团股份有限公司提供,经天津中医药大学王春华副研究员鉴定为木兰科植物五味子[Schisandra chinensis(Turcz.)Baill.]的干燥成熟果实。
1.2 试剂D-甘露糖(批号:C16J8H28561,含量≥98%)、鼠李糖(批号:SA0411GA13,含量≥98%)、D-半乳糖(批号:Z22J9H64187,含量≥98%)、D-无水葡萄糖(批号:S10S9I69833,含量≥98%)、L-阿拉伯糖(批号:T05J6C1,含量≥98%)、D-木糖(批号:B02M6W1,含量≥99%)、D-葡萄糖醛酸(批号:K14J7S9017,含量≥98%)、D-半乳糖醛酸(批号:K02A9B66077,含量≥98%)购于上海源叶生物科技有限公司;甲醇(色谱纯)、乙腈(色谱纯)购于美国Fisher公司;葡聚糖凝胶G-150、乙酸铵购于北京索莱宝科技有限公司;乙酸钠购于上海阿拉丁生化科技有限公司;重蒸酚购于北京鼎国昌盛生物科技有限责任公司;溴化钾(KBr)购于国际晶体实验室;氘代水(D2O)购于青岛艾弗斯特科贸有限公司;氢氧化钠(NaOH)购于天津市津科精细化工研究所;盐酸(HCl)购于天津市大茂化学试剂厂;1-苯基-3-甲基-5-吡唑啉酮(1-phenyl-3-methyl-5-pyrazolone,PMP)购于上海源叶生物科技有限公司。
1.3 仪器LC-20AD型高效液相色谱仪、RID-20A示差检测器、傅里叶变换红外光谱仪(日本岛津公司);DAWN 8型多角度激光光散射仪(美国怀雅特技术公司);ACQUITY Arc液相色谱仪、2998型二极管阵列检测器(美国Waters公司);FDU-2110型冷冻干燥机(东京理化EYELA公司);AB135-S型电子分析天平[十万分之一,梅特勒-托利多仪器(上海)有限公司];KQ2200DB型超声波清洗器(昆山超声仪器有限公司);AVANCE Ⅲ 400 MHz全数字化核磁共振谱仪(瑞士Bruker公司)。
2 方法 2.1 粗多糖的提取及分级醇沉称取130 g脱脂后的干燥的五味子,加入10倍量的纯水,提取3次,每次3 h,合并提取液,减压浓缩。采用Sevage法脱蛋白,直到在260 nm和280 nm波长下没有紫外吸收峰后,加入3倍体积的95%乙醇,置于4 ℃静置过夜,离心得到多糖沉淀,冷冻干燥得五味子粗多糖。
称取5.0 g五味子粗多糖,加入500 mL纯水搅拌16 h,使其充分溶胀,加入95%乙醇,使溶液中乙醇浓度依次达到20%、40%、60%、80%分别收集沉淀,沉淀依次用无水乙醇、丙酮、乙醚洗涤3次,冷冻干燥得级分1(SCP-1)、级分2(SCP-2)、级分3(SCP-3)和级分4(SCP-4)。
2.2 多糖的分离纯化称取SCP-3配成1%的多糖溶液,使其充分溶胀,调节pH值为4.0,加入1.5%活性炭脱色[10],抽滤去除活性炭,透析48 h,冷冻干燥。取冻干的多糖200 mg加入10 mL纯水溶解,采用葡聚糖凝胶G-150进一步分离纯化,洗脱剂为0.1 mol/L NaCl,流速为0.3 mL/min,每15 min收集1管,采用苯酚-硫酸法检测收集液,绘制检测曲线。根据检测曲线收集主峰部分进行合并,合并后的多糖溶液采用3000 kD透析袋透析脱盐,冷冻干燥,得五味子多糖组分SCP-3-1,备用。
2.3 SCP-3-1的含量测定 2.3.1 标准曲线的绘制称取干燥至恒质量(105 ℃)的葡萄糖5.03 mg,置于50 mL容量瓶中,配制成葡萄糖标准溶液。分别精密移取葡萄糖标准溶液0.2、0.4、0.6、0.8、0.9、1.0 mL于6个试管中,精密补水至1.0 mL,分别加入6%苯酚溶液1.0 mL,迅速加入浓硫酸5.0 mL,剧烈振摇,沸水浴10 min后,冰水浴至室温,490 nm处测得吸光度。以吸光度(Y)对葡萄糖浓度(X)进行线性拟合,得到线性方程[11]。
2.3.2 多糖的含量测定称取2.98 mg SCP-1、2.54 mg SCP-2、2.55 mg SCP-3、2.53 mg SCP-4和2.50 mg SCP-3-1,分别置于5.0 mL容量瓶中定容,各取0.1 mL置于试管中,补水至1.0 mL,分别加入6%苯酚溶液1.0 mL,迅速加入浓硫酸5.0 mL,剧烈振摇,沸水浴10 min后,冰水浴至室温,490 nm处测得吸光度。根据下列公式计算多糖含量[12-15]。
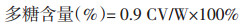 |
式中:C为样品溶液中葡萄糖的浓度,V为样品溶液的体积,0.9为换算因子,W为样品的质量(mg)。
2.4 SCP-3-1的结构表征 2.4.1 分子量及其分布的测定称取SCP-3-1适量加入流动相配制成浓度为2.0 mg/mL的多糖溶液,0.22 μm微孔滤膜滤过,取续滤液即得样品。采用高效分子排阻色谱法测定其纯度和分子量[16]。色谱条件为:色谱柱:TSKgel GMPWxl凝胶色谱柱(7.8 mm l.D.×30 cm,13 μm);流动相:0.003 mol/L乙酸钠溶液;流速:0.8 mL/min进行等度洗脱;进样量:100 μL;柱温:40 ℃;使用MALLS-RID检测多糖,Astra 6软件收集及处理数据。
2.4.2 单糖组成分析 2.4.2.1 多糖的水解将SCP-3-1样品置于具塞试管中,用2.0 mol/L三氟乙酸(TFA)进行完全酸水解(m多糖∶vTFA=2∶1),沸水浴水解6 h,取出放至室温,用甲醇反复浓缩蒸除TFA,最后用双蒸水溶解,得多糖水解液。
2.4.2.2 衍生化产物的制备称取D-甘露糖1.53 mg、鼠李糖1.10 mg、D-半乳糖1.50 mg、D-无水葡萄糖1.51 mg、L-阿拉伯糖1.54 mg、D-木糖1.50 mg、D-葡萄糖醛酸1.46 mg、D-半乳糖醛酸1.53 mg置于10 mL容量瓶,纯水定容,作为混合对照品溶液。分别取混合对照品溶液和多糖水解液200 μL,加入200 μL的0.5 mol/L的PMP-甲醇溶液和200 μL的0.3 mol/L的NaOH溶液,70 ℃衍生化30 min,冷却至室温,加入200 μL的0.3 mol/L的HCl溶液,混匀,加入1.0 mL氯仿萃取,去除多余的PMP试剂,重复3次,8 000 r/min离心10 min,离心半径6.0 cm,取上清液进样测定。
2.4.2.3 色谱条件色谱柱:Kromasil 100-5-C18(4.6 mm×250 mm,5 μm);流动相:0.1 mol/L乙酸铵水溶液-乙腈(84∶16);柱温:35 ℃;检测波长:250 nm;流速:1.0 mL/min;进样量:20 μL。
2.4.3 红外光谱分析称取1.50 mg SCP-3-1样品,加入150 mg干燥的KBr粉末置于玛瑙研钵中研磨均匀后压片。采用傅里叶变换红外光谱仪扫描,扫描波数范围为4 000~400 cm-1。
2.4.4 核磁共振波谱分析称取20.64 mg SCP-3-1溶于D2O中,采用全数字化核磁共振谱仪(400 MHz),测定1H-NMR、13C-NMR和DEPT-135谱。
3 结果 3.1 粗多糖的分级醇沉结果采用水提醇沉法提取得到五味子粗多糖,通过加入95%乙醇使五味子多糖溶液达到20%、40%、60%、80%的乙醇浓度,分级醇沉得到SCP-1、SCP-2、SCP-3和SCP-4,见表 1。
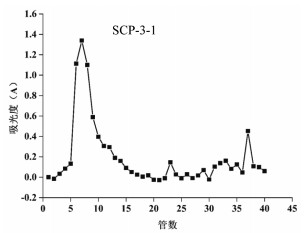
SCP-3经葡聚糖凝胶柱进一步分离,以0.1 mol/L的NaCl为洗脱剂,洗脱得到纯度较高的五味子多糖。采用苯酚-硫酸法检测收集液,绘制洗脱曲线(图 1),根据洗脱曲线收集主峰部分进行合并,合并后的多糖溶液采用3 000 kDa透析袋透析脱盐,冷冻干燥得SCP-3-1。
|
| 图 1 SCP-3洗脱曲线 Fig. 1 Elution profile of SCP-3 |
采用苯酚-硫酸法对得到的SCP-3-1的多糖含量进行测定,首先用不同浓度的葡萄糖标准溶液建立标准曲线,以吸光度为纵坐标(Y)、葡萄糖浓度为横坐标(X)进行线性拟合,得到线性方程Y=10.027 37X+0.013 89,R2=0.994 08。根据标准曲线计算出SCP-3-1的多糖含量为74.28%。
3.4 SCP-3-1的结构表征 3.4.1 分子量及其分布测定结果采用HPSEC-MALLS-RID法测定多糖,Astra 6软件收集及处理数据,得到SCP-3-1的分子量为84.9 kDa,多分散指数为1.207,SCP-3-1的多分散指数接近于1且峰型为单一对称峰,说明SCP-3-1的纯度较高。见图 2、表 2。

|
| 图 2 SCP-3-1示差及多角度激光光散射色谱图 Fig. 2 Chromatograms of SCP-3-1 using MALLS-RID |

|
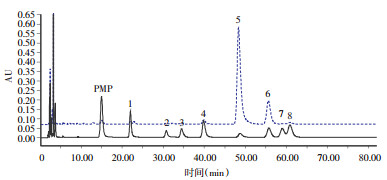
采用PMP柱前衍生化HPLC法测定五味子多糖的单糖组成,TFA将多糖水解为单糖,PMP对单糖衍生化处理后,采用二极管阵列检测器检测,得到多糖的单糖组成及其摩尔比(图 3)。结果表明,SCP-3-1主要由甘露糖、半乳糖醛酸、葡萄糖、半乳糖和阿拉伯糖(摩尔比为0.09∶0.19∶19.82∶2.08∶0.13)组成。
|
| 注:1.甘露糖 2.鼠李糖 3.葡萄糖醛酸 4.半乳糖醛酸 5.葡萄糖 6.半乳糖 7.木糖 8.阿拉伯糖。 图 3 混合对照品、SCP-3-1的HPLC色谱图 Fig. 3 HPLC chromatograms of standard monosaccharides and acidolysis products of SCP-3-1 |
分析结果见图 4。SCP-3-1具有多糖特征吸收峰,3 383 cm-1为多糖分子间或分子内氢键O-H伸缩振动的强且宽的吸收峰[17],2 927 cm-1为甲基和次甲基的C-H伸缩振动的吸收峰,1 740 cm-1处的吸收峰为酯键的特征吸收峰,说明有一部分的半乳糖醛酸是以内酯的形式存在的。1 622 cm-1为羰基的C=O伸缩振动形成的吸收峰,1 417 cm-1为C-H的变形振动的吸收峰,1 400~1 200 cm-1 为C-H的变角振动,和C-H的伸缩振动构成了糖环的特征吸收,SCP-3-1在1 022、1 080和1 153 cm-1处为3个吸收峰,说明其糖环构型为吡喃型,848 cm-1处的吸收峰表明SCP-3-1含有α-吡喃糖苷键[18-20]。
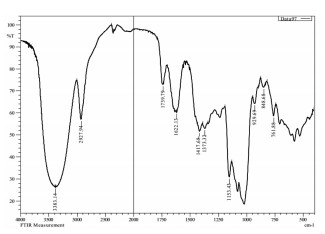
|
| 图 4 SCP-3-1红外光谱图 Fig. 4 IR spectrum of SCP-3-1 |
1H-NMR主要用于判断多糖的糖苷键构型,多糖的C1上的1H-NMR信号出现在δ 5.5~4.8 ppm,C2-C6的1H-NMR信号出现在δ 4.8~4.0 ppm,此处信号堆积严重,难以解析。通常,α构型的吡喃糖其C1上的1H-NMR信号化学位移值大于5.0 ppm,β构型的则小于5.0 ppm。13C-NMR的范围较广,通常在δ 110~96 ppm处为糖端基碳信号,其他化学位移为非端基碳信号。未发生取代的C2、C3、C4、C5信号通常在δ 78~70 ppm,发生取代后在δ 85~78 ppm。未发生取代的C6信号通常在δ 64~60 ppm,取代后在δ 70~67 ppm[18, 20-21]。
SCP-3-1的1H-NMR谱如图 5所示,结果表明,δ 5.43 ppm和δ 5.42 ppm为糖端基C1的质子信号,δ 4.7~3.6 ppm为非端基质子信号,δ 3.80处的强信号含有半乳糖醛酸的甲氧酯基的甲基质子信号。化学位移δ 5.43 ppm、δ 5.42 ppm大于5.0 ppm,表明其构型为α构型,说明级分SCP-3-1的单糖是以α-糖苷键连接的。
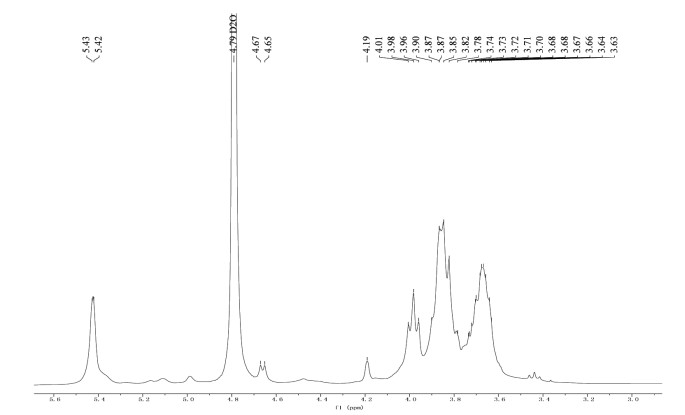
|
| 图 5 SCP-3-1的1H-NMR谱 Fig. 5 The 1H-NMR spectrum of SCP-3-1 |
SCP-3-1的13C-NMR谱如图 6所示,结果表明,δ 104.4 ppm、δ 99.7 ppm为异头碳的信号,δ 77~70 ppm为未发生取代的C2、C3、C4、C5的信号,δ 60.8 ppm、δ 60.5 ppm为未取代的C6的信号。
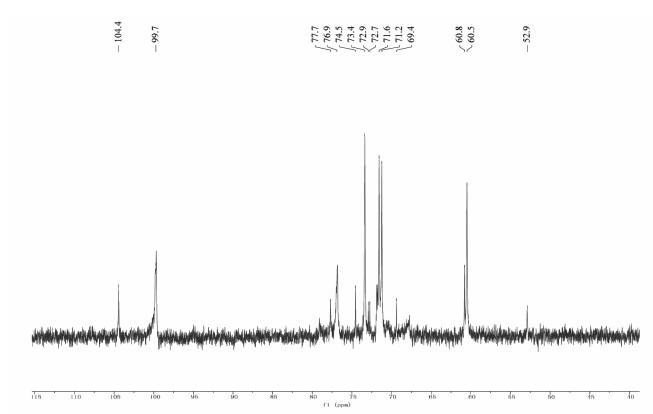
|
| 图 6 SCP-3-1的13C-NMR谱 Fig. 6 The 13C-NMR spectrum of SCP-3-1 |
SCP-3-1的DEPT-135谱如图 7所示,δ 60.3 ppm、δ 60.4 ppm和δ 60.7 ppm可能为吡喃糖6位的碳信号,且谱图中在δ 84~82 ppm处没有碳的共振吸收峰,表明该多糖不含有呋喃糖环。
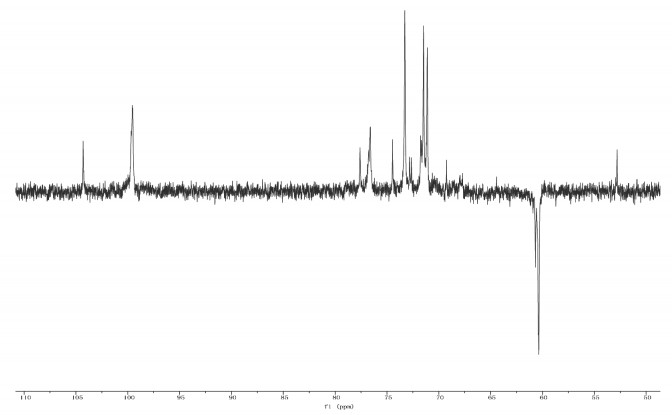
|
| 图 7 SCP-3-1的DEPT-135谱 Fig. 7 The DEPT-135 spectrum of SCP-3-1 |
多糖的分离纯化是对其结构表征的基础。从天然产物提取的粗多糖通常含有蛋白质、色素等杂质,因此,本实验通过水提醇沉法得到五味子粗多糖,分级醇沉、脱蛋白、脱色及葡聚糖凝胶G-150进一步分离纯化得五味子多糖组分SCP-3-1。经鉴定SCP-3-1是纯度较高的相对分子质量为84.9 kDa的吡喃型多糖,主要由甘露糖、半乳糖醛酸、葡萄糖、半乳糖和阿拉伯糖组成。
五味子多糖是五味子的重要活性成分,也是中药的重要功效成分之一,具有多种生理活性功能。且其功能活性与相对分子质量及其分布、单糖组成等结构特征密切相关[22]。而本研究通过对五味子多糖的结构表征,为五味子药材的综合开发利用及进一步解析多糖的构效关系提供一定理论参考。
| [1] |
白文宇, 王厚恩, 王冰瑶, 等. 五味子化学成分及其药理作用研究进展[J]. 中成药, 2019, 41(9): 2177-2183. BAI W Y, WANG H E, WANG B Y, et al. Research progress on the chemical constituents and pharmacological effects of Schisandra chinensis[J]. Chinese Traditional Patent Medicine, 2019, 41(9): 2177-2183. DOI:10.3969/j.issn.1001-1528.2019.09.033 |
| [2] |
HWANG D, SHIN S Y, LEE Y, et al. A compound isolated from Schisandra chinensis induces apoptosis[J]. Bioorganic & Medicinal Chemistry Letters, 2011, 21(20): 6054-6057. |
| [3] |
CHEN Q, ZHANG H, CAO Y, et al. Schisandrin B attenuates CCl4-induced liver fibrosis in rats by regulation of Nrf2-ARE and TGF-β/Smad signaling pathways[J]. Drug Design, Development and Therapy, 2017, 11: 2179-2191. DOI:10.2147/DDDT.S137507 |
| [4] |
史琳, 王志成, 冯叙桥. 五味子化学成分及药理作用的研究进展[J]. 药物评价研究, 2011, 34(3): 208-212. SHI L, WANG Z C, FENG X Q. Advances in studies on chemical constituents and pharmacological activities of Schisandrae Chinensis[J]. Drug Evaluation Research, 2011, 34(3): 208-212. |
| [5] |
王越. 五味子化学成分的研究[D]. 长春: 吉林大学, 2015. WANG Y. Study on chemical constituents from Schisandrae chinensis Fructus[D]. Changchun: Jilin University, 2015. |
| [6] |
李兵. 北五味子化学成分的研究[J]. 中国医药指南, 2018, 16(21): 20-21. LI B. Study on chemical constituents of Schisandra Chinensis[J]. Guide of China Medicine, 2018, 16(21): 20-21. |
| [7] |
刘宇灵, 付赛, 樊丽姣, 等. 南北五味子化学成分、药理作用等方面差异的研究进展[J]. 中国实验方剂学杂志, 2017, 23(12): 228-234. LIU Y L, FU S, FAN L J, et al. Review on differences in pharmacological, constituents and other aspects between Schisandra Chinensis fructus and Schisandrae sphenantherae fructus[J]. Chinese Journal of Experimental Traditional Medical Formulae, 2017, 23(12): 228-234. |
| [8] |
孟庆龙, 金莎, 刘雅婧, 等. 植物多糖药理功效研究进展[J]. 食品工业科技, 2020, 41(11): 335-341. MENG Q L, JIN S, LIU Y J, et al. Research progress in pharmacological efficacy of plant polysaccharides[J]. Science and Technology of Food Industry, 2020, 41(11): 335-341. |
| [9] |
徐翠莲, 杜林洳, 樊素芳, 等. 多糖的提取、分离纯化及分析鉴定方法研究[J]. 河南科学, 2009, 27(12): 1524-1529. XU C L, DU L R, FAN S F, et al. Progress of polysaccharides extraction, purification and identification methods[J]. Henan Sciences, 2009, 27(12): 1524-1529. DOI:10.3969/j.issn.1004-3918.2009.12.013 |
| [10] |
高晓旭. 北五味子多糖理化性质、结构及活性研究[D]. 沈阳: 沈阳农业大学, 2009: 27-29. GAO X X. Study on physical and chemical properties, structure and biological active of the polysaccharides from Schisandra chinensis[D]. Shenyang: Shenyang Agricultural University, 2009: 27-29. |
| [11] |
李薇, 宋新波, 孙成荣, 等. 三个不同品种甘草多糖的含量测定[J]. 天津中医药, 2013, 30(1): 47-49. LI W, SONG X B, SUN C R, et al. Content determination of polysaccharides in Radix Glycyrrhizae from three different species[J]. Journal of Tianjin University of Traditional Chinese Medicine, 2013, 30(1): 47-49. |
| [12] |
何佩娟, 张宇洁. 多糖含量测定的方法综述[J]. 现代食品, 2019(2): 27-31. HE P J, ZHANG Y J. A review of methods for determination of polysaccharide[J]. Modern Food, 2019(2): 27-31. |
| [13] |
景永帅, 马云凤, 王非凡, 等. 丹参多糖的含量测定、结构表征及药理活性研究进展[J]. 中国药房, 2020, 31(16): 2037-2042. JING Y S, MA Y F, WANG F F, et al. Research progress on content determination, structure characterization and pharmacological activity of Salvia miltiorrhiza Bunge polysaccharides[J]. Chinese Preventive Medicine, 2020, 31(16): 2037-2042. DOI:10.6039/j.issn.1001-0408.2020.16.22 |
| [14] |
程莹, 赵骏. 桑叶多糖含量测定与成分分析[J]. 中国临床药理学杂志, 2017, 33(18): 1803-1805, 1809. CHENG Y, ZHAO J. Determination the content and analysis the composition of polysaccharides from mulberry leaves[J]. The Chinese Journal of Clinical Pharmacology, 2017, 33(18): 1803-1805, 1809. |
| [15] |
ZHAO S, HAN Z, YANG L, et al. Extraction, characterization and antioxidant activity evaluation of polysaccharides from Smilacina Japonica[J]. International Journal of Biological Macromolecules, 2020, 151: 576-583. DOI:10.1016/j.ijbiomac.2020.02.015 |
| [16] |
ZHAO T, MAO G, MAO R, et al. Antitumor and immunomodulatory activity of a water-soluble low molecular weight polysaccharide from Schisandra chinensis (Turcz.) Baill[J]. Food and Chemical Toxicology, 2013, 55: 609-616. DOI:10.1016/j.fct.2013.01.041 |
| [17] |
刘艳秋. 轮叶党参多糖的分离纯化、结构分析及其生物活性研究[D]. 哈尔滨: 东北林业大学, 2018: 68-82. LIU Y Q. Isolation, purification, structure identification and biological activities of polysaccharide from Codonopsis lanceolata[D]. Harbin: Northeast Forestry University, 2018: 68-82. |
| [18] |
汪艳群. 五味子多糖的分离、结构鉴定及免疫活性研究[D]. 沈阳: 沈阳农业大学, 2012: 102-119. WANG Y Q. Isolation, structural characterization and immunological activity of polysaccharides from Schisandra Chinensis(Turcz. ) Baill[D]. Shenyang: Shenyang Agricultural University, 2012: 102-119. |
| [19] |
张旭. 人参多糖的系统分析及其免疫活性研究[D]. 长春: 东北师范大学, 2009. ZHANG X. Systematical analysis of the polysaccharides from Panax ginseng[D]. Changchun: Northeast Normal University, 2009. |
| [20] |
赵婷. 五味子多糖的分离纯化、结构表征及其活性研究[D]. 镇江: 江苏大学, 2009: 63-95. ZHAO T. Extraction, purification, characterization and activities of polysaccharides from Schisandra[D]. Zhenjiang: Jiangsu University, 2009: 63-95. |
| [21] |
赵婷. 五味子多糖的结构、生物活性及免疫机制研究[D]. 镇江: 江苏大学, 2013. ZHAO T. Study on the structure, bioactivities and immune mechanism of polysaccharides from Schisandra[D]. Zhenjiang: Jiangsu University, 2013. |
| [22] |
HU D J, CHEONG K L, ZHAO J, et al. Chromatography in characterization of polysaccharides from medicinal plants and fungi[J]. Journal of Separation Science, 2013, 36(1): 1-19. DOI:10.1002/jssc.201200874 |
2. State Key Laboratory of Component-based Chinese Medicine, Tianjin 301617, China
 2022, Vol. 39
2022, Vol. 39