文章信息
- 孙宏源, 张圆, 石存忠, 刘晓亚, 赵桂峰, 赵强, 陈明虎, 武锃, 吕仕超, 赵寻, 冯利民, 李强, 马妍, 张少强, 陈卓阳, 张磊, 李桂伟, 刘新桥, 毛静远
- SUN Hongyuan, ZHANG Yuan, SHI Cunzhong, LIU Xiaoya, ZHAO Guifeng, ZHAO Qiang, CHEN Minghu, WU Zeng, LYU Shichao, ZHAO Xun, FENG Limin, LI Qiang, MA Yan, ZHANG Shaoqiang, CHEN Zhuoyang, ZHANG Lei, LI Guiwei, LIU Xinqiao, MAO Jingyuan
- 中西医结合治疗天津地区奥密克戎新型冠状病毒感染患者核酸转阴时间的影响因素分析
- Factor analysis of nucleic acid turning negative time of novel coronavirus Omicron infection patients treated by integrated traditional Chinese and Western medicine in Tianjin area
- 天津中医药, 2022, 39(5): 551-555
- Tianjin Journal of Traditional Chinese Medicine, 2022, 39(5): 551-555
- http://dx.doi.org/10.11656/j.issn.1672-1519.2022.05.02
-
文章历史
- 收稿日期: 2022-02-20
2. 天津市南开医院, 天津 300100;
3. 天津中医药大学第二附属医院, 天津 300250;
4. 天津市天津医院, 天津 300211
天津市于2022年1月8日确诊首例社区感染新型冠状病毒奥密克戎变种患者[1], 并迅速开展广泛筛查, 同时根据流行病学调查结果对不同区域采取封控措施, 有效控制了疫情进一步蔓延。为更好地开展新型冠状病毒肺炎患者救治工作, 充分发挥中西医结合抗疫优势, 由天津医院、天津中医药大学第一附属医院、天津中医药大学第二附属医院及南开医院4所医院挑选骨干力量组建中医抗疫战队, 在天津市海河医院开展中医会诊及中医病区管理工作。截至2月13日, 天津市累计报告本土新冠肺炎确诊病例425例, 其中治愈出院398例[2]。目前有关新型冠状病毒奥密克戎变种感染成年患者的中西医结合治疗效果报道较少, 本研究拟对已出院病例开展回顾性调查, 重点观察住院患者核酸转阴时间, 并分析其影响因素, 旨在为今后该疾病的中西医结合治疗提供理论依据。
1 资料与方法 1.1 研究对象2022年1月8日-2022年2月13日天津市因感染新型冠状病毒奥密克戎变种住院的成年患者。本项研究符合医学伦理学标准, 并得到了天津中医药大学第一附属医院医学科研伦理委员会的批准(批件号: TYLL2020[K]字006)。
1.2 诊断标准 1.2.1 疾病诊断标准参照《新型冠状病毒肺炎诊疗方案(试行第八版)》[3]制定, 具以下任意1条流行病学史: 1)发病前14 d内有病例报告社区的旅行史或居住史。2)发病前14 d内与新型冠状病毒感染的患者或无症状感染者有接触史。3)聚集性发病。同时具备实时荧光逆转录聚合酶链反应(RT-PCR)检测新型冠状病毒核酸阳性, 病毒基因测序可确定为奥密克戎变种。
1.2.2 临床分型诊断标准1) 轻型: 临床症状轻微, 影像学未见肺炎表现。2)普通型: 具有发热、呼吸道症状等, 同时影像学可见肺炎表现。3)重型: 符合下述4条中任意1条: ①气促, 呼吸频率(RR) ≥ 30次/min; ②静息状态下, 吸空气时指氧饱和度≤ 93%;③动脉血氧分压(PaO2)/吸氧浓度(FiO2) ≤ 300;④临床症状进行性加重, 肺部影像学显示24~48 h内病灶明显进展>50%。4)危重型: 符合下述3种情况之一者: ①呼吸衰竭需要机械通气; ②休克; ③合并其他器官功能衰竭需重症监护治疗。5)无症状感染: 不具有临床症状, 同时生命体征、影像学及化验指标均无异常, 但具有流行病学史, 同时核酸阳性者。
1.3 病历纳入标准/排除标准 1.3.1 纳入标准1) 符合疾病诊断标准。2)年龄≥ 18岁。3)截至2022年2月13日已出院患者。4)住院期间曾接受中西医结合诊治, 中西医结合治疗方案遵循《新型冠状病毒肺炎诊疗方案(试行第8版)》。
1.3.2 排除标准1) 明确拒绝或未接受中西医结合诊疗者。2)资料显示患者或家属不能准确描述发病症状。3)病历中首次中医会诊四诊信息或中药处方记录不完整者。
1.4 病历资料采集利用EXCEL制作病历信息调查表, 内容包括住院号、性别、年龄、疫苗接种信息、既往慢性病情况、临床分型、合并前期症状、发病日期、入院日期、中医首次会诊日期、中医首诊辨证用药信息、核酸转阴日期。按纳排标准筛选病历后, 填写上述信息调查表, 并进行双人校对。
1.5 指标及定义 1.5.1 结局指标核酸转阴时间: 指患者核酸转阴日期与该名患者入院日期的差值。核酸转阴指连续两次呼吸道标本核酸检测阴性, 采样时间至少间隔24 h, 末次应为鼻咽拭子采样。并以该指标平均数进行分组, 分为早转组和晚转组。
1.5.2 影响因素指标1) 一般指标: 年龄、性别。2)疫苗接种: 指入院时患者新型冠状病毒疫苗接种情况, 分为未接种、未完成、完成及加强等4种情况。3)合并慢性疾病: 指患者入院时已知存在慢性疾病或在此次诊疗过程中发现患者存在慢性疾病。4)临床分型: 依照出院诊断中临床分型为准。5)合并前期症状: 指患者入院前是否存在新型冠状病毒感染的相关症状, 包括发热、乏力、呼吸道症状(鼻塞、咽痛、咽痒、咳嗽、咳痰等)、消化道症状(食欲下降、恶心、呕吐、腹痛、腹泻等)及其他症状(头痛、胸痛、关节痛等)。6)入院时间差: 指患者入院日期与本次疫情首例成人患者入院日期(2022年1月8日)的差值。7)中西医结合干预时间: 指患者接受中医首次会诊日期与该名患者入院日期的差值。8)中医证型分类: 根据首次中医会诊及用药情况将中医证型简单二分为单一证与兼杂证。
1.6 统计学方法选用SPSS 22.0统计软件对数据进行统计学分析。定量资料采用均数±标准差(x±s)表示, 组间比较采用独立样本t检验, 定性资料采用频数和百分率表示, 组间比较采用卡方检验。采用多元线性回归分析评价入选指标对结局指标的影响, P < 0.05表示差异具有统计学意义。
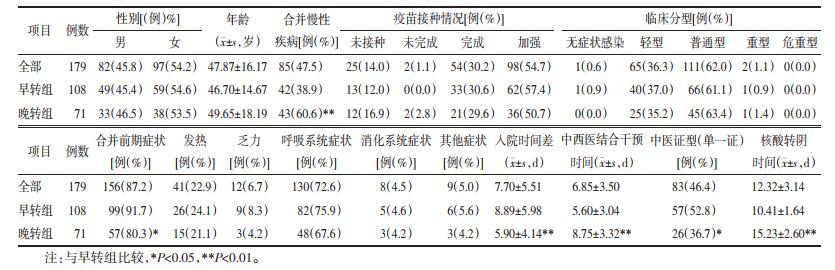
2 结果 2.1 一般资料共收集到出院患者病历信息合计398例, 根据纳排标准共剔除219例, 其中 < 18岁患者106例, 明确拒绝或未接受中西医结合诊疗者2例, 不能准确描述发病症状者2例, 首次中医会诊四诊信息或中药处方记录不完整者109例, 最终纳入研究179例。核酸转阴时间平均为(12.32±3.14) d, 并以此分组为早转组(≤ 12 d)108例, 晚转组(>12 d)71例。
2.2 临床特征及分组比较两组间在性别、年龄、疫苗接种情况、临床分型、各单项前期症状上, 差异无统计学意义(P>0.05);两组间在是否合并慢性疾病、是否有合并前期症状、入院时间差、中西医结合干预时间、中医证型分类等指标比较上, 差异具有统计学意义(P < 0.05)。结果见表 1。
|
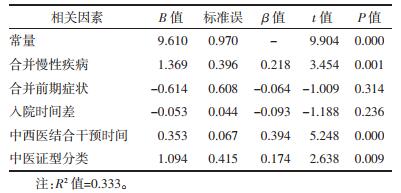
以组间比较具有统计学意义影响因素作为自变量, 分别为合并慢性疾病、合并前期症状、入院时间差、中西医结合干预时间、中医证型分类等5个指标因素, 以核酸转阴时间作为因变量, 进行多元线性回归分析, 结果显示, 核酸转阴时间与是否合并慢性疾病(β=0.218, P=0.001)、中西医结合干预时间(β=0.394, P=0.000)、是否为兼杂证(β=0.174, P=0.009)等3项指标呈正相关。自变量赋值情况见表 2, 结果见表 3。
|
新型冠状病毒奥密克戎变种病毒株最初于2021年11月24日向世界卫生组织(WHO)报告, 并于11月26日被标注为第5种"密切关注变种", 同时将其命名为奥密克戎[4]。根据全球不断增长的病例数和基因测序数据报道, 初步推算奥密克戎单位时间内传染力是德尔塔变种的3~6倍[5], 目前已成为世界范围内的主要传播变种, 大多数国家均已有社区内感染病例报告, 中国在香港地区也有社区感染报道[6], 具有高传播性、潜伏期短、轻症状、疫苗预防功能下降的临床特征[7], 这应与其基因高变异度相关。基础研究[8]表明奥密克戎与其他变种不同, 其诱导合胞体形成的能力减弱, 且能够通过其他非经典途径进入细胞, 提示这可使其在上呼吸道直接感染上皮细胞而进行复制, 从而在较低病毒复制量下具有传染性, 可初步解释其高传播性、轻病症、潜伏期短的流行病特征。1项来自荷兰的临床研究[9]证明其平均潜伏期约为3.2 d, 显著低于其他世界范围内主要流行的新型冠状病毒病种。此外, 奥密克戎是WHO列举的5种"密切关注变种"中变异度最高的病毒株, 它在全基因组内有50个突变, 其中在刺突蛋白上有26~32个突变, 分子生物学研究[10]显示其部分刺突蛋白(如K417N、N440K、G446S、S4777N、T478K和N501Y)的变异可导致单克隆抗体、恢复期血浆及血清中的抗体功能失效, 同时导致疫苗预防功能下降, 重复感染率上升。
体外实验[11]表明辉瑞或阿斯利康疫苗接种者在完成疫苗接种5个月后的血清抗体几乎不能抑制奥密克戎活性, 而来自原始株感染痊愈后6~12个月患者的血清抗体对奥密克戎也仅有极低的抑制性。同时, 有报道[12]称奥密克戎将多种新型冠状病毒肺炎疫苗平均预防有效性从80%降低到33%, 其中辉瑞疫苗对预防不良结局和降低住院治疗率的有效性从93%降低到70%, 而感染过德尔塔变种的人群再次感染奥密克戎变种的相对风险仍达到40%, 在2020年初感染过贝塔变种的人群可有60%的再次感染相对风险。尽管如此, Robinson等[13]对3 365例未接种疫苗的患者和808例有疫苗接种史或既往曾感染的患者感染奥密克戎后不良结局风险开展临床观察研究, 结果显示疫苗接种或既往曾感染的患者不良结局风险是未接种患者的46%, 提示疫苗接种对奥密克戎的防治仍是重要的防疫策略。此外, 已有临床研究[14]表明尽管奥密克戎较德尔塔的感染患者轻微症状率更高(63.2%和60.7%~79.8%), 但其可能导致更多的临床症状, 且更容易感染年轻人, 尤其针对未接种疫苗群体。1项来自美国的前瞻性病例对照研究[15]表明在未接种疫苗的住院成年患者群体中, 奥密克戎症状虽不如德尔塔严重, 但仍导致较高的不良结局率, 与初始病毒感染后的不良结局率相当。
本研究在结局指标方面未选用不良结局率或住院时间, 是因在观察中发现患病群体的不良结局率极低, 同时存在家庭统一出入院的情况, 对统计患者住院时间造成影响。在参考相关指南[3]基础上, 选取核酸转阴时间作为主要结局指标, 该指标提示呼吸道病毒显著复制结束, 同时疾病传染性明显降低, 因而具有较强的社会经济价值。同时, 既往研究[16]表明鼻咽拭子在所有样本检测中最为可靠, 与唾液(85%)、鼻拭子(86%)和咽拭子(68%)等其他来源的样本相比, 其具有高达97%的灵敏度, 故在结局指标中要求末次核酸检测应为鼻咽拭子样本。在影响因素方面, 主要选择年龄、性别、疫苗注射情况、慢性疾病、临床分型及症状等常用指标, 并在此基础上增加入院时间差这一流行病学指标。因本次天津抗疫过程中防疫管控及时有效, 基本未造成社区交叉反复传播, 故可将病毒传播视简单链条传播, 因而时间差可能反映病毒传代情况对疾病预后的影响。研究结果显示, 存在慢性疾病会延长患者核酸转阴时间, 提示罹患慢性疾病患者体内病毒复制时间延长, 产生有效抗体时间较晚, 因而罹患慢性病患者的临床治疗情况值得重点关注。
中西医结合治疗方面, 在回顾性观察中发现所有患者基本均接受过中医药诊治, 故未将中西医结合治疗率作为影响因素。但发现不同患者的中医治疗起始时间存在差异, 故将中西医结合诊疗介入时间纳为影响因素, 其主要反映在西医治疗基础上中医介入时间早晚对结局指标的影响。同时, 为初步观察中医辨证的有效性和特殊性, 故将中医证型进行简单分类, 初步分为仅存在单一证候的单一证和存在多个证候的兼杂证。研究结果显示, 中医介入时间晚及中医辨证为兼杂证均会延长患者核酸转阴时间, 提示更早的中医介入可能缩短气道病毒复制时间, 同时中医辨证可对疾病预后做出较为有效判断。
本研究尚有很多不足之处, 首先是初期病例未能完整对中医诊疗信息进行收集, 故本研究未能纳入所有经治患者。其次是本次疫情病例疫苗接种率较高, 同时临床分型主要为轻症及普通症, 可能会导致数据偏倚, 因而出现疫苗注射情况、临床分型及症状等多因素均不具备显著影响的情况。另外, 研究结果显示回归分析中所选取影响因素组合与结局指标可初步达到轻度(33.3%)相关, 提示数据信息有进一步挖掘的空间。最后, 本研究对中医具体证型及中西医结合治疗方案对临床结局的影响研究不足, 对今后制定奥密克戎中西医结合治疗方案的作用较为局限, 有待于扩大样本量及对病历信息的更多数据挖掘。
| [1] |
天津市卫生健康委员会. 津南区两名人员新冠病毒核酸结果呈阳性[EB/OL]. (2022-1-8)[2022-02-16]. http://wsjk.tj.gov.cn/ZTZL1/ZTZL750/YQFKZL9424/FKDT1207/202201/t20220108_5774620.html. Tianjin Municipal Health Commission. Novel coronavirus nucleic acid results of two persons in Jinnan District were positive[EB/OL]. (2022-01-08)[2022-02-16]. http://wsjk.tj.gov.cn/ZTZL1/ZTZL750/YQFKZL9424/FKDT1207/202201/t20220108_5774620.html. |
| [2] |
天津市卫生健康委员会. 截至2月13日24时天津市新型冠状病毒肺炎疫情最新情况[EB/OL]. (2022-2-14)[2022-02-16]. http://wsjk.tj.gov.cn/ZTZL1/ZTZL750/YQFKZL9424/YQTB7440/202202/t20220214_5803065.html. Tianjin Municipal Health Commission. The latest COVID-19 situation in Tianjin as of 24: 00 on February 13[EB/OL]. (2022-02-14)[2022-02-16]. http://wsjk.tj.gov.cn/ZTZL1/ZTZL750/YQFKZL9424/YQTB7440/202202/t20220214_5803065.html. |
| [3] |
中华人民共和国国家卫生健康委员会办公厅, 国家中医药管理局办公室. 新型冠状病毒肺炎诊疗方案(试行第八版)[J]. 中国医药, 2020, 15(10): 1494-1499. General Office of National Health Commission of the People's Republic of China, Office of National Administration of Traditional Chinese Medicine. Diagnosis and treatment of corona virus disease-19 (8th trial edition)[J]. China Medicine, 2020, 15(10): 1494. |
| [4] |
World Health Organization. Update on Omicron. November, 28, 2021[EB/OL]. (2021-11-28)[2022-02-16]. https://www.who.int/news/item/28-11-2021-update-on-omicron.
|
| [5] |
CALLAWAY E, LEDFORD H. How bad is Omicron? What scientists know so far[J]. Nature, 2021, 600(7888): 197-199. DOI:10.1038/d41586-021-03614-z |
| [6] |
GU H G, KRISHNAN P, NG D Y M, et al. Probable transmission of SARS-CoV-2 Omicron variant in quarantine hotel, Hong Kong, China, November 2021[J]. Emerging Infectious Diseases, 2022, 28(2): 460-462. DOI:10.3201/eid2802.212422 |
| [7] |
REN S Y, WANG W B, GAO R D, et al. Omicron variant (B.1.1.529) of SARS-CoV-2:Mutation, infectivity, transmission, and vaccine resistance[J]. World Journal of Clinical Cases, 2022, 10(1): 1-11. DOI:10.12998/wjcc.v10.i1.1 |
| [8] |
BURKI T K. Omicron variant and booster COVID-19 vaccines[J]. The Lancet Respiratory Medicine, 2022, 10(2): e17. DOI:10.1016/S2213-2600(21)00559-2 |
| [9] |
BACKER J A, EGGINK D, ANDEWEG S P, et al. Shorter serial intervals in SARS-CoV-2 cases with Omicron BA.1 variant compared with Delta variant, the Netherlands, 13 to 26 December 2021[J]. European Communicable Disease Bulletin, 2022, 27(6): 2200042. |
| [10] |
WANG R K, ZHANG Q, GE J W, et al. Analysis of SARS-CoV-2 variant mutations reveals neutralization escape mechanisms and the ability to use ACE2 receptors from additional species[J]. Immunity, 2021, 54(7): 1611-1621. DOI:10.1016/j.immuni.2021.06.003 |
| [11] |
PLANAS D, SAUNDERS N, MAES P, et al. Considerable escape of SARS-CoV-2 Omicron to antibody neutralization[J]. Nature, 2022, 602(7898): 671-675. DOI:10.1038/s41586-021-04389-z |
| [12] |
ZHANG M. Omicron now accounts for 3% of US coronavirus cases. China Daily Global[EB/OL]. (2021-12-15)[2022-02-16]. https://global.chinadaily.com.cn/a/202112/15/WS61b95f63a310cdd39bc7b7f8.html.
|
| [13] |
ROBINSON M L, MORRIS C P, BETZ J, et al. Impact of SARS-CoV-2 variants on inpatient clinical outcome[J]. The Preprint Server for Health Sciences, 2022, 22270337. |
| [14] |
MIGUERES M, DIMEGLIO C, TRÉMEAUX P, et al. Influence of immune escape and nasopharyngeal virus load on the spread of SARS-CoV-2 Omicron variant[J]. The Journal of Infection, 2022(22): 54-58. |
| [15] |
LAURING A S, TENFORDE M W, CHAPPELL J D, et al. Clinical severity and mRNA vaccine effectiveness for Omicron, delta, and alpha SARS-CoV-2 variants in the United States: A prospective observational study[J]. the Preprint Server for Health Sciences, 2022(2022): 558. |
| [16] |
TSANG N N Y, SO H C, NG K Y, et al. Diagnostic performance of different sampling approaches for SARS-CoV-2 RT-PCR testing: A systematic review and Meta-analysis[J]. The Lancet Infectious Diseases, 2021, 21(9): 1233-1245. DOI:10.1016/S1473-3099(21)00146-8 |
2. Tianjin Hospital of ITCWM Nankai Hospital, Tianjin 300100, China;
3. Second Teaching Hospital of Tianjin University of Traditional Chinese Medicine, Tianjin 300250, China;
4. Tianjin Hospital, Tianjin 300211, China
 2022, Vol. 39
2022, Vol. 39