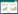文章信息
- 侯丽, 韩伟
- HOU Li, HAN Wei
- 慢肝养阴胶囊对酒精性肝炎大鼠肝组织Caspase-3及PTP1B表达的影响及相关性研究
- Effects of Mangan Yangyin Capsule on the expression of Caspase-3 and PTP1B in liver tissues of alcoholic hepatitis rats and correlation study
- 天津中医药, 2022, 39(5): 643-648
- Tianjin Journal of Traditional Chinese Medicine, 2022, 39(5): 643-648
- http://dx.doi.org/10.11656/j.issn.1672-1519.2022.05.21
-
文章历史
- 收稿日期: 2022-01-10
2. 内蒙古医科大学附属医院中医科,呼和浩特 014030
酒精性肝病(ALD)是因长期大量饮酒所引起的肝脏疾病[1]。初期表现为脂肪肝,进而可发展成为酒精性肝炎和酒精性肝硬化,严重酗酒可诱发广泛的肝组织细胞坏死甚至引起肝功能衰竭[2]。慢肝养阴胶囊的处方由北沙参、麦冬、地黄、枸杞子、川楝子、当归、五味子、党参、桂枝、人参组成,内容物为棕色粉末,味微苦。功能主治为养阴清热,滋补肝肾,用于迁延性肝炎、慢性肝炎、肝炎后综合症。研究表明慢肝养阴胶囊对大鼠四氯化碳肝损害具有保护作用[3],对于抗结核药物所致肝损害具有良好的预防作用[4]。本研究通过实验观察慢肝养阴胶囊对酒精性肝炎大鼠模型的影响,为慢肝养阴胶囊在临床上用于治疗酒精性肝炎提供实验研究基础。
1 材料和方法 1.1 实验动物Wistar大鼠50只,SPF级,雄性,体质量180~220 g,许可证号:SCXK(蒙)2020-0001,购于内蒙古医科大学实验动物中心。实验大鼠于内蒙古医科大学实验动物中心饲养,实验动物使用许可证号:SYXK(蒙)2020-0003。饲养条件:温度20~25 ℃,湿度40%~50%,自由饮食饮水。饲料经辐照消毒处理。
1.2 药品和试剂慢肝养阴胶囊,规格:0.25 g/粒,60粒/盒。用法用量:口服,每次4粒,每日3次。国药准字Z52020175,贵州威门药业股份有限公司。多烯磷脂酰胆碱胶囊,规格:228 mg×36粒,每日3次,每次1粒,国药准字H20059010,赛诺菲(北京)制药有限公司。天冬氨酸氨基转移酶(AST)试剂盒,批号:20191219;γ-谷氨酰基转肽酶(γ-GT)试剂盒,批号:20200127;超氧化物歧化酶(SOD)批号:20200312;丙二醛(MDA)酶联免疫试剂盒,试剂批号:20200119,以上酶联免疫试剂盒购于南京建成生物工程研究所。活化半胱胺酸蛋白酶蛋白-3抗体(Caspase-3)批号:AE031025;蛋白酪氨酸磷酸酶1B抗体(PTP1B)批号:03293306以上抗体均购于北京博奥森生物技术有限公司。TMS-P超敏试剂盒,福建迈新生物技术开发有限公司,2002215476b。DAB显色剂,福建迈新生物技术开发有限公司,批号:2003210031B。磷酸缓冲盐溶液(PBS),北京索莱宝科技有限公司,批号:20200210。
1.3 实验仪器贝克曼库尔特AU5800全自动生化分析仪。日本岛津UV-2700紫外可见分光光度计。MY2300全自动免疫组化染色机。BX43型显微镜,奥林巴斯中国有限公司。
1.4 方法 1.4.1 动物模型的建立及分组给药大鼠适应饲养1周,按体质量随机分为空白对照组、模型对照组、慢肝养阴胶囊低剂量组(0.27 g/kg)、慢肝养阴胶囊高剂量组(0.54 g/kg)、多烯磷脂酰胆碱胶囊(西药阳性药对照)组(0.15 g/kg),每组10只。除了空白对照组外,其他各组均用50%乙醇造模,灌胃体积为12 mL/kg[5-6]。各给药组灌胃相应药物,每日1次,10 mL/kg,空白对照组、模型对照组灌胃等体积的蒸馏水。造模同时给药16周。隔夜禁食,次日腹腔内注射0.3%戊巴比妥钠溶液按10 mL/kg麻醉,取静脉血,分离血清,按试剂盒说明操作检测血清AST、γ-GT。取肝组织1 g匀浆后提取上清液,按试剂盒说明操作检测肝组织中SOD、MDA的活性。取肝左叶用福尔马林固定,用于苏木精-伊红(HE)染色,采用免疫组织化学技术检测肝组织细胞中Caspase-3和PTP1B的表达。
1.4.2 肝脏组织HE染色肝脏组织病理切片脱蜡至水,首先采用苏木精染色,再用1%的盐酸乙醇进行分化,用0.5%的伊红液复染,梯度乙醇脱水,二甲苯透明液透明处理两次,最后采用中性树胶封片,观察肝脏组织细胞脂肪变性及炎症损伤程度。
1.4.3 免疫组化法检测肝脏组织中Caspase-3和PTP1B的表达切片脱蜡至水,放入已沸腾的柠檬酸盐缓冲液(pH=6.0)中,中档微波处理10 min,3%H2O2室温孵育,PBS冲洗3次。10%的山羊血清孵育10 min。然后滴加一抗(Caspase-3抗体稀释比例为1∶200;PTP1B抗体稀释比例为1∶150),室温孵育2 h。PBS缓冲液冲洗。滴加二抗,室温孵育30 min。磷酸缓冲盐溶液冲洗。滴加100 μL辣根酶标记的链霉素工作液,室温下孵育30 min。磷酸缓冲盐溶液冲洗。滴加50 μL新鲜配制的DAB显色剂,4 min后自来水冲洗,苏木精复染,梯度脱水,二甲苯透明,中性树胶封片[7-8]。使用Image J软件检测图片光密度值(OD)。
1.5 统计学方法采用SPSS22.0统计软件对实验数据进行分析,计量数据采用均值±标准差(x±s)表示,多组间比较采用单因素方差分析,组间两两比较采用LSD检验,相关性分析采用Pearson相关。P < 0.05为差异具有统计学意义。
2 结果 2.1 慢肝养阴胶囊对血液生化指标影响造模同时给药16周后,模型对照组大鼠的血清AST和γ-GT比空白对照组的血清AST和γ-GT显著增加(P<0.01),与模型对照组相比各给药干预组血清中的AST和γ-GT比模型对照组显著减少(P<0.05或P<0.01),慢肝养阴胶囊低剂量组与慢肝养阴胶囊高剂量组的作用呈剂量依赖性,多烯磷脂酰胆碱胶囊组与慢肝养阴胶囊高剂量组作用结果未见显著性差异,见表 1。
|
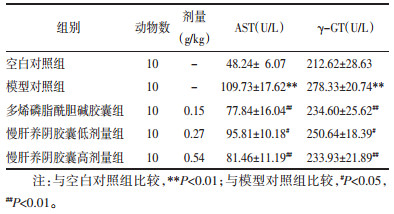
边造模边给药16周后,模型对照组肝脏中SOD显著降低(P<0.01),与模型对照组相比各给药组肝组织中SOD活性显著增加(P<0.05或P<0.01)。边造模边给药16周后,模型对照组肝脏中MDA显著增多(P<0.01),与模型对照组相比各给药组肝组织中MDA含量显著降低(P<0.05或P<0.01),慢肝养阴胶囊低剂量组与慢肝养阴胶囊高剂量组的作用呈剂量依赖性,多烯磷脂酰胆碱胶囊组与慢肝养阴胶囊高剂量组作用结果差异无统计学意义(P > 0.05),见表 2。
|
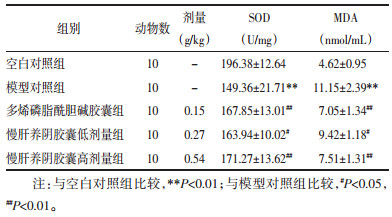
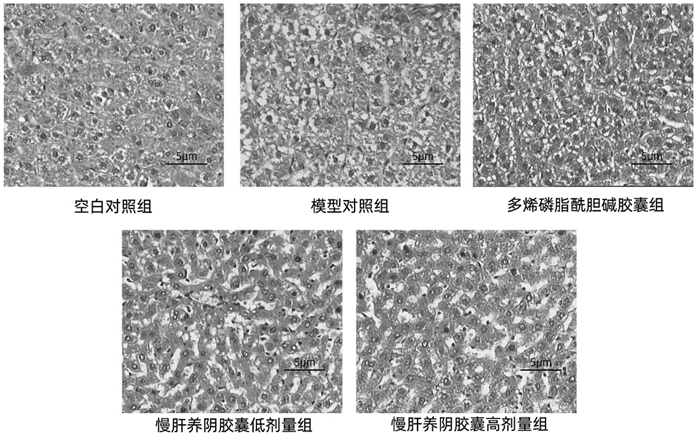
空白对照组肝细胞排列整齐,结构完整,胞浆染色均匀,无脂肪变性,未见炎性细胞浸润和细胞坏死特征,与空白对照组对比模型对照组大鼠肝索排列紊乱,肝细胞生肿大,可见有明显的脂肪空泡和炎细胞浸润;经16周防治后可见各给药组存在一定数量的脂肪空泡,但脂肪空泡和炎细胞浸润较模型对照组有一定的减轻,见图 1。
|
| 图 1 大鼠肝脏组织HE结果(×200) Fig. 1 HE results of rat liver tissue (×200) |
造模同时给药16周后,与空白对照组相比模型对照组肝脏组织中Caspase-3和PTP1B表达显著增加(P < 0.01),与模型对照组相比各给药组肝组织中Caspase-3和PTP1B表达显著降低(P<0.05或P<0.01),慢肝养阴胶囊低剂量组与慢肝养阴胶囊高剂量组的作用呈剂量依赖性,慢肝养阴胶囊高剂量组作用优于多烯磷脂酰胆碱胶囊组,但结果见显著性差异,结果见表 3、图 2和3。
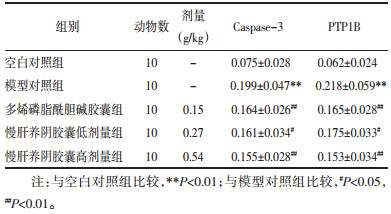
|

|
| 图 2 大鼠肝组织Caspase-3表达的结果(×200) Fig. 2 Results of Caspase-3 expression in rat liver tissue (×200) |

|
| 图 3 大鼠肝组织PTP1B的结果(×200) Fig. 3 Results of PTP1B expression in rat liver tissue (×200) |
Pearson相关分析显示大鼠血清中AST的活性与肝脏组织中Caspase-3及PTP1B表达之间具有相关性(r=0.755,r=0.826,P<0.01),见表 4。
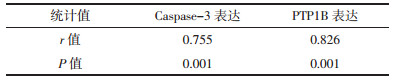
|
Pearson相关分析显示大鼠肝脏组织中Caspase-3与PTP1B表达之间具有相关性(r=0.696,P<0.01)。
3 讨论酒精性肝病临床分为脂肪肝、肝炎、肝硬化,常混合存在[9]。酒精主要在肝脏组织中代谢,经过肝脏组织细胞中的乙醇脱氢酶的催化氧化为乙醛,再经过乙醛脱氢酶催化转成乙酸,最终形成二氧化碳[10]。在酒精的氧化过程中分解出大量的氢离子和辅酶结合,引起依赖还原型辅酶的物质代谢发生了改变,最终成为物质代谢紊乱和诱发疾病的基础[11]。乙醛还对肝脏组织细胞具有直接毒性作用,如影响线粒体产生腺嘌呤核苷三磷酸(ATP)、抑制生物合成蛋白质和排泌以及引起脂肪在肝细胞内蓄积[12]。一次酗醉几小时后即可发生肝脂肪变。酒精性肝炎主要表现为血清AST升高,谷氨酸氨基转移酶(ALT)水平升高不灵敏是因为乙醛使酶的活性辅因子B6下降所引起的[13]。γ-谷氨酰转肽酶广泛地分布在人体组织中,肾脏组织中最多,其次是胰腺和肝脏[14]。在肝脏组织中主要分布于胞浆和肝内胆管上皮组织中,血液中γ-GT主要来自肝脏组织[15]。嗜酒会引起肝脏损伤致使血清γ-GT活性升高,酒精损伤肝细胞微粒体时γ-谷氨酰转肽酶升高较灵敏[16]。本研究结果表明慢肝养阴胶囊可降低酒精性肝炎大鼠模型血清中AST和γ-GT的活力。
SOD,又称为肝蛋白,可以消除组织在新陈代谢过程中产生的有害物质,还能够对抗和阻断氧自由基对细胞造成的损害,并能够及时修复受损的细胞,抵抗因为自由基造成的细胞伤害[17]。MDA是脂质氧化代谢的终产物,可以影响线粒体关键酶的活性。氧化应激性肝损害在酒精性肝病占有至关重要的地位,氧化应激(OS)是体内抗氧化作用与氧化反应的失衡状态,倾向于氧化反应,氧化应激能够引起中性粒细胞的炎性浸润和白酶分泌增加,从而产生大量的氧化中间产物[18]。本研究结果表明慢肝养阴胶囊可升高酒精性肝炎大鼠模型肝组织中SOD的活性,降低酒精性肝炎大鼠模型肝组织中MDA的含量。
酒精性肝病中由于线粒体功能失调可导致肝细胞的凋亡,Caspase-3活性增加。Caspase-3在细胞凋亡中具有重要的作用,Caspase-3主要的底物是腺嘌呤核苷二磷酸(ADP)-核糖聚合酶,在细胞启动凋亡时,ADP-核糖聚合酶能够被Caspase-3剪切成85kD和31kD两个片段,使ADP-核糖聚合酶中与DNA结合的两个催化区域分离,最终使受ADP-核糖聚合酶负调控影响的Ca2+/Mg2+依赖性核酸内切酶的活性增高,裂解了核小体间的DNA,诱导细胞凋亡[19-21]。本研究结果表明慢肝养阴胶囊可降低Caspase-3在酒精性肝炎大鼠模型肝组织中的表达。
PTP1B广泛存在于肝组织细胞、脂肪细胞、肌组织细胞和上皮细胞多个组织中,PTP1B主要位于胞浆内质网组织中,参与细胞内的信号转导,调节细胞的分化、生长、代谢和基因转录等[22]。机体PTP1B活性的升高与胰岛素抵抗和非酒精性脂肪性肝病(NAFLD)均密切相关,通过调控靶点PTP1B可降低肝脏脂质合成、减少三酰甘油在肝细胞中的堆积,也有研究表明长期大量饮酒可增加胰岛素抵抗[23-25]。本研究结果表明慢肝养阴胶囊可降低PTP1B在酒精性肝炎大鼠模型肝组织中的表达。
本研究结果表明肝脏组织中Caspase-3与PTP1B表达之间具有相关性,呈正相关,说明酒精性肝炎时线粒体调控能量代谢、细胞凋亡、氧化应激损害等功能的异常和胰岛素抵抗共同参与了肝细胞损伤的病理过程。慢肝养阴胶囊可能通过提高机体的抗氧化能力、减轻胰岛素抵抗、抗凋亡等途径对大量饮酒产生的肝损伤起到保护作用。
| [1] |
张志雄, 刘春芳, 孔庆辉. 酒精性肝病的中西医治疗进展[J]. 光明中医, 2020, 35(19): 3137-3140. ZHANG Z X, LIU C F, KONG Q H. Progress in treatment of alcoholic liver disease with traditional Chinese and Western medicine[J]. Guangming Journal of Chinese Medicine, 2020, 35(19): 3137-3140. DOI:10.3969/j.issn.1003-8914.2020.19.064 |
| [2] |
申绪芹, 李亚萍, 殷晓轩. 酒精性肝病诊疗的新进展[J]. 中西医结合肝病杂志, 2020, 30(3): 278-282. SHEN X Q, LI Y P, YIN X X. New progress in diagnosis and treatment of alcoholic liver disease[J]. Chinese Journal of Integrated Traditional and Western Medicine on Liver Diseases, 2020, 30(3): 278-282. |
| [3] |
LIANG Z J, CHEN X W, SHI J N, et al. Efficacy and safety of traditional Chinese medicines for non-alcoholic fatty liver disease: a systematic literature review of randomized controlled trials[J]. Chinese Medicine, 2021, 16(1): 9. DOI:10.1186/s13020-020-00422-x |
| [4] |
刘琰. 慢肝养阴胶囊预防抗结核药物肝损害疗效观察[J]. 吉林医学, 2010, 31(28): 4941-4942. LIU Y. Effect of Mangan Yangyin Capsule on prevention of liver damage caused by antituberculosis drugs[J]. Jilin Medical Journal, 2010, 31(28): 4941-4942. DOI:10.3969/j.issn.1004-0412.2010.28.063 |
| [5] |
王书庆, 刘烨, 徐思, 等. 葛根素联合美他多辛对急性酒精性肝损伤的保护作用研究[J]. 现代医院, 2020, 20(12): 1838-1840, 1844. WANG S Q, LIU Y, XU S, et al. Study on the protective effect of puerarin combined with metadoxin on acute alcoholic liver injury[J]. Modern Hospitals, 2020, 20(12): 1838-1840, 1844. |
| [6] |
SAYAN M, KARABULUT D, ZDAMAR S. Assessment of the protective and therapeutic effect of melatonin against thioacetamide-induced acute liver damage[J]. Journal of Biochemical and Molecular Toxicology, 2020, 34(4): e22450. |
| [7] |
徐芳, 施海东, 马建民, 等. 藏红花改善酒精性肝病患者的氧化应激作用及对Caspase-3、Bcl-2水平的影响[J]. 中西医结合肝病杂志, 2020, 30(1): 39-41, 44. XU F, SHI H D, MA J M, et al. Saffron adjuvant therapy improved oxidative stress in alcoholic liver disease patients and its effect on Caspase-3 and Bcl-2 levels[J]. Chinese Journal of Integrated Traditional and Western Medicine on Liver Diseases, 2020, 30(1): 39-41, 44. |
| [8] |
陈国超, 李小莉, 陈广. 黄连中木脂素类化合物的分离鉴定及其对蛋白酪氨酸磷酸酶1B的抑制活性[J]. 中国药房, 2016, 27(16): 2197-2200. CHEN G C, LI X L, CHEN G. Isolation and identification of lignans chemical constituents from coptis chinensis and their inhibitory activity to protein tyrosine phosphatase-1B[J]. China Pharmacy, 2016, 27(16): 2197-2200. DOI:10.6039/j.issn.1001-0408.2016.16.11 |
| [9] |
谢佛添, 王冬梅, 吕翼. 自噬在酒精性肝病中的作用[J]. 中国生物化学与分子生物学报, 2020, 36(10): 1151-1158. XIE F T, WANG D M, LYU Y. Role of autophagy in alcoholic liver disease[J]. Chinese Journal of Biochemistry and Molecular Biology, 2020, 36(10): 1151-1158. |
| [10] |
邱礼佳, 林贞葵, 陈慧怡, 等. 乙醛脱氢酶2(ALDH2)基因多态性与酒精相关疾病的研究进展[J]. 实验与检验医学, 2020, 38(4): 611-617. QIU L J, LIN Z K, CHEN H Y, et al. Research progress of acetaldehyde dehydrogenase 2 (ALDH2) gene polymorphism and alcohol-related diseases[J]. Experimental and Laboratory Medicine, 2020, 38(4): 611-617. DOI:10.3969/j.issn.1674-1129.2020.04.002 |
| [11] |
苏金玲, 郭茂娟, 姜希娟. 五田保肝液对酒精性肝病大鼠肝组织Fas、Fasl、Caspase-8蛋白表达的影响[J]. 天津中医药, 2017, 34(9): 626-628. SU J L, GUO M J, JIANG X J. Effects on protein expression of Fas, Fasl and Caspase-8 in alcohol liver disease of rats intervented by Wutian Baogan Ye[J]. Tianjin Journal of Traditional Chinese Medicine, 2017, 34(9): 626-628. |
| [12] |
DROZDZIK M, SZELAG-PIENIEK S, POST M, et al. Protein abundance of hepatic drug transporters in patients with different forms of liver damage[J]. Clinical Pharmacology and Therapeutics, 2020, 107(5): 1138-1148. DOI:10.1002/cpt.1717 |
| [13] |
梁希晨, 刘雪枫, 景明. 湿生扁蕾乙酸乙酯提取物对乙醇诱导LO2细胞氧化损伤的保护作用研究[J]. 中兽医医药杂志, 2020, 39(5): 52-55. LIANG X C, LIU X F, JING M. Study on the protective effect of ethyl acetate extract of gentianopsis paludosa on the oxidative damage of LO2 cell induced by ethanol[J]. Journal of Traditional Chinese Veterinary Medicine, 2020, 39(5): 52-55. |
| [14] |
位松华. ALT、AST、ALP、γ-GT组合实验室检验结果分析在各类肝胆疾病诊断中的临床价值[J]. 检验医学与临床, 2016, 13(6): 848-849. WEI S H. Clinical value of ALT, AST, ALP, γ-GT combined laboratory test results in the diagnosis of various hepatobiliary diseases[J]. Laboratory Medicine and Clinic, 2016, 13(6): 848-849. DOI:10.3969/j.issn.1672-9455.2016.06.053 |
| [15] |
CHEN Z J, WU A C, JIN H M, et al. Β-Sitosterol attenuates liver injury in a rat model of chronic alcohol intake[J]. Archives of Pharmacal Research, 2020, 43(11): 1197-1206. DOI:10.1007/s12272-020-01271-w |
| [16] |
尹玉香, 张云, 董秋霞. 螺旋CT多期扫描与血清CXCL13、NGAL联合检测在肝癌疾病中的诊断意义[J]. 肝脏, 2019, 24(6): 702-704. YIN Y X, ZHANG Y, DONG Q X. Diagnostic significance of multi-phase spiral CT scanning combined with serum CXCL13 and NGAL in liver cancer[J]. Chinese Hepatology, 2019, 24(6): 702-704. DOI:10.3969/j.issn.1008-1704.2019.06.040 |
| [17] |
MENG X, TANG G Y, ZHAO C N, et al. Hepatoprotective effects of hovenia dulcis seeds against alcoholic liver injury and related mechanisms investigated via network pharmacology[J]. World Journal of Gastroenterology, 2020, 26(24): 3432-3446. DOI:10.3748/wjg.v26.i24.3432 |
| [18] |
梁婕, 凌敏, 张薇, 等. 葛根提取物对小鼠酒精性肝损伤的辅助保护效果[J]. 江苏预防医学, 2020, 31(3): 280-282. LIANG J, LING M, ZHANG W, et al. Protective effect of pueraria extract on alcoholic liver injury[J]. Jiangsu Journal of Preventive Medicine, 2020, 31(3): 280-282. |
| [19] |
刘霞, 廖梅香, 范小娜. 广枣提取物对内质网应激参与的大鼠酒精性肝损伤的保护作用[J]. 中国当代医药, 2019, 26(21): 8-11. LIU X, LIAO M X, FAN X N. Protective effect of choerospondias axillaries extracts on endoplasmic reticulum stress-participated in rats with alcoholic liver injury[J]. China Modern Medicine, 2019, 26(21): 8-11. DOI:10.3969/j.issn.1674-4721.2019.21.004 |
| [20] |
李贵宾. 丹参多酚酸盐通过抑制内质网应激减轻小肠缺血再灌注损伤的研究[J]. 天津中医药, 2021, 38(9): 1195-1200. LI G B. Salvia polyphenolate reduces the intestinal ischemia-reperfusion injury by inhibiting endoplasmic reticulum stress[J]. Tianjin Journal of Traditional Chinese Medicine, 2021, 38(9): 1195-1200. |
| [21] |
胡亚丽, 杨杰, 庞茜茜. 葛根素诱导人肝癌HepG2细胞凋亡与自噬及其分子机制研究[J]. 天津中医药, 2021, 38(11): 1472-1477. HU Y L, YANG J, PANG Q Q. Study of puerarin induce apoptosis and autophagy in human liver cancer HepG2 cells and its molecular mechanism[J]. Tianjin Journal of Traditional Chinese Medicine, 2021, 38(11): 1472-1477. DOI:10.11656/j.issn.1672-1519.2021.11.22 |
| [22] |
陈茂林, 王晓栋, 李波, 等. 枳葛口服液基于AMPK/SREBP-1/Lipin-1通路调控酒精性肝病大鼠糖脂代谢[J]. 时珍国医国药, 2020, 31(5): 1080-1084. CHEN M L, WANG X D, LI B, et al. Zhige oral liquid regulates glucose and lipid metabolism in rats with alcoholic liver disease based on AMPK/SREBP-1/lipin-1 pathway[J]. Lishizhen Medicine and Materia Medica Research, 2020, 31(5): 1080-1084. DOI:10.3969/j.issn.1008-0805.2020.05.015 |
| [23] |
CETIN E G, DEMIR N, SEN I. The relationship between insulin resistance and liver damage in non-alcoholic fatty liver patients[J]. Sisli Etfal Hastanesi Tip Bulteni, 2020, 54(4): 411-415. |
| [24] |
贾丽燕, 朱燕波, 徐佳, 等. 中医血瘀体质危险因素的logistic回归分析[J]. 天津中医药, 2019, 36(8): 753-757. JIA L Y, ZHU Y B, XU J, et al. Logistic regression analysis in risk factors of traditional Chinese medicine blood stasis constitution[J]. Tianjin Journal of Traditional Chinese Medicine, 2019, 36(8): 753-757. |
| [25] |
郝原青, 郭晓雪, 丁雅珊, 等. 葛根素对大鼠酒精性肝纤维化的干预作用以及对肝星状细胞增殖活化的影响[J]. 天津中医药大学学报, 2016, 35(2): 132-135. HAO Y Q, GUO X X, DING Y S, et al. Effects of puerarin on proliferation activation of hepatic stellate cell in rats with alcoholic liver fibrosis[J]. Journal of Tianjin University of Traditional Chinese Medicine, 2016, 35(2): 132-135. |
2. Department of Traditional Chinese Medicine, The Affiliated Hospital of Inner Mongolia Medical University, Hohhot 014030, China
 2022, Vol. 39
2022, Vol. 39