文章信息
- 陈静洁, 方敬, 赵亚云, 刘海平, 马赟, 陈志强
- CHEN Jingjie, FANG Jing, ZHAO Yayun, LIU Haiping, MA Yun, CHEN Zhiqiang
- 三焦祛湿方对膜性肾病小鼠肾组织ZO-1和synaptopodin蛋白表达的影响
- Effects of Sanjiao Qushi Formula on ZO-1 and synaptopodin protein expression in mice with membranous nephropathy
- 天津中医药, 2022, 39(5): 649-655
- Tianjin Journal of Traditional Chinese Medicine, 2022, 39(5): 649-655
- http://dx.doi.org/10.11656/j.issn.1672-1519.2022.05.22
-
文章历史
- 收稿日期: 2022-01-08
2. 河北中医学院第一附属医院,石家庄 050011
膜性肾病(MN)是一种自身免疫性肾小球疾病,诊断依赖于肾穿刺,病理表现主要是肾小球基底膜弥漫性增厚并伴有免疫复合物的沉积。目前已经证实血清抗磷脂酶A2抗体(PLA2R)滴度水平与疾病的活动性具有相关性[1]。发病年龄以中年男性居多,近年来发病人数在逐步攀升[2]。环境污染与MN发病人数的增加密切相关,研究显示[3],空气中PM2.5浓度的增加与患MN的风险之间呈现一定的相关性。临床上MN患者以大量蛋白尿、水肿为主要表现。大量蛋白尿的产生与足细胞的损伤密不可分,遗传、药物等因素会导致足细胞足突融合、数量减少、结构和功能受损,滤过膜通透性发生改变,蛋白漏出而形成蛋白尿[4-5]。足细胞的正常工作依赖骨架蛋白的维系,骨架蛋白主要由中间丝、微管及肌动蛋白微丝构成,每个部分均分布着与足细胞相关的特殊蛋白,其中紧密连接蛋白ZO-1、骨架蛋白synaptopodin即为足细胞相关蛋白,对维持足细胞的结构和功能具有重要意义[6-7]。因此恢复受损的足细胞,改善滤过膜的完整性和通透性对减少蛋白尿保护肾功能作用重大。
在中医基础理论指导下,辨证运用中医药治疗MN在临床上效果显著。中医古籍认为“蛋白质”属于精微物质,其输布运行与三焦有着密切的关系。《五脏穿凿论》曰“肾与三焦相通,肾与命门相通。”据此后代医家在治疗肾脏疾病时多注重调和三焦,补益肾脏。《难经》云:“三焦,水谷之通道,气之所始终也。”可见三焦是气血津液正常输布的重要通道,是联络各脏腑的通路。MN患者多病程长久,易导致脏腑亏损,加之近年来人们饮食结构的改变、生活压力的增加、饮食劳倦等多种因素导致脾无力运化,则易酿生湿邪。三焦祛湿方(黄芪、淫羊藿、丹参、川芎、红花、水蛭、藿香、陈皮、白豆蔻、积雪草、炒白术、茯苓)具有宣通三焦、活血通络、祛湿化痰的作用,是陈志强教授根据临床经验总结出的治疗MN的有效方剂。课题组前期的临床观察显示[8]:宣通三焦、活血通络法可以显著降低MN患者的尿蛋白,保护肾功能,延缓疾病的进展。本研究拟通过复制MN动物模型,探讨该方可能的肾保护作用机制以及对ZO-1、synaptopodin蛋白表达水平的影响。
1 实验材料 1.1 实验动物雌性Balb/c小鼠60只,体质量16~19 g,6~8周龄,SPF级,购自北京维通利华实验动物技术有限公司,合格证号SCXK(京)2016-0006。本实验方案由河北中医学院动物伦理委员会批准。
1.2 实验试剂C-BSA(美国Chondrex公司,批号9058);弗氏完全佐剂(美国Sigma公司,批号F5881);ALB(血清白蛋白)测定试剂盒(中生北控生物科技股份有限公司,批号200923);Scr(血肌酐)、BUN(尿素氮)、TC(总胆固醇)测定试剂盒(贝克曼库尔特实验系统有限公司,批号分别为AUZ3592,AUZ3625,AUZ3611);ZO-1抗体、synaptopodin抗体(武汉塞维尔生物科技有限公司,批号GB111402、GB111049);辣根过氧化物酶(HRP)标记的山羊抗兔、辣根过氧化物酶(HRP)标记的山羊抗小鼠(武汉塞维尔生物科技有限公司,批号GB23303、GB23301);FITC标记的山羊抗小鼠IgG(美国KPL公司);ACTIN抗体(武汉塞维尔生物科技有限公司,批号GB12001)。
1.3 实验药物盐酸贝那普利片(深圳信立泰药业股份有限公司,批号H20054771);三焦祛湿方颗粒剂型:黄芪、淫羊藿、丹参、川芎、红花、水蛭、藿香、陈皮、白豆蔻、积雪草、炒白术、茯苓(广东一方制药有限公司,批号分别为:012263,010049,101123,101149,101149,012028,004636,012165,009644,011590,011271,012347)。
1.4 实验仪器7170A型全自动生化分析仪(Hitachi公司);BX43型免疫荧光显微镜(日本Olympus公司);BX51型光学显微镜(日本Olympus公司);双垂直电泳仪(北京六一仪器厂);Image Quant LAS4000型化学发光成像分析仪(美国GE Healthcare公司)。
2 实验方法 2.1 造模与分组造模60只小鼠测定24 h尿蛋白定量(24 h-UTP)均小于22 μg。随机分组,给予小鼠尾静脉注射阳离子化牛血清白蛋白(C-BSA)进行建模[9]。预免疫:造模组给予0.2 mg C-BSA与等体积的弗氏完全佐剂充分乳化后多点位皮下注射;对照组用等体积的弗氏完全佐剂多点位皮下注射。2周后,正式免疫:造模组给予小鼠尾静脉注射C-BSA(6.5 mg/kg),隔日1次,持续6周;对照组尾静脉注射生理盐水代替,余操作相同。实验8周后,造模组小鼠共死亡6只,造模组余下的小鼠测24 h-UTP均大于60 μg,提示造模成功[10]。造模组小鼠随机选取4只做肾组织免疫荧光检查,均观察到免疫复合物沿毛细血管壁呈颗粒样沉积,证实MN造模成功。然后将造模组剩余的40只小鼠随机分为4组,模型组(10只)、中药低剂量组(10只)、中药高剂量组(10只)、盐酸贝那普利组(10只)。
2.2 给药方法8周后,空白组和模型组都给予蒸馏水0.2 mL灌胃;中药低剂量组、中药高剂量组分别给予三焦祛湿方3.71 g/kg、7.42 g/kg,灌胃治疗;盐酸贝那普利组将盐酸贝那普利片溶于羧甲基纤维素钠中,按照1.3 mg/kg灌胃给药。共给药4周。于实验第12周末取材。留取尿液,血液,肾标本做进一步分析。
2.3 检测 2.3.1 尿、血标本的检测给药后留取小鼠的24 h尿液,测24 h-UTP。在给药后第4周末,用异氟烷吸入麻醉小鼠,腹主动脉取血,进行TC、Alb、BUN、Scr等指标的检测。
2.3.2 肾脏行病理形态观察肾组织经固定,脱水,包埋,切片后分别行苏木素-伊红(HE)染色、马松(Masson)染色、过碘酸-六胺银(PASM)染色,在光镜下观察肾组织的结构形态。
2.3.3 免疫荧光法检测小鼠肾脏IgG的沉积从4 ℃冰箱取出肾组织,OCT包埋,迅速放入-20 ℃冷冻切片机中切片(4 μm),丙酮固定5 min,再用磷酸盐缓冲溶液(PBS)漂洗3遍,避光封闭免疫球蛋白G(IgG)抗体,室温下孵育1 h,PBS再次浸洗,于荧光显微镜下观察荧光强度并做好记录。
2.3.4 蛋白免疫印迹法(Western blot)检测目的蛋白的表达取出肾组织,剪取100 mg,放入离心管中,加入含有蛋白酶抑制剂的RIPA裂解液,裂解组织,于冰上操作。裂解后,4 ℃,离心10 min(12 000 r/min),离心半径10 cm,BCA法检测组织上清液中蛋白浓度。将蛋白溶液按4∶1的比例加入5×蛋白上样缓冲液,沸水浴5 min使蛋白变性。加样,经凝胶电泳(根据分子量的大小选择合适的分离胶浓度)进行蛋白分离,转膜,5%的脱脂奶粉室温封闭2 h,4 ℃孵育一抗过夜,TBST洗膜3次,滴加二抗,室温摇床孵育1 h,然后进行发光,显影以及蛋白表达量的分析。
2.3.5 统计学方法采用SPSS 26.0软件对数据进行统计分析,计量资料用均数±标准差(x±s)表示,多组间比较采用单因素方差分析,组间两两比较采用LSD法。P < 0.05为差异有统计学意义。
3 实验结果 3.1 给药后小鼠尿液24 h-UTP及血清TC、ALB、Scr、BUN的表达与空白组相比,模型组小鼠尿液UTP增高,血清TC增高,ALB降低,差异有统计学意义(P < 0.05)。各治疗组与模型组比较,尿液UTP降低,血清TC降低,ALB增高,差异有统计学意义(P < 0.05);各治疗组间比较UTP、TC、ALB,差异无统计学意义(P>0.05)。各组小鼠Scr和BUN比较,差异无统计学意义(P>0.05)。见表 1。

|
光镜下观察空白组上皮细胞、基底膜、内皮细胞、系膜细胞及基质、肾小管以及肾间质形态结构均未见明显异常;模型组可见小鼠肾组织肾小球体积增大,MASSON染色可见基底膜增厚,部分可见到嗜复红蛋白沉积,PASM染色可见“钉突”形成;与模型组比较,各治疗组可见肾小球体积有所减小,偶见嗜复红蛋白沉积,基底膜增厚减轻,“钉突”减少。见图 1。

|
| 注:蓝色箭头表示:基底膜增厚;黑色箭头表示:嗜复红蛋白沉积;红色箭头表示:“钉突”。N组.空白组;M组.模型组;L组.中药低剂量组;H组. 中药高剂量组;X组.盐酸贝那普利组。 图 1 三焦祛湿方对MN小鼠肾组织病理形态的影响(光镜,×400) Fig. 1 Effect of Sanjiao Qushi Formula on the pathological morphology of renal tissue in mice with membranous nephropathy (light microscope, ×400) |
空白组几乎未见免疫复合物的沉积;其他各组均有不同程度的IgG沿肾小球毛细血管基底膜的沉积。模型组荧光染色较强,各治疗组与其相比IgG的沉积明显减少,荧光强度明显减弱。中药高剂量组与盐酸贝那普利组的IgG沉积无明显差异,在荧光强度上均弱于中药低剂量组。见图 2。

|
| 注:N组.空白组;M组.模型组;L组.中药低剂量组;H组.中药高剂量组;X组.盐酸贝那普利组。 图 2 三焦祛湿方对膜性肾病小鼠肾组织IgG沉积的影响(荧光显微镜,×400) Fig. 2 Effect of Sanjiao Qushi Formula on IgG deposition in mouse kidney with membranous nephropathy mice (fluorescence microscope, ×400) |
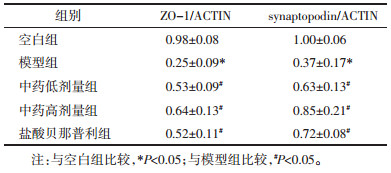
与空白组比较,模型组ZO-1、synaptopodin的表达显著减少(P<0.05);与模型组相比,各治疗组ZO-1、synaptopodin的表达明显增加(P<0.05),各治疗组间比较ZO-1、synaptopodin差异没有统计学意义(P>0.05)。见表 2,图 3。
|

|
| 注:与空白组比较,*P<0.05;与模型组比较,#P<0.05。N组.空白组;M组.模型组;L组.中药低剂量组;H组.中药高剂量组;X组.盐酸贝那辛利组。 图 3 各组小鼠ZO-1、synaptopodin蛋白的表达 Fig. 3 Expression of ZO-1 and synaptopodin protein of mice in each group |
MN是肾脏病中较为常见的疾病类型,由于目前没有特效药物,且容易带来一系列并发症,因此在临床治疗中颇为棘手,蛋白尿的大量丢失是疾病加重的重要原因。而大量漏蛋白主要是肾脏足细胞受损,足突融合消失,滤过膜的完整性被破坏,蛋白漏出形成蛋白尿[11]。其预后与临床表现具有很大差异,关于疾病的进展有着经典的“三分之一理论”[12],虽有一定的自发缓解率,但仍需警惕MN可能带来的血栓栓塞等严重并发症。MN的患者应自确诊之日起接受支持治疗,尽量减少蛋白质的排泄,以改善预后,提高生活质量。
目前西医的治疗方案主要是激素加免疫抑制剂,同时辅以降压护肾、调节糖脂代谢、抗凝等治疗,取得了一定的临床疗效,但因药物带来的满月脸、水牛背、感染、骨质疏松等不良反应以及停药后易反弹等局限性,长期应用效果欠佳,因此给临床治疗带来很大的挑战。中医认为MN属于“水肿”“尿浊”等范畴。课题组在长期的临床观察中发现,MN患者日久均有脾肾亏虚之象。中医理论认为脏腑亏虚日久无力鼓动气血运行,则三焦气化不利、血液凝滞;瘀血即为病理产物又是致病因素,故血瘀为MN患者的重要病因之一。导师陈志强教授有着多年的临床经验,在治疗MN方面有着独到的见解。陈教授认为MN“脾肾气阳两虚,水湿痰瘀内阻,三焦气化不利”为病机关键[13]。脾肾为MN的主要病位,脾肾亏虚导致气血运行不利,气虚易发展成阳虚,阳虚不能温化水湿,水液停聚机体,形成水肿;血不利则为水,亦成水肿;脾肾亏虚失去升清固摄之职,则蛋白易漏出形成蛋白尿。三焦作为脏腑功能正常运行的主要通道,在水液输布中起着重要作用。一旦受损,则上焦不能宣散,中焦不能燥化,下焦不能泄利,三焦气化功能失司,水湿邪浊留滞机体,则易发生病变。
据此,陈教授自拟三焦祛湿方治疗MN,方中黄芪、炒白术、淫羊藿益气温阳,化气行水;藿香化湿通上焦,陈皮、白豆蔻燥湿运中焦,积雪草、茯苓渗湿利下焦;丹参、川芎、红花、水蛭活血化瘀通络。其中黄芪是必用药,研究显示[14],黄芪的有效成分黄芪甲苷Ⅳ可减少细胞骨架的丢失调节相关通路蛋白,恢复足细胞形态,减轻足细胞损伤。中医认为久病入络,络脉纤细深邃,血流缓慢,易发生瘀滞。红花、川芎等植物类的活血化瘀药力难以触及深部,而水蛭等动物类的化瘀通络药能破血逐瘀,消除癥瘕积聚,直捣疾病深处。现代药理研究认为水蛭是作用较强的凝血酶抑制剂,而且对炎性介质具有拮抗作用,能够减弱免疫复合物的沉积,减轻蛋白尿,保护肾功能[15]。近年来中医药在治疗疾病方面的优势逐渐凸显,但确切的分子机制尚不明确,本研究主要是探讨中药三焦祛湿方对MN小鼠足细胞蛋白表达的影响,以进一步探讨MN尿蛋白减少的可能生物学机制,为临床提供参考。
足细胞是终末分化的细胞,为肾小球提供结构支持,由胞体、初级突起、足突3部分构成,对维持完整的肾小球滤过屏障至关重要,可因遗传、药物、感染等诱因被破坏,且破坏之后功能难以恢复[16]。目前认为MN的足细胞破坏,主要是由于肾小球上皮下免疫复合物的沉积,补体系统被激活,形成膜攻击复合物C5b-9,C5b-9导致足突的融合、凋亡等改变,是蛋白尿加重的重要原因[17-18]。裂孔隔膜蛋白和骨架蛋白的异常表达是足细胞受损的重要表现。毗邻足突之间有规律的相互交错,在它们之间形成的间隙为裂孔,之间有裂孔膜桥连接形成裂孔隔膜。ZO-1是分子量为220 kd的蛋白质,在肾小球主要表达于足细胞足突胞质侧裂孔隔膜附近,属于鸟苷酸激酶家族的一种链接蛋白,主要附着在裂孔隔膜上,ZO-1与neph-1相互作用形成一个结构稳定的蛋白复合体,形成裂孔隔膜的重要组成部分之一。ZO-1将裂孔隔膜与足细胞骨架蛋白actin相连接,以维持足细胞滤过膜的完整性。Mark C Wagner等[19]研究显示肾小球损伤后,足细胞消失,ZO-1与neph-1出现解离,两者之间的相互作用丧失,裂孔隔膜的结构被破坏。表明ZO-1在足细胞裂空隔膜复合体中发挥重要作用。足细胞中ZO-1特异性表达的缺失,会损害裂孔隔膜的形成,导致蛋白尿和肾小球硬化[20]。文献资料[6]显示,在C-BSA诱导的MN大鼠模型中ZO-1的表达下降,经药物治疗后其表达量有所增加,表明ZO-1蛋白表达的减少可能是尿蛋白加重的影响因素。
骨架蛋白以肌动蛋白为主,维持着足细胞的特殊结构。synaptopodin是分子量为100 kd的蛋白质,是骨架蛋白的重要组成部分,一种富含脯氨酸的肌动蛋白结合蛋白[21],与α-actinin-4相互作用,和紧密连接蛋白一起与肌动蛋白微丝密切相连,维持足细胞的结构和功能。synaptopodin调控下游蛋白RhoA的表达,RhoA是影响细胞信号转导的重要蛋白之一,对维持肾小球的滤过屏障具有重要作用[22]。synaptopodin表达量的降低,会引起足突融合,肌动蛋白细胞骨架的重组。研究显示[23],C-BSA诱导的膜性肾病大鼠肾组织synaptopodin的表达明显下降,治疗组与模型组相比其表达量明显增加,表明synaptopodin表达的减少会加重蛋白尿。据报道[24],synaptopodin是环孢素的作用靶点,环孢素能够抑制钙调磷酸酶的活性,增加突触足蛋白的丰度,从而起到降低蛋白尿的作用。本研究显示MN小鼠肾组织中ZO-1、synaptopodin的表达减少;与模型组相比,各治疗组ZO-1、synaptopodin的表达均有增加,与文献中的研究结果是一致的。进一步说明了ZO-1、synaptopodin的表达对维持足细胞正常功能和结构起着重要作用。
本实验采用尾静脉注射阳离子化牛血清白蛋白诱导小鼠出现MN的病理模型,给予高、低剂量的三焦祛湿方或盐酸贝那普利片干预,研究表明造模后小鼠出现肾小球毛细血管基底膜增厚、钉突形成、免疫复合物沉积等病理改变,血清白蛋白降低、血脂升高等生化的改变,经三焦祛湿方干预后,MN小鼠的蛋白尿、血脂显著降低,血清白蛋白明显升高,疗效与西药组相当。各组小鼠血清尿素氮、肌酐相比变化不大,分析原因可能与实验时间短,造模后小鼠肾功能尚处于代偿阶段有关。对目的蛋白ZO-1、synaptopodin的检测显示:造模组ZO-1、synaptopodin表达显著减少,经三焦祛湿方治疗后ZO-1、synaptopodin表达显著增多,由此笔者推测三焦祛湿方减少蛋白尿的机制可能是通过增加ZO-1、synaptopodin的表达,修复足细胞的完整性,从而减少蛋白的漏出,证实了三焦祛湿方治疗膜性肾病是有效的。但是由于检测数据的误差、实验中的不可控事件以及客观实验条件的限制等因素,使得实验存在一些不足,其进一步的机制有待未来更深入的研究。
| [1] |
BOMBAC K, ANDREW S. Management of membranous nephropathy in the PLA2R era[J]. Clinical Journal of the American Society of Nephrology, 2018, 13(5): 784-786. DOI:10.2215/CJN.12461117 |
| [2] |
HOU J H, ZHU H X, ZHOU M L, et al. Changes in the spectrum of kidney diseases: an analysis of 40, 759 biopsy-proven cases from 2003 to 2014 in China[J]. Kidney Dis, 2018, 4(1): 10-19. DOI:10.1159/000484717 |
| [3] |
XU X, WANG G B, CHEN N, et al. Long-term exposure to air pollution and increased risk of membranous nephropathy in China[J]. Journal of the American Society of Nephrology: JASN, 2016, 27(12): 3739-3746. DOI:10.1681/ASN.2016010093 |
| [4] |
杨凤文, 冯忖, 陈文军, 等. 人类白细胞抗原DP基因多态性与特发性膜性肾病遗传易感性研究[J]. 现代预防医学, 2017, 44(11): 2108-2112. YANG F W, FENG C, CHEN W J, et al. Association between HLA-DP polymorphisms and idiopathic membranous nephropathy[J]. Modern Preventive Medicine, 2017, 44(11): 2108-2112. |
| [5] |
LUCAS G, LEITO A C C, ALENCAR R L, et al. Pathophysiological aspects of nephropathy caused by non-steroidal anti-inflammatory drugs[J]. J Bras Nefrol, 2019, 41(1): 124-130. DOI:10.1590/2175-8239-jbn-2018-0107 |
| [6] |
靳晓华. 降脂通络软胶囊对膜性肾病大鼠的肾保护作用及对肾组织α-actinin-4、ZO-1表达的影响[D]. 石家庄: 河北医科大学, 2016. JIN X H. Effect of Jiangzhi Tongluo Soft capsule on renal protection and expression of α-Actinin-4 and ZO-1 in membranous nephropathy rats[D]. Shijiazhuang: Hebei Medical University, 2016. |
| [7] |
何依玲, 胡珏. 白藜芦醇对膜性肾病大鼠的肾保护作用[J]. 中国临床药理学杂志, 2021, 37(6): 707-709. HE Y L, HU J. Renal protective effect of resveratrol on the rats with membranous nephropathy[J]. The Chinese Journal of Clinical Pharmacology, 2021, 37(06): 707-709. |
| [8] |
张芬芳, 艾雨, 赵炳武, 等. 宣通三焦、活血通络方治疗特发性膜性肾病的临床疗效观察[J]. 中华中医药杂志, 2020, 35(3): 1596-1598. ZHANG F F, AI Y, ZHAO B W, et al. Clinical observation on Xuantong Sanjiao and Huoxue Tongluo Formula in treating idiopathic membranous nephropathy[J]. China Journal of Traditional Chinese Medicine and Pharmacy, 2020, 35(3): 1596-1598. |
| [9] |
WU C C, CHEN J S, LIN H S, et al. Experimental model of membranous nephropathy in mice: sequence of histological and biochemical events[J]. Laboratory Animals, 2008, 42(3): 350-359. DOI:10.1258/la.2007.06016e |
| [10] |
赵亚云, 方敬, 陈静洁, 等. 三焦祛湿方对C-BSA诱导膜性肾病小鼠肾脏保护作用及其对Nrf2/HO-1信号通路的影响[J]. 中国实验方剂学杂志, 2021, 27(18): 58-65. ZHAO Y Y, FANG J, CHEN J J, et al. Renoprotective effect of Sanjiao Qushi Prescription against cationic bovine serum albumin induced membranous nephropathy mice model and its influence on Nrf2/HO-1 signaling pathway[J]. Chinese Journal of Experimental Traditional Medical Formulae, 2021, 27(18): 58-65. |
| [11] |
邢建月, 王世荣, 刘光珍, 等. 芪龙通肾方治疗膜性肾病大鼠蛋白尿的作用机制研究[J]. 中国药物与临床, 2021, 21(1): 14-17. XING J Y, WANG S R, LIU G Z, et al. Efficacy of Qilong Tongshen Decoction for treatment of proteinuria in rats with membranous nephropathy: a mechanistic study[J]. Chinese Remedies & Clinics, 2021, 21(1): 14-17. |
| [12] |
UNCANIN S, DZEMIDZIC J, SERDAREVIC N, et al. Idiopathic membranous nephropathy and treatment related complications[J]. Medical Archives (Sarajevo, Bosnia and Herzegovina), 2020, 74(3): 228-232. |
| [13] |
吴苏, 张学琴, 赵炳武, 等. 陈志强教授治疗肾病综合征学术思想与临床经验介绍[J]. 天津中医药, 2019, 36(7): 631-634. WU S, ZHANG X Q, ZHAO B W, et al. Professor CHEN Zhiqiang's academic thoughts and clinical experience of the treatment on the nephrotic syndrome[J]. Tianjin Journal of Traditional Chinese Medi- cine, 2019, 36(7): 631-634. |
| [14] |
ZHENG R, DENG Y, CHEN Y, et al. Astragaloside IV attenuates complement membranousattack complex induced podocyte injury through the MAPK pathway[J]. Phytotherapy Research, 2012, 26(6): 892-898. DOI:10.1002/ptr.3656 |
| [15] |
曹静, 赵文静, 旺建伟, 等. 水蛭的本草考证及现代研究[J]. 中医药信息, 2015, 32(4): 122-124. CAO J, ZHAO W J, WANG J W, et al. Textual research and modern research on Leeches[J]. Information on Traditional Chinese Medicine, 2015, 32(4): 122-124. |
| [16] |
SATO Y, WHARRAM B, LEE S, et al. Urine podocyte mRNAs mark progression of renal disease[J]. Journal of the American Society of Nephrology Jasn, 2009, 20(5): 1041-1052. DOI:10.1681/ASN.2007121328 |
| [17] |
MA H, SANDOR D G, BECK L H. The role of complement in membranous nephropathy[J]. Semin Nephrol, 2013, 33(6): 531-542. DOI:10.1016/j.semnephrol.2013.08.004 |
| [18] |
郝剑, 于为民, 李慧. 特发性膜性肾病补体及补体攻膜复合物C5b-9的关联性分析[J]. 中国药物与临床, 2018, 18(4): 639-640. HAO J, YU W M, LI H. Correlation analysis of complement and complement attacking membrane complex C5b-9 in idiopathic membranous nephropathy[J]. Chinese Remedies & Clinics, 2018, 18(4): 639-640. |
| [19] |
WAGNER MC, RHODES G, WANG E, et al. Ischemic injury to kidney induces glomerular podocyte effacement and dissociation of slit diaphragm proteins Neph1 and ZO-1[J]. Journal of Biological Chemistry, 2008, 283(51): 35579-35589. |
| [20] |
ITOH M, NAKADATE K, MATSUSAKA T, et al. Effects of the differential expression of ZO-1 and ZO-2 on podocyte structure and function[J]. Genes Cells, 2018, 23(7): 546-556. |
| [21] |
杨琪, 汪建国, 潘涛, 等. Synaptopodin在肾小球病变中的表达研究[J]. 中国组织化学与细胞化学杂志, 2004, 13(4): 485-488. YANG Q, WANG J G, PAN T, et al. Expression of Synaptopodin in glomerular lesions[J]. Chinese Journal of Histochemistry and Cytochemistry, 2004, 13(4): 485-488. |
| [22] |
邱雯雯. 温阳活血利水法对嘌呤霉素损伤足细胞的细胞骨架及相关蛋白的影响[D]. 武汉: 湖北中医药大学, 2017. QIU W W. Effects of Warming Yang, Activating Blood and benefiting Water method on cytoskeleton and related proteins of podocyte damaged by purinomycin[D]. Wuhan: Hubei University of Chinese Medicine, 2017. |
| [23] |
臧倩男. 益肾通络方对膜性肾病大鼠肾保护作用及对Ezrin和Synaptopodin蛋白表达的影响[D]. 石家庄: 河北医科大学, 2018. ZANG Q N. Effect of Yishen Tongluo Decoction on renal protection and expression of Ezrin and Synaptopodin protein in rats with membranous nephropathy[D]. Shijiazhuang: Hebei Medical University, 2018. |
| [24] |
FAUL C, DONNELLY M, MERSCHER-GOMEZ S, et al. The actin cytoskeleton of kidney podocytes is a direct target of the antiproteinuric effect of cyclosporine A[J]. Nature Medicine, 2008, 14(9): 931-938. |
2. The First Affiliated Hospital of Hebei University of Traditional Chinese Medicine, Shijiazhuang 050011, China
 2022, Vol. 39
2022, Vol. 39