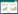文章信息
- 赵海霞, 曹盼盼, 刘林昊, 刘风勋
- ZHAO Haixia, CAO Panpan, LIU Linhao, LIU Fengxun
- 槲皮素对1型糖尿病肾病肾小管上皮细胞间质转分化的作用
- Effect of quercetin on the mesenchymal transdifferentiation of renal tubular epithelial cells in type 1 diabetic nephropathy
- 天津中医药, 2022, 39(5): 663-667
- Tianjin Journal of Traditional Chinese Medicine, 2022, 39(5): 663-667
- http://dx.doi.org/10.11656/j.issn.1672-1519.2022.05.24
-
文章历史
- 收稿日期: 2022-01-08
2. 郑州大学第一附属医院肾内科,郑州 450000
糖尿病肾病(DN)是1型糖尿病(T1D)的常见微血管并发症之一,有15%~25%的1型糖尿病最终发展为1型糖尿病肾病(T1DN)[1]。T1DN是青少年末期肾病的主要类型,主要临床特征为尿蛋白异常、肾脏损伤、肾间质纤维化和肾小球硬化等[2]。肾间质纤维化形成与成纤维细胞有关,而肾小球上皮细胞的间充质转化是受损的肾产生成纤维细胞,并且最终导致肾纤维化的关键因素[3]。因此,基于T1DN的发病基质,寻求新型有效的预防和治疗药物来抑制T1DN的发生发展具有深远意义。
槲皮素是一种天然黄酮类化合物,其化学名为3,3,4,5,7-五羟基黄酮,广泛存在于蔬菜、水果等植物中[4]。槲皮素的主要药理作用为抗炎、抗氧化、免疫调节及心血管保护等作用[5]。研究表明,槲皮素可降低DN大鼠的血糖,改善DN的发展[6]。然而,槲皮素对T1DN的作用以及机制研究尚少。
本研究采用链脲佐菌素构建T1DN大鼠模型,检测槲皮素对血糖和肾脏病理学的影响,并探究槲皮素对T1DN大鼠肾脏肾小球上皮细胞的间充质转化及肾间质纤维化影响,为临床患者的治疗提供实验依据。
1 材料与方法 1.1 实验动物SPF级的雄性SD大鼠30只[北京维通利华实验动物技术有限公司提供,许可证号:SCXK(鄂)2019-0023],12周龄,体质量(230±10)g。所有大鼠均饲养于恒温(25±2)℃,湿度50%~60%的无特殊病原体环境中,并可随意进食高压灭菌的水和饲料。本实验方案通过郑州大学实验动物中心伦理委员会的审核,并且在国家卫生研究所关于保护和使用实验动物的方针指导下进行。
1.2 实验试剂槲皮素(丽珠集团利民制药公司);尿蛋白试剂盒(赛默飞世尔科技有限公司);福尔马林(济南百博生物技术股份有限公司);戊巴比妥钠(上海信裕生物科技有限公司);Weigert铁苏木素染色液(北京博润莱特科技有限公司);Trizol试剂、RIPA缓冲液、PMSF、BSA和BCA试剂(上海碧云天生物技术有限公司);PrimeScript TM RT试剂盒(Takara Biotechnology);SYBR-Green qPCR Master Mix(北京康润诚业生物科技有限公司);兔抗鼠转化生长因子-β(TGF-β)、smad2/3、α-平滑肌肌动蛋白(α-SMA)、Snail、E-钙黏蛋白(E-cadherin)和甘油醛-3-磷酸脱氢酶(GAPDH)单分子抗体(Abcam);山羊抗兔二抗(赛信通生物试剂有限公司);超敏发光液(北京四正柏生物科技有限公司)。
1.3 实验方法 1.3.1 实验动物分组和建模随机将30只SD大鼠分为3组:对照组、T1DN组和槲皮素组,每组10只。SD大鼠在动物房适应饲养1周后,T1DN组和槲皮素组单次空腹腹腔注射100 mg/kg链脲佐菌素。48 h后尾静脉采血测血糖,血糖含量≥16.7 nmol/L,认定为糖尿病模型构建成功[7]。大鼠糖尿病建模4周后,收集其24 h尿液并测定尿蛋白,为T1DN建模成功。本实验30只SD大鼠血糖含量均≥16.7 nmol/L,尿蛋白>30 mg/24 h,成模率100%。槲皮素干预浓度参考文献,选取100 mg/kg,每次灌胃前将槲皮素与生理盐水涡旋成槲皮素混悬液[8]。血糖检测完毕后,槲皮素组按100 mg/kg槲皮素混悬液灌胃,每日1次。对照组和T1DN组每日灌胃等量生理盐水,连续8周。最后一次灌药结束后收集24 h尿液。在所有大鼠处死之前检测大鼠空腹血糖值,安乐死大鼠后,原位灌洗肾脏后,去除包膜,滤纸吸干后,沿着肾门沿冠状面破开,一半放入福尔马林中固定,通过常规脱水、浸蜡、包埋及切片,另一部分放入液氮中冻存。
1.3.2 24 h尿蛋白检测收集所有大鼠24 h的尿后,记录尿量。采用尿蛋白试剂盒(比色法)检测尿蛋白的浓度,24 h尿蛋白=尿蛋白浓度×24 h尿量。
1.3.3 天狼星红染色所有大鼠肾脏5 μm石蜡切片,脱蜡至水化,Weigert铁苏木素染色液染色10 min后,生理盐水冲洗。天狼星红染液染色1~2 h,生理盐水浸泡,脱水,透明,封片后,在光学显微镜下观察各组大鼠肾组织的病理学变化。
1.3.4 实时荧光定量核酸扩增检测系统(qPCR)检测取所有组大鼠肾脏组织0.5 mg,放入低温匀浆机100 Hz匀浆10 min后,使用Trizol试剂提取总RNA。用NanoDrop 2000分光光度计检测RNA的纯度和浓度后,通过PrimeScript TM RT试剂盒逆转录合成cDNA(反转录条件:37 ℃ 60 min,85 ℃ 5 min)。在ABI 7500实时PCR系统上,实时荧光定量PCR实验。PCR扩增条件为:95 ℃预变性2 min,95 ℃变性15 s,60 ℃退火45 s,72 ℃延伸30 s,共计40个循环。以GAPDH作为mRNA的标准内参基因表达结果均以2-ΔΔct进行统计。目的基因及参考基因序列见表 1。
所有组大鼠肾脏组织0.5 mg放入低温匀浆机100 Hz匀浆10 min后,RIPA缓冲液和PMSF抑制蛋白降解液(100∶1)将样本裂解后提取各组总蛋白。通过BCA试剂检测蛋白质的总浓度,将各组的总蛋白浓度调为一致,将其于100 ℃进行变性后保存至-20 ℃。SDS-PAGE电泳分离总蛋白后,将其转膜至PVDF膜。5%脱脂牛奶封闭2 h,TBST洗涤3次,每次10 min,将其放入对应的一抗(TGF-β、Smad2/3、α-SMA、Snail、E-cadherin和GAPDH)和一抗稀释混悬液(1∶1 000)中,4 ℃孵育过夜。TBST洗涤3次,放入二抗和二抗稀释液(1∶4 000)混悬液中,室温孵育2 h。TBST洗涤3次,每次10 min,将超敏发光液ECL滴在膜上,放入化学发光成像仪(Invitorgen,美国)进行蛋白显影。通过Image J软件进行分析,相对蛋白表达以GAPDH标准化。
1.3.6 统计学方法应用SPSS 20.0软件进行数据分析,GraphPad Prism Version 7.0计量作图,资料以均数±标准差(x±s)表示,多组数据见的比较采用单因素方差分析(One-way ANOVA),P<0.05为差异有统计学意义。
2 结果 2.1 大鼠空腹血糖值以及24 h尿蛋白的变化与对照组空腹血糖值(3.82±0.28)nmol/L比较,T1DN组空腹血糖值(23.25±1.88)nmol/L显著增加(P<0.01)。与T1DN组比较,槲皮素组空腹血糖值(10.57±1.01)nmol/L显著降低(P<0.05)。与对照组的24 h尿蛋白[(41.33±2.64)μg/24 h]比较,T1DN组24 h尿蛋白[(231.42±5.32)μg/24 h]显著增加(P<0.01)。与T1DN组比较,槲皮素组24 h尿蛋白[(73.72±2.51)μg/24 h]显著降低(P<0.05)。见图 1A和1B。
|
| 注:A. 3组大鼠空腹状态下血糖浓度变化柱状图(与对照组比较,**P<0.01;与T1DN组比较,#P<0.05);B. 3组大鼠24 h尿蛋白量变化柱状图(与对照组比较,**P<0.01;与T1DN组比较,#P<0.05)。 图 1 各组大鼠空腹血糖值和24 h尿蛋白含量变化 Fig. 1 Changes of fasting blood glucose and 24 h urine protein content of rats in each group |
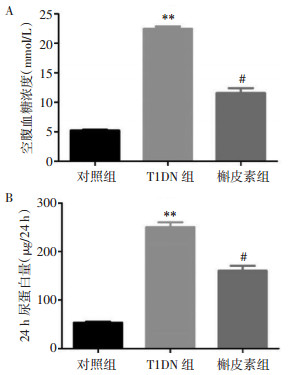
天狼星染色结果显示,对照组大鼠的肾小球和肾小管结构完整,肾小管间质未见胶原纤维沉积。T1DN组肾小球增生,肾小管上皮损伤,肾小管间质胶原纤维沉积明显。槲皮素组大鼠的肾小管结构较完整,肾小球肥大程度减轻,肾小管间质胶原纤维沉积明显降低,见图 2。
|
| 图 2 各组大鼠肾组织病理变化(×200,标尺=10 μm) Fig. 2 Pathological changes of renal tissue of rats in each group (×200, standard=10 μm) |
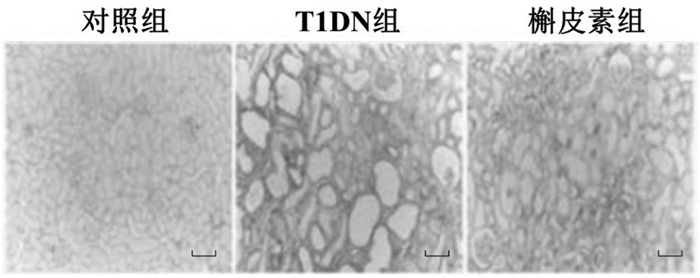
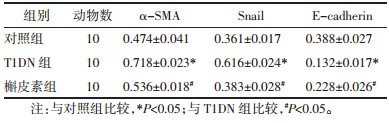
Western blot和qPCR结果显示,与对照组比较,T1DN组的α-SMA、Snail蛋白和mRNA表达显著增加(P<0.05或P<0.01),E-cadherin的蛋白和mRNA表达显著减少(P<0.05或P<0.01)。与T1DN组比较,槲皮素组的α-SMA、Snail蛋白和mRNA表达显著减少(P<0.05),E-cadherin的蛋白和mRNA表达显著增加(P<0.05)。见图 3和表 2。
|
| 注:A. Western blot检测3组大鼠肾组织中上皮细胞间质转分化标志蛋白;B. 3组大鼠肾组织上皮细胞间质转分化标志蛋白表达量柱状图(与对照组比较,**P<0.01;与T1DN组比较,#P<0.05)。 图 3 各组大鼠肾脏组织上皮细胞间质转分化标志蛋白含量变化 Fig. 3 Changes in protein levels of epithelial-mesenchymal transdifferentiation marker proteins in kidney tissue of rats in each group |
|
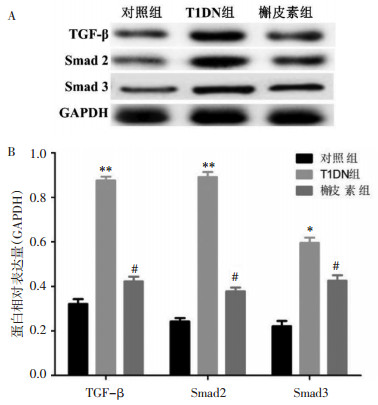
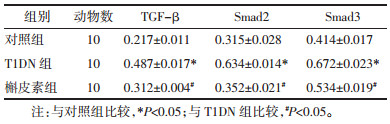
Western blot和qPCR结果显示,与对照组比较,T1DN组的TGF-β、Smad2/3蛋白和mRNA表达显著增加(P<0.05或P<0.01)。与T1DN组比较,槲皮素组的TGF-β、Smad2/3蛋白和mRNA表达显著减少(P<0.05)。见图 4和表 3。
|
| 注:A. Western blot检测3组大鼠肾组织中TGF-β/Smad信号通路关键蛋白变化;B. 3组大鼠肾组织TGF-β/Smad信号通路关键蛋白表达量柱状图(与对照组比较,*P<0.05,**P<0.01;与T1DN组比较,#P<0.05)。 图 4 各组大鼠肾脏组织上皮细胞间质转分化标志蛋白含量变化 Fig. 4 Changes in protein levels of epithelial-mesenchymal transdifferentiation marker proteins in kidney tissue of rats in each group |
|
中国是全世界糖尿病发病的第一大国,超过一半的糖尿病患者会发展成DN [9]。DN的基本机制是细胞内途径的促炎因子和促纤维化因子产生,引起肾损伤和纤维化的过程,并且细胞外基质代谢不正常,在间质内异常积聚[10]。研究表明,肾小管上皮细胞间质转分化的异常导致纤维细胞增加,进而引起蛋白尿和肾小球纤维化,最终发展成终末期肾病,即T1DN[11]。本研究采用一次性腹腔注射链脲佐菌素诱导糖尿病模型,12周后,糖尿病大鼠的24 h尿蛋白和空腹血糖明显增加,肾脏主要的病理变化为肾小球肥大,肾小管扩张和间质胶原纤维沉积增多和基底膜不规则增厚,符合T1DN早期功能和结构的改变,说明实验造模成功。研究表明,慢病肾间质纤维化疾病中,有36%肾间质成纤维细胞是来自肾小管上皮细胞转分化[12-13]。因此,阻碍肾小管上皮细胞间质转分化对T1DN的发生发展具有重要临床意义。α-SMA是肌成纤维细胞的标志蛋白,在纤维化早期高表达,与肾纤维化呈正相关[14]。Snail属于锌指蛋白家族,能促进肾小管上皮细胞间质转分化[15]。Snail直接抑制靶基因E-cadherin的表达,进而启动上皮细胞间质转分化[16]。本研究结果表明,T1DN模型大鼠的α-SMA和Snail表达明显增加,而E-cadherin的表达受到抑制。综上所述,本研究的T1DN构建成功。
槲皮素存在100多种中药草中,对多种疾病具有预防和治疗作用,其中对DN有较好的效果,但作用机制尚不明确[6]。本研究结果显示,槲皮素干预8周后,大鼠血糖和尿蛋白明显降低,并且肾脏组织病理学形态得到改善,胶原纤维减少。Western blot和qPCR结果显示,槲皮素可抑制T1DN大鼠肾组织中的α-SMA和Snail表达,促进E-cadherin的表达,说明槲皮素可抑制肾小管上皮细胞间质转分化,从而改善T1DN大鼠肾组织纤维化。
研究表明,TGF-β/Smad信号通路是调控上皮间质转化的中心环节,主要是TGF-β激活Smad信号蛋白,从而调节靶基因的转录,促进肾小管上皮间质转分化的α-SMA和Snail表达,抑制标志蛋白E-cadherin[17]。本研究结果显示,槲皮素可阻碍TGF-β/Smad信号通路的传导,主要是抑制TGF-β、Smad2/3的表达。综上所述,槲皮素可阻断TGF-β/Smad信号的传递,抑制肾小管上皮细胞间质转分化的标志蛋白α-SMA和Snail表达,促进E-cadherin表达,进而改善T1DN的肾损伤,降低血糖和尿蛋白。因此,槲皮素可改善链脲佐菌素诱导的T1DN,有望成为治疗抗T1DN的药物。
| [1] |
ANDERS H J, HUBER T B, ISERMANN B, et al. CKD in diabetes: diabetic kidney disease versus nondiabetic kidney disease[J]. Nature Reviews Nephrology, 2018, 14(6): 361-377. DOI:10.1038/s41581-018-0001-y |
| [2] |
JOBBAGY S, TAN R J. Nitrolipids in kidney physiology and disease[M]. Nitric Oxide: Biology and Chemistry, 2018: S1089-S8603(18)30006-5.
|
| [3] |
MULDER S, HAMIDI H, KRETZLER M, et al. An integrative systems biology approach for precision medicine in diabetic kidney disease[J]. Diabetes, Obesity & Metabolism, 2018, 20(Suppl 3): 6-13. |
| [4] |
LI Y, YAO J Y, HAN C Y, et al. Quercetin, inflammation and immunity[J]. Nutrients, 2016, 8(3): 167. DOI:10.3390/nu8030167 |
| [5] |
FORNEY L A, LENARD N R, STEWART L K, et al. Dietary quercetin attenuates adipose tissue expansion and inflammation and alters adipocyte morphology in a tissue-specific manner[J]. International Journal of Molecular Sciences, 2018, 19(3): E895. DOI:10.3390/ijms19030895 |
| [6] |
TANG L X, LI K, ZHANG Y, et al. Quercetin liposomes ameliorate streptozotocin-induced diabetic nephropathy in diabetic rats[J]. Scientific Reports, 2020, 10(1): 2440. DOI:10.1038/s41598-020-59411-7 |
| [7] |
ZHANG Y, REN S Y, JI Y, et al. Pterostilbene ameliorates nephropathy injury in streptozotocin-induced diabetic rats[J]. Pharmacology, 2019, 104(1/2): 71-80. |
| [8] |
LAI P B, ZHANG L, YANG L Y. Quercetin ameliorates diabetic nephropathy by reducing the expressions of transforming growth factor-β1 and connective tissue growth factor in streptozotocin-induced diabetic rats[J]. Renal Failure, 2012, 34(1): 83-87. DOI:10.3109/0886022X.2011.623564 |
| [9] |
KAWANAMI D, MATOBA K, UTSUNOMIYA K. Signaling pathways in diabetic nephropathy[J]. Histology and Histopathology, 2016, 31(10): 1059-1067. |
| [10] |
MEDINA-NAVARRO R, TORRES-RAMOS Y D, GUZMÁN-GRENFELL A M, et al. Lysosomal dysfunction induced by changes in albumin's tertiary structure: potential key factor in protein toxicity during diabetic nephropathy[J]. Life Sciences, 2019, 230: 197-207. DOI:10.1016/j.lfs.2019.05.069 |
| [11] |
CHEN K H, CHEN J, WANG L, et al. Parkin ubiquitinates GATA4 and attenuates the GATA4/GAS1 signaling and detrimental effects on diabetic nephropathy[J]. The FASEB Journal, 2020, 34(7): 8858-8875. DOI:10.1096/fj.202000053R |
| [12] |
LAGIES S, PICHLER R, BORK T, et al. Impact of diabetic stress conditions on renal cell metabolome[J]. Cells, 2019, 8(10): E1141. DOI:10.3390/cells8101141 |
| [13] |
XIONG Y B, ZHOU L L. The signaling of cellular senescence in diabetic nephropathy[J]. Oxidative Medicine and Cellular Longevity, 2019(2019): 7495629. |
| [14] |
GERRITS T, ZANDBERGEN M, WOLTERBEEK R, et al. Endoglin promotes myofibroblast differentiation and extracellular matrix production in diabetic nephropathy[J]. International Journal of Molecular Sciences, 2020, 21(20): E7713. DOI:10.3390/ijms21207713 |
| [15] |
TIAN H Y, YANG J B, XIE Z C, et al. Gliquidone alleviates diabetic nephropathy by inhibiting Notch/snail signaling pathway[J]. Cellular Physiology and Biochemistry, 2018, 51(5): 2085-2097. DOI:10.1159/000495827 |
| [16] |
YANG G N, ZHAO Z J, ZHANG X X, et al. Effect of berberine on the renal tubular epithelial-to-mesenchymal transition by inhibition of the Notch/snail pathway in diabetic nephropathy model KKAy mice[J]. Drug Design, Development and Therapy, 2017(11): 1065-1079. |
| [17] |
SRIVASTAVA S P, HEDAYAT A F, KANASAKI K, et al. microRNA crosstalk influences epithelial-to-mesenchymal, endothelial-to-mesenchymal, and macrophage-to-mesenchymal transitions in the kidney[J]. Frontiers in Pharmacology, 2019, 10: 904. |
2. Department of Nephrology, The First Affiliated Hospital of Zhengzhou University, Zhengzhou 450000, China
 2022, Vol. 39
2022, Vol. 39