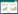文章信息
- 蒋昊
- JIANG Hao
- 基于电子鼻和HPLC多成分含量分析的焦山楂烘制工艺研究
- Baking process study of Crataegus pinnatifida based on multi-component content analysis by electronic nose and HPLC
- 天津中医药, 2022, 39(5): 668-674
- Tianjin Journal of Traditional Chinese Medicine, 2022, 39(5): 668-674
- http://dx.doi.org/10.11656/j.issn.1672-1519.2022.05.25
-
文章历史
- 收稿日期: 2021-11-18
山楂是蔷薇科山楂属植物山里红Cralaegus pinnatifida.Bge.var.major N.E.Br.或山楂Crataegus pinnatifida Bge.的干燥成熟果实。山楂具有消食健胃、行气散瘀、化湿降浊的功效,临床上常以炮制品入药。山楂的炮制存在多种方法:蒸法、清炒、醋炒、酒炒、姜汁制等,目前多采用清炒法,根据炒制程度的不同细分为炒山楂、焦山楂、山楂炭[1]。传统清炒法常常会受操作人员技术、投药量、加热程度、翻炒频率等因素影响炮制品的品质,导致出现“炮制不及”或“炮制过火”等现象,因此有学者尝试以更简便、且能严格控制加热温度和时间的烘制法[2]和微波法[3]来进行山楂炮制新工艺的研究,但相关报道较少且烘制工艺不规范。本文借助电子鼻和高效液相色谱法(HPLC)两种分析技术,从外观性状、气味和有机酸含量多方面比较烘制焦山楂与清炒焦山楂的异同,通过正交实验优选焦山楂烘制工艺,旨在找到与传统清炒工艺制备的焦山楂最为接近的烘制工艺,为山楂烘制工艺的进一步规范提供参考。
1 材料 1.1 试剂与材料山楂饮片(去核),经天津中医药大学李天祥教授鉴定为蔷薇科山楂属植物山楂Crataegus pinnatifidaBge.的干燥成熟果实。草酸、酒石酸、苹果酸、乳酸、柠檬酸、琥珀酸、没食子酸、原儿茶酸、香草酸、咖啡酸对照品(上海源叶生物科技有限公司,纯度≥98%),水为超纯水,甲醇、乙腈为色谱纯,其他试剂均为分析纯。
1.2 仪器1260型高效液相色谱仪,二极管阵列检测器(美国安捷伦科技有限公司),Hypersil ODS2色谱柱,Heracles II气相电子鼻和HS-100型自动进样器(Alpha Soft工作站,Alpha MOS公司),JP-060S型超声波清洗仪(深圳市洁盟清洗设备有限公司),MSE6.6S-OCE-DM型百万分之一微量天平(赛多利斯实验室仪器有限公司),FW100型高速粉碎机(天津泰斯特仪器有限公司)。
2 实验方法 2.1 样品制备 2.1.1 对照品溶液的制备精密称取适量草酸、酒石酸、苹果酸、乳酸、柠檬酸、琥珀酸、没食子酸、原儿茶酸、香草酸和咖啡酸对照品,用50%甲醇水溶解,配制浓度分别为240、400、800、640、800、720、40、80、60、60 μg/mL的混合对照品储备液,并逐级稀释成一系列浓度的混合对照品溶液,备用。
2.1.2 炒制焦山楂的制备取适量净山楂,置入预热适度的炒制容器中,用中火(1 000 w)加热,翻炒约13 min,得到表面棕褐色、内部为黄褐色的焦山楂。根据2020版《中国药典》[4],焦山楂的外观性状符合该部药典规定。
2.1.3 烘制焦山楂的制备及其正交实验每组取净山楂样品6份,放入提前预热的烘箱中,分别按照正交实验设计的烘制温度、烘制时间、烘制堆叠的层数进行烘制。正交实验考察烘制温度、烘制时间、烘制厚度层数3个因素,3个水平分别为烘制温度:160、170、180 ℃;烘制时间:6、8、10 min;烘制厚度层数:1、2、3层。
2.1.4 电子鼻样品制备取生山楂及各焦山楂炮制品,粉碎,过3号筛,备用。
2.1.5 含量测定样品制备取山楂饮片,粉碎后过80目筛,称取过筛后细粉1.0 g,加25 mL纯水,30 ℃超声30 min,4 000 r离心10 min,离心半径15 cm,取上清液过0.45 μm微孔滤膜,即得。
2.2 气相电子鼻测定 2.2.1 分析参数通过前期对进样体积、振摇温度、载样量和振摇时间的单因素考察,建立了生山楂及各焦山楂炮制品的气相电子鼻的分析参数。顶空发生部分:进样瓶规格20 mL,载样量1 g,振摇时间3 min,振摇温度60 ℃;进样部分:进样体积2 000 μL,进样速度125 μL/s,进样口温度70 ℃,进样持续时间29 s;捕集阱:初始温度40 ℃,分流速度10 mL/min,捕集持续时间34 s,最终温度200 ℃;色谱分离部分:柱温40 ℃,程序升温3.0 ℃/s,采集时间165 s,检测器温度250 ℃,FID增益为12。
2.2.2 样品测定精密称取“2.1.4电子鼻样品制备”项下制备粉末1.0 g置于20 mL顶空进样瓶中,顶空进样测定,每组样品制备3份,平行测定2次,炒制焦山楂和9个烘制工艺的气味信息图见图 1。

|
| 图 1 电子鼻气味信息图 Fig. 1 Odor information of electronic nose data |
按照“2.1.5含量测定样品制备”项下方法制备提取液,精密吸取滤液6 mL,加水66 mL,加酚酞指示剂3滴,用0.1 mol/L NaOH溶液测定提取液中的有机酸含量。每1 mL的NaOH溶液(0.1 mol/L)相当于6.404 mg的枸橼酸(C6H8O7)。
2.4 HPLC法测定水溶性有机酸成分 2.4.1 色谱条件Hypersil ODS2色谱柱(4.6 mm×250 mm,5 μm),流动相:0.1%磷酸水溶液(A):甲醇(B)梯度洗脱(0~10 min,1%~25% B;10~28 min,25% B;28~30 min,25%~1% B;30~35 min,1% B),检测波长:210 nm,流速:0.8 mL/min,柱温为27.5 ℃,进样量10 μL。
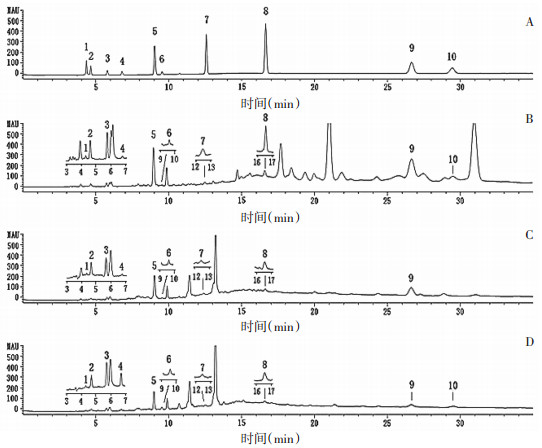
2.4.2 样品测定按照“2.1.5含量测定样品制备”项下方法制备提取液,每组样品制备3份,生山楂、炒制焦山楂和烘制焦山楂(工艺8)的液相色谱图见图 2。
|
| 注:A.混合对照品;B.生山楂;C.炒制焦山楂;D.烘制焦山楂(工艺8);1.草酸;2.酒石酸;3.苹果酸;4.乳酸;5.柠檬酸;6.琥珀酸;7.没食子酸;8.原儿茶酸;9.香草酸;10.咖啡酸。 图 2 山楂的HPLC色谱图 Fig. 2 HPLC chromatograms of Crataegus pinnatifida |
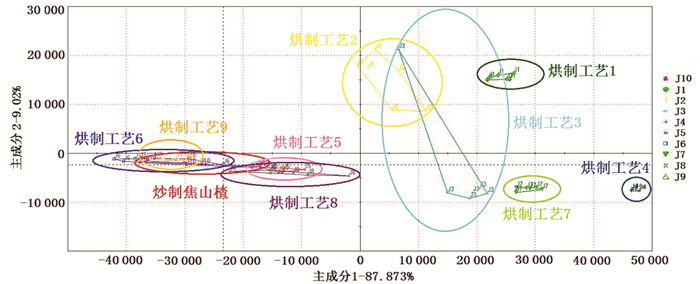
作为数据降维的常用方法,PCA能够很好地呈现样品之间的差异性,并表示出样品集群和离群的特点。在快速气相电子鼻中获得的各焦山楂炮制品的气相色谱信息,以峰面积作为PCA分析的输入值,对炒制焦山楂和烘制焦山楂进行分析比较,结果见图 3。从PCA二维图中可知主成分1(PC1)和主成分2(PC2)总贡献率为96.893%,能较好地反映原始数据信息。烘制工艺5、6、8、9制备的焦山楂与炒制焦山楂的分布区域较为接近,而烘制工艺1、2、3、4、7制备的焦山楂与炒制焦山楂的分布区域相距较远,说明烘制工艺5、6、8、9制备的焦山楂与炒制焦山楂相似程度更高。
|
| 图 3 电子鼻数据二维PCA分析图 Fig. 3 2D PCAanalysis of electronic nose data |
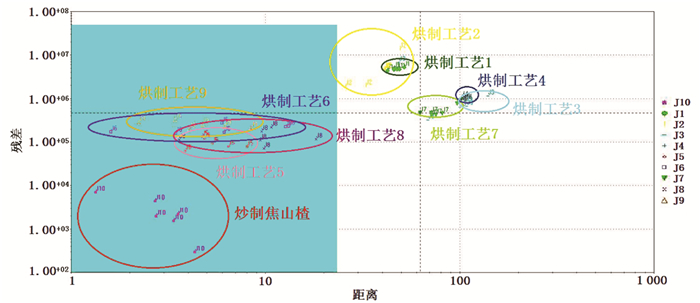
SIMCA分析是用于对目标进行简单分类与判定的一种分析方法。以炒制焦山楂作为参照,对9个不同烘制工艺制备的焦山楂样品进行分析判定,结果见图 4。结果显示烘制工艺5、6、8、9制备的焦山楂被划入炒制焦山楂的区域之内,而烘制工艺1、2、3、4、7制备的焦山楂被划于区域之外,与PCA分析结果一致。说明该方法可将与炒制焦山楂差异较大的烘制工艺焦山楂样品划于区域之外,该模型可在一定程度上实现不同烘制工艺焦山楂与炒制焦山楂相似程度的鉴别与区分。
|
| 图 4 电子鼻数据SIMCA分析图 Fig. 4 SIMCA analysis of electronic nose data |
以炒制焦山楂组作为参照,对9个不同烘制工艺制备的焦山楂样品进行分析判定,结果见图 5。结果显示烘制工艺5、6、8、9制备的焦山楂被划入炒制焦山楂的区域之内,而烘制工艺1、2、3、4、7制备的焦山楂被划于区域之外,与PCA和SIMCA的分析结果一致。说明SQC分析同样可将与炒制焦山楂差异较大的烘制工艺焦山楂样品划于区域之外,该模型也可用于不同烘制工艺焦山楂与炒制焦山楂相似程度的鉴别与区分。
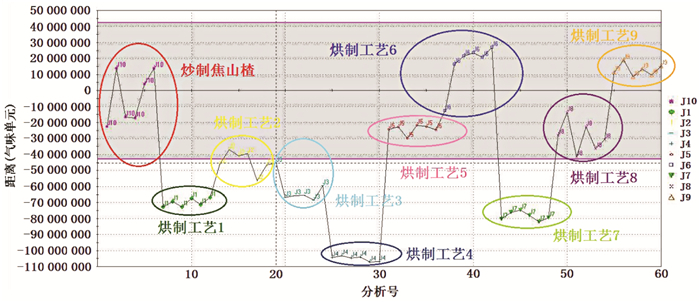
|
| 图 5 电子鼻数据SQC分析 Fig. 5 SQC analysis of electronic nose data |
与生山楂相比,炒制焦山楂和烘制焦山楂工艺1~9总有机酸含量分别下降1.74%、0.14%、0.67%、1.20%、0.67%、2.28%、0.94%、2.01%、1.21%、3.35%,每个工艺平行制备6份,RSD在1.06%~2.56%。
3.3 HPLC法测定水溶性有机酸成分采用外标一点法进行各成分的含量计算(单位为mg/g),并利用SPSS Statistics17.0软件对烘法炮制正交实验的结果进行方差分析。生山楂及各焦山楂炮制品中10种水溶性有机酸成分含量见表 1。
根据与炒制焦山楂外观性状特征的相似程度,对正交实验中各组烘制焦山楂进行评分,评分标准如下。5分:表面颜色棕褐色,内部黄褐色;3分:表面颜色黄褐色或黑褐色,内部深黄色或棕褐色;1分:表面颜色深黄或炭黑色,内部不变色或棕褐色。
4.2 气味评价通过气相电子鼻对炒制焦山楂与9个不同正交实验烘制工艺制备的焦山楂样品气味的检测结果,进行PCA、SIMCA、SQC分析。根据与炒制焦山楂总有机酸含量的接近程度,对正交实验中各组烘制焦山楂进行评分,评分标准如下。5分:与炒制焦山楂分布在相同区域;1分:与炒制焦山楂分布在不同区域。
4.3 总有机酸含量评价根据与炒制焦山楂总有机酸含量的接近程度,对正交实验中各组烘制焦山楂进行评分,评分标准见表 2。
根据与炒制焦山楂10种水溶性有机酸总含量的接近程度,对正交实验中各组烘制焦山楂进行评分,评分标准见表 3。
将外观性状、气味、总有机酸含量和10种水溶性有机酸总含量作为评价指标,4个评价指标的权重均为1,对照炒制焦山楂进行综合评分,评分结果见表 4。
在烘制工艺正交实验中,因素A、B、C对各组实验结果均无显著性差异,即烘制温度、烘制时间、烘制厚度层数对于烘法炮制的质量结果皆无显著性意义。经由直观分析法,比较R值可知,烘制焦山楂各因素作用主次顺序为A>B>C。将炒制焦山楂的评分视为5分,依照综合评分值越接近5分与炒制焦山楂越接近的原则,烘法炮制焦山楂的最佳工艺为工艺8(A3B2C1),即烘制温度180 ℃、烘制时间8 min、烘制厚度层数为1层。方差分析结果见表 5。
正交实验的因素和水平设计参考了相关的文献报道[5-7],并在前期实验中进行了烘制温度(因素A)、烘制时间(因素B)和叠加层数(因素C)等单因素的考察。当烘制温度超过190 ℃时,焦山楂表面会因温度过高出现焦黑,且颜色深浅不一;而烘制温度低于150 ℃时,烘制时间超过20 min。虽然加大正交实验中各因素的水平差异可能会使实验结果产生显著性差异,但是这样却不能找到更贴近传统炒制焦山楂的烘制工艺,因此本文以及前期单因素考察结果从炮制品的外观性状、受热的均匀程度、节能、安全等方面综合考虑,最终确定了正交实验的因素和水平。
正交实验评分指标的确定:外观性状评价和总有机酸含量是2020版《中国药典》中山楂生品及炮制品规定的检查项目,因此作为评价指标。同时药典中对焦山楂的气味描述为“有焦香气”,山楂在炮制过程中会发生糖降解反应和美拉德反应,这两种反应均会产生焦香气味,炮制品气味的不同变化也能反应出炮制的程度,因此将气味列入评价指标之中。而炮制过程中山楂中其他部分热不稳定性化学成分也会发生改变,有机酸作为山楂的主要药效成分,尤其是水溶性有机酸成分受热后变化更加显著,因此水溶性有机酸的含量也被列入了评价指标之中。本文中选取了山楂中含量较高或对人体有益的10种水溶性有机酸成分进行含量测定,其中包括人体三羧酸循环(TAC Cycle)的重要代谢中间产物的苹果酸和柠檬酸[8-10],对于肾脏有显著的保护作用以及抑制结肠癌增殖[11-12]的没食子酸,具有减轻神经炎症、抑制艾氏腹水癌细胞等药理作用[13-15]的原儿茶酸等。
本文将正交实验与电子鼻、HPLC法等分析技术相结合,从炮制品的外观性状、气味、总有机酸含量和10种水溶性有机酸总含量4个方面综合评价,初步优选出与炒制焦山楂最为接近的焦山楂烘制工艺,为山楂烘制工艺的进一步规范提供参考。
| [1] |
戴衍朋, 孙立立, 张泰. 山楂炮制法古今沿革及对相关问题的思考[A]. 2010中药炮制技术、学术交流暨产业发展高峰论坛论文集[C]. 中华中医药学会, 2010: 87-92. DAI Y P, SUN L L, ZHANG T. Ancient and modern evolution of hawthorn processing method and thoughts on related problems[A]. Proceedings of 2010 Chinese medicine processing technology, academic exchange and Industrial Development Summit Forum[C]. China Association of Chinese Medicine, 2010: 87-92. |
| [2] |
周艳, 苌建峰, 葛佳文. 不同烘制温度对山楂炮制品有机酸含量的影响[J]. 中国军转民, 2011, 12(3): 71, 77. ZHOU Y, CHANG J F, GE J W. Effects of different baking temperatures on organic acid content of hawthorn processed products[J]. Defence Industry Conversion in China, 2011, 12(3): 71, 77. |
| [3] |
宋艺君, 樊怡媛, 郭涛, 等. 均匀设计法优选焦山楂饮片微波炮制工艺[J]. 西北药学杂志, 2016, 31(1): 32-34. SONG Y J, FAN Y Y, GUO T, et al. Optimization of the processing technology for cokecrataegi fructus by uniform design method[J]. Northwest Pharmaceutical Journal, 2016, 31(1): 32-34. |
| [4] |
国家药典委员会. 中华人民共和国药典(一部), 2020, 33. Chinese Pharmacopoeia Commission. Pharmacopoeia of the people's republic of China(vol. 1)[J]. Beijing: China Medical Science and Technology Press, 2020, 33. |
| [5] |
朱翠霞, 康大力. 山楂烘法炮制工艺初探[J]. 海峡药学, 2007, 19(12): 67-68. ZHU C X, KANG D L. Baking process of fructus crataegi[J]. Strait Pharmaceutical Journal, 2007, 19(12): 67-68. |
| [6] |
魏运姣, 赵熠, 宋红萍, 等. 正交设计法研究法半夏的炮制工艺[J]. 中国医院药学杂志, 2013, 33(2): 134-136, 150. WEI Y J, ZHAO Y, SONG H P, et al. Study on the processing technology of rhizoma pinelliae preparation by orthogonal design[J]. Chinese Journal of Hospital Pharmacy, 2013, 33(2): 134-136, 150. |
| [7] |
张姗姗, 姚梦雪, 范兰兰, 等. 多指标综合评分法正交实验优选菊花的炒制工艺[J]. 天津中医药大学学报, 2020, 39(5): 570-575. ZHANG S S, YAO M X, FAN L L, et al. Optimization of frying technology of chrysanthemum by orthogonal test with multi-index comprehensive scoring method[J]. Journal of Tianjin University of Traditional Chinese Medicine, 2020, 39(5): 570-575. |
| [8] |
陈牧, 刘锐, 翁屹. 三羧酸循环的发现与启示[J]. 医学与哲学(A), 2012, 33(1): 71-73. CHEN M, LIU R, WENG Y. The discovery and revelation of tricarboxylic acid cycle[J]. Medicine & Philosophy, 2012, 33(1): 71-73. |
| [9] |
冀东. 炎症和抗炎环境下三羧酸循环对线粒体功能的影响[D]. 上海: 上海海洋大学, 2020. JI D. Effects of tricarboxylic acid cycle on mitochondrial function in inflammatory and anti-inflammatory environments[D]. Shanghai: Shanghai Ocean University, 2020. |
| [10] |
姚明鹤, 闫海峰, 王静, 等. 基于网络药理学探讨荷丹片治疗高脂血症的作用机制[J]. 天津中医药大学学报, 2021, 40(6): 783-789. YAO M H, YAN H F, WANG J, et al. Network pharmacology-based molecular mechanisms of Hedan Tablets for hyperlipidemia regression[J]. Journal of Tianjin University of Traditional Chinese Medicine, 2021, 40(6): 783-789. |
| [11] |
LEE J H, PARK M, JUNG K, et al. Identification of Gallic acid as a active ingredient of syzygium aromaticum against tacrolimus-induced damage in renal epithelial LLC-PK1 cells and rat kidney[J]. Bioorganic & Medicinal Chemistry Letters, 2021, 41: 128012. |
| [12] |
LIN X M, WANG G F, LIU P, et al. Gallic acid suppresses colon cancer proliferation by inhibiting SRC and EGFR phosphorylation[J]. Experimental and Therapeutic Medicine, 2021, 21(6): 638. |
| [13] |
XI Z Y, XU C X, CHEN X, et al. Protocatechuic acid suppresses microglia activation and facilitates M1 to M2 phenotype switching in intracerebral hemorrhage mice[J]. Journal of Stroke and Cerebrovascular Diseases, 2021, 30(6): 105765. |
| [14] |
蒋昊. HPLC法测定山楂炮制前后10种有机酸成分的含量[J]. 天津中医药, 2021, 38(7): 935-940. JIANG H. Content determination of ten organic acids in Crataegus pinnatifida before and after processing by HPLC[J]. Tianjin Journal of Traditional Chinese Medicine, 2021, 38(7): 935-940. |
| [15] |
瞿璐, 王剑丽, 黄培建, 等. 莫哈韦丝兰化学成分的研究[J]. 天津中医药大学学报, 2019, 38(3): 279-283. QU L, WANG J L, HUANG P J, et al. Study on the constituents of Yucca schidigera Roezl (Mojave)[J]. Journal of Tianjin University of Traditional Chinese Medicine, 2019, 38(3): 279-283. |
 2022, Vol. 39
2022, Vol. 39