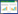文章信息
- 马中岭, 刘鑫, 汪玉凤
- MA Zhongling, LIU Xin, WANG Yufeng
- 基于PI3K/Akt/NF-κB途径探究补肾活血方治疗子宫内膜异位症的作用机制研究
- Study on the mechanism of Bushen Huoxue Recipe in the treatment of endometriosis based on PI3K/Akt/NF-κB pathway
- 天津中医药, 2022, 39(6): 771-777
- Tianjin Journal of Traditional Chinese Medicine, 2022, 39(6): 771-777
- http://dx.doi.org/10.11656/j.issn.1672-1519.2022.06.20
-
文章历史
- 收稿日期: 2022-01-07
子宫内膜异位症(EMS)是一种临床常见的妇科疾病,因子宫内膜组织发生转移、侵袭,定植在宫腔以外部位造成,患者常有痛经、不孕、月经不调、盆腔包块等症状,该病发病率高,影响着全球范围内5%~10%的育龄妇女,严重威胁着女性身体健康和生活质量[1-2]。目前,西医学临床治疗主要采用药物和手术两种疗法,长期药物疗法可能加重肝肾功能损伤,而手术切除病灶后仍具有一定的复发率,临床疗效欠佳[3]。中医认为,肾虚血瘀、肾阳不足、瘀毒阻络是诱发EMS的主要原因,因此,对于EMS的治疗,应以补肾活血、祛瘀解毒法为主,研究表明,补肾活血方(BSHXR)联合西药对EMS术后的疗效确切,可提高治疗效果,改善患者生活质量,显著减轻患者的临床症状,降低EMS的复发率,然而BSHXR对EMS的治疗作用机制尚不清楚[4-5]。磷脂酰肌醇3-激酶(PI3K)/蛋白激酶B(Akt)/核因子κB(NF-κB)途径是一种密切参与到细胞生长繁殖、运动、代谢和免疫应答调节的信号通路,多在恶性肿瘤疾病中呈激活状态[6-7]。研究表明,EMS虽是良性妇科疾病,但其特点与恶性肿瘤的转移侵袭能力相似,同样,PI3K途径也与子宫内膜异位症的发病密切相关,该途径的激活可诱导血管内皮细胞生长,加速EMS的发展进程[8]。因此,本研究以PI3K/Akt/NF-κB途径为切入点,研究BSHXR对EMS大鼠的治疗作用及其作用机制。
1 材料和方法 1.1 实验动物SPF级SD大鼠60只,健康未孕雌性,体质量(250±20)g,购自北京维通利华实验动物技术有限公司[SCXK(京)2016-0006]。动物饲养于青海大学医学院动物实验中心标准动物房,饲养条件:室温(22±1)℃,湿度50%±10%,每日定时换气,保持12 h∶12 h光暗照明,自由采食、饮水。
1.2 主要试剂与仪器BSHXR由熟地黄6 g,枫香脂10 g,人工麝香10 g,蛴螬10 g,土鳖虫10 g,五灵脂6 g,制何草乌6 g,乳香10 g,虻虫10 g,当归6 g组成,由本院药剂科制备成含生药量2 g/mL的水煎液;PI3K抑制剂LY294002(英国Abcam公司,货号:ab120243);肿瘤坏死因子-α(TNF-α)、白细胞介素-1β(IL-1β)、白细胞介素-6(IL-6)ELISA检测试剂盒(武汉伊莱瑞特生物科技股份有限公司,货号:E-EL-R2856c、E-EL-R0012c、E-EL-R0896c);RevertAidTM first Strand cDNA Synthesis Kit、SYBR Green Real-Time PCR Master Mixes(美国Thermo scientific公司,货号:K1621、K0252);血小板-内皮细胞黏附分子(CD31)、磷脂酰肌醇3-激酶(PI3K)、磷酸化磷脂酰肌醇3-激酶(p-PI3K)、蛋白激酶B(Akt)、磷酸化蛋白激酶B(p-AKT)、核因子κB(NF-κB)p65兔单抗(美国CST公司,货号:77699、17366、17366、4685、4060、8242);辣根过氧化物酶标记的山羊抗兔免疫球蛋白G(IgG)(IgG-HRP)(上海碧云天生物技术有限公司,货号:A0208);双板垂直电泳仪(北京六一仪器厂,型号:DYCZ-24KS);显微镜(日本奥林巴斯,型号:IX53);多功能凝胶成像系统(Syngene,型号:G:BOX);7500型PCR仪(美国Applied Biosystems公司);酶标仪(Thermo Fisher Scientific公司,型号:Multiskan MK3)。
1.3 实验方法 1.3.1 造模方法参考文献方法建立EMS大鼠模型[9]:大鼠适应性喂养1周后,腹腔注射2.5%戊巴比妥钠溶液麻醉,固定、备皮、消毒,在下腹正中处打开腹腔,分离子宫,剪取右侧子宫角的部分组织并剥离子宫内膜,用活检穿孔器取2个面积为5 mm×5 mm的片段,移植于肠系膜动脉血管处,尽量远离切口。使用庆大霉素冲洗腹腔,逐层关腹,缝合切口。术后3 d内,大鼠腹腔注射0.1 mL庆大霉素防止感染。造模4周后,开腹观察大鼠移植物呈椭圆形或圆形的囊性结节,高度≥2 mm,并且表面有大量血管形成,与周围组织黏连紧密,表明造模成功,共成功造模50只大鼠。
1.3.2 分组与给药将建模成功的EMS大鼠随机分为模型组、BSHXR高、中、低剂量组、LY294002组,每组10只,另取10只大鼠作为假手术组,仅开腹剪开子宫组织,随后缝合。造模4周后开始给药,按照人与大鼠体表面积折算等效剂量,中剂量为7.56 g/kg,高剂量为15.12 g/kg,低剂量为3.78 g/kg,BSHXR低、中、高剂量组大鼠按照上述剂量灌胃给药,假手术组和模型组大鼠灌胃等体积0.9%氯化钠溶液,LY294002组大鼠腹腔注射0.04 g/kg的LY294002溶液,每日1次,连续28 d。
1.3.3 EMS大鼠异位子宫内膜病灶体积检测末次给药后24 h,使用游标卡尺测量各组大鼠异位子宫内膜病灶的体积。处死大鼠后,腹主动脉取血,置于4 ℃冰箱中静置3 h,然后3 000 r/min,离心15 min(离心半径为12.5 cm),取上清液,用于ELISA试剂盒检测。剥离大鼠子宫,假手术组分离正常子宫内膜组织,其余各组大鼠分离异位子宫内膜组织,生理盐水清洗后取1 g用于实时荧光定量聚合酶链反应(RT-qPCR)及Western blot检测,其余组织放置于4%多聚甲醛溶液固定,用于苏木精-伊红(HE)和免疫组化染色。
1.3.4 HE染色观察异位子宫内膜灶组织病理变化将大鼠子宫内膜组织在4%多聚甲醛溶液中固定48 h后,蒸馏水清洗,梯度乙醇脱水,石蜡包埋,作4 μm组织切片,二甲苯脱蜡30 min,梯度乙醇及蒸馏水中复水,HE染色,脱水、透明后中性树胶封片,光镜下观察大鼠异位子宫内膜组织病理变化。
1.3.5 ELISA法检测血清TNF-α、IL-1β和IL-6的水平取各组大鼠血清,严格按照试剂盒说明书步骤检测TNF-α、IL-1β、IL-6水平。
1.3.6 免疫组化检测异位子宫内膜组织CD31表达取1.3.3中制备的组织石蜡切片,组织切片首先进行烤片、脱蜡、复水,然后抗原修复、封闭,滴加稀释的CD31兔单抗(稀释比例为1∶100),放入湿盒中4 ℃过夜,次日滴加羊抗兔二抗37℃孵育30 min,磷酸盐缓冲液(PBS)冲洗后滴加DAB显色液,苏木精染细胞核,梯度乙醇脱水,中性树胶封片,每组切片于光镜下拍摄5个视野,通过Image J软件统计获得CD31阳性细胞比率并取平均值,LSD-t检验分析不同组间CD31阳性表达差异。
1.3.7 RT-qPCR检测异位子宫内膜组织VEGF及MMP-9 mRNA水平取大鼠异位子宫内膜组织,加入Trizol裂解液提取总RNA,使用逆转录试剂盒合成cDNA作为荧光定量模版。引物序列见表 1。反应条件为:95 ℃预变性5 min,95 ℃变性30 s、62 ℃退火30 s、72 ℃延伸30 s,共40个循环,最后72 ℃延伸10 min,4 ℃ 5 min终止反应,实验重复3次。采用2-ΔΔCT法计算目的基因mRNA相对表达水平。
取大鼠异位子宫内膜组织,研磨匀浆后加入裂解液提取组织蛋白,测定蛋白浓度,蛋白中加入loading buffer,混匀后置于沸水中煮沸5 min使蛋白变性,然后进行SDS-PAGE电泳,转膜、封闭后将聚偏二氟乙烯(PVDF)膜放入各一抗稀释液中,稀释比例均为1∶1 000,4 ℃过夜,次日以TBST清洗后加入羊抗兔二抗(1∶2 000)37 ℃孵育2 h,洗膜,滴加发光液,置凝胶成像仪显影。以甘油醛-3-磷酸脱氢酶(GAPDH)为内参蛋白,采用Image J软件分析各蛋白对应的灰度值,计算蛋白的相对表达量,蛋白相对表达量=目的蛋白灰度值/GAPDH蛋白灰度值。
1.4 统计学分析应用SPSS 25.0统计软件进行统计学分析,计量资料以均数±标准差(x±s)表示,多组间比较采用单因素方差分析,两两比较采用LSD-t检验。P<0.05为差异有统计学意义。
2 结果 2.1 BSHXR对EMS大鼠异位子宫内膜病灶体积的影响结果显示,假手术组大鼠无异位的子宫内膜组织,模型组可见明显异位子宫内膜病灶形成。与模型组比较,BSHXR低、中、高剂量组大鼠及LY294002组大鼠异位子宫内膜病灶体积均减小,其中,BSHXR降低异位子宫内膜病灶体积的作用呈剂量依赖性,差异有统计学意义(P<0.05)。BSHXR高剂量组与LY294002组比较,差异无统计学意义(P>0.05)。见图 1。
|
| 注:与假手术组比较,*P<0.05;与模型组比较,#P<0.05;与BSHXR低剂量组比较,△P<0.05;与BSHXR中剂量组比较,▲P<0.05。 图 1 BSHXR对EMS大鼠异位子宫内膜体积的影响 Fig. 1 Effect of BSHXR on the volume of ectopic endometrium in EMS rats |
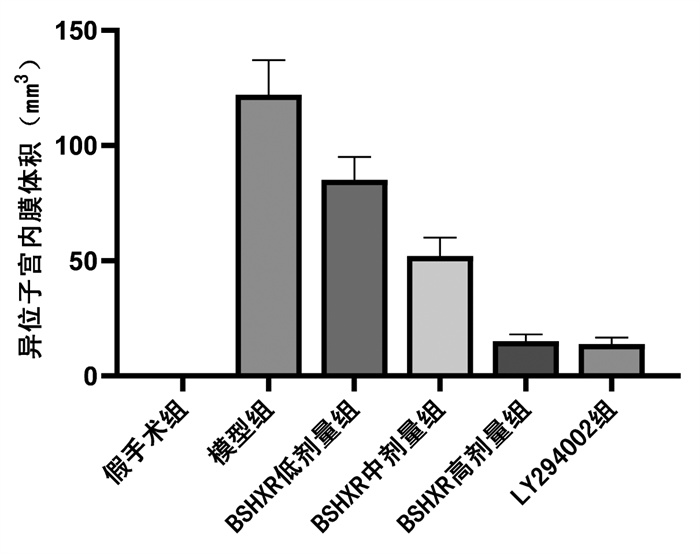
HE染色显示,假手术组大鼠子宫内膜组织完整,上皮细胞排列整齐、有序,细胞核较小,腺体数量和形态正常。与假手术组比较,模型组大鼠异位子宫内膜组织腺上皮细胞和基质细胞密集,细胞核较大,胞浆丰富,腺腔完整。与模型组比较,BSHXR低、中、高剂量组及LY294002组腺上皮细胞胞核体积缩小、不规则,排列松散,形态逐渐变为单层柱状,内膜腺上皮层变薄。见图 2。
|
| 图 2 HE染色观察各组大鼠子宫内膜组织病理学变化(HE×400) Fig. 2 The histopathological changes of endometrium of rats in each group(HE staining×400) |
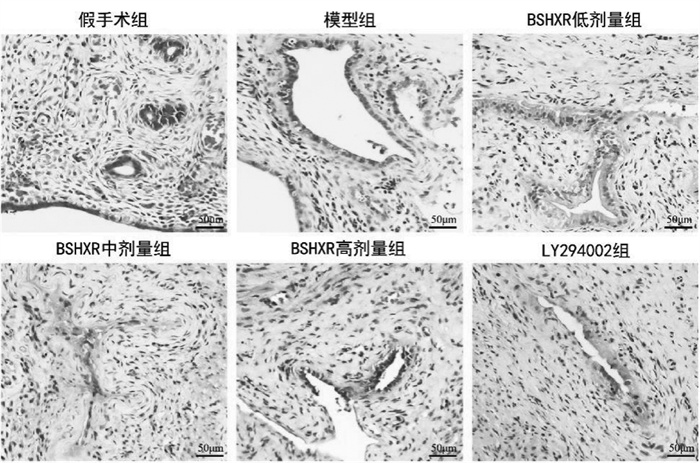
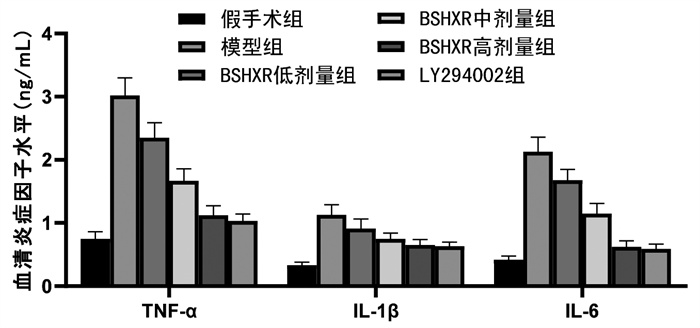
结果显示,模型组大鼠血清炎症因子TNF-α、IL-1β、IL-6的水平显著高于假手术组,BSHXR低、中、高剂量组大鼠及LY294002组大鼠血清炎症因子TNF-α、IL-1β、IL-6的水平均低于模型组,BSHXR各剂量组之间呈剂量依赖性,差异有统计学意义(P<0.05)。BSHXR高剂量组炎症因子TNF-α、IL-1β、IL-6的水平与LY294002组比较,差异无统计学意义(P>0.05)。见图 3。
|
| 注:与假手术组比较,*P<0.05;与模型组比较,#P<0.05;与BSHXR低剂量组比较,△P<0.05;与BSHXR中剂量组比较,▲P<0.05。 图 3 各组大鼠血清炎症因子水平比较 Fig. 3 Comparison of serum inflammatory factors of rats in each group |
与假手术组比较,模型组大鼠异位子宫内膜组织中CD31阳性细胞比例显著增加,与模型组比较,BSHXR低、中、高剂量组CD31阳性细胞比例呈剂量依赖性降低,差异有统计学意义(P<0.05)。BSHXR高剂量组CD31阳性细胞比例与LY294002组比较,差异无统计学意义(P>0.05)。见图 4。
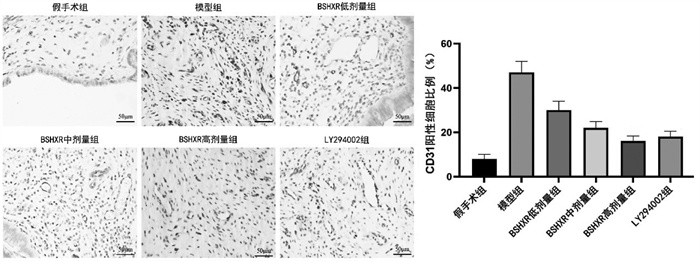
|
| 注:与假手术组比较,*P<0.05;与模型组比较,#P<0.05;与BSHXR低剂量组比较,△P<0.05;与BSHXR中剂量组比较,▲P<0.05。 图 4 各组大鼠异位子宫内膜组织CD31表达水平比较(IHC,×400) Fig. 4 Comparison of CD31 expression in ectopic endometrium of rats in each group (IHC, ×400) |
结果显示,模型组大鼠异位子宫内膜组织VEGF、MMP-9 mRNA水平显著高于假手术组,BSHXR低、中、高剂量组VEGF、MMP-9 mRNA水平低于模型组,BSHXR各剂量组之间呈剂量依赖性,差异有统计学意义(P<0.05)。BSHXR高剂量组VEGF、MMP-9 mRNA水平与LY294002组比较,差异无统计学意义(P>0.05)。见图 5。
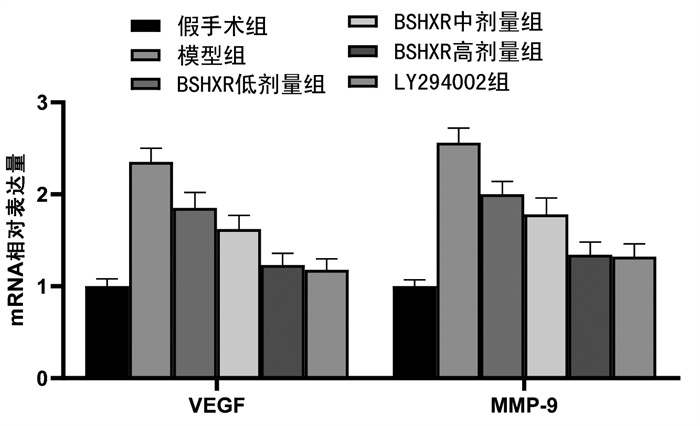
|
| 注:与假手术组比较,*P<0.05;与模型组比较,#P<0.05;与BSHXR低剂量组比较,△P<0.05;与BSHXR中剂量组比较,▲P<0.05。 图 5 各组大鼠异位子宫内膜组织VEGF、MMP-9 mRNA水平比较 Fig. 5 Comparison of VEGF and MMP-9 mRNA levels in ectopic endometrium of rats in each group |
与假手术组比较,模型组大鼠PI3K、Akt磷酸化水平显著增加,胞核中NF-κB p65表达增加,胞质中NF-κB p65表达减少(P<0.05)。与模型组比较,BSHXR低、中、高剂量组及LY294002组PI3K、Akt磷酸化水平降低,胞核中NF-κB p65表达降低,胞质中NF-κB p65表达增加,且BSHXR的作用呈剂量依赖性(P<0.05)。BSHXR高剂量组PI3K、Akt磷酸化水平和NF-κB p65表达与LY294002组比较,差异无统计学意义(P>0.05)。见图 6。
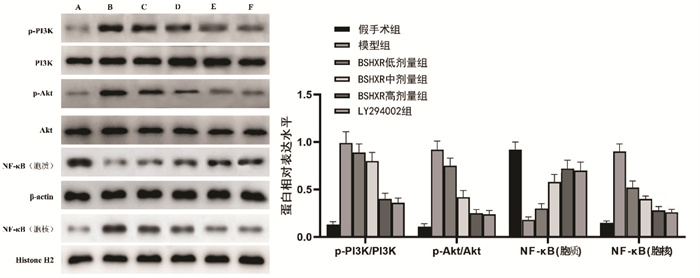
|
| 注:A.假手术组;B.模型组;C.BSHXR低剂量组;D.BSHXR中剂量组;E.BSHXR高剂量组;F.LY294002组。与假手术组比较,*P<0.05;与模型组比较,#P<0.05;与BSHXR低剂量组比较,△P<0.05;与BSHXR中剂量组比较,▲P<0.05。 图 6 各组大鼠异位子宫内膜组织PI3K/Akt/NF-κB通路蛋白表达水平比较 Fig. 6 Comparison of PI3K/Akt/NF-κB pathway protein expression levels in ectopic endometrial tissues of rats in each group |
EMS属于临床常见的良性妇科疾病,生育期女性的发病率较高,该病症状易反复且顽固,包括痛经、性交疼痛、月经异常、不孕等,发病易累及盆腔器官甚至全身组织,不仅损害患者个人身体健康,给患者家庭及中国卫生系统也带来较大的经济负担[10-11]。EMS属中医“癥瘕”“不孕”“月经不调”等范畴,血瘀和肾虚分别是EMS的关键病机和根本病机,血瘀和肾虚互为因果,相互影响,共同促进EMS的发生和发展[5]。已有多项研究表明,以补肾活血法治疗EMS可显著改善患者月经异常、经期腹痛等症状,降低雌激素水平,提高患者生活质量,但其具体作用机制尚不清楚[12-13]。本研究所用BSHXR由熟地黄、枫香脂、当归、制草乌、人工麝香、土鳖虫、蛴螬、五灵脂、虻虫、乳香等药材组成,具有温通补肾、活血化瘀之功效。本研究旨在通过EMS模型大鼠观察BSHXR对EMS的治疗作用,探究其作用机制。
本研究结果显示,模型组大鼠可见明显异位子宫内膜组织,病理切片显示该组大鼠异位子宫内膜组织上皮细胞排列相对整齐,细胞核增大,腺腔完整,表明造模成功。使用高、中、低剂量BSHXR治疗后,大鼠异位子宫内膜病灶体积均降低,且大鼠异位子宫内膜上皮细胞形态逐渐变为单层柱状,腺体数量和基质细胞的数量减少,表明BSHXR对EMS具有治疗作用,与既往研究结果一致[14]。研究表明,EMS的发生与腹腔免疫监视功能降低和炎症反应增加密切相关,改善机体炎症反应能够抑制异位子宫内膜病灶的生长[15]。TNF-α、IL-1β、IL-6均是参与机体免疫应答、具有广泛免疫调节的促炎细胞因子,具有促进异位内膜及间质细胞的增殖、侵袭、转移及促进血管生成的作用,可导致盆腔局部组织黏连及纤维化,促使EMS异位子宫内膜病灶的形成[16-17]。本研究结果显示,模型组大鼠血清炎症因子TNF-α、IL-1β、IL-6水平显著升高,使用不同剂量BSHXR治疗后,大鼠血清中TNF-α、IL-1β、IL-6水平均降低,表明BSHXR可减轻EMS大鼠炎症反应。
现代研究认为,EMS的发生发展均涉及细胞的黏附、侵袭和血管形成过程,因此,抑制细胞异常的黏附、侵袭和血管形成过程已成为预防EMS的关键[18]。MMPs和VEGF是异位子宫内膜在盆腔病变的关键因子,其中,MMP-9是基质金属蛋白酶家族中活性最强的一员,可降解细胞外基质成分,促进EMS的侵袭和血管形成过程,而EMS患者MMP-9基因的表达水平也往往呈异常增高的状态,该基因的水平可作为评估EMS严重程度的指标[19]。VEGF是一种强效特异性血管生成因子,可直接作用于内皮细胞而促进血管新生,加快在位子宫内膜异常转移及异位子宫内膜的增生[20]。CD31是内皮细胞特异性标志物,常用于反映血管生成情况[21]。本研究结果显示,模型组大鼠异位子宫内膜组织CD31阳性细胞比例升高,VEGF、MMP-9 mRNA水平亦显著升高,使用BSHXR低、中、高剂量治疗后,大鼠异位子宫内膜组织中CD31阳性细胞比例和VEGF、MMP-9 mRNA水平均降低,表明BSHXR治疗EMS的机制之一可能是抑制CD31、VEGF及MMP-9的表达,抑制EMS黏附、侵袭和血管形成过程。
PI3K/Akt/NF-κB信号通路是一种密切参与到细胞生长繁殖、运动、代谢和免疫应答调节的信号通路,几乎所有人类和动物肿瘤疾病中均发现了其被活化的现象[22]。PI3K是生长因子受体超家族信号传导途径的关键分子,可被生长因子、细胞因子和激素与受体酪氨酸激酶和G蛋白偶联受体结合而激活,激活后的PI3K可进一步活化下游的Akt,而PI3K/Akt通路的表达改变会影响IκB的表达水平,由于IκB是NF-κB的抑制性因子,因此当IκB被抑制后可促进NF-κB的活化,并进一步引起炎症因子释放[23-24]。研究表明,PI3K相关信号转导途径在EMS中发挥重要作用,抑制该信号通路的活化可改善大鼠EMS相关症状[25]。在本研究中,模型组大鼠PI3K、Akt磷酸化水平显著增加,NF-κB p65转移入核水平增加,使用BSHXR低、中、高剂量治疗后,大鼠异位子宫内膜中PI3K、Akt磷酸化水平降低,NF-κB p65入核减少。为了进一步探究BSHXR治疗EMS的作用机制,本研究同时使用了PI3K抑制剂LY294002。LY294002是PI3K的选择性抑制剂,可阻断该通路上部分基因和蛋白表达,有研究表明,LY294002可通过抑制PI3K通路对EMS动物产生治疗作用,抑制上皮间质细胞的活性,促进细胞凋亡[26-27]。与上述研究结果一致,本研究结果显示,LY294002对EMS大鼠的治疗作用与BSHXR高剂量组比较,差异无统计学意义(P > 0.05),提示BSHXR对EMS的治疗作用可能是通过抑制PI3K/Akt/NF-κB信号通路活化产生的。
综上所述,BSHXR可抑制PI3K/Akt/NF-κB信号通路的活化,缩小异位子宫内膜病灶体积,改善异位子宫内膜病理学变化,抑制炎症反应及血管新生过程,下调VEGF和MMP-9的表达。本研究初步揭示了BSHXR治疗EMS的作用机制,但EMS是一种多因素疾病,病机复杂,其疗效及作用机制仍需进一步结合体外实验及临床研究加以阐明。
| [1] |
TAYLOR H S, KOTLYAR A M, FLORES V A. Endometriosis is a chronic systemic disease: Clinical challenges and novel innovations[J]. The Lancet, 2021, 397(10276): 839-852. DOI:10.1016/S0140-6736(21)00389-5 |
| [2] |
URITS I, SCHWARTZ R, HERMAN J, et al. A comprehensive update of the superior hypogastric block for the management of chronic pelvic pain[J]. Current Pain and Headache Reports, 2021, 25(3): 13. DOI:10.1007/s11916-020-00933-0 |
| [3] |
GUPTA S, GAVARD J A, KRAUS E, et al. Endometriosis in hydatid cysts of morgagni: A retrospective cohort study of another atypical manifestation of endometriosis[J]. Journal of Minimally Invasive Gynecology, 2017, 24(4): 653-658. DOI:10.1016/j.jmig.2017.02.011 |
| [4] |
何珏, 胡国华. 子宫内膜异位症(子宫腺肌病)痛经的中医治疗方法研究进展[J]. 中华中医药学刊, 2017, 35(3): 692-695. HE J, HU G H. Progress on TCM treatment for dysmenorrhea due to endometriosis (adenomyosis)[J]. Chinese Archives of Traditional Chinese Medicine, 2017, 35(3): 692-695. |
| [5] |
李友云, 张丽, 王永超. 补肾活血方联合米非司酮治疗子宫内膜异位症术后的临床研究[J]. 中华中医药学刊, 2019, 37(4): 1021-1024. LI Y Y, ZHANG L, WANG Y C. To observe the effect of self designedbushenhuoxuefang combined with mifepristone in the treatment of endometriosis patients after gynecological laparoscopy[J]. Chinese Archives of Traditional Chinese Medicine, 2019, 37(4): 1021-1024. |
| [6] |
LING D Y, ZHAO Y, ZHANG Z W, et al. Morphine inhibits the promotion of inflammatory microenvironment on chronic tibial cancer pain through the PI3K-Akt-NF-κB pathway[J]. American Journal of Translational Research, 2020, 12(10): 6868-6878. |
| [7] |
ZENG M L, SU Y, LI K Y, et al. Gallic acid inhibits bladder cancer T24 cell progression through mitochondrial dysfunction and PI3K/Akt/NF-κB signaling suppression[J]. Frontiers in Pharmacology, 2020, 11: 1222. DOI:10.3389/fphar.2020.01222 |
| [8] |
MA T Y, LIU P W, WEI J P, et al. Imperatorin alleviated endometriosis by inhibiting the activation of PI3K/Akt/NF-κB pathway in rats[J]. Life Sciences, 2021, 274: 119291. DOI:10.1016/j.lfs.2021.119291 |
| [9] |
JAMALI N, ZAL F, MOSTAFAVI-POUR Z, et al. Ameliorative effects of quercetin and metformin and their combination against experimental endometriosis in rats[J]. Reproductive Sciences, 2021, 28(3): 683-692. DOI:10.1007/s43032-020-00377-2 |
| [10] |
YANG X J. Telocytes in inflammatory gynaecologic diseases and infertility[J]. Advances in Experimental Medicine and Biology, 2016, 913: 263-285. |
| [11] |
ÖZEL Ş, SÜNTAR İ, ERCAN GÖKAY N, et al. The effectiveness of Teucrium chamaedrys L. extracts on endometriotic implant regression in rat endometriosis model[J]. Veterinary Research Forum: an International Quarterly Journal, 2020, 11(4): 305-309. |
| [12] |
钟志艳, 黄冬梅, 黄光英. 补肾活血法治疗不孕症评述[J]. 中医学报, 2019, 34(1): 47-53. ZHONG Z Y, HUANG D M, HUANG G Y. Review on the treatment of infertility with bushenHuoxue method[J]. Acta Chinese Medicine, 2019, 34(1): 47-53. |
| [13] |
王靖雯, 夏亲华. 夏亲华教授以补肾调周法行卵巢子宫内膜异位症术后助孕的经验探析[J]. 浙江中医药大学学报, 2020, 44(2): 173-177. WANG J W, XIA Q H. Empirical analysis of professor XIA Qinhua on assisting pregnancy of postoperative ovarian endometriosis by tonifying kidney and regulating menstruation[J]. Journal of Zhejiang Chinese Medical University, 2020, 44(2): 173-177. |
| [14] |
周华, 齐聪, 杨红, 等. 补肾活血方对大鼠子宫内膜细胞病理形态学及凋亡的影响[J]. 上海中医药大学学报, 2012, 26(6): 96-100. ZHOU H, QI C, YANG H, et al. Effect of "reinforcing kidney and activating blood recipe" on pathomorphology and apoptosis of endometrial cell in rats[J]. Acta Universitatis TraditionisMedicalis Sinensis Pharmacologiaeque Shanghai, 2012, 26(6): 96-100. |
| [15] |
LAGANÀ A S, GARZON S, GÖTTE M, et al. The pathogenesis of endometriosis: Molecular and cell biology insights[J]. International Journal of Molecular Sciences, 2019, 20(22): E5615. DOI:10.3390/ijms20225615 |
| [16] |
庄梦斐, 曹阳, 谢丹丹, 等. 温经汤对子宫内膜异位症小鼠异位内膜生长及炎症因子水平的影响[J]. 中医学报, 2020, 35(5): 1040-1044. ZHUANG M F, CAO Y, XIE D D, et al. Effect of Wenjing Decoction on the growth of ectopic endometrium and the level of inflammatory factors in mice with endometriosis[J]. Acta Chinese Medicine, 2020, 35(5): 1040-1044. |
| [17] |
KRASNYI A M, SADEKOVA A A, SEFIHANOV T G, et al. The content of cytokines IL-6, IL-8, TNF-α, IL-4 and the level of expression in macrophages CD86 and CD163 in peritoneal fluid has a reverse correlation with the degree of severity of external genital endometriosis[J]. Biomeditsinskaia Khimiia, 2019, 65(5): 432-436. DOI:10.18097/pbmc20196505432 |
| [18] |
郎景和. 对子宫内膜异位症认识的历史、现状与发展[J]. 中国实用妇科与产科杂志, 2020, 36(3): 193-196. LANG J H. Past history, current situation and progress in the knowledge of endometriosi[J]. Chinese Journal of Practical Gynecology and Obstetrics, 2020, 36(3): 193-196. |
| [19] |
KODARAHMIAN M, AMIDI F, MOINI A, et al. The modulating effects of Resveratrol on the expression of MMP-2 and MMP-9 in endometriosis women: A randomized exploratory trial[J]. Gynecological Endocrinology: the Official Journal of the International Society of Gynecological Endocrinology, 2019, 35(8): 719-726. DOI:10.1080/09513590.2019.1576612 |
| [20] |
RASHIDI B H, SARHANGI N, AMINIMOGHADDAM S, et al. Association of vascular endothelial growth factor (VEGF) Gene polymorphisms and expression with the risk of endometriosis: A case-control study[J]. Molecular Biology Reports, 2019, 46(3): 3445-3450. DOI:10.1007/s11033-019-04807-6 |
| [21] |
SASS F A, SCHMIDT-BLEEK K, ELLINGHAUS A, et al. CD31+ cells from peripheral blood facilitate bone regeneration in biologically impaired conditions through combined effects on immunomodulation and angiogenesis[J]. Journal of Bone and Mineral Research: the Official Journal of the American Society for Bone and Mineral Research, 2017, 32(5): 902-912. DOI:10.1002/jbmr.3062 |
| [22] |
FRUMAN D A, CHIU H, HOPKINS B D, et al. The PI3K pathway in human disease[J]. Cell, 2017, 170(4): 605-635. DOI:10.1016/j.cell.2017.07.029 |
| [23] |
YOON J H, SHIN J W, PHAM T H, et al. Methyl lucidone induces apoptosis and G2/M phase arrest via the PI3K/Akt/NF-κB pathway in ovarian cancer cells[J]. Pharmaceutical Biology, 2020, 58(1): 51-59. DOI:10.1080/13880209.2019.1701044 |
| [24] |
李玲, 吕惠卿. 黄连素抑制小鼠CXCL-12/CXCR-4/PI3K/AKT/NF-κB通路防治NASH的作用研究[J]. 浙江中医药大学学报, 2018, 42(11): 941-950. LI L, LYU H Q. Research on the effect of inhibition the CXCL-12/CXCR-4/PI3K/AKT/NF-κB pathway by berberine in NASH mice[J]. Journal of Zhejiang Chinese Medical University, 2018, 42(11): 941-950. |
| [25] |
MA T Y, LIU P W, WEI J P, et al. Imperatorin alleviated endometriosis by inhibiting the activation of PI3K/Akt/NF-κB pathway in rats[J]. Life Sciences, 2021, 274: 119291. DOI:10.1016/j.lfs.2021.119291 |
| [26] |
BAI J H, XU Y E, DIEO Y, et al. Combined low-dose LiCl and LY294002 for the treatment of osteoporosis in ovariectomized rats[J]. Journal of Orthopaedic Surgery and Research, 2019, 14(1): 177. DOI:10.1186/s13018-019-1210-1 |
| [27] |
张亚萍, 李卫红, 李婧, 等. 蠲痛饮对子宫内膜异位症大鼠PI3K/Akt/mTOR信号通路蛋白的影响[J]. 中国实验方剂学杂志, 2019, 25(16): 24-30. ZHANG Y P, LI W H, LI J, et al. Effect of Juantong Decoction on PI3K/Akt/mTOR signaling pathway proteins in rats with endometriosis[J]. Chinese Journal of Experimental Traditional Medical Formulae, 2019, 25(16): 24-30. |
 2022, Vol. 39
2022, Vol. 39