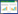文章信息
- 李连瑞, 陈志勇, 刘婕, 李天祥
- LI Lianrui, CHEN Zhiyong, LIU Jie, LI Tianxiang
- 乾坤丹Ⅵ号对糖尿病肾病模型大鼠的疗效及作用机制研究
- Effect and mechanism of Qiankun Dan Ⅵ on diabetic nephropathy model rats
- 天津中医药, 2022, 39(6): 778-782
- Tianjin Journal of Traditional Chinese Medicine, 2022, 39(6): 778-782
- http://dx.doi.org/10.11656/j.issn.1672-1519.2022.06.21
-
文章历史
- 收稿日期: 2022-01-13
2. 天津中医药大学中药学院,天津 301617
糖尿病肾病(DN)是糖尿病患者最常见的微血管并发症,在糖尿病人群中DN患病率约20%~40%[1]。其病理改变临床常以微量白蛋白尿/蛋白尿、肾功能减退等典型表现。研究发现在DN早期进行有效的治疗,可逆转肾脏损害,减少进入终末期肾病的发生发展[1]。目前,DN暂时仍没有特效药物,雷帕霉素是一种免疫抑制剂,是DN的常用药,通过与细胞FK506结合蛋白结合后特异性阻断雷帕霉素把分子(mTOR),参与多种免疫抑制达到肾脏保护的作用,但是研究发现雷帕霉素有明显的毒副作用[2]。在临床实践中,中医药治疗DN体现出比西药更好的优势,可延缓DN的进展。因此,本课题拟通过检测DN模型大鼠结缔组织生长因子(CTGF)、转化生长因子-β1(TGF-β1)、骨形态发生蛋白-7(BMP-7)信号通路研究乾坤丹Ⅵ号对DN的作用,明确其治疗作用及机制,为其开发上市中药复方制剂提供基础。
1 材料与方法 1.1 实验材料清洁级雄性Wistar大鼠40只,体质量(200±20)g,高糖高脂饲料均购自北京华阜康生物科技股份有限公司;注射用链佐霉素(STZ,美国Sigma公司,货号S0130);全蛋白提取试剂盒(北京索莱宝科技有限公司,货号BC3711);小鼠抗CTGF单克隆抗体(美国SANTA公司,货号sc-373936);兔抗TGF-β1单克隆抗体(美国Abcam公司,货号ab215715);小鼠抗BMP-7单克隆抗体(美国SANTA公司,货号sc-53917);ECL化学发光法检测试剂盒[小鼠免疫球蛋白G(IgG),北京索莱宝科技有限公司,货号SW2010];总RNA提取试剂盒(北京索莱宝科技有限公司,货号R1200);逆转录-聚合酶链反应(RT-PCR)试剂盒(北京索莱宝科技有限公司,货号RP1100);PCR引物由宝日医生物技术(北京)有限公司合成,引物序列为:CTGF上游:CACCCGGGTTACCAATGACA、下游:AAGGTTCTGACTCCCGACC,TGF-β1上游:CTCCCGTGGCTTCTAGTGC、下游:GCCTTAGTTTGGACAGGATCTG,BMP-7上游:GGAAGCGTGCAAGGCATTAG、下游:CTCACCGACCTCTTCTGAGC,β-actin上游:CTGAACGTGAAATTGTCCGAGA、下游:TTGCCAATGGTGATGACCTG。乾坤丹Ⅵ号由天津市北辰中医医院药剂科自行制备。
1.2 实验仪器罗氏血糖仪,LEGEND MICRO 21R台式高速冷冻离心机(美国THERMO公司),分光光度计(美国THERMO公司),StepOne Software荧光定量PCR仪(美国Applied biosystems公司),BG-subMIDI电泳仪(北京百晶生物技术有限公司),SDS-PAGE电泳系统(美国BIO-Rad公司),StepOne Software(美国UPV公司)。
1.3 动物模型制备采用雄性Wistar大鼠40只,随机抽取30只,依照文献方法[3],腹腔注射链脲佐菌素(STZ,60 mg/kg),同时给予高糖高脂饲料,建立糖尿病大鼠模型,以造模后1周糖尿病模型大鼠随机血糖≥16.7 mmol/L提示糖尿病模型建立成功;以24 h尿蛋白定量≥30 mg提示DN模型建立成功,成模率在90%以上。并随机分为模型组、乾坤丹Ⅵ号组、阳性对照组,每组10只;其余10只大鼠作为空白对照组。
1.4 药物治疗试药组灌胃给予乾坤丹Ⅵ号水溶液,通过表观分布容积计算得来,成人用量为每次12 g,每日3次,即每日36 g。成人平均体质量为60 kg,即0.6 g/(kg·d)。大鼠表观分布容积为人的6~9倍,0.6 g/(kg·d)×6=3.6 g/(kg·d)。每日用药量改为3.6 g/(kg·d),阳性对照组灌胃给予雷帕霉素[0.2 mg/(kg·d)],模型组和空白对照组给于等体积蒸馏水。连续给药12周后处死,采用促凝管腹主动脉取血,取尿液备用,取肾脏并将其分为两部分,一部分4%多聚甲醛溶液固定,另一部分置于液氮之中保存。
1.5 检测指标 1.5.1 血糖检测1.4中所采集动物血液于半径为13.5 cm离心机中3 000 r/min离心10 min,取上层血清,采用罗氏血糖仪及相应试纸,依照血糖仪说明书方法检测实验动物血清中血糖,以评价糖尿病治疗情况。
1.5.2 尿微量白蛋白检测使用上文中所采集血清,采用大鼠尿微量白蛋白(mALB)酶联免疫吸附实验(ELISA)试剂盒(货号ml059011),依照试剂盒说明书方法检测实验动物尿微量白蛋白,以评价肾功能的改变。
1.5.3 肾脏病理检测取多聚甲醛溶液固定的肾脏组织,脱水、石蜡包埋,切片,并进行苏木精-伊红(HE)染色,于显微镜400倍视野下观察肾小球病理改变情况。
1.5.4 Western blotting法检测CTGF、TGF-β1、BMP-7等因子蛋白的表达液氮保存的肾脏组织加液氮进行匀浆,加入1 mL磷酸盐缓冲液(PBS),500 ×g离心5 min;吸干残留的PBS,估计样品体积,加入5倍体积裂解液,混匀;冰浴中以最大功率超声破碎细胞(3×10 s);4 ℃,12 000 r/min离心15 min,离心半径10 cm,收集上清液;BCA蛋白定量法测定蛋白浓度根据蛋白定量结果,加入相应体积的总蛋白样品与5×蛋白质凝胶电泳上样Buffer混合,95 ℃变性10 min,立即置于冰中待用;蛋白上样Buffer将蛋白定量为5 mg/mL,-20 ℃保存备用;将样品加至制备好的SDS-PAGE电泳凝胶孔中,电泳仪设置成稳压状态,接通电源,将电压调至80 V使样品通过浓缩胶与分离胶(电压约8 V/cm);电泳使染料至分离胶适当位置,结束电泳;凝胶电泳结束后,将凝胶上分离到的蛋白条带通过转移电泳方式转印至PVDF膜。恒压状态下,65 V转膜2 h;将转好的膜(参考目的条带分子量大小)对照marker进行裁剪。小心取出转移膜置于封闭液中,室温、摇床上缓慢摇动状态下乳清蛋白封闭1 h,将封闭后的膜分别加入对应的一抗工作液中,4 ℃反应过夜,羊抗兔二抗孵育60 min,洗去游离二抗,使用ELC化学发光成像系统成像。
1.5.5 荧光定量RT-PCR法检测CTGF、TGF-β1、BMP-7 mRNA转录水平肾脏组织匀浆后,采用总RNA提取试剂盒提取总RNA,使用索莱宝反转录试剂盒进行反转录,合成cDNA。采用实时荧光定量PCR仪,以20 μL反应体系上样进行PCR反应,以β-actin为内参;反应条件为:95 ℃预变性5 min,95 ℃变性10 s,58 ℃退火20 s,72 ℃延伸20 s,共40个循环;溶解曲线95 ℃15 s、60 ℃60 s、95 ℃15 s,1循环。
1.6 统计学方法采用SPSS 21.0统计软件进行数据分析,所有结果以均数±标准差(x±s)表示。多组间比较采用单因素方差分析法,组间两两比较采用LSD-t检验,P < 0.05为差异有统计学意义。
2 结果 2.1 乾坤丹Ⅵ号对DN模型大鼠肾脏病理的改善作用HE染色结果显示,空白组大鼠肾小球饱满,肾小管上皮细胞排列规则,肾小管结构正常;模型组大鼠肾脏肾小球萎缩、变形,肾小管细胞出现空泡变性;乾坤丹Ⅵ号组与阳性对照组肾脏结构有所好转,损伤减轻。见图 1。
|
| 图 1 各组肾脏病理HE染色结果 Fig. 1 HE staining results of renal pathology in each group |
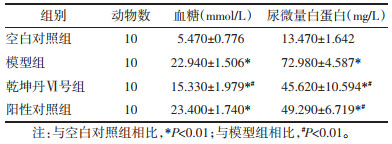
造模12周后,与空白对照组相比,模型组、乾坤丹Ⅵ号组和阳性对照组的血糖、尿微量白蛋白显著升高(P < 0.01),且显著高于阈值(随机血糖≥16.7 mmol/L,24 h尿蛋白定量≥30 mg),提示造模成功。乾坤丹Ⅵ号组与阳性对照组大鼠血糖、尿微量白蛋白显著低于模型组(P < 0.01),且低于阈值。乾坤丹Ⅵ号组与阳性对照组间血糖、尿微量白蛋白无统计学差异(P > 0.01)。见表 1。
|
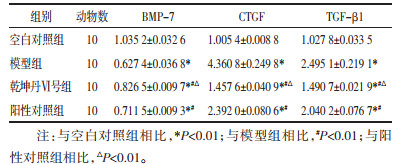
Western blot检测结果显示,与空白对照组相比,模型组、乾坤丹Ⅵ号组和阳性对照组的CTGF、TGF-β1蛋白表达量显著升高,而BMP-7蛋白表达显著下调(P < 0.01),药物治疗后,乾坤丹Ⅵ号组和阳性对照组CTGF、TGF-β1蛋白表达量较模型组显著降低,BMP-7蛋白表达量较模型组显著升高(P < 0.01),且乾坤丹Ⅵ号组CTGF、TGF-β1蛋白表达量较阳性对照组显著降低,BMP-7蛋白表达量较阳性对照组显著升高(P < 0.01)。见图 2和表 2。

|
| 注:1.空白对照组;2.模型组;3.乾坤丹Ⅵ号组;4.阳性对照组。 图 2 各组Western blot实验结果 Fig. 2 Western blot experimental results in each group |

|
Real time PCR实验结果显示,与空白对照组相比,模型组、乾坤丹Ⅵ号组和阳性对照组的CTGF、TGF-β1 mRNA转录水平显著升高,而BMP-7 mRNA转录水平显著下调(P < 0.01);药物治疗后,乾坤丹Ⅵ号组和阳性对照组CTGF、TGF-β1 mRNA转录水平较模型组显著降低,BMP-7 mRNA转录水平较模型组显著升高(P < 0.01),且乾坤丹Ⅵ号组CTGF、TGF-β1 mRNA转录水平较阳性对照组显著降低,BMP-7 mRNA转录水平较阳性对照组显著升高(P < 0.01)。见表 3。
|
DN早期没有肾脏病方面的症状,甚至尿常规检查也正常,极易漏诊。一旦出现明显的蛋白尿,肾脏的病理损伤已很难逆转。目前对DN的发病机制尚未完全阐明。研究发现足细胞的分化蛋白减少是导致DN持续发展的重要原因[3]。BMP-7是转化生长因子-β超家族成员,在肾脏发育中起重要作用。BMP-7可部分逆转糖尿病引起的肾脏肥大,恢复肾小球滤过率,使尿白蛋白排泄、肾小球组织学趋于正常。CTGF在肾小管间质损害过程中起重要作用,通过多种途径诱导肾间质纤维化形成和发展,在肾间质纤维化中起重要作用[4]。研究表明,在DN模型肾组织中,CTGF上调,BMP-7下调;CTGF抑制了BMP-7的表达,且CTGF是治疗DN的重要靶点之一[5]。TGF-β是一种具有多重生物学效应的细胞因子,参与了多种组织器官纤维化的形成[6]。TGF-β是CTGF的强效诱导物,CTGF是TGF-β的重要下游介质[7-8]。CTGF与TGF-β在肾小球病理改变中起到重要作用[9]。
目前常见的DN动物模型包括自发型、诱发型和转基因动物模型。诱发型2型DN动物模型主要模拟人类2型DN发生发展的过程,其原理为采用高脂、高糖饲料喂养大鼠1个月左右使大鼠产生胰岛素抵抗,腹腔或尾静脉注射STZ破坏大鼠胰岛细胞,使其部分丧失分泌胰岛素功能而模拟2型糖尿病的发生,在糖尿病模型成模后继续喂养4~8周,可出现DN早期特征,且成模率与存活率均 > 90%[10]。
近年来,中医药治疗DN表现出极大的优势。吕娟等[11]研究表明,当归黄芪汤可抑制糖尿病大鼠JAK2STAT3信号通路的表达,而该信号通路与氧化应激损伤有关。邓文超等[3]研究表明,黄芪水煎剂对DN大鼠肾间质Wnt/β-catenin及TGF-β1的表达也表现出抑制作用。宋恩峰等[12]研究了黄芪对DN大鼠的治疗作用,发现黄芪可治疗DN,其机制可能与降低肾组织CTGF蛋白及其mRNA的过度表达有关。因此,影响TGF-β1、CTGF、BMP-7信号通路可能是黄芪等中药治疗DN的作用机制之一。
乾坤丹Ⅵ号是本院医生根据治疗DN多年临床经验研制的院内制剂。主要由黄芪、天花粉、白茅根、蒲公英、麦冬、玄参等27味药组成。功用健脾化湿行水,固肾养血祛痰;用于脾肾两虚,阴虚火旺型糖尿病并发肾病或单纯尿糖不消者。前期研究表明,乾坤丹Ⅵ号能显著降低DN患者的尿蛋白、血糖、胆固醇、三酰甘油等指标的含量;与西药对比,对DN患者有明显的作用优势,能够显著延缓DN的发展。临床研究表明,与阳性对照组相比,乾坤丹Ⅵ号治疗组治疗后两组患者的空腹血糖、餐后2 h血糖、糖化血红蛋白、胆固醇、三酰甘油、血浆总蛋白的水平间差别均无统计学意义;而24 h尿白蛋白、24 h尿总蛋白含量间差别有统计学意义。说明乾坤丹Ⅵ号对延缓、阻止早、中期DN发展有一定疗效。对耳穴敷贴联合乾坤丹Ⅵ号治疗气阴两虚型早期DN的临床疗效观察也表明,耳穴贴压联合乾坤丹Ⅵ号治疗早期DN(气阴两虚型)临床疗效确切、值得临床上推广使用[13]。
本研究中,乾坤丹Ⅵ号可显著降低DN模型大鼠血糖,降低血清总蛋白含量,对于DN有一定治疗作用。病理检测结果显示,乾坤丹Ⅵ号治疗组大鼠的肾脏病变有所改善,肾小球萎缩与肾小管纤维化受到抑制。且通过Western blot和PCR检测,结果显示,乾坤丹Ⅵ号可显著升高肾脏组织中BMP-7的转录与表达水平,降低CTGF和TGF-β1转录与表达水平。由于BMP-7对肾损伤有逆转作用,可抑制肾小球损伤。BMP-7水平的升高,提示乾坤丹Ⅵ号对肾脏有一定保护作用。BMP-7的拮抗因子CTGF与TGF-β1在肾小球病理改变中起到重要作用,TGF-β/CTGF是引发肾脏纤维化、肾小球损伤的重要因子。乾坤丹Ⅵ号对这两者的抑制作用,可能也是其治疗糖尿病肾损伤,改善肾小球病理改变的主要机制。本研究结果表明,乾坤丹Ⅵ号发挥对DN的治疗作用可能是通过影响TGF-β1-CTGF-BMP-7轴而发挥作用的。
| [1] |
王宓, 左力. 糖尿病肾病诊治专家共识解读[J]. 临床内科杂志, 2020, 37(9): 675-678. WANG M, ZUO L. Interpretation of the interpretation of diabetic nephropathic treatment[J]. Journal of Clinical Internal Medicine, 2020, 37(9): 675-678. |
| [2] |
杨辰. 从Akt-mTOR信号通路研究黄芪菟箭合剂对糖尿病大鼠的肾脏保护机制[D]. 北京: 中国中医科学院, 2016. YANG C. Based on Akt-mTOR signaling pathway in diabetic rats to investigate the mechanism of Huangqitujian decoction on renal protection[D]. Beijing: China Academy of Chinese Medical Sciences, 2016. |
| [3] |
邓文超, 方敬爱. 黄芪对糖尿病肾病大鼠肾间质Wnt/β-catenin及TGF-β1信号通路表达的影响[J]. 中国中西医结合肾病杂志, 2012, 13(7): 571-574. DENG W C, FANG J A. Effect of atragalusmongholicusWnt/β-catenin and TGF-β1 signaling pathway expression in the renal interstitial of diabetic nephropathy rats nephropathy rats[J]. Chinese Journal of Integrated Traditional and Western Nephrology, 2012, 13(7): 571-574. DOI:10.3969/j.issn.1009-587X.2012.07.003 |
| [4] |
IVANAC-JANKOVI R, ORI M, FURI-UNKO V, et al. Bmp-7 protein expression is downregulated in human diabetic nephropathy[J]. Acta Clinica Croatica, 2015, 54(2): 164-168. |
| [5] |
张爱民, 刘佳丽, 向长铁, 等. 气体信号分子硫化氢下调CTGF途径在改善小鼠酒精性肾间质纤维化中的应用[J]. 吉林医学, 2020, 41(8): 1797-1800. ZHANG A M, LIU J L, XIANG C T, et al. Hydrogen sulfide alleviates renal fibrosis in alcoholic rats through CTGF signaling pathway[J]. Jilin Medical Journal, 2020, 41(8): 1797-1800. |
| [6] |
RAMZY M M, ABDALLA A M, ZENHOM N M, et al. Therapeutic effect of liraglutide on expression of CTGF and BMP-7 in induced diabetic nephropathy[J]. Journal of Cellular Biochemistry, 2019, 120(10): 17512-17519. DOI:10.1002/jcb.29015 |
| [7] |
贾哲, 杨文文, 杨雅昊, 等. 转化生长因子-β在糖尿病微血管病变发病中作用的机制研究进展[J]. 山东医药, 2019, 59(30): 103-106. JIA Z, YANG W W, YANG Y H, et al. Research progress on mechanism of transforming growth factor-β in diabetic microvascular disease[J]. Shandong Medical Journal, 2019, 59(30): 103-106. DOI:10.3969/j.issn.1002-266X.2019.30.029 |
| [8] |
贾会玉, 段陈方圆, 李莉, 等. 丹蛭降糖胶囊对糖尿病肾病大鼠TGF-β1/Smads信号通路的调控作用[J]. 中国药理学通报, 2019, 35(5): 714-720. JIA H Y, DUAN C F Y, LI L, et al. Control of TGF-β1/Smads signaling pathway in diabetic nephropathy rats by Danzhijiangtang capsule[J]. Chinese Pharmacological Bulletin, 2019, 35(5): 714-720. DOI:10.3969/j.issn.1001-1978.2019.05.024 |
| [9] |
WÜNSCHE C, KOCH A, GOLDSCHMEDING R, et al. Transforming growth factor β2 (TGF-β2)-induced connective tissue growth factor (CTGF) expression requires sphingosine 1-phosphate receptor 5 (S1P5) in human mesangial cells[J]. Biochimica et Biophysica Acta, 2015, 1851(5): 519-526. DOI:10.1016/j.bbalip.2015.01.003 |
| [10] |
李春雨, 郭海洋, 崔晶晶, 等. 针刺联合糖克煎剂对糖尿病肾病大鼠TGF-β1/CTGF/MMP-9的影响[J]. 中国动脉硬化杂志, 2019, 27(4): 330-336. LI C Y, GUO H Y, CUI J J, et al. Effect of acupuncture combined with Tangkeapozem on TGF-β1/CTGF/MMP-9 in rats with diabetic nephropathy[J]. Chinese Journal of Arteriosclerosis, 2019, 27(4): 330-336. DOI:10.3969/j.issn.1007-3949.2019.04.011 |
| [11] |
吕娟, 曹兰秀. 当归黄芪汤对糖尿病大鼠肾组织JAK2STAT3信号通路的影响[J]. 中国药业, 2018, 27(15): 9-11. LYU J, CAO L X. Effect of Danggui Huangqi Decoction on JAK2STAT3 signaling pathway in renal tissue of diabetic rats[J]. China Pharmaceuticals, 2018, 27(15): 9-11. DOI:10.3969/j.issn.1006-4931.2018.15.003 |
| [12] |
宋恩峰, 刘蒙, 贾汝汉, 等. 黄芪对糖尿病肾病大鼠肾组织CTGF蛋白及其mRNA表达的影响[J]. 中西医结合研究, 2009, 1(3): 126-128, 132. SONG E F, LIU M, JIA R H, et al. Effect of Astragalus on the expression of connective tissue growth factor(CTGF) protein and CTGF mRNA in renal tissues of rats with diabetic nephropathy[J]. Research of Integrated Traditional Chinese and Western Medicine, 2009, 1(3): 126-128, 132. |
| [13] |
马国海. 乾坤丹Ⅵ号治疗糖尿病肾病62例疗效观察[J]. 中国全科医学, 2006, 9(20): 1730-1731. MA G H. Treatment of 62 cases of diabetic nephropathy in Qiankun Dan Ⅵ[J]. Chinese General Practice, 2006, 9(20): 1730-1731. DOI:10.3969/j.issn.1007-9572.2006.20.037 |
2. School of Chinese Materia Medica, Tianjin University of Traditional Chinese Medicine, Tianjin 301617, China
 2022, Vol. 39
2022, Vol. 39