文章信息
- 樊倩, 杨程, 刘云霓
- FAN Qian, YANG Cheng, LIU Yunshang
- 醉茄素A通过circOSBPL10/miR-128-3p通路调控乳腺癌MDA-MB-231细胞糖酵解、增殖、迁移及侵袭的机制研究
- Molecular mechanism of withaferin A regulating glycolysis, proliferation, migration and invasion of breast cancer MDA-MB-231 cells through the circOSBPL10/miR-128-3p pathway
- 天津中医药, 2022, 39(6): 801-808
- Tianjin Journal of Traditional Chinese Medicine, 2022, 39(6): 801-808
- http://dx.doi.org/10.11656/j.issn.1672-1519.2022.06.24
-
文章历史
- 收稿日期: 2022-01-20
乳腺癌是威胁女性生命安全的恶性肿瘤之一,中国乳腺癌发病率与病死率呈增长趋势,既往研究证实,植物提取物具有抗肿瘤的作用,西黄丸、小檗碱等可抑制乳腺癌细胞增殖及促进细胞凋亡进而发挥抗乳腺癌的作用[1-3]。醉茄素A是茄科植物醉茄中提取的主要活性成分,具有抗炎、抗肿瘤的作用,并可抑制胆囊癌细胞增殖及诱导细胞凋亡[4]。环状RNA(circRNA)是3’端与5’端以共价键结合形成的RNA分子,其具有组织特异性与结构稳定性等特点,研究表明circOSBPL10在胃癌组织中上调表达,沉默其表达可抑制胃癌细胞的增殖、迁移和侵袭[5]。靶基因预测显示circOSBPL10与miR-128-3p存在结合位点,miR-128-3p通过靶向LIMK1抑制乳腺癌发展进程[6]。但醉茄素A是否通过circOSBPL10/miR-128-3p通路调控乳腺癌MDA-MB-231细胞糖酵解、增殖、迁移和侵袭目前还尚未可知。因此,本研究主要探讨醉茄素A对乳腺癌MDA-MB-231细胞糖酵解、增殖、迁移、侵袭的影响及其对circOSBPL10/miR-128-3p通路的调控作用。
1 材料与方法 1.1 材料与试剂醉茄素A购自美国Sigma公司;乳腺癌细胞MDA-MB-231购自美国ATCC公司;DMEM培养基、胎牛血清购自美国Gibco公司;Lipofectamine2000购自美国Invitrogen公司;miR-128-3p寡核苷酸模拟物(miR-128-3p mimics)及阴性对照mimic NC序列(miR-NC)、circOSBPL10小分子干扰RNA(si-circOSBPL10)及阴性对照序列(si-NC)购自广州锐博生物科技有限公司;pcDNA与circOSBPL10过表达载体pcDNA-circOSBPL10购自上海远慕生物科技有限公司;Trizol试剂、反转录试剂、SYBR Green试剂购自美国Thermo Fisher公司;噻唑蓝(MTT)试剂、Matrigel基质胶、葡萄糖、丙酮酸激酶与乳酸含量检测试剂盒购自北京索莱宝科技有限公司;己糖激酶检测试剂盒购自上海信帆生物;Transwell小室购自美国Corning公司;荧光素酶活性检测试剂及其系统购自美国Promega公司;兔抗人蛋白细胞增殖核抗原-67(Ki-67)、基质金属白酶-2(MMP-2)、基质金属白酶-9(MMP-9)抗体购自美国CST公司;辣根过氧化物酶(HRP)标记的山羊抗兔二抗购自北京中杉金桥生物技术有限公司。Multiskan Mk3酶标仪购自美国Thermo Fisher公司;电泳仪购自美国BioRad公司;StepOnePlus实时荧光定量聚合酶链反应(qRt-PCR)仪购自美国ABI公司。
1.2 方法 1.2.1 实验分组取对数生长期MDA-MB-231细胞(1×105个/mL)接种于96孔板(100 μL/孔),分别加入不同浓度(10、20、40 μg/mL)的醉茄素A预处理细胞24 h[7],分别记为醉茄素A低剂量组、醉茄素A中剂量组、醉茄素A高剂量组。同时将正常培养的细胞作为对照组。
1.2.2 细胞转染细胞转染用不含血清的培养液稀释si-NC、si-circOSBPL10后作为A液,用不含血清的培养液稀释Lipofectamine2000后作为B液,A液与B液充分混匀后室温孵育20 min,将其加入MDA-MB-231细胞中,分别记为si-NC组、si-circOSBPL10组。回复实验:pcDNA、pcDNA-circOSBPL10分别转染入MDA-MB-231细胞后加入40 μg/mL的醉茄素A处理细胞24 h,分别记为醉茄素A+pcDNA组、醉茄素A+pcDNA-circOSBPL10组。
1.2.3 检测葡萄糖消耗、乳酸产生收集“1.2.1”各分组MDA-MB-231细胞后经3 000 r/min转速离心,弃上清液,加入1 mL蒸馏水后应用超声波破碎细胞,根据试剂盒说明书检测葡萄糖消耗与乳酸产生量。
1.2.4 MTT检测细胞增殖收集各组MDA-MB-231细胞(1×105个/mL)接种于96孔板(100 μL/孔),每孔加入质量浓度为5 mg/mL的MTT溶液20 μL,于培养箱内继续培养4 h后弃上清,将DMSO加入96孔板(150 μL/孔),室温避光孵育5 min后应用酶标仪检测各孔吸光度值(OD 490 nm)并计算细胞增殖抑制率[(对照组OD-实验组OD)/(对照组OD-空白组OD)×100%]。
1.2.5 Transwell实验检测细胞迁移与侵袭收集各组MDA-MB-231细胞加入0.25%胰蛋白酶消化后加入培养液制备细胞悬液(2.5×105个/mL),将其加入小室的上室(200 μL/孔),下室加入600 μL含有10%胎牛血清的培养液,于培养箱内继续培养24 h后采用多聚甲醛溶液固定20 min,采用磷酸盐缓冲液(PBS)洗涤后加入0.1%结晶紫染液染色10 min,应用显微镜观察迁移细胞数。采用预冷培养液稀释Matrigel基质胶后加入小室的上室(40 μL/孔),于培养箱内继续培养5 h后加入各组MDA-MB-231细胞悬液,后续实验步骤同细胞迁移实验,应用显微镜观察侵袭细胞数。
1.2.6 qRT-PCR检测细胞中circOSBPL10、miR-128-3p的表达水平采用Trizol法提取各组MDA-MB-231细胞总RNA后置于-80 ℃超低温冰箱内保存。RNA 2 μL,10×RT Buffer 2 μL,dNTP 0.4 μL,Multiscripe RT 1 μL,10×Random Primer 2 μL,RNase-Free ddH2O补足体系至20 μL;反应条件:25 ℃ 10 min,37 ℃ 60 min,95 ℃ 5 min,4 ℃保存。qRT-PCR反应体系:SYBR Green Master Mix 10 μL/孔,正反向引物0.8 μL/孔,cDNA 1 μL/孔,ddH2O补足体系至20 μL;反应程序:95 ℃预变性5 min循环1次,95 ℃变性30 s,60 ℃退火30 s,72 ℃延伸30 s,共循环40次。采用2-ΔΔCt法计算circOSBPL10、miR-128-3p相对表达量。
1.2.7 双荧光素酶报告基因检测circOSBPL10与miR-128-3p的靶向关系StarBase预测显示circOSBPL10与miR-128-3p存在结合位点,含有结合位点的片段克隆至pmirGLO载体得到野生型载体WT-circOSBPL10,采用基因突变技术将结合位点进行突变,含有突变位点的片段克隆至pmirGLO载体得到突变型载体MUT-circOSBPL10,miR-NC、miR-128-3p mimics分别与WT-circOSBPL10、MUT-circOSBPL10共转染入MDA-MB-231细胞后置于培养箱内继续培养24 h,采用双荧光素酶报告基因检测系统检测各组细胞荧光素酶活性。
1.2.8 Western blot检测Ki-67、MMP-2、MMP-9蛋白表达各组MDA-MB-231细胞中加入500 μL RIPA裂解液提取细胞总蛋白,采用BCA法测定蛋白浓度后加入上样缓冲液,沸水孵育10 min,蛋白变性,取50 μg蛋白进行SDS-PAGE电泳分离蛋白,将分离的蛋白凝胶转移至聚偏二氟乙烯(PVDF)膜后室温封闭2 h(5%脱脂奶粉),加入稀释比例1∶1 000的一抗与内参GAPDH(1∶1 000)一抗,将其置于4 ℃培养箱内孵育过夜,采用TBST洗涤后加入二抗稀释液(1∶50 000),将其置于室温条件下孵育1 h,采用TBST洗涤,滴加ECL,暗室内曝光显影,应用Image J软件分析各条带灰度值(蛋白相对表达量=目的蛋白条带灰度值/内参照条带灰度值)。
1.3 统计学处理采用SPSS 21.0统计学软件分析数据,计量资料均符合正态分布以均数±标准差(x±s)表示,两组间比较采用独立样本t检验,多组间比较采用单因素方差分析,组间两两比较采用LSD法,P<0.05为差异具有统计学意义。
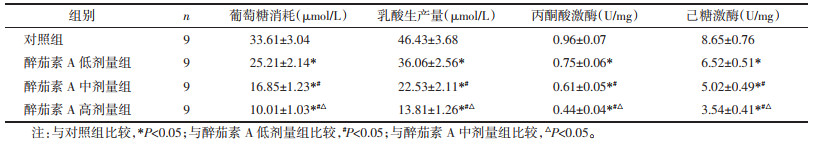
2 结果 2.1 醉茄素A对乳腺癌MDA-MB-231细胞糖酵解的影响与对照组比较,醉茄素A低剂量组、醉茄素A中剂量组、醉茄素A高剂量组葡萄糖消耗与乳酸生成量以及丙酮酸激酶、己糖激酶的水平均明显降低(P<0.05),且醉茄素A低剂量组、醉茄素A中剂量组、醉茄素A高剂量组间各指标比较差异有统计学意义(P<0.05),见表 1。
|
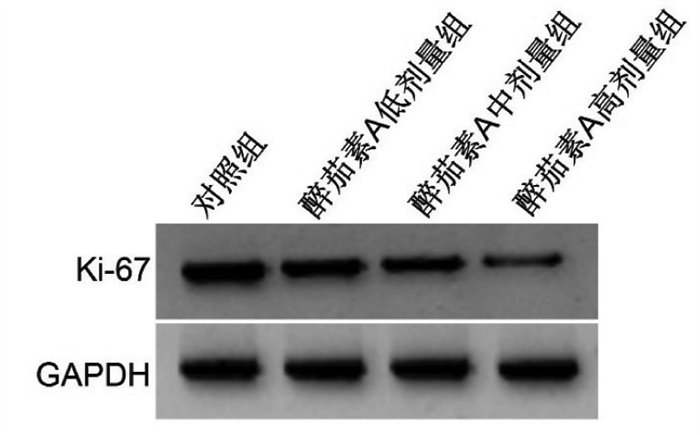
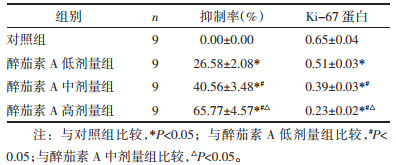
与对照组比较,醉茄素A低剂量组、醉茄素A中剂量组、醉茄素A高剂量组细胞增殖抑制率升高(P<0.05),Ki-67蛋白水平降低(P<0.05),且醉茄素A低剂量组、醉茄素A中剂量组、醉茄素A高剂量组间细胞增殖抑制率、Ki-67蛋白水平比较差异有统计学意义(P<0.05),见图 1、表 2。
|
| 注:1.对照组;2.醉茄素A低剂量组;3.醉茄素A中剂量组;4.醉茄素A高剂量组。 图 1 Ki-67蛋白表达 Fig. 1 Expression of Ki-67 protein |
|
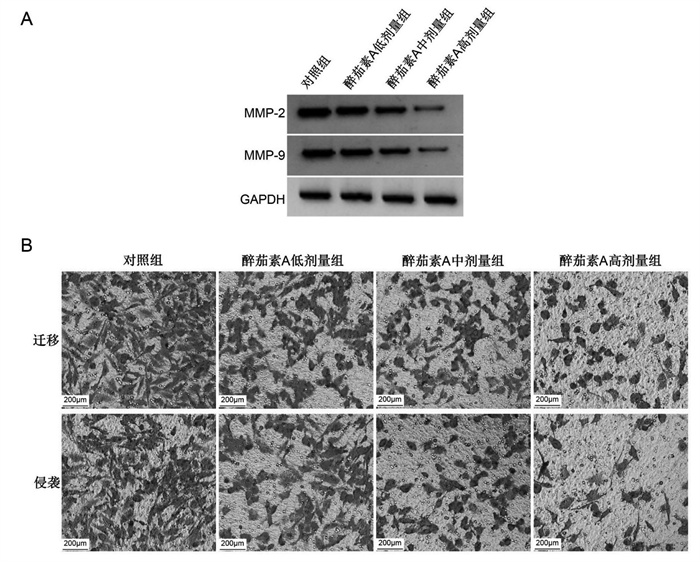
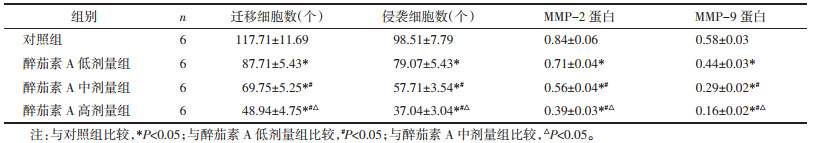
与对照组比较,醉茄素A低剂量组、醉茄素A中剂量组、醉茄素A高剂量组迁移及侵袭细胞数减少(P<0.05),MMP-2、MMP-9蛋白水平降低(P<0.05),且醉茄素A低剂量组、醉茄素A中剂量组、醉茄素A高剂量组间上述指标比较差异有统计学意义(P<0.05),见图 2、表 3。
|
| 注:A.迁移侵袭相关蛋白表达;B.乳腺癌MDA-MB-231细胞的迁移、侵袭。 图 2 醉茄素A对乳腺癌MDA-MB-231细胞迁移、侵袭的影响 Fig. 2 Effect of withaferin A on the migration and invasion of breast cancer MDA-MB-231 cells |
|
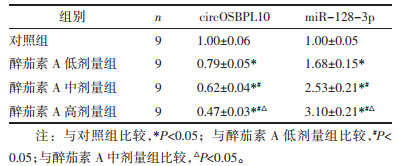
与对照组比较,醉茄素A低剂量组、醉茄素A中剂量组、醉茄素A高剂量组circOSBPL10的表达水平降低(P<0.05),miR-128-3p的表达水平升高(P<0.05),且醉茄素A低剂量组、醉茄素A中剂量组、醉茄素A高剂量组间circOSBPL10、miR-128-3p的表达水平比较差异有统计学意义(P<0.05),见表 4。
|
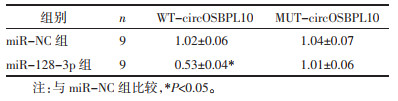
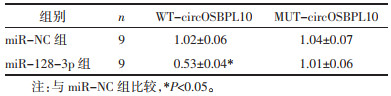
StarBase预测显示circOSBPL10与miR-128-3p存在结合位点,见图 3。miR-128-3p过表达可明显降低野生型载体WT-circOSBPL10的荧光素酶活性(P<0.05),而对突变型载体MUT-circOSBPL10的荧光素酶活性无明显影响(P>0.05),见表 5。与pcDNA组比较,pcDNA-circOSBPL10组miR-128-3p的表达水平降低(P<0.05);与si-NC组比较,si-circOSBPL10组miR-128-3p的表达水平升高(P<0.05),见表 6。

|
| 图 3 circOSBPL10的序列中含有与miR-128-3p互补的核苷酸序列 Fig. 3 Sequence of circOSBPL10 contains a nucleotide sequence complementary to miR-128-3p |
|
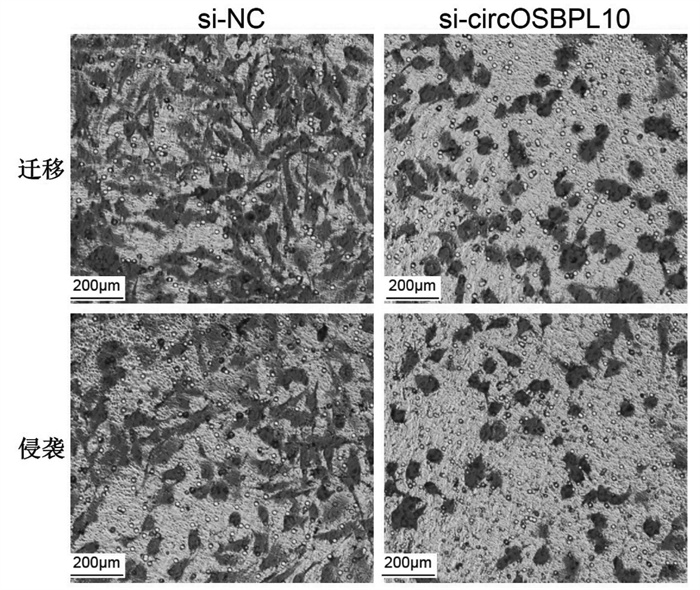
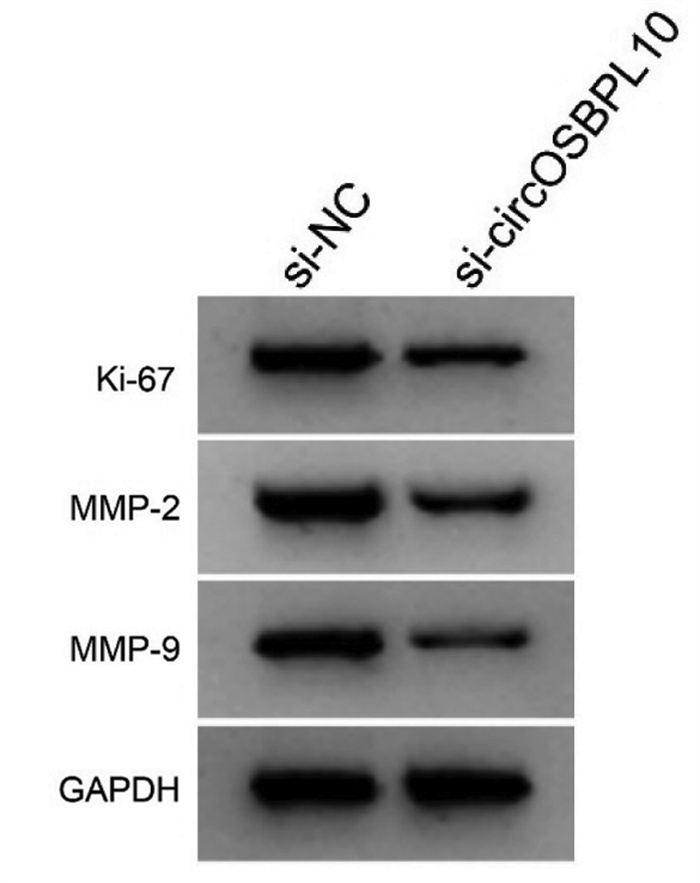
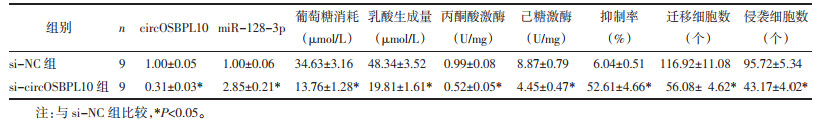
与si-NC组比较,si-circOSBPL10组葡萄糖消耗与乳酸产生量以及丙酮酸激酶、己糖激酶的水平均明显降低(P<0.05),细胞增殖抑制率升高(P<0.05),迁移及侵袭细胞数减少(P<0.05),Ki-67、MMP-2、MMP-9蛋白水平降低(P<0.05),见图 4、图 5、表 7、表 8。
|
| 图 4 抑制circOSBPL10表达对乳腺癌MDA-MB-231细胞迁移、侵袭的影响 Fig. 4 ffect of inhibiting the expression of circOSBPL10 on the migration and invasion of breast cancer MDA-MB-231 cells |
|
| 注:1. si-NC;2. si-circOSBPL10。 图 5 增殖、迁移、侵袭相关蛋白表达 Fig. 5 Expression of the proliferation, migration and invasion related protein |
|
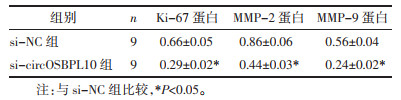
|
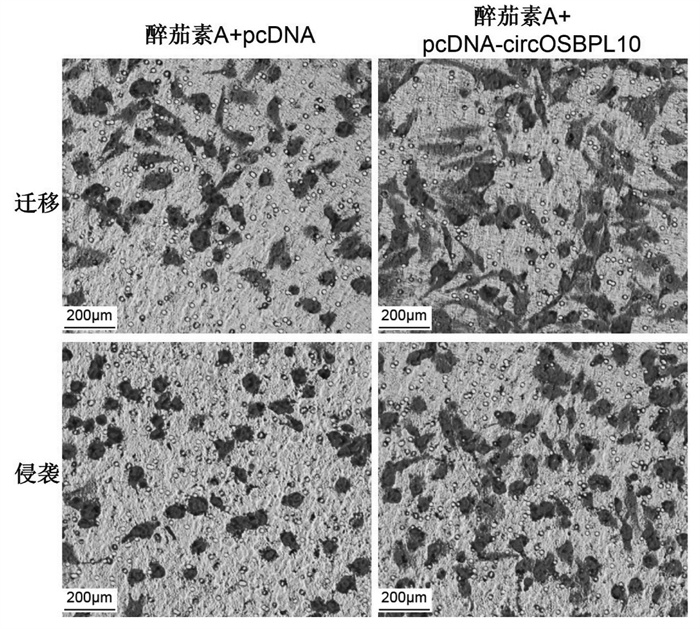
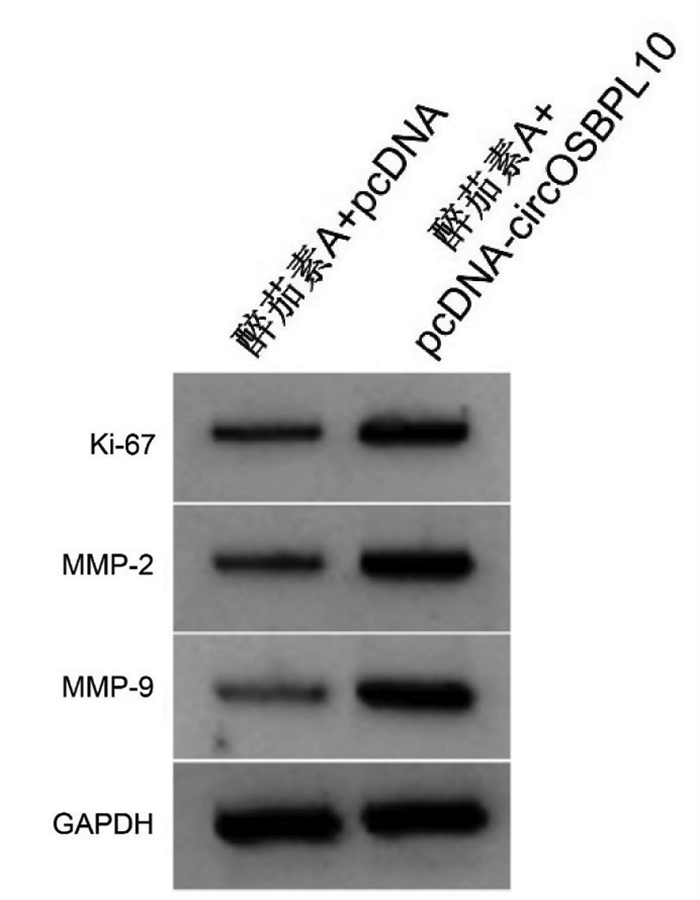
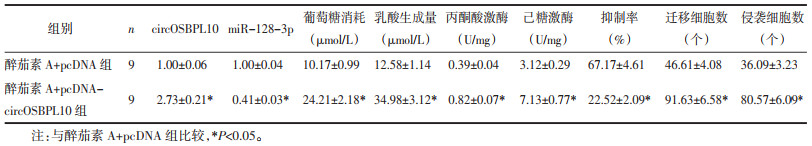
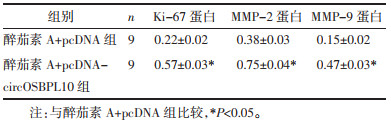
与醉茄素A+pcDNA组比较,醉茄素A+pcDNA-circOSBPL10组葡萄糖消耗与乳酸产生量以及丙酮酸激酶、己糖激酶的水平均明显升高(P<0.05),细胞增殖抑制率降低(P<0.05),迁移及侵袭细胞数增多(P<0.05),Ki-67、MMP-2、MMP-9蛋白水平升高(P<0.05),见图 6、图 7、表 9、表 10。
|
| 图 6 乳腺癌MDA-MB-231细胞的迁移和侵袭 Fig. 6 Migration and invasion of breast cancer MDA-MB-231 cells |
|
| 注:1. 醉茄素A+pcDNA;2.醉茄素A+pcDNA-circOSBPL10。 图 7 增殖、迁移、侵袭相关蛋白表达 Fig. 7 Expression of the proliferation, migration and invasion related protein |
|
|
乳腺癌的治疗方案主要包括手术、放疗、化疗等,降低患者生活质量。随着研究的不断深入,越来越多的研究发现,植物提取物及其活性成分对抗乳腺癌具有抑制作用,例如,葛根素通过阻断核因子-κB(NF-κB)和外周信号调节激酶(Erk)途径抑制乳腺癌细胞迁移,侵袭和黏附[8]。人参皂苷Rh2通过调控LncRNA C3orf67-AS1抑制乳腺癌细胞的增殖[9]。番石榴碱通过阻断STAT3信号通路而抑制乳腺癌的生长和转移[10]。但醉茄素A治疗乳腺癌的分子机制尚未阐明。
醉茄素A对乳腺癌等肿瘤细胞具有明显抑制作用,研究表明醉茄素A可抑制非小细胞肺癌细胞增殖及促进细胞凋亡,其作用机制与抑制PI3K/Akt通路的激活有关[11]。醉茄素A可促进肝癌耐药细胞凋亡,其作用机制与抑制JAK/STAT通路的活化有关[12]。本研究结果显示,不同剂量的醉茄素A可明显降低乳腺癌细胞葡萄糖消耗与乳酸生成量,且随着药物浓度的增加而明显降低。葡萄糖消耗与乳酸生成量以及丙酮酸激酶、己糖激酶的水平是反应糖酵解水平的重要指标,而糖酵解水平升高可促进细胞增殖[13]。本研究结果提示醉茄素A可降低乳腺癌细胞糖酵解水平,且呈剂量依赖性。本研究结果显示,不同剂量的醉茄素A处理后可明显提高乳腺癌细胞增殖抑制率,并可抑制Ki-67的表达,且呈剂量依赖性。研究表明Ki-67的表达情况可作为判断肿瘤细胞增殖活性的指标,其表达量升高预示增殖能力增强[14]。提示醉茄素A可能通过降低乳腺癌细胞糖酵解水平而抑制细胞增殖。本研究结果显示,不同剂量的醉茄素A作用于乳腺癌细胞后可明显减少迁移及侵袭细胞数,还可抑制MMP-2、MMP-9的表达,且呈剂量依赖性。MMP-2、MMP-9蛋白是反映细胞转移能力的检测指标,其发挥作用与降解细胞外基质沉积有关[15]。提示醉茄素A可抑制乳腺癌细胞迁移及侵袭。然而,醉茄素A调控乳腺癌细胞生物学行为的分子机制尚未可知。
为进一步探讨醉茄素A影响乳腺癌细胞生物学行为的分子机制,本研究采用qRT-PCR检测醉茄素A处理后乳腺癌细胞中基因表达情况,结果发现circOSBPL10的表达水平降低,且随着药物剂量的增加而明显降低,提示醉茄素A可能通过抑制circOSBPL10的表达从而发挥抗乳腺癌的作用。circOSBPL10在宫颈癌细胞中呈高表达,并可通过miR-1179 / UBE2Q1轴增强宫颈癌细胞的增殖和迁移能力[16]。本研究结果显示,抑制circOSBPL10表达可明显降低乳腺癌细胞葡萄糖消耗与乳酸生成量,提高细胞增殖抑制率,而减少迁移及侵袭细胞数,提示抑制circOSBPL10表达可降低乳腺癌细胞糖酵解水平而抑制细胞增殖,并可降低细胞迁移及侵袭能力。本研究进一步证实circOSBPL10可充当miR-128-3p的海绵分子,并可负向调控miR-128-3p的表达。miR-128-3p通过靶向ZEB1而抑制食管鳞状细胞癌细胞转移和上皮-间质转化[17]。LncRNA PVT1通过调节miR-128-3p / GREM1轴促进胶质瘤的发生和发展[18]。抑制LncRNA MIR4435-2HG通过调节miR-128-3p / MSI2轴而抑制宫颈癌细胞的增殖、迁移和侵袭[19]。LncRNA TUG1通过调节miR-128-3p / YES1轴而加速前列腺癌的进展[20]。本研究结果显示,醉茄素A处理的乳腺癌细胞中miR-128-3p的表达水平升高,且随着药物浓度的增加而明显升高,提示醉茄素A可能通过降低circOSBPL10的表达而上调miR-128-3p的表达,分析原因可能为circOSBPL10序列上含有miR-128-3p的结合位点,circOSBPL10可竞争性结合miR-128-3p而负向调控其表达。同时,采用醉茄素A与circOSBPL10过表达联合处理乳腺癌细胞,结果显示,葡萄糖消耗与乳酸生成量均明显升高,而细胞增殖抑制率降低,细胞迁移及侵袭能力增强,提示醉茄素A可通过下调circOSBPL10的表达而上调miR-128-3p的表达从而调控乳腺癌细胞糖酵解、增殖、迁移及侵袭。
综上所述,醉茄素A可通过调控circOSBPL10/miR-128-3p轴而降低乳腺癌细胞糖酵解水平进而抑制细胞增殖,并可抑制乳腺癌细胞迁移及侵袭,circOSBPL10/miR-128-3p轴可能作为醉茄素A治疗乳腺癌的潜在靶点。但醉茄素A如何调控circOSBPL10/miR-128-3p通路下游靶基因,及其可能作用机制尚需进一步探究,下一步实验将采用体内动物实验进一步验证circOSBPL10/miR-128-3p通路在醉茄素A抗乳腺癌中的作用机制。
| [1] |
何丽娟, 李晋生, 陈霞, 等. 西黄丸含药血清对人乳腺癌细胞株MDA-MB-435和MCF-7细胞增殖的影响[J]. 中国中药杂志, 2018, 43(13): 2784-2788. HE L J, LI J S, CHEN X, et al. Effect of serum containing Xihuang Pill on proliferation of human breast cancer cell line MDA-MB-435 and MCF-7 Cells[J]. China Journal of Chinese Materia Medica, 2018, 43(13): 2784-2788. |
| [2] |
钱洁, 谭佳妮, 程海波, 等. 小檗碱对乳腺癌MDA-MB-231细胞增殖抑制作用及其分子机制研究[J]. 天然产物研究与开发, 2019, 31(3): 422-427. QIAN J, TAN J N, CHENG H B, et al. Effect of berberine on the proliferation of breast cancer MDA-MB-231 cells and its molecular mechanism[J]. Natural Product Research and Development, 2019, 31(3): 422-427. |
| [3] |
GUPTA N, BISEN P S, BHAGYAWANT S S. Chickpea lectin inhibits human breast cancer cell proliferation and induces apoptosis through cell cycle arrest[J]. Protein and Peptide Letters, 2018, 25(5): 492-499. DOI:10.2174/0929866525666180406142900 |
| [4] |
李旭, 王敏, 田锐, 等. 醉茄素A诱导人胆囊癌GBC-SD细胞凋亡及其可能的机制[J]. 肿瘤, 2013, 2(6): 502-508. LI X, WANG M, TIAN R, et al. Apoptosis of human gallbladder carcinoma GBC-SD cells induced by withaferin A and its possible mechanism[J]. Tumor, 2013, 2(6): 502-508. DOI:10.3969/j.issn.1009-0460.2013.06.006 |
| [5] |
WANG S, ZHANG X, LI Z, et al. Circular RNA profile identifies circOSBPL10 as an oncogenic factor and prognostic marker in gastric cancer[J]. Oncogene, 2019, 38(44): 6985-7001. DOI:10.1038/s41388-019-0933-0 |
| [6] |
ZHAO J, LI D, FANG L. miR-128-3p suppresses breast cancer cellular progression via targeting LIMK1[J]. Biomedicine & Pharmacotherapy, 2019, 115(1): 108947. |
| [7] |
王鹏飞, 刘凤娟, 武晓, 等. 醉茄素A对肺鳞状细胞癌细胞上皮间质转化及凋亡的影响[J]. 肿瘤研究与临床, 2018, 30(12): 825-829. WANG P F, LIU F J, WU X, et al. Effect of Withaferin A on epithelial-mesenchymal transition and apoptosis in cells of lung squamous cell carcinoma[J]. Cancer Research and Clinic, 2018, 30(12): 825-829. DOI:10.3760/cma.j.issn.1006-9801.2018.12.002 |
| [8] |
LIU X, ZHAO W, WANG W, et al. Puerarin suppresses LPS-induced breast cancer cell migration, invasion and adhesion by blockage NF-κB and Erk pathway[J]. Biomedicine & Pharmacotherapy, 2017, 92(1): 429-436. |
| [9] |
JEONG D, HAM J, PARK S, et al. Ginsenoside Rh2 suppresses breast cancer cell proliferation by epigenetically regulating the long noncoding RNA C3orf67-AS1[J]. The American Journal of Chinese Medicine, 2019, 47(7): 1643-1658. DOI:10.1142/S0192415X19500848 |
| [10] |
WANG J, XU J, XING G Q. Lycorine inhibits the growth and metastasis of breast cancer through the blockage of STAT3 signaling pathway[J]. Acta Biochimica et Biophysica Sinica, 2017, 49(9): 771-779. DOI:10.1093/abbs/gmx076 |
| [11] |
蔡勇, 王季颖. 醉茄素A对非小细胞肺癌A549细胞增殖、凋亡及PI3K/Akt信号通路的影响[J]. 临床肿瘤学杂志, 2014, 19(2): 107-111. CAI Y, WANG J Y. Influences of withaferin A on proliferation, apoptosis and PI3K/Akt signaling pathway of non-small cell lung cancer A549 cell[J]. Chinese Clinical Oncology, 2014, 19(2): 107-111. |
| [12] |
张阳, 赵柯心, 张磊. 醉茄素A通过JAK/STAT通路对人肝癌耐药细胞HepG2/ADM凋亡的影响[J]. 现代药物与临床, 2020, 35(4): 641-646. ZHANG Y, ZHAO K X, ZHANG L. Effect of withaferin A on apoptosis of HepG2/ADM cells through JAK/STAT pathway[J]. Drugs & Clinic, 2020, 35(4): 641-646. |
| [13] |
张亚珍, 何贵省, 吴晓明, 等. miR-103a-3p在乳腺癌组织和血清中的表达及通过下调PDK4抑制乳腺癌细胞的有氧糖酵解及增殖[J]. 中国肿瘤生物治疗杂志, 2018, 25(5): 490-496. ZHANG Y Z, HE G S, WU X M, et al. Expression of miR-103a-3p in breast cancer tissues and its suppression on glycolysis and proliferation of breast cancer cells via down-regulating PDK4[J]. Chinese Journal of Cancer Biotherapy, 2018, 25(5): 490-496. |
| [14] |
贾文婷, 陈国福, 张雪鹏, 等. ADAM17-shRNA转染的BMSCs对乳腺癌移植瘤ADAM17、EGFR和Ki-67的影响[J]. 安徽医科大学学报, 2018, 53(4): 589-595. JIA W T, CHEN G F, ZHANG X P, et al. Effects of ADAM17-shRNA transfected BMSCs on ADAM17, EGFR and Ki-67 expression in breast cancer[J]. Acta Universitatis Medicinalis Anhui, 2018, 53(4): 589-595. |
| [15] |
SHARMA P, KUMAR S. Metformin inhibits human breast cancer cell growth by promoting apoptosis via a ROS-independent pathway involving mitochondrial dysfunction: pivotal role of superoxide dismutase (SOD)[J]. Cellular Oncology, 2018, 41(6): 637-650. DOI:10.1007/s13402-018-0398-0 |
| [16] |
YANG S, JIANG Y, REN X, et al. FOXA1-induced circOSBPL10 potentiates cervical cancer cell proliferation and migration through miR-1179/UBE2Q1 axis[J]. Cancer Cell International, 2020, 20(1): 389. DOI:10.1186/s12935-020-01360-2 |
| [17] |
ZHAO L L, LI R, XU S L, et al. Tumor suppressor miR-128-3p inhibits metastasis and epithelial-mesenchymal transition by targeting ZEB1 in esophageal squamous-cell cancer[J]. Acta Biochimica et Biophysica Sinica, 2018, 50(2): 171-180. DOI:10.1093/abbs/gmx132 |
| [18] |
FU C, LI D Y, ZHANG X N, et al. LncRNA PVT1 facilitates tumorigenesis and progression of glioma via regulation of miR-128-3p/GREM1 axis and BMP signaling pathway[J]. Neurotherapeutics, 2018, 15(4): 1139-1157. DOI:10.1007/s13311-018-0649-9 |
| [19] |
WANG R, LIU L, JIAO J, et al. Knockdown of MIR4435-2HG suppresses the proliferation, migration and invasion of cervical cancer cells via regulating the miR-128-3p/MSI2 axis in vitro[J]. Cancer Management and Research, 2020, 12(1): 8745-8756. |
| [20] |
HAO S D, MA J X, LIU Y, et al. Long non-coding TUG1 accelerates prostate cancer progression through regulating miR-128-3p/YES1 axis[J]. European Review for Medical and Pharmacological Sciences, 2020, 24(2): 619-632. |
 2022, Vol. 39
2022, Vol. 39