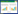1. 天津市中心妇产科医院, 天津 300052;
2. 天津市医学科学院血液病医院, 天津 300020
收稿日期:2022-04-15
基金项目:天津市卫生健康委员会,天津市中医药管理局中医、中西医结合科研课题项目(2019103)
作者简介:苏健(1986-),男,硕士,主管药师,主要从事门诊药房管理工作.
近年来,随着排卵障碍引起的不孕症逐年增多,严重影响着广大女性的生活质量。西医在治疗排卵障碍成功率上有明显优势,然而临床疗效不稳定,停药后患者月经周期及卵巢功能不能彻底恢复至正常,且可能伴随严重并发症[1-4]。传统中医药治疗排卵障碍有明显优势,在促进排卵的同时对于机体的整体功能具有明显促进作用[5]。由本院自主研制的促排合剂近十余年来在本院临床广泛应用,可益肾调经,促排卵,调节内分泌,对于肾虚不孕、月经不调、内分泌功能失调患者的治疗取得了显著的效果,但目前仍无促排合剂改善生殖调控作用机制的相关研究报道。文章以“肾气-天癸-冲任-胞宫”的平衡协调理论为基础,探讨促排合剂对肾阳虚排卵障碍模型大鼠生殖内分泌功能影响的作用机制,从而为促排合剂的临床应用提供了实验基础。
1 实验材料
1.1 动物
雌性SD健康大鼠60只,SPF级,6周龄,体质量(200±10)g,北京维通利华实验动物技术有限公司提供,许可证号SCXK(京)2016-0006。常规饲养于天津南开医院动物中心,标准合格环境中。
1.2 药物
促排合剂由生地黄、熟地黄、枸杞子、酒山萸肉、麦冬、牡丹皮、附片、肉桂、干益母草、覆盆子、菟丝子、制巴戟天、炙淫羊藿、制何首乌、酒肉苁蓉15味中药组成(津药制字Z20070552号,批号:20200909,由天津市中心妇产科医院药剂科提供)。枸橼酸氯米芬片(Codal Synto Limited生产,50 mg/片,批号L0806)。氢化可的松注射液(天津金耀药业公司生产,批号:1911201)。
1.3 主要试剂与仪器
离心机(可成仪器,L3-5KR,离心半径19 cm),全自动酶标仪(THERMO V.2.3),快速瑞氏-姬姆萨染色试剂盒(天津航瑞成生物科技有限公司,批号E607315)孕酮(P)测定试剂盒(上海岚派生物科技有限公司,以下此厂家简称上海岚派,批号201910),促性腺激素释放激素(GnRH)测定试剂盒(上海岚派,批号201910),卵泡刺激素(FSH)测定试剂盒(上海岚派,批号201910),黄体生成素(LH)测定试剂盒(上海岚派,批号201910),血清雌二醇(E2)测定试剂盒(上海岚派,批号201910),肾上腺皮质激素(ACTH)测定试剂盒(上海岚派,批号201910),皮质醇(COR)测定试剂盒(上海岚派,批号201910),总超氧化物歧化酶(T-SOD)测定试剂盒(武汉博士康生物工程有限公司,以下此厂家简称武汉博士康,批号20190210),丙二醛(MDA)测定试剂盒(武汉博士康,批号20190302),过氧化氢酶(CAT)测定试剂盒(武汉博士康,批号20190408)。
2 实验方法
2.1 巴氏染色观察大鼠动情周期变化
阴道细胞学检查将蘸取生理盐水(NaCl,0.9%)的无菌小棉签轻轻地插入大鼠阴道口缓慢转动充分粘取阴道黏液,然后将采集的黏液均匀地涂在干净的玻片上,待涂片自然干燥。干燥后,用95%乙醇固定2~3 min→蒸馏水冲洗2~3 min→在涂片上滴加一核染液染色2 min→自来水冲洗30~60 s→在涂片上滴加试剂二浆染液染色2 min左右→立即在涂片上滴加三增色液增色5 s→再用增色液冲洗涂片1遍→取出后用滤纸吸干→转移至倒置显微成像系统下观察涂片。
2.2 造模
本实验在之前其他学者研究的基础上,选择较为经典且应用最多的肌注氢化可的松的方法[6]复制肾阳虚排卵障碍大鼠模型,以获得肾阳虚表现稳定,排卵障碍明显的大鼠模型。
空白对照组每日肌注等容积生理盐水,其余5组按上述造模方法每日下肢肌注氢化可的松注射液25 mg/kg,连续11 d。肌注氢化可的松第6日起每日早晨连续阴道涂片(1个性周期4~5 d)。每日上午9点进行阴道细胞学检查,观察造模期间大鼠动情周期地变化。
2.3 实验分组及给药方法
成年雌性SD大鼠60只,随机分为6组,每组10只。第1组为空白对照组,后5组建立动物模型,分别为模型对照组、氯米芬阳性组、促排合剂低、中、高剂量组。空白对照组每日肌注等容积生理盐水,其余5组按上述造模方法肌注氢化可的松。模型制备成功后,促排合剂组按等效剂量0.5、1、2倍作为低、中、高剂量组剂量标准。按大鼠剂量(g/kg)=成人剂量(g)×0.018/0.2 kg作为大鼠等效剂量。氯米芬阳性组大鼠剂量为4.5 mg/kg,模拟人的月经周期,在15 d的治疗期(3个性周期),每个性周期的前2 d给药,后3 d停药。模型对照组及空白对照组以l mL/100 g体质量灌服生理盐水,每日1次,连续15 d。
2.4 指标检测
2.4.1 大鼠给药前后肾阳虚症状
肾阳虚症状表现:外观见竖毛、毛无光泽,拱背少动,饮食减少,体质量下降,反应迟钝,呼吸深迟,肉眼未见外生殖器潮湿、阴道口变大、触之兴奋等动情期反应。
2.4.2 大鼠给药前后体质量及脏器质量系数测定
分别于造模前和最后1次给药后,测量大鼠体质量;最后1次给药后,大鼠饥饿12 h,腹腔注射0.4%戊巴比妥(1 mL/100 g)麻醉,75%乙醇消毒腹部皮肤,开腹,快速摘除大鼠卵巢、子宫、下丘脑、垂体和肾上腺,剔除附着脂肪组织,立即测定卵巢、子宫、下丘脑、垂体和肾上腺质量,计算各脏器质量系数,质量系数=脏器质量/体质量。
2.4.3 大鼠给药前后下丘脑-垂体-卵巢轴(HPO轴)相关激素分泌水平检测
最后1次给药后,大鼠饥饿12 h,腹腔注射0.4%戊巴比妥(1mL/100Lg)麻醉,75%乙醇消毒腹部皮肤,开腹,腹主静脉取血,3 200 r/min离心15 min,取上层血清,采用酶联免疫吸附法(Elisa)测定大鼠血清P、GnRH、FSH、LH、血清E2含量水平。
2.4.4 大鼠给药前后下丘脑-垂体-肾上腺轴(HPA轴)相关激素水平检测
最后1次给药后,大鼠饥饿12 h,腹腔注射0.4%戊巴比妥(1mL/100 g)麻醉,75%乙醇消毒腹部皮肤,开腹,腹主静脉取血,3 200 r/min离心15 min,取上层血清,采用酶联免疫吸附法(ELISA)测定大鼠血清ACTH和COR含量水平。
2.4.5 大鼠给药前后氧化应激相关因子水平检测
最后1次给药后,大鼠饥饿12 h,腹腔注射0.4%戊巴比妥(1 mL/100 g)麻醉,75%乙醇消毒腹部皮肤,开腹,腹主静脉取血,3 200 r/min离心15 min,取上层血清,采用ELISA测定大鼠血清T-SOD、MDA和CAT含量水平。
2.5 统计学方法
本研究采用SPSS 26.0软件对数据进行统计分析,计量资料采用平均值±标准差(x±s)进行描述,多组间数据差异比较采用单因素方差分析(One-Way ANOVA),组间两两比较若方差齐时采用LSD检验;若方差不齐时,使用Tamhane’s T2检验。所有检验均采取双侧检验,检验水准α=0.05。
3 结果
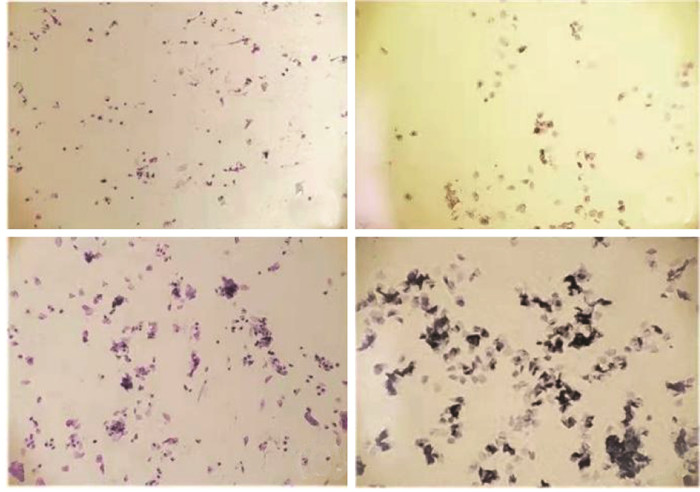
3.1 阴道分泌物图片
通过大鼠阴道分泌物涂片,可见大鼠动情周期:动情间期(A)、动情前期(B)及动情后期(C)、动情期(D),见图 1。动情间期:镜下可见大量白细胞;动情前期:镜下可见大量有核上皮细胞;动情后期:镜下可同时见角化上皮细胞、白细胞及有核上皮细胞;动情期:镜下可见大量角化上皮细胞。
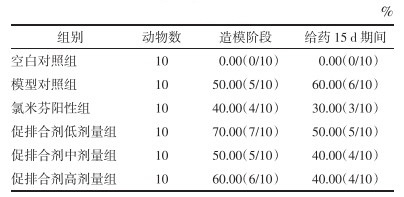
3.2 各组动情周期紊乱率
正常饲养的大鼠动情周期呈现“B-D-C-A”的连续变化且稳定。造模阶段除空白对照组以外各组均出现不同数量大鼠动情周期紊乱并伴有动情间期消失现象,然而,在给药期间,大部分动情周期紊乱的大鼠仍未恢复到正常阶段。见表 1。
表 1 各组大鼠动情周期紊乱率
Tab. 1
Disordered rate of estrous cycle of rats in each group
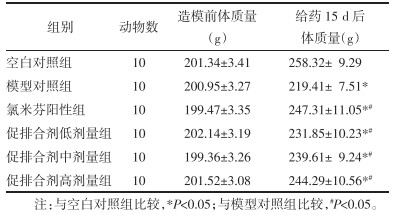
3.3 各组大鼠造模前后体质量比较
造模前,各组间大鼠体质量差异均无统计学意义(P>0.05);给药15 d后,模型对照组、氯米芬阳性组、促排合剂低、中、高剂量组大鼠体质量均低于空白对照组水平,而氯米芬阳性组、促排合剂低、中、高剂量组大鼠体质量均高于模型对照组水平,差异具有统计学意义(P<0.05),各组大鼠造模前后体质量比较结果详见表 2。
表 2 各组大鼠造模前后体质量比较
Tab. 2
Comparison of body weight of rats before and after modeling
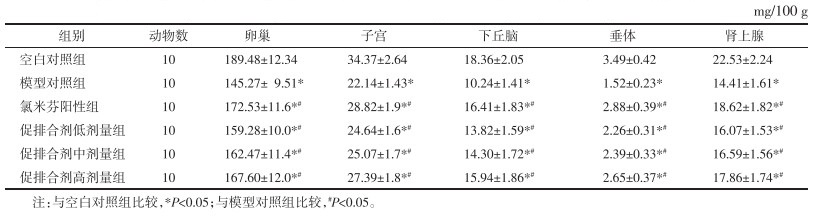
3.4 各组大鼠给药后各脏器质量系数比较
给药15 d后,模型对照组、氯米芬阳性组、促排合剂低、中、高剂量组大鼠卵巢、子宫、下丘脑、垂体和肾上腺等脏器质量系数均低于空白对照组水平,而氯米芬阳性组、促排合剂低、中、高剂量组大鼠各脏器质量系数均高于模型对照组水平,差异具有统计学意义(P<0.05),各组大鼠给药后各脏器质量系数比较结果详见表 3。
表 3 各组大鼠给药后各脏器质量系数比较
Tab. 3
Comparison of weight cofficients of each organ in each group after drug administration
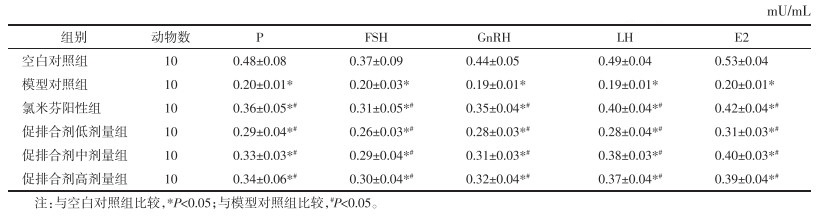
3.5 各组大鼠HPO轴相关激素分泌水平比较
模型对照组大鼠血清P、GnRH、FSH、LH和E2含量水平均低于空白对照组水平,虽然氯米芬阳性组、促排合剂低、中、高剂量组大鼠血清P、GnRH、FSH、LH和E2含量水平均低于空白对照组水平,然而均高于模型对照组水平,差异具有统计学意义(P<0.05),各组大鼠HPO轴相关激素分泌水平比较结果详见表 4。
表 4 各组大鼠HPO轴相关激素分泌水平比较
Tab. 4
Comparison of HPO axis- related hormone secretion levels in each group
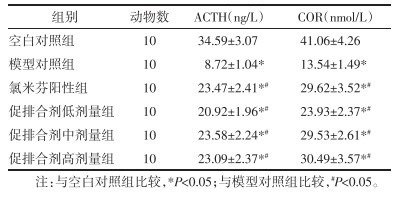
3.6 各组大鼠HPA轴相关激素分泌水平比较
模型对照组大鼠血清ACTH和COR含量水平均低于空白对照组水平,虽然氯米芬阳性组、促排合剂低、中、高剂量组大鼠血清ACTH和COR含量水平均低于空白对照组水平,然而均高于模型对照组水平,差异具有统计学意义(P<0.05),各组大鼠HPA轴相关激素分泌水平比较结果详见表 5。
表 5 各组大鼠HPA轴相关激素分泌水平比较
Tab. 5
Comparison of HPA axis- -related hormone secretion levels in each group
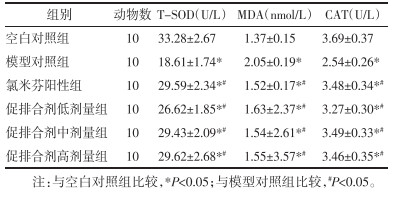
3.7 各组大鼠氧化应激相关因子分泌水平比较
模型对照组大鼠血清T-SOD和CAT含量水平均低于空白对照组水平,而MDA含量水平显著高于空白对照组水平;虽然氯米芬阳性组、促排合剂低、中、高剂量组大鼠血清T-SOD和CAT含量水平均低于空白对照组水平,MDA含量水平高于空白对照组水平,然而T-SOD和CAT含量水平均高于模型对照组水平,且MDA含量水平高于模型对照组水平,差异具有统计学意义(P<0.05),各组大鼠氧化应激相关因子分泌水平比较结果详见表 6。
表 6 各组大鼠氧化应激相关因子分泌水平比较
Tab. 6
Comparison of the secretion levels of oxidative stress related factors in each group
4 讨论
不孕症通常由于卵巢功能减退导致排卵功能障碍所致,且诱发不孕的危险因素不断增多,困扰着广大育龄女性[7]。在传统中医领域,“肾-天癸-冲任-胞宫”是阐述女性生殖功能的重要理论基础,该理论认为肾气阴阳平衡是维持女性月经周期、生殖功能的重要保障,对女性生殖激素分泌水平、下游靶器官激素受体数目及受体对于激素作用的敏感性均产生重要影响[8-10]。若肾阳虚损,则可导致虚寒衰弱诸症及生殖机能的减退,因此,通过温补肾阳,恢复肾气阴阳平衡,改善生殖激素内分泌功能,是临床治疗不孕症的重要途径[11-16]。促排合剂作为本院自主研发的现代中成制剂,已有近十余年临床应用实践经验,在治疗女性不孕症方面,临床疗效和用药安全性方面得到了广大患者的认可,方中主要成分熟地黄、酒肉苁蓉发挥补血养阴、填精益髓、温补肾阳之功效,枸杞子、制何首乌发挥滋补肝肾、益精明目之功效,与其他诸药共奏,共同发挥温补肾阳、填精益髓、活血通经之功效。虽然,促排合剂于本院具有较为丰富临床应用经验,然而目前缺乏改善生殖功能的药理学机制研究,不利于该中成方剂在不孕症治疗领域的推广。
本研究探索了促排合剂对肾阳虚排卵障碍模型大鼠生殖内分泌功能影响的作用机制,研究结果显示,大部分肾阳虚模型大鼠的动情周期出现紊乱现象,个别鼠动情间期消失,且在给药期间许多周期紊乱大鼠仍未恢复。模型大鼠的体质量和卵巢、子宫、下丘脑、垂体和肾上腺等生殖功能相关脏器质量系数均低于正常大鼠水平,说明肾阳虚病理状况对大鼠生殖器官和机体生长发育均产生阻碍作用,而氯米芬阳性组大鼠和促排合剂不同给药剂量大鼠体质量的卵巢、子宫、下丘脑、垂体和肾上腺等生殖功能相关脏器质量系数均较肾阳虚模型大鼠显著改善,说明促排合剂可有助于促进肾阳虚大鼠的生殖器官的生长发育。现代病理学研究显示,“肾-天癸-冲任-胞宫”与下丘脑-垂体-靶腺轴(卵巢、肾上腺等)的调控机制密切相关[17-19]。通过研究肾阳虚大鼠性激素分泌水平(HPO轴)变化发现,肾阳虚模型大鼠血清P、GnRH、FSH、LH和E2含量水平均低于正常大鼠水平,说明肾阳虚病理状况导致大鼠生殖内分泌功能下降,而氯米芬阳性组大鼠和促排合剂不同给药剂量大鼠性激素分泌水平较肾阳虚模型大鼠改善,说明促排合剂可有效调节肾阳虚大鼠生殖内分泌功能,提高性激素分泌水平;通过研究肾阳虚大鼠HPA轴相关激素分泌水平变化发现,肾阳虚模型大鼠血清ACTH和COR含量均低于正常大鼠水平,而氯米芬阳性组大鼠和促排合剂不同给药剂量大鼠ACTH和COR分泌水平均较肾阳虚模型大鼠提高,说明促排合剂在发挥性激素分泌功能调节作用的同时,可有效改善HPA轴的调节作用,从而对大鼠生殖功能的改善起到协同促进作用。临床研究显示,在女性生殖过程中存在氧化应激反应,且肾阳虚症状的加剧与氧化应激反应导致脏器损伤密切相关,也是导致机体器官发育迟缓的重要机制[20-23]。通过观察肾阳虚大鼠氧化应激状况发现,较正常大鼠,肾阳虚模型大鼠血清氧化应激抑制因子T-SOD和CAT含量水平下调,而氧化应激促进因子MDA含量水平上调,说明肾阳虚大鼠出现氧化应激反应加剧的状况,而氯米芬阳性组大鼠和促排合剂不同给药剂量大鼠氧化应激相关因子水平均得到有效改善,说明促排合剂具有缓解肾阳虚大鼠氧化应激反应的作用,从而有利于促进生殖及腺体器官发育,对生殖功能的改善起到积极作用。
综上所述,促排合剂可通过改善下丘脑-垂体-靶腺轴调节功能和缓解氧化应激反应的相关机制,促进肾阳虚大鼠生殖功能的改善和生殖器官的发育,为该制剂的临床推广提供了一定的药理学依据。然而,由于本研究纳入的样本数量有限,研究周期较短,且仅以大鼠模型为研究对象,存在一定的局限性,后续有待通过进一步研究,对促排合剂治疗不孕症的药理学机制进行更加深入和充分的剖析。
Study on reproductive regulation mechanism of Cupai Heji on ovulation disorder model rats with kidney yang deficiency
1. Tianjin Central Hospital of Gynecology Obstetrics, Tianjin 300052, China;
2. Tianjin Academy of Medical Sciences Hematology Hospital, Tianjin 300020, China
 2022, Vol. 39
2022, Vol. 39