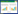文章信息
- 柴士伟, 邢彦超, 高建, 庞旭, 韩立峰
- CHAI Shiwei, XING Yanchao, GAO Jian, PANG Xu, HAN Lifeng
- 何首乌及炮制品中二苯乙烯苷的稳定性研究
- Studies on the stability of stilbene glycoside in crude Polygoni multiflora and its processed products
- 天津中医药, 2022, 39(7): 934-939
- Tianjin Journal of Traditional Chinese Medicine, 2022, 39(7): 934-939
- http://dx.doi.org/10.11656/j.issn.1672-1519.2022.07.22
-
文章历史
- 收稿日期: 2022-02-08
2. 天津市中药化学与分析重点实验室, 天津 301617
何首乌(Polygonum multiflorum Thunb.)是享誉中外、延用千年的知名中药。其生品具有解毒消痈和润肠通便的功效,而炮制品主要是通过滋补肝肾而表现出诸多补益功效,包括益精血、强筋骨、乌须发等[1]。现代药理学研究证明何首乌的药理活性主要表现为抗氧化、抗肿瘤、抗动脉粥样硬化、抗衰老、增强免疫功能、降血脂和神经保护等方面,并具有治疗神经退行性疾病、降血糖等方面的潜力[2-3]。文献报道何首乌的炮制方法较多,而炮制中所用到的炮制辅料多达十几种,包括黑豆、黄酒、黑芝麻、牛膝、干枣、人乳、牛乳、醋、米泔水和甘草等,其中以黑豆炮制记载最多[4-5]。炮制工艺主要以“蒸制”为主,其中“九蒸九晒”的炮制工艺被誉为是何首乌最为经典的炮制方法,同时也是工序最为繁琐且极其耗时的炮制方法[6]。研究选用“蒸制”工艺,选取不同的辅料炮制,对各炮制品及生品中2,3,5,4’-四羟基二苯乙烯-2-O-β-D-葡萄糖苷(TSG)的稳定性进行研究。考虑到传统的何首乌炮制方法大都经历“蒸”和“晒”的操作,而古人用到的水为富含各种金属离子的水,同时在重要的煎煮、贮藏和其他加工条件下也或多或少经历光照和高温等条件。因此,实验中对光照、高温和金属离子等3个因素对TSG的稳定性影响进行了系统研究。
何首乌中含有多种具有生物活性的化合物,例如二苯乙烯类、蒽醌类、酚酸类等。二苯乙烯类成分为何首乌中存在含量较高的大类成分,已被发现高达几十种[7]。TSG是何首乌中含量最高的二苯乙烯类化合物,同时也是中国药典的指标成分,是近年来何首乌的活性、毒性研究热点。TSG具有多种药理活性,如抗炎、抗氧化、抗细胞凋亡和清除自由基等[8]。与此同时,关于它影响代谢酶的研究也有诸多报道[9-12]。该化合物作为二苯乙烯类化合物,由于双键的存在而天然存在顺(cis-)、反(trans-)两种构型,已有文献报道在某些特定条件下,顺反构型可反生相互转化[13-14]。作为传统的补益类中药,在中医药典籍中记载的“九蒸九晒”和“忌铁器”等理论可能体现了古代中医药学者对何首乌中化合物稳定性的相关认识[15]。为了全面了解TSG的稳定性以及复杂体系的药材何首乌中TSG的稳定性,有必要进行系统的考察。因此,实验对TSG单体、何首乌生品以及4种炮制品在光照、高温和金属离子(Fe3+)介导的稳定性进行了系统研究。
1 材料与方法 1.1 仪器与试剂超高效液相色谱-四级杆静电场轨道阱质谱联用仪(UHPLC/ESI-Q-Orbitrap MS),美国赛默飞世尔有限公司;1260 Infinity高效液相色谱仪,美国安捷伦有限公司;微量移液器,德国艾本德生命科学有限公司;涡旋振荡器,美国莱伯特公司;TSG(批号:Must-16121311,纯度:98.72%),成都曼特生物科技有限公司;分析纯乙醇(天津协和科技有限公司),色谱纯乙腈、甲醇,美国赛默飞世尔公司;超纯水,美国Millipore公司;乙酸,美国ACS恩科化学公司;Centrifuge 5424 R冷冻台式高速离心机(离心机半径为150 mm),德国艾本德生命科学有限公司。
何首乌、黑豆均够自安国祁安药业有限公司,何首乌药材经天津中医药大学张丽娟教授鉴定为廖科植物何首乌Polygonum multiflorum Thunb.的干燥根茎,样品标本保存于天津中医药大学中医药研究院(PM-20160432)。黑豆经张丽娟鉴定为豆科植物大豆 Glycine max(L.)Merr的干燥成熟种子,样品标本保存于天津中医药大学中医药研究院(GM-20170530)。黄酒够自浙江绍兴第三酿酒厂。
1.2 样品制备方法 1.2.1 何首乌炮制品及其分析样品的制备根据前期研究工作基础[5],各何首乌炮制品制备工艺如下。何首乌清水蒸制品组(Q):超纯水拌匀浸渍何首乌药材后,蒸制32 h;何首乌黄酒炮制品(J):黄酒拌匀浸渍何首乌药材后,蒸制32 h;何首乌黑豆汁炮制品(D):黑豆汁拌匀浸渍何首乌药材后,蒸制32 h;何首乌黑豆汁合并黄酒炮制品(DJ):黑豆汁合并黄酒拌匀浸渍何首乌药材后,蒸制32 h。分别称取何首乌生品(SP)及其4种炮制品(Q,D,J和DJ)各10 mg于1.5 mL离心管中,分别加入1 mL超纯水,封口膜封口后涡旋震荡5 min,超声提取30 min后,14 000 r/min离心10 min,离心半径10 cm,取上清液加入附有内插管的进样小瓶中。
1.2.2 光照样品的制备分别用超纯水、50%乙醇和乙醇为溶剂配置成浓度0.1 mg/mL的TSG溶液。3组样品命名为超纯水组、50%乙醇组和乙醇组。将以上3份样品分别均匀平铺于培养皿中并存放在户外阳光下。在不同时间点(0.5、1、2、3、4、5 h)取样,过滤并分析。
用超纯水制备浓度为10 μg/mL二苯乙烯苷溶液10 mL。分别称取SP及其4种炮制品(Q,D,J和DJ)各10 mg于1.5 mL离心管中,分别加入1 mL超纯水,封口膜封口后涡旋震荡5 min,超声提取30 min后,14 000 r/min离心10 min,离心半径10 cm,再分别稀释成含有10 μg/mL的TSG溶液10 mL。将以上6份样品分别均匀平铺于培养皿中并存放在户外阳光下。在不同时间点(0.5、1、2、3、4、5 h)取样,过滤并分析。
1.2.3 高温实验样品制备用超纯水制备浓度为10 μg/mL的TSG溶液10 mL。分别称取SP及其4种炮制品(Q,D,J和DJ)各10 mg于1.5 mL离心管中,分别加入1 mL超纯水,封口膜封口后涡旋震荡5 min,超声提取30 min后,14 000 r/min离心10 min,离心半径10 cm,再分别稀释成含有10 μg/mL TSG的溶液10 mL。将以上6份样品一同放入100 ℃水浴锅中,全程避光。在不同时间点(0、2、4、6、8、10 h)取样,过滤并分析。
1.2.4 金属离子实验样品制备用超纯水制备浓度为10 μg/mL的TSG溶液10 mL。分别称取SP及其4种炮制品(Q,D,J和DJ)各10 mg于1.5 mL离心管中,分别加入1 mL超纯水,封口膜封口后涡旋震荡5 min,超声提取30 min后,14 000 r/min离心10 min,离心半径10 cm,再分别稀释成含有10 μg/mL二苯乙烯苷和100 μg/mL氯化铁(FeCL3)的溶液10 mL。将以上6份样品室温下避光保存。在不同时间点(0、2、4、6、8、10 h)取样,过滤并分析。
1.3 分析方法 1.3.1 何首乌及其炮制品的分析超高效液相色谱方法:用反相柱BEH C18(1.7 μm,250×4.6 mm,Waters)在35 ℃下,对样品进行分离。流动相为0.1%乙酸-水溶液(A)和乙腈(B)。梯度洗脱条件为乙腈(B)从5%至100%,运行时间为25 min。进样体积为2 μL,流速为0.4 mL/min。
质谱方法:UHPLC/ESI-Q-Orbitrap MS液质联用系统,负离子检测,配有加热的电喷雾离子源(HESI),采用Full MS/dd-MS2(TopN)的扫描方法对何首乌样品中成分进行检测。具体参数为:源喷雾电压:-2.8 kV,鞘气(N2)35 L/h;辅助气(N2)10 L/h;吹扫气(N2)0 L/h;毛细管温度350 ℃;辅助气加热温度350 ℃。MS1全扫描范围是m/z 100~1 500,分辨率是70 000;MS2质谱扫描是动态质量范围,分辨率是17 500。所有操作均由Xcalibur软件(版本3.1,Thermo Scientific,USA)控制。
1.3.2 何首乌中二苯乙烯苷的分析使用安捷伦1260高效液相色谱法对TSG进行检测。使用反相SB-C18柱(150 mm×4.6 mm,5 μm,Agilent Technologies Inc.,USA),在30 ℃下测定TSG。流动相为水和乙腈75∶25(V/V)。进样体积为10 μL,流速为1 mL/min,运行时间为10 min。应用紫外可变波长检测器(VWD)在320 nm波长下进行检测。
2 实验结果 2.1 TSG标准品和何首乌不同样品中的TSG在不同处理条件下随时间变化结果TSG标准品和何首乌不同样品中的TSG在不同处理条件下随时间变化的折线图如图 1所示。图 1A的结果表明:TSG在水、50%乙醇和乙醇溶液中经光照均能异构化为cis-TSG,转化速率和反应平衡点没有明显的差异。实验结果进一步说明了光照是何首乌中TSG异构化的敏感因素,而反应过程并不局限于特定溶剂。从图 1B的结果表明:在所有组中,各组间无明显差异,何首乌中的TSG与TSG标准品无差异,同样不稳定,易发生异构化反应。在本实验中,反应达到平衡点时,顺式结构的峰面积大于反式结构的峰面积,转化率超过50%,转化率的高低可能与浓度有关。图 1C的结果表明:在100 ℃高温水浴下,各组中TSG的含量均随时间逐渐减少,呈现时间依赖性,而各组整体趋势无明显差异。图 1D的结果表明:在反应前期各组中TSG的含量均随时间逐渐减少,之后便趋于稳定,各组整体趋势无明显差异。
|
| 注:A. TSG光照条件下不同溶剂中顺反构型变化面积比;B.何首乌各炮制品中TSG光照条件下顺反构型变化面积比;C.何首乌各炮制品中TSG高温条件下反式构型峰面积变化;D.何首乌各炮制品中TSG在Fe3+条件下反式构型峰面积变化。 图 1 TSG标准品和何首乌不同样品中的TSG在不同处理条件下随时间变化的折线图 Fig. 1 Line chart of TSG in different samples of fallopia multiflora and TSG standard under different treatment conditions at different time |
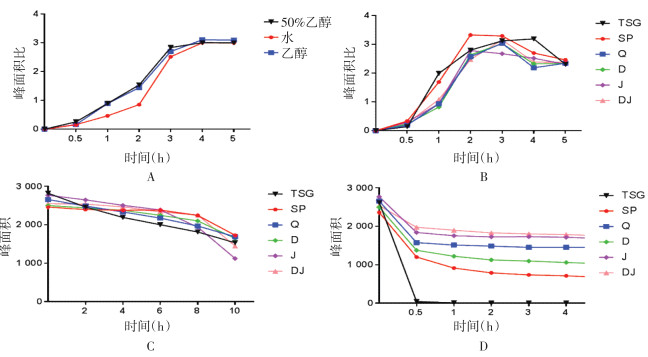
TSG经光照的顺反异构化由trans-TSG在光照的条件下经过二苯乙烯骨架C=C双键的P-垂直中间态扭转实现相的转变,如图 2所示[16]。有研究表明,cis-TSG具有降低血糖的药理作用[17],也有研究表明它会造成肝损伤[18-19]。因此,cis-TSG的相关研究对研究何首乌的药理活性和致毒物质基础具有参考价值,对何首乌的质量控制和临床应用具有一定的指导意义。
|
| 图 2 TSG经P-垂直中间态扭转的顺反异构化过程 Fig. 2 Cis/trans isomerization of TSG by P-vertical intermediate state |
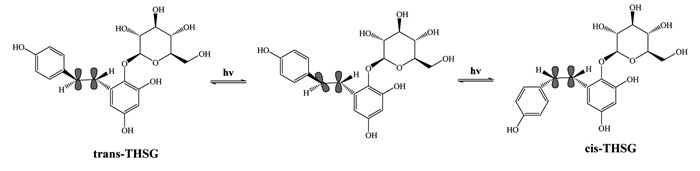
何首乌的炮制工艺几乎均涉及“蒸制”,时间长达十几个小时甚至更久,如此长时间的高温接触势必会对何首乌中TSG的稳定性产生较大影响,故炮制后其含量会明显降低。TSG发生高温降解反应的可能的机制如图 3所示[13]。
|
| 图 3 TSG高温降解反应过程图 Fig. 3 Reaction process chart of high temperature degradation of TSG |
何首乌及TSG单体在Fe3+作用下发生反应。在反应前期,折线的斜率的大小顺序为:TSG>SP>D>Q>J>DJ。在稳定阶段,峰面积大小的顺序为DJ>J>Q>D>SP>TSG。造成各组之间存在明显差异的原因之一可能是何首乌中的一些其他成分也可以与溶液中的Fe3+发生反应,这些化合物的结构可能类似于TSG,并与其存在竞争关系。文献报导各种金属离子均会影响二苯乙烯苷的稳定性,如Cu2+、Ca2+、Zn2+、Mg2+、Al3+和Fe3+。Fe3+和Fe2+可能主要参与催化TSG的氧化聚合,而Cu2+、Ca2+、Zn2+、Mg2+和Al3+可能主要参与双键氧化分解反应,TSG的二聚体生成的可能机制之一如图 4所示[20]。TSG与不同的金属离子反应的确切机制有待进一步研究和阐明。何首乌的加工和煎煮需要用水,而中国古代没有净化水的技术,人们通常用井水来处理和蒸煮何首乌。井水含有许多金属离子,它们可能影响TSG的稳定性。
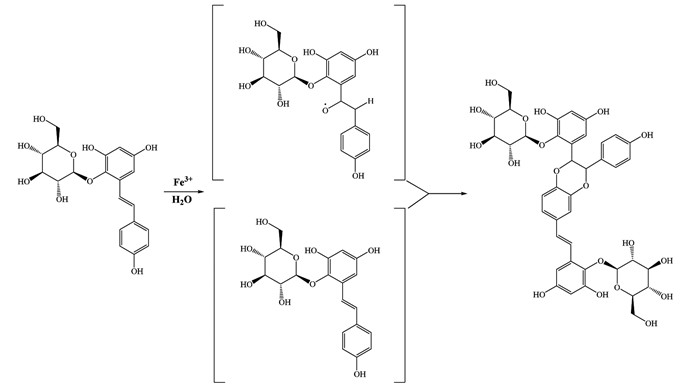
|
| 图 4 TSG二聚体生成的可能机制 Fig. 4 Possible formation mechanism of TSG dimer |
另一方面,金属离子亦可以与中药中的化合物形成配合物,包括金属离子络合物在内的中药成分的配合物在某些中药临床应用中起到至关重要的作用。有些成分由于相互影响(物理吸附或化学反应)而产生新的物质-配位络合物和分子络合物,这些新物质可能改变了原来各组分的溶解度、吸收光谱等物理性质,进而也可能对其药效产生影响。例如黄芩苷在溶液中与锌或铜形成的配合物对红细胞膜的保护作用优于黄芩苷本身,对氧自由基具有明显的清除作用,并呈量效关系;与铝形成的络合物黄芩苷铝,作为抗菌收敛药用于临床,兼有黄芩苷抗菌和铝收敛之双重功效。而生物碱类、黄酮类、蒽醌类等成分分子间又可通过静电、疏水、包合、交叠等作用结合成分子络合物,改变中药原有成分的溶解度、熔点、亲脂性、立体构型、紫外和红外光谱等理化性质,从而引起药理活性或者毒性作用的。例如喜树碱具有抗癌作用,但有毒性,当其与甘草酸配伍后,喜树碱生成分子络合物,不仅增强喜树碱抗癌作用,而且使其毒性降低[21-22]。故何首乌中的二苯乙烯类、蒽醌类和黄酮类等成分可能与铁离子等金属离子形成配合物,是否会对药效和毒性产生影响是值得继续探讨的。
3 结论实验考察了光照、高温和Fe3+对TSG、何首乌生品和炮制品稳定性的影响,结果表明这3个因素均对TSG的稳定性造成了影响,同时这些因素对药材中的TSG的影响是基本一致的。其中光照、温度等因素对TSG单体、何首乌生品及其炮制品中TSG的影响并不存在明显差别,而在TSG的Fe3+稳定性的实验中,何首乌生品及其炮制品中反应平衡点存在明显差别,原因可能是何首乌中的其他相似结构的二苯乙烯类等其他成分与TSG竞争消耗Fe3+所致。TSG在适宜的条件下经光照发生顺反异构,经高温反生降解反应,而在含有Fe3+的溶液中可能生成相应的聚合物。研究为何首乌的加工、贮藏、炮制和制剂等体外过程的标准化奠定了基础,对进一步研究其中的物质基础和转化规律具有一定的参考价值,为相似成分的稳定性研究提供了参考。
| [1] |
王亭, 龚千锋. 何首乌炮制后化学成分及药理作用的研究进展[J]. 中国实验方剂学杂志, 2017, 23(2): 220-226. WANG T, GONG Q F. Progress in study on chemical constituents and pharmacological action of polygoni multiflori radix after being processed[J]. Chinese Journal of Experimental Traditional Medical Formulae, 2017, 23(2): 220-226. |
| [2] |
林艳, 肖榕, 李春, 等. 生/制/发酵何首乌化学成分、药理作用及肝毒性研究进展[J]. 中药新药与临床药理, 2018, 29(5): 661-672. LIN Y, XIAO R, LI C, et al. Research progress on chemical constituents, pharmacology and hepatoxicity of raw, processed and fermented polygonum multiflorum thunb[J]. Traditional Chinese Drug Research & Clinical Pharmacology, 2018, 29(5): 661-672. |
| [3] |
王浩, 杨健, 周良云, 等. 何首乌化学成分与药理作用研究进展[J]. 中国实验方剂学杂志, 2019, 25(13): 192-205. WANG H, YANG J, ZHOU L Y, et al. Chemical compositions and pharmacological activities of polygoni multiflori radix[J]. Chinese Journal of Experimental Traditional Medical Formulae, 2019, 25(13): 192-205. |
| [4] |
杨磊, 张志国, 周逸群, 等. 何首乌历代炮制方法考证[J]. 中华中医药学刊, 2020, 38(9): 25-29. YANG L, ZHANG Z G, ZHOU Y Q, et al. Research on processing methods of prepared Heshouwu (polygonum multiflorum thunb) in successive dynasties[J]. Chinese Archives of Traditional Chinese Medicine, 2020, 38(9): 25-29. |
| [5] |
HAN L F, WANG P, WANG Y L, et al. Rapid discovery of the potential toxic compounds in polygonum multiflorum by UHPLC/Q-orbitrap-MS-based metabolomics and correlation analysis[J]. Frontiers in Pharmacology, 2019, 10: 329. DOI:10.3389/fphar.2019.00329 |
| [6] |
成颜芬, 聂欣, 谭睿, 等. 基于经典"九蒸九晒"法不同炮制程度何首乌的化学质量概貌评价[J]. 中国中药杂志, 2019, 44(23): 5151-5158. CHENG Y F, NIE X, TAN R, et al. Evaluation of chemical quality profile of polygoni multiflori radix at different processing degrees based on its classic processing method "nine-steaming and nine-sun-curing"[J]. China Journal of Chinese Materia Medica, 2019, 44(23): 5151-5158. |
| [7] |
LIN L F, NI B R, LIN H M, et al. Traditional usages, botany, phytochemistry, pharmacology and toxicology of polygonum multiflorum thunb.: a review[J]. Journal of Ethnopharmacology, 2015, 159: 158-183. DOI:10.1016/j.jep.2014.11.009 |
| [8] |
WU J J, HU W F, GONG Y, et al. Current pharmacological developments in 2, 3, 4', 5-tetrahydroxystilbene 2-O-β-D-glucoside (TSG)[J]. European Journal of Pharmacology, 2017, 811: 21-29. DOI:10.1016/j.ejphar.2017.05.037 |
| [9] |
刘薇, 王一飞, 刘中秋. 大黄素在人肝肠微粒体的葡萄糖醛酸化反应[J]. 中国病理生理杂志, 2012, 28(9): 1681-1685. LIU W, WANG Y F, LIU Z Q. Glucuronidation of emodin in human liver and intestinal microsomes[J]. Chinese Journal of Pathophysiology, 2012, 28(9): 1681-1685. DOI:10.3969/j.issn.1000-4718.2012.09.025 |
| [10] |
YU Q, JIANG L L, LUO N, et al. Enhanced absorption and inhibited metabolism of emodin by 2, 3, 5, 4'-tetrahydroxystilbene-2-O-β-D-glucopyranoside: possible mechanisms for polygoni multiflori radix-induced liver injury[J]. Chinese Journal of Natural Medicines, 2017, 15(6): 451-457. DOI:10.1016/S1875-5364(17)30067-5 |
| [11] |
MA J, ZHENG L, DENG T, et al. Stilbene glucoside inhibits the glucuronidation of emodin in rats through the down-regulation of UDP-glucuronosyltransferases 1A8:application to a drug-drug interaction study in radix polygoni multiflori[J]. Journal of Ethnopharmacology, 2013, 147(2): 335-340. DOI:10.1016/j.jep.2013.03.013 |
| [12] |
XU S F, LIU J, SHI J S, et al. 2, 3, 4', 5-tetrahydroxystilbene-2-O-β-D-glucoside exacerbates acetaminophen-induced hepatotoxicity by inducing hepatic expression of CYP2E1, CYP3A4 and CYP1A2[J]. Scientific Reports, 2017, 7(1): 16511. DOI:10.1038/s41598-017-16688-5 |
| [13] |
REN X L, WANG G F, WANG M, et al. Kinetics and mechanism of 2, 3, 5, 4'-tetrahydroxystilbene-2-O-β-d-glycoside (THSG) degradation in aqueous solutions[J]. Journal of Pharmaceutical and Biomedical Analysis, 2011, 55(1): 211-215. DOI:10.1016/j.jpba.2010.12.026 |
| [14] |
王贵芳, 任晓亮, 欧阳慧子, 等. 化学动力学法研究4种光源对二苯乙烯苷稳定性的影响[J]. 药物分析杂志, 2011, 31(3): 458-462. WANG G F, REN X L, OUYANG H Z, et al. Stability study of stilbene glucoside by chemical kinetics under four illuminant using[J]. Chinese Journal of Pharmaceutical Analysis, 2011, 31(3): 458-462. |
| [15] |
崔鹤蓉, 柏兆方, 宋海波, 等. 从古今炮制方法演变探讨何首乌毒性的潜在影响因素[J]. 中国中药杂志, 2016, 41(2): 333-339. CUI H R, BAI Z F, SONG H B, et al. Investigation of potential toxic factors for fleece-flower root: from perspective of processing methods evolution[J]. China Journal of Chinese Materia Medica, 2016, 41(2): 333-339. |
| [16] |
XING Q Y, XU R Q, ZHOU Z, et al. Fundamental opiceidanic chemistry[M]. nd edition.Beijing: Higher Edueation Press, 1994.
|
| [17] |
TANG W P, LI S M, LIU Y, et al. Anti-inflammatory effects of trans-2, 3, 5, 4'-tetrahydroxystilbene 2-O-β-glucopyranoside (THSG) from polygonum multiflorum (PM) and hypoglycemic effect of Cis-THSG enriched PM extract[J]. Journal of Functional Foods, 2017, 34: 1-6. DOI:10.1016/j.jff.2017.04.014 |
| [18] |
LI C, NIU M, BAI Z, et al. Screening for main components associated with the idiosyncratic hepatotoxicity of a tonic herb, polygonum multiflorum[J]. Frontiers of Medicine, 2017, 11(2): 253-265. DOI:10.1007/s11684-017-0508-9 |
| [19] |
张乐, 柏兆方, 李春雨, 等. 制首乌中顺式二苯乙烯苷转化量与特异质肝损伤的相关性研究[J]. 药学学报, 2017, 52(7): 1041-1047. ZHANG L, BAI Z F, LI C Y, et al. Study on idiosyncratic liver injury and content of Cis-2, 3, 5, 4'-tetrahydroxystilbene-2-O-β-D-glucoside in radix polygoni multiflori preparata[J]. Acta Pharmaceutica Sinica, 2017, 52(7): 1041-1047. |
| [20] |
李瑞煜, 冯五文, 李晓菲, 等. 金属离子对何首乌中二苯乙烯苷稳定性的影响[J]. 药学学报, 2016, 51(1): 116-121. LI R Y, FENG W W, LI X F, et al. Influence of metal ions on stability of 2, 3, 5, 4'-tetrahydroxy stilbene-2-O-β-D-glucoside contained in polygoni multiflori radix[J]. Acta Pharmaceutica Sinica, 2016, 51(1): 116-121. |
| [21] |
何军, 梁国刚. 配位化学在中药研究中的应用[J]. 中国实验方剂学杂志, 2008, 14(12): 77-80. HE J, LIANG G G. Application of coordination chemistry on the research of traditional Chinese medicine[J]. Chinese Journal of Experimental Traditional Medical Formulae, 2008, 14(12): 77-80. DOI:10.3969/j.issn.1005-9903.2008.12.027 |
| [22] |
李英华, 吕秀阳, 刘霄, 等. 中药配位化学研究进展[J]. 中国中药杂志, 2006, 31(16): 1309-1313. LI Y H, LYU X Y, LIU X, et al. Research advances in coordination chemistry of traditional Chinese medicine[J]. China Journal of Chinese Materia Medica, 2006, 31(16): 1309-1313. DOI:10.3321/j.issn:1001-5302.2006.16.001 |
2. Key Laboratory of Traditional Chinese Medicinal Chemistry and Analytical Chemistry of Tianjin, Tianjin 301617, China
 2022, Vol. 39
2022, Vol. 39